レプリソームの構成タンパク質であるCtf4は複製が阻害された際に生じるDNA 2本鎖切断の修復に重要である
佐々木真理子・小林武彦
(東京大学分子細胞生物学研究所 ゲノム再生研究分野)
email:佐々木真理子,小林武彦
DOI: 10.7875/first.author.2017.051
Ctf4 prevents genome rearrangements by suppressing DNA double-strand break formation and its end resection at arrested replication forks.
Mariko Sasaki, Takehiko Kobayashi
Molecular Cell, 66, 533-545.e5 (2017)
複製が阻害され複製フォークが停止するとDNA 2本鎖切断が生じるが,その際のDNA 2本鎖切断の修復の機構については不明であった.筆者らは,出芽酵母のリボソームRNA遺伝子(rDNA)領域において複製の阻害にともない生じるDNA 2本鎖切断は,複製が起こっていないときにDNA 2本鎖切断を修復する相同組換え経路には依存しない,新規の経路により修復されることを明らかにした.一方で,レプリソームの構成タンパク質であるCtf4が欠損すると,DNA 2本鎖切断の末端は削り込みをうけて相同組換え経路により修復されるようになり,さらに,rDNAのコピー数が異常に増幅した.このことから,Ctf4は複製が阻害された際に生じるDNA 2本鎖切断を正しく修復するために重要であることが判明した.複製が阻害されたときには相同組換え経路を抑制することによりゲノムの再編成をふせぎ,ゲノムの安定性を維持することが重要であることが明らかにされた.
DNAを正確に複製することは,たったひとつの受精卵からまったく同じ遺伝情報をもつ数十兆個もの細胞をつくるために重要である.しかし,複製はさまざまなストレスにより阻害される.たとえば,DNA損傷剤,DNA架橋剤,ヌクレオチドの量を減少させるヒドロキシ尿素などを細胞に添加すると,ゲノムの全体にわたり複製が阻害される.さらに,複製フォークはDNAに存在する損傷や強固に結合したタンパク質などによっても停止する.
レプリソームは,鋳型DNAを巻きもどすCMGヘリカーゼ,リーディング鎖の合成を担うDNAポリメラーゼε,ラギング鎖の合成を開始するDNAポリメラーゼα-プライマーゼ複合体,ラギング鎖の伸長を担うDNAポリメラーゼδ,さらに,アクセサリータンパク質から構成される.アクセサリータンパク質のひとつであるCtf4(分裂酵母においてはMcl1,哺乳類においてはAND-1)はホモ三量体を形成し,CMGヘリカーゼおよびDNAポリメラーゼαと結合することにより鋳型DNAの巻きもどしとラギング鎖の合成とを共役させると考えられている1-3).Ctf4はそのほかにも多くのタンパク質と結合することから3,4),これらのタンパク質をレプリソームにリクルートし複製と染色体におけるさまざまなイベントとを共役させる重要なタンパク質として注目されている.
複製が阻害されると,レプリソームをDNAに安定的に維持することにより複製の再開が促進されるが,複製の再開に失敗するとDNA 2本鎖切断が生じる.DNA 2本鎖切断はゲノムの再編成をひき起こし細胞のがん化やさまざまな疾患の原因になるだけでなく,ゲノムの多様性にも影響をおよぼす5).減数分裂期や体細胞分裂期のG2期/M期に生じたDNA 2本鎖切断は相同組換え経路により修復される.複製が阻害された際に生じるDNA 2本鎖切断も相同組換え経路により修復されると信じられてきたが,それを示す直接的な証拠はなかった.そのおもな理由として,複製の阻害はゲノムにおいてランダムに起こるためDNA 2本鎖切断の生じた部位を予測することが困難であり,DNA 2本鎖切断の修復の過程をDNAレベルで解析できなかったことがあげられる.
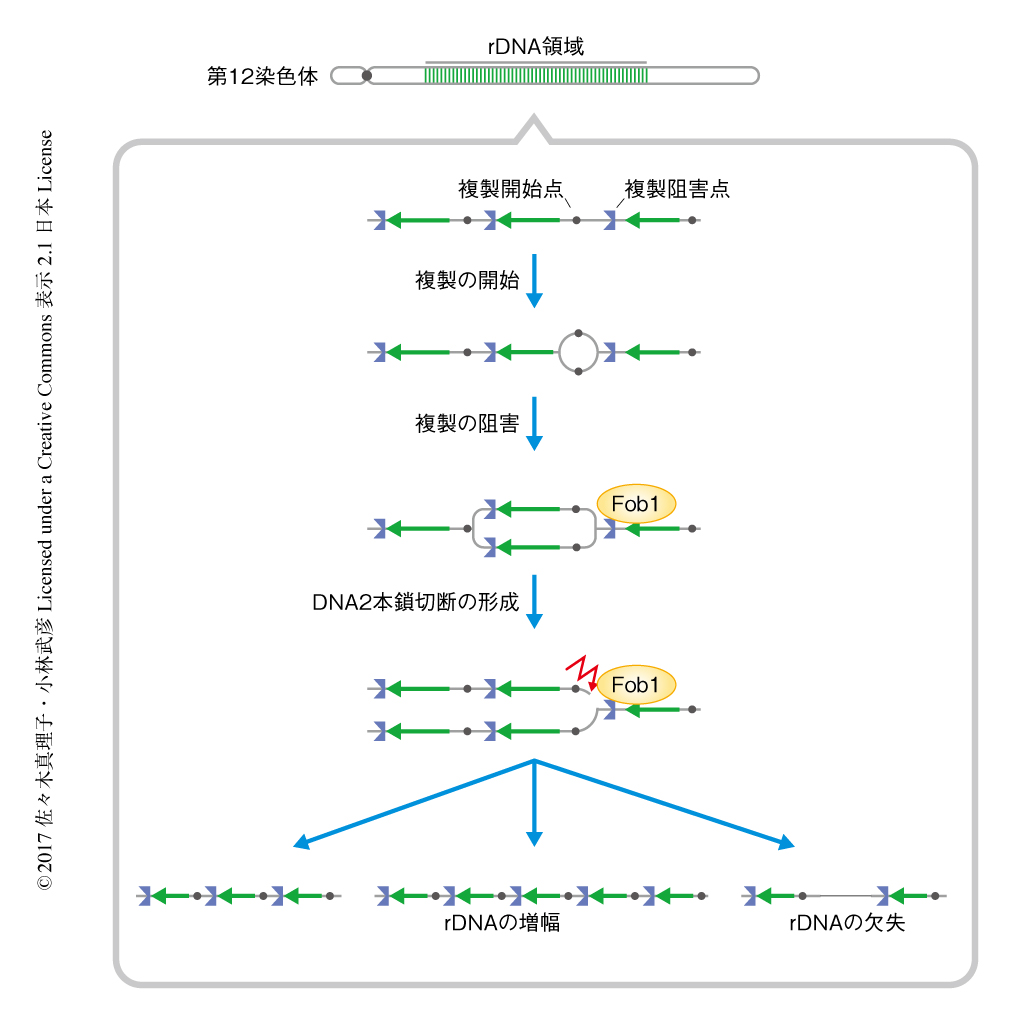
出芽酵母のリボソームRNA遺伝子(rDNA)領域は第12染色体にあり,約150コピーのrDNAが縦列に並んでいる(図1).ひとつのコピーには転写ユニットのほか複製開始点および複製阻害点が存在する.複製が開始されると複製フォークは両方向に進んでいくが,一方の複製フォークは複製阻害点に到達するとFob1により進行が阻害されDNA 2本鎖切断が生じる.また,DNA 2本鎖切断の修復にともないrDNAのコピー数が増減することがわかっていた.しかし,DNA 2本鎖切断の修復の機構については不明であった.この研究においては,出芽酵母のrDNA領域を用いて複製が阻害された際に生じるDNA 2本鎖切断の修復の機構を明らかにすることを目的とした.
以前の研究において筆者らは,複製の阻害およびその結果として生じるDNA 2本鎖切断に正しく応答できない細胞はrDNAのコピー数の異常な増減を起こすという仮説をたて,rDNAのコピー数の異常な遺伝子欠損株を網羅的に探索した6,7).出芽酵母は約6000個の遺伝子をもつが,そのうち約4800個は増殖には必須でない.そして,これらの非必須遺伝子をそれぞれ破壊した遺伝子欠損株のライブラリーが構築されている.このライブラリーのおのおのの遺伝子欠損株からDNAを単離し,パルスフィールド電気泳動法により染色体を分離してrDNAのある第12染色体の大きさの変化について調べた結果,rDNAが不安定になる約700個もの遺伝子欠損株が同定された6,7).さらに,ctf4遺伝子の欠損株は,すべての遺伝子欠損株のなかでも群をぬいて巨大なrDNA領域をもっていた.
ctf4欠損株においてrDNAの異常な増幅の起こる原因について探るため,この増幅はFob1に依存的な複製の阻害により起こるのかどうかを調べた.すると,ctf4遺伝子の単独での欠損株においてはrDNAのコピー数は野生型の約2倍にも増加していたが,ctf4 fob1二重変異株においてはrDNAのコピー数は増加していなかった.このことから,rDNAの異常な増幅は複製の阻害により起こることが示された.つまり,Ctf4は複製の阻害によりrDNAが異常に増幅するのをふせぐのに重要であることが明らかにされた.
Ctf4の欠損によりrDNAの異常な増幅が起こる原因として,DNA 2本鎖切断がより多く生じる可能性と,DNA 2本鎖切断があやまった経路により修復されやすくなる可能性とが考えられた.これらの可能性について確かめるため,進行の阻害された複製フォーク,DNA 2本鎖切断,DNA 2本鎖切断の修復中間体の量を経時的かつ定量的に解析できる実験系を構築した.
進行が阻害された複製フォークの量はCtf4の有無により変わらなかった.Ctf4が存在するときには,停止した複製フォークのうち約10%が切断されDNA 2本鎖切断を生じた.また,rDNAにおいては複製期において少なくとも1個のDNA 2本鎖切断が生じると推定された.細胞にDNA 2本鎖切断が修復されないままひとつでも残ると細胞死が誘導される.rDNAにおいて生じたDNA 2本鎖切断は複製のたびにゲノムの安定性および細胞の生存をあやうくする可能性のあることから,このDNA 2本鎖切断は正確に修復される必要がある.Ctf4が欠損したときには,このDNA 2本鎖切断はCtf4が存在するときよりも1.6倍も多く生じた.このことから,Ctf4が欠損すると停止した複製フォークが崩壊しDNA 2本鎖切断が生じやすくなることがわかった.
Ctf4が欠損したときには,Ctf4が存在するときにはほとんどみられなかったDNA 2本鎖切断の修復中間体が約13倍も多く蓄積した.この修復中間体を2次元電気泳動法により同定したところ,相同組換え経路に必要な,DNA 2本鎖切断の末端が削り込みをうけたものであった.相同組換えによるDNA 2本鎖切断の修復の経路において,DNA 2本鎖切断は5’-3’方向に削り込みをうけ,3’末端の1本鎖DNAを露出したDNAが形成され組換えがはじまる.つまり,DNA 2本鎖切断の末端の削り込みはDNA 2本鎖切断が相同組換え経路により修復されるかどうかを決定する重要な過程である.
Ctf4が存在するときにはDNA 2本鎖切断の末端はほとんど削り込みをうけていなかった.このことから,複製が阻害されたときにはDNA 2本鎖切断は相同組換えに依存しない経路により修復される可能性が示唆された.一方で,Ctf4が欠損したときにはDNA 2本鎖切断の末端は削り込みをうけていたことから,DNA 2本鎖切断は相同組換え経路により修復されると考えられた.つまり,Ctf4はDNA 2本鎖切断の削り込みを抑制することにより,DNA 2本鎖切断が相同組換え経路により修復されるかどうかを決定すると考えられた.
MRX複合体はDNA損傷応答において中心的な役割をはたすことが知られている.Ctf4が存在するときにはMRX複合体の構成タンパク質が欠損するとDNA 2本鎖切断は修復されなかったことから,MRX複合体はDNA 2本鎖切断の修復に必要であった.MRX複合体はDNA 2本鎖切断の修復において,Sae2とともにDNA 2本鎖切断の末端を削り込み相同組換えを開始する役割と,Sae2には依存せずにDNA 2本鎖切断の末端をつなぎとめる役割とをもつ.このどちらの役割が重要なのか,Sae2が欠損したときのDNA 2本鎖切断の修復について調べたところ,Sae2の欠損によりDNA 2本鎖切断の末端の削り込みが起こらなくてもDNA 2本鎖切断は修復された.さらに,相同組換え経路の後半にはたらくRad51あるいはRad52が欠損してもDNA 2本鎖切断は修復された.これらのことから,Ctf4が存在するときには,DNA 2本鎖切断はMRX複合体に依存するが相同組換え経路に依存しない,新規の経路により修復されることが明らかにされた.
Ctf4が欠損した際にもMRX複合体はDNA 2本鎖切断の修復に必要であった.しかし,Ctf4が存在するときとは対照的に,Ctf4が欠損した際にはDNA 2本鎖切断の修復にはSae2も必要であった.さらに,Ctf4およびRad52が欠損した際にはDNA 2本鎖切断の末端が削り込みをうけたものが過剰に蓄積したことから,DNA 2本鎖切断の末端が削り込みをうけたのちの相同組換え経路は進行しないことが明らかにされた,つまり,Ctf4が欠損した際にはDNA 2本鎖切断は相同組換え経路により修復されるという対照的な結果となった.また,相同組換えによるDNA 2本鎖切断の修復はrDNAの異常な増幅をひき起こしたことから,Ctf4はDNA 2本鎖切断の末端の削り込みを抑制することにより,ゲノムの再編成をひき起こしやすい相同組換え経路を阻害することが明らかにされた.
DNA 2本鎖切断の末端の削り込みはCtf4がないという特殊な状況でしか起こらないのだろうか? 以前の筆者らの研究により,rDNAのコピー数が半分になった細胞は相同組換え経路にかかわるタンパク質であるRad52に依存した経路によりrDNAのコピー数を徐々に増加させることが示されている8).このように,rDNAの増幅が必要なときは相同組換え経路を誘導するためにDNA 2本鎖切断の末端の削り込みが起こるのではないかと仮説をたてた.それぞれ20コピー,40コピー,80コピー,110コピーのrDNAをもつ株におけるDNA 2本鎖切断について解析したところ,rDNAのコピー数が少ない株においては,Ctf4が存在するにもかかわらずDNA 2本鎖切断の末端が削り込みをうけた.つまり,DNA 2本鎖切断の末端の削り込みはrDNAのコピー数の維持のために制御されていることが示された.
この相同組換えに依存しないDNA 2本鎖切断の修復の経路は,rDNA領域におけるDNA 2本鎖切断に特有なのかどうか調べた.その結果,複製の阻害が起こりやすいtRNA遺伝子9) において生じたDNA 2本鎖切断の修復においても,相同組換え経路にかかわるタンパク質は必要ではなかった.つまり,rDNA領域にかぎらず,複製が阻害された際に生じるDNA 2本鎖切断は,これまで知られていなかった新規の経路により修復されることがわかった.
筆者らは,複製の阻害により生じるDNA 2本鎖切断が高頻度で起こる出芽酵母のrDNA領域をモデルとして,複製が阻害された際に生じるDNA 2本鎖切断の修復の機構について解析した.先行研究において,ヒドロキシ尿素による複製の阻害にてCtf4が欠損した際にはレプリソームの構成タンパク質の複製フォークへの結合が減少することが示されている1,10).このことから,Fob1により複製フォークの進行が停止すると,Ctf4はDNAポリメラーゼαやCMGヘリカーゼとの結合能により1-3),停止した複製フォークにレプリソームを安定的につなぎとめると考えられた.この巨大なタンパク質複合体が複製フォークに存在することにより,DNA 2本鎖切断をひき起こす酵素のDNAへのアクセスがふせがれ,また,DNA 2本鎖切断が生じたとしても,レプリソームを維持することによりDNA 2本鎖切断の末端の削り込みに必要なタンパク質のリクルートがふせがれると考えている.
ゲノムに1コピーしか存在しない塩基配列においてDNA 2本鎖切断が生じた場合には,相同組換え経路はこれを正確に修復する.しかし,真核生物にはリピート配列が多く存在するため,ゲノムのほかの部位にある相同配列を用いてDNA 2本鎖切断を修復すると大規模なゲノムの再編成が起こりゲノムは不安定化する5).この研究により,Ctf4はレプリソームの構成タンパク質として,複製の阻害によりDNA 2本鎖切断が生じた際にDNA 2本鎖切断の末端の削り込みを抑制することにより相同組換え経路を抑制し,ゲノムの再編成をふせぐ重要なタンパク質であることがわかった.今後の研究により,この新たなDNA 2本鎖切断の修復の機構およびその制御機構について明らかにしていきたい.
略歴:2012年 米国Weill Cornell Graduate School of Medical Sciences博士課程 修了,2015年より東京大学分子細胞生物学研究所 助教.
研究テーマ:複製が阻害された際に生じるDNA 2本鎖切断の修復の機構.
小林 武彦(Takehiko Kobayashi)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://lafula-com.info/kobayashiken/CytoGen/
© 2017 佐々木真理子・小林武彦 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 ゲノム再生研究分野)
email:佐々木真理子,小林武彦
DOI: 10.7875/first.author.2017.051
Ctf4 prevents genome rearrangements by suppressing DNA double-strand break formation and its end resection at arrested replication forks.
Mariko Sasaki, Takehiko Kobayashi
Molecular Cell, 66, 533-545.e5 (2017)
要 約
複製が阻害され複製フォークが停止するとDNA 2本鎖切断が生じるが,その際のDNA 2本鎖切断の修復の機構については不明であった.筆者らは,出芽酵母のリボソームRNA遺伝子(rDNA)領域において複製の阻害にともない生じるDNA 2本鎖切断は,複製が起こっていないときにDNA 2本鎖切断を修復する相同組換え経路には依存しない,新規の経路により修復されることを明らかにした.一方で,レプリソームの構成タンパク質であるCtf4が欠損すると,DNA 2本鎖切断の末端は削り込みをうけて相同組換え経路により修復されるようになり,さらに,rDNAのコピー数が異常に増幅した.このことから,Ctf4は複製が阻害された際に生じるDNA 2本鎖切断を正しく修復するために重要であることが判明した.複製が阻害されたときには相同組換え経路を抑制することによりゲノムの再編成をふせぎ,ゲノムの安定性を維持することが重要であることが明らかにされた.
はじめに
DNAを正確に複製することは,たったひとつの受精卵からまったく同じ遺伝情報をもつ数十兆個もの細胞をつくるために重要である.しかし,複製はさまざまなストレスにより阻害される.たとえば,DNA損傷剤,DNA架橋剤,ヌクレオチドの量を減少させるヒドロキシ尿素などを細胞に添加すると,ゲノムの全体にわたり複製が阻害される.さらに,複製フォークはDNAに存在する損傷や強固に結合したタンパク質などによっても停止する.
レプリソームは,鋳型DNAを巻きもどすCMGヘリカーゼ,リーディング鎖の合成を担うDNAポリメラーゼε,ラギング鎖の合成を開始するDNAポリメラーゼα-プライマーゼ複合体,ラギング鎖の伸長を担うDNAポリメラーゼδ,さらに,アクセサリータンパク質から構成される.アクセサリータンパク質のひとつであるCtf4(分裂酵母においてはMcl1,哺乳類においてはAND-1)はホモ三量体を形成し,CMGヘリカーゼおよびDNAポリメラーゼαと結合することにより鋳型DNAの巻きもどしとラギング鎖の合成とを共役させると考えられている1-3).Ctf4はそのほかにも多くのタンパク質と結合することから3,4),これらのタンパク質をレプリソームにリクルートし複製と染色体におけるさまざまなイベントとを共役させる重要なタンパク質として注目されている.
複製が阻害されると,レプリソームをDNAに安定的に維持することにより複製の再開が促進されるが,複製の再開に失敗するとDNA 2本鎖切断が生じる.DNA 2本鎖切断はゲノムの再編成をひき起こし細胞のがん化やさまざまな疾患の原因になるだけでなく,ゲノムの多様性にも影響をおよぼす5).減数分裂期や体細胞分裂期のG2期/M期に生じたDNA 2本鎖切断は相同組換え経路により修復される.複製が阻害された際に生じるDNA 2本鎖切断も相同組換え経路により修復されると信じられてきたが,それを示す直接的な証拠はなかった.そのおもな理由として,複製の阻害はゲノムにおいてランダムに起こるためDNA 2本鎖切断の生じた部位を予測することが困難であり,DNA 2本鎖切断の修復の過程をDNAレベルで解析できなかったことがあげられる.
出芽酵母のリボソームRNA遺伝子(rDNA)領域は第12染色体にあり,約150コピーのrDNAが縦列に並んでいる(図1).ひとつのコピーには転写ユニットのほか複製開始点および複製阻害点が存在する.複製が開始されると複製フォークは両方向に進んでいくが,一方の複製フォークは複製阻害点に到達するとFob1により進行が阻害されDNA 2本鎖切断が生じる.また,DNA 2本鎖切断の修復にともないrDNAのコピー数が増減することがわかっていた.しかし,DNA 2本鎖切断の修復の機構については不明であった.この研究においては,出芽酵母のrDNA領域を用いて複製が阻害された際に生じるDNA 2本鎖切断の修復の機構を明らかにすることを目的とした.
1.Ctf4は複製の阻害によりrDNAが異常に増幅することをふせぐ
以前の研究において筆者らは,複製の阻害およびその結果として生じるDNA 2本鎖切断に正しく応答できない細胞はrDNAのコピー数の異常な増減を起こすという仮説をたて,rDNAのコピー数の異常な遺伝子欠損株を網羅的に探索した6,7).出芽酵母は約6000個の遺伝子をもつが,そのうち約4800個は増殖には必須でない.そして,これらの非必須遺伝子をそれぞれ破壊した遺伝子欠損株のライブラリーが構築されている.このライブラリーのおのおのの遺伝子欠損株からDNAを単離し,パルスフィールド電気泳動法により染色体を分離してrDNAのある第12染色体の大きさの変化について調べた結果,rDNAが不安定になる約700個もの遺伝子欠損株が同定された6,7).さらに,ctf4遺伝子の欠損株は,すべての遺伝子欠損株のなかでも群をぬいて巨大なrDNA領域をもっていた.
ctf4欠損株においてrDNAの異常な増幅の起こる原因について探るため,この増幅はFob1に依存的な複製の阻害により起こるのかどうかを調べた.すると,ctf4遺伝子の単独での欠損株においてはrDNAのコピー数は野生型の約2倍にも増加していたが,ctf4 fob1二重変異株においてはrDNAのコピー数は増加していなかった.このことから,rDNAの異常な増幅は複製の阻害により起こることが示された.つまり,Ctf4は複製の阻害によりrDNAが異常に増幅するのをふせぐのに重要であることが明らかにされた.
2.Ctf4はDNA 2本鎖切断を生じにくくする
Ctf4の欠損によりrDNAの異常な増幅が起こる原因として,DNA 2本鎖切断がより多く生じる可能性と,DNA 2本鎖切断があやまった経路により修復されやすくなる可能性とが考えられた.これらの可能性について確かめるため,進行の阻害された複製フォーク,DNA 2本鎖切断,DNA 2本鎖切断の修復中間体の量を経時的かつ定量的に解析できる実験系を構築した.
進行が阻害された複製フォークの量はCtf4の有無により変わらなかった.Ctf4が存在するときには,停止した複製フォークのうち約10%が切断されDNA 2本鎖切断を生じた.また,rDNAにおいては複製期において少なくとも1個のDNA 2本鎖切断が生じると推定された.細胞にDNA 2本鎖切断が修復されないままひとつでも残ると細胞死が誘導される.rDNAにおいて生じたDNA 2本鎖切断は複製のたびにゲノムの安定性および細胞の生存をあやうくする可能性のあることから,このDNA 2本鎖切断は正確に修復される必要がある.Ctf4が欠損したときには,このDNA 2本鎖切断はCtf4が存在するときよりも1.6倍も多く生じた.このことから,Ctf4が欠損すると停止した複製フォークが崩壊しDNA 2本鎖切断が生じやすくなることがわかった.
3.Ctf4はDNA 2本鎖切断の末端の削り込みを制限することにより相同組換え経路を抑制する
Ctf4が欠損したときには,Ctf4が存在するときにはほとんどみられなかったDNA 2本鎖切断の修復中間体が約13倍も多く蓄積した.この修復中間体を2次元電気泳動法により同定したところ,相同組換え経路に必要な,DNA 2本鎖切断の末端が削り込みをうけたものであった.相同組換えによるDNA 2本鎖切断の修復の経路において,DNA 2本鎖切断は5’-3’方向に削り込みをうけ,3’末端の1本鎖DNAを露出したDNAが形成され組換えがはじまる.つまり,DNA 2本鎖切断の末端の削り込みはDNA 2本鎖切断が相同組換え経路により修復されるかどうかを決定する重要な過程である.
Ctf4が存在するときにはDNA 2本鎖切断の末端はほとんど削り込みをうけていなかった.このことから,複製が阻害されたときにはDNA 2本鎖切断は相同組換えに依存しない経路により修復される可能性が示唆された.一方で,Ctf4が欠損したときにはDNA 2本鎖切断の末端は削り込みをうけていたことから,DNA 2本鎖切断は相同組換え経路により修復されると考えられた.つまり,Ctf4はDNA 2本鎖切断の削り込みを抑制することにより,DNA 2本鎖切断が相同組換え経路により修復されるかどうかを決定すると考えられた.
4.Ctf4が存在するときDNA 2本鎖切断はMRX複合体に依存するが相同組換えに依存しない経路により修復される
MRX複合体はDNA損傷応答において中心的な役割をはたすことが知られている.Ctf4が存在するときにはMRX複合体の構成タンパク質が欠損するとDNA 2本鎖切断は修復されなかったことから,MRX複合体はDNA 2本鎖切断の修復に必要であった.MRX複合体はDNA 2本鎖切断の修復において,Sae2とともにDNA 2本鎖切断の末端を削り込み相同組換えを開始する役割と,Sae2には依存せずにDNA 2本鎖切断の末端をつなぎとめる役割とをもつ.このどちらの役割が重要なのか,Sae2が欠損したときのDNA 2本鎖切断の修復について調べたところ,Sae2の欠損によりDNA 2本鎖切断の末端の削り込みが起こらなくてもDNA 2本鎖切断は修復された.さらに,相同組換え経路の後半にはたらくRad51あるいはRad52が欠損してもDNA 2本鎖切断は修復された.これらのことから,Ctf4が存在するときには,DNA 2本鎖切断はMRX複合体に依存するが相同組換え経路に依存しない,新規の経路により修復されることが明らかにされた.
5.Ctf4が欠損するとDNA 2本鎖切断は削り込みをうけ相同組換え経路により修復される
Ctf4が欠損した際にもMRX複合体はDNA 2本鎖切断の修復に必要であった.しかし,Ctf4が存在するときとは対照的に,Ctf4が欠損した際にはDNA 2本鎖切断の修復にはSae2も必要であった.さらに,Ctf4およびRad52が欠損した際にはDNA 2本鎖切断の末端が削り込みをうけたものが過剰に蓄積したことから,DNA 2本鎖切断の末端が削り込みをうけたのちの相同組換え経路は進行しないことが明らかにされた,つまり,Ctf4が欠損した際にはDNA 2本鎖切断は相同組換え経路により修復されるという対照的な結果となった.また,相同組換えによるDNA 2本鎖切断の修復はrDNAの異常な増幅をひき起こしたことから,Ctf4はDNA 2本鎖切断の末端の削り込みを抑制することにより,ゲノムの再編成をひき起こしやすい相同組換え経路を阻害することが明らかにされた.
6.rDNAの増幅はDNA 2本鎖切断の相同組換え経路による修復により起こる
DNA 2本鎖切断の末端の削り込みはCtf4がないという特殊な状況でしか起こらないのだろうか? 以前の筆者らの研究により,rDNAのコピー数が半分になった細胞は相同組換え経路にかかわるタンパク質であるRad52に依存した経路によりrDNAのコピー数を徐々に増加させることが示されている8).このように,rDNAの増幅が必要なときは相同組換え経路を誘導するためにDNA 2本鎖切断の末端の削り込みが起こるのではないかと仮説をたてた.それぞれ20コピー,40コピー,80コピー,110コピーのrDNAをもつ株におけるDNA 2本鎖切断について解析したところ,rDNAのコピー数が少ない株においては,Ctf4が存在するにもかかわらずDNA 2本鎖切断の末端が削り込みをうけた.つまり,DNA 2本鎖切断の末端の削り込みはrDNAのコピー数の維持のために制御されていることが示された.
7.複製の阻害により生じたDNA 2本鎖切断は相同組換えに依存しない経路により修復される
この相同組換えに依存しないDNA 2本鎖切断の修復の経路は,rDNA領域におけるDNA 2本鎖切断に特有なのかどうか調べた.その結果,複製の阻害が起こりやすいtRNA遺伝子9) において生じたDNA 2本鎖切断の修復においても,相同組換え経路にかかわるタンパク質は必要ではなかった.つまり,rDNA領域にかぎらず,複製が阻害された際に生じるDNA 2本鎖切断は,これまで知られていなかった新規の経路により修復されることがわかった.
おわりに
筆者らは,複製の阻害により生じるDNA 2本鎖切断が高頻度で起こる出芽酵母のrDNA領域をモデルとして,複製が阻害された際に生じるDNA 2本鎖切断の修復の機構について解析した.先行研究において,ヒドロキシ尿素による複製の阻害にてCtf4が欠損した際にはレプリソームの構成タンパク質の複製フォークへの結合が減少することが示されている1,10).このことから,Fob1により複製フォークの進行が停止すると,Ctf4はDNAポリメラーゼαやCMGヘリカーゼとの結合能により1-3),停止した複製フォークにレプリソームを安定的につなぎとめると考えられた.この巨大なタンパク質複合体が複製フォークに存在することにより,DNA 2本鎖切断をひき起こす酵素のDNAへのアクセスがふせがれ,また,DNA 2本鎖切断が生じたとしても,レプリソームを維持することによりDNA 2本鎖切断の末端の削り込みに必要なタンパク質のリクルートがふせがれると考えている.
ゲノムに1コピーしか存在しない塩基配列においてDNA 2本鎖切断が生じた場合には,相同組換え経路はこれを正確に修復する.しかし,真核生物にはリピート配列が多く存在するため,ゲノムのほかの部位にある相同配列を用いてDNA 2本鎖切断を修復すると大規模なゲノムの再編成が起こりゲノムは不安定化する5).この研究により,Ctf4はレプリソームの構成タンパク質として,複製の阻害によりDNA 2本鎖切断が生じた際にDNA 2本鎖切断の末端の削り込みを抑制することにより相同組換え経路を抑制し,ゲノムの再編成をふせぐ重要なタンパク質であることがわかった.今後の研究により,この新たなDNA 2本鎖切断の修復の機構およびその制御機構について明らかにしていきたい.
文 献
- Tanaka, H., Katou, Y., Yagura, M. et al.: Ctf4 coordinates the progression of helicase and DNA polymerase alpha. Genes Cells, 14, 807-820 (2009)[PubMed]
- Simon, A.C., Zhou, J. C., Perera, R. L. et al.: A Ctf4 trimer couples the CMG helicase to DNA polymerase a in the eukaryotic replisome. Nature, 510, 293-297 (2014)[PubMed]
- Villa, F., Simon, A. C., Ortiz Bazan, M. A. et al.: Ctf4 is a hub in the eukaryotic replisome that links multiple CIP-box proteins to the CMG helicase. Mol. Cell, 63, 385-396 (2016)[PubMed]
- Samora, C. P., Saksouk, J., Goswami, P. et al.: Ctf4 links DNA replication with sister chromatid cohesion establishment by recruiting the Chl1 helicase to the replisome. Mol. Cell, 63, 371-384 (2016)[PubMed]
- Sasaki, M., Lange, J. & Keeney, S.: Genome destabilization by homologous recombination in the germ line. Nat. Rev. Mol. Cell Biol., 11, 182-195 (2010)[PubMed]
- Saka, K., Takahashi, A., Sasaki, M. et al.: More than 10% of yeast genes are related to genome stability and influence cellular senescence via rDNA maintenance. Nucleic Acids Res., 44, 4211-4221 (2016)[PubMed]
- Kobayashi, T. & Sasaki, M.: Ribosomal DNA stability is supported by many 'buffer genes': introduction to the Yeast rDNA Stability Database. FEMS Yeast Res., 17, fox001 (2017)[PubMed]
- Tittel-Elmer, M., Alabert, C., Pasero, P. et al.: The MRX complex stabilizes the replisome independently of the S phase checkpoint during replication stress. EMBO J., 28, 1142-1156 (2009)[PubMed]
- Kobayashi, T., Heck, D. J., Nomura, M. et al.: Expansion and contraction of ribosomal DNA repeats in Saccharomyces cerevisiae: requirement of replication fork blocking (Fob1) protein and the role of RNA polymerase I. Genes Dev., 12, 3821-3830 (1998)[PubMed]
- Ivessa, A. S., Zhou, J. Q. & Zakian, V. A.: The Saccharomyces Pif1p DNA helicase and the highly related Rrm3p have opposite effects on replication fork progression in ribosomal DNA. Cell, 100, 479-489 (2000)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012年 米国Weill Cornell Graduate School of Medical Sciences博士課程 修了,2015年より東京大学分子細胞生物学研究所 助教.
研究テーマ:複製が阻害された際に生じるDNA 2本鎖切断の修復の機構.
小林 武彦(Takehiko Kobayashi)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://lafula-com.info/kobayashiken/CytoGen/
© 2017 佐々木真理子・小林武彦 Licensed under CC 表示 2.1 日本