タンパク質に対する要求はドーパミン作動性ニューロンの分枝に特異的な可塑性により符号化される
田渕理史・Mark N. Wu
(米国Johns Hopkins大学Department of Neurology)
email:田渕理史
DOI: 10.7875/first.author.2017.039
Branch-specific plasticity of a bifunctional dopamine circuit encodes protein hunger.
Qili Liu, Masashi Tabuchi, Sha Liu, Lay Kodama, Wakako Horiuchi, Jay Daniels, Lucinda Chiu, Daniel Baldoni, Mark N. Wu
Science, 356, 534-539 (2017)
食物の摂取においてはつねに“何をどのくらい食べるか”という重要な選択が存在する.栄養成分に特異的な要求に由来する食物の選択は生物の生存戦略においてとくに重要であると考えられるが,これに関する神経基盤についてはよくわかっていない.筆者らは,ショウジョウバエにおいて,タンパク質に対する要求は特定のドーパミン作動性ニューロンの分枝に特異的な可塑性の変化により符号化されることを見い出した.同定された特定のドーパミン作動性ニューロンの神経活動はタンパク質の不足に依存して増大し,この神経活動の増大はタンパク質の摂取の増加をひき起こすと同時に糖質の摂取の減少をもひき起こした.さらに,このような栄養に特異的な嗜好性の変化は,このニューロンの出力先である2つのニューロンとのあいだのシナプスにおける分枝に特異的な可塑性の変化および持続性の変化に起因した.この研究により,食物の摂取におけるタンパク質の摂取における恒常性の維持のためのニューロンの分枝に特異的な可塑性にもとづく神経基盤の一端が明らかにされた.
食物の摂取においては“どのくらい食べるか”というカロリーに対する要求をみたすための選択があるが,これにくわえ,“何を食べるか”という栄養成分に特異的な要求に由来する選択も存在し,これは生物の生存戦略においてとくに重要であると考えられる.各種の栄養成分のなかでも,タンパク質は生物にとり欠くことのできない重要な栄養素である1).とりわけ,ヒトを含め生物の幼年期や妊娠期にはタンパク質の要求量が増加することが知られている2,3).近年,ショウジョウバエをモデルとしてタンパク質に対する要求の神経機構がさかんに研究されている.しかし,これまで,タンパク質に対する要求を脳において符号化する特定のニューロンは同定されていない.近年,交尾ののちの妊娠したショウジョウバエにおいてタンパク質に対する要求量が増加することが明らかにされており4,5),筆者らは,これをタンパク質に対する要求の神経機構のモデルとして用いた.
ショウジョウバエにおいてタンパク質の不足に依存して神経活動の増大するニューロンを同定するため,行動実験による網羅的なスクリーニングを実施した.交尾したメスのショウジョウバエにタンパク質源として酵母を摂取させ,同時に,ショウジョウバエにおいて豊富にある遺伝学的なツールを用いて各種のニューロンのタイプごとに神経活動を停止させた.もし,標的としたニューロンがタンパク質の不足に依存して神経活動を増大させるニューロンだとすると,その神経活動を人為的に停止させることによりタンパク質に対する要求量は減少する.その結果,脳の片方の半球に1組ずつ存在する特定のドーパミン作動性ニューロンが同定され,DA-WEDニューロンと命名された.実際に,このDA-WEDニューロンの膜活動性を穿孔パッチクランプ法6) により測定したところ,自発的なスパイク発火および電流の注入に対する内因的な応答において,タンパク質の不足に依存して増大した.
DA-WEDニューロンの神経活動を人為的に停止させた場合,交尾したメスのショウジョウバエにおいてタンパク質に対する要求量が低下する同時に,糖質に対する要求量も増大した.すなわち,DA-WEDニューロンの神経活動の増大はタンパク質の摂取の増加をひき起こすと同時に,糖質の摂取の減少をもひき起こすという2つの機能をもつことが示唆された.そこで,DA-WEDニューロンの下流においてシナプスを形成するニューロンおよびそのシナプス受容体を同定するため,GRASP(GFP reconstitution across synaptic partners)法7) とよばれる網羅的なスクリーニングを実施した.この方法を用いると,同定されたひとつのニューロンと単シナプス結合する可能性のあるニューロンを遺伝学的に標識することができる.その結果,DA-WEDニューロンの下流においてシナプスを形成する2つのニューロンが同定され,それぞれ,FB-LALニューロンおよびPLPニューロンと命名された.
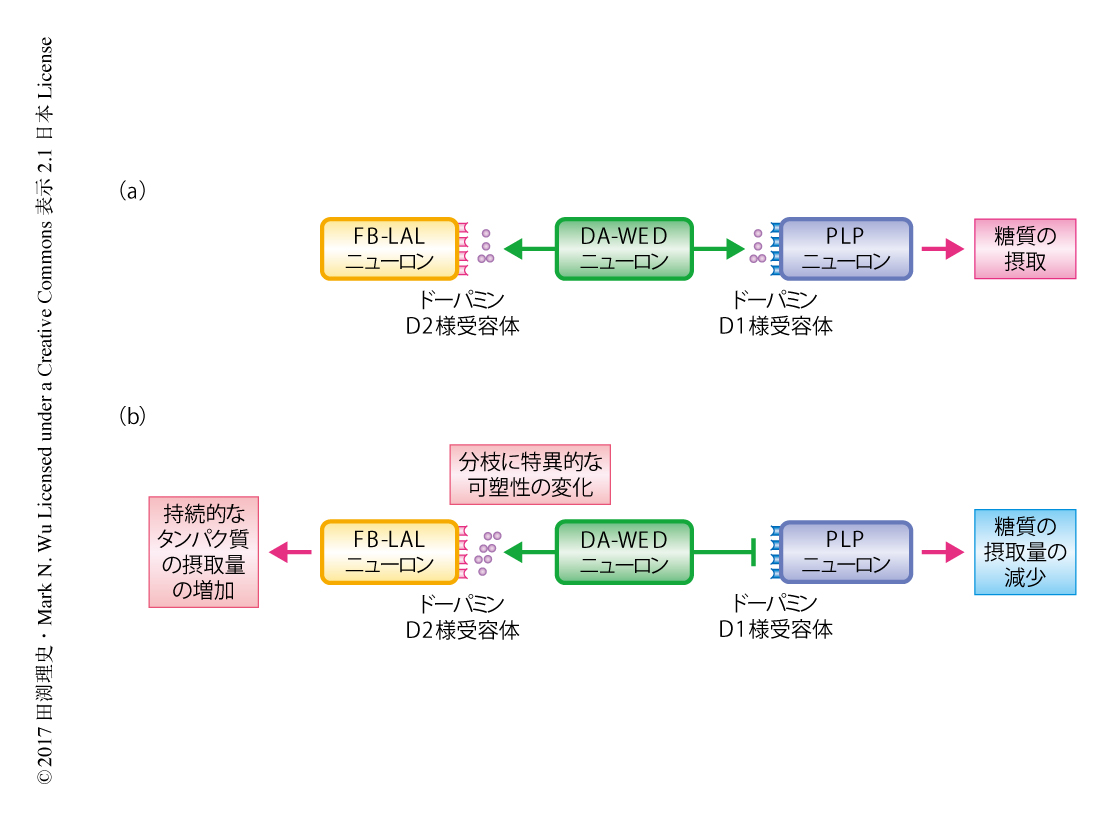
DA-WEDニューロンとFB-LALニューロンあるいはPLPニューロンとのあいだにどのようなシナプス受容体が存在するかマイクロRNAを用いたノックダウン法により調べた.その結果,DA-WEDニューロンにおけるFB-LALニューロンあるいはPLPニューロンを出力先とする2つの分枝それぞれに異なるシナプス受容体が存在した.具体的には,DA-WEDニューロンとPLPニューロンとのあいだのシナプスにはドーパミンD1様受容体が,DA-WEDニューロンとFB-LALニューロンとのあいだのシナプスにはドーパミンD2様受容体が機能的に発現していた.さらに,行動学的な解析により,DA-WEDニューロンにおける2つの分枝それぞれが下流に位置するFB-LALニューロンおよびPLPニューロンに特異的にシグナルを伝達することによりタンパク質の摂取の増加および糖質の摂取の減少の両方を担うことが示された.すなわち,ドーパミンD1様受容体を発現する分枝がDA-WEDニューロンとPLPニューロンとのあいだのシナプス伝達を抑制することにより糖質の摂取の減少をひき起こし,ドーパミンD2様受容体を発現する分枝がDA-WEDニューロンとFB-LALニューロンとのあいだのシナプス伝達を促進することによりタンパク質の摂取の増加をひき起こしている可能性が示唆された(図1).
タンパク質の摂取の増加を符号化するドーパミンD2様受容体を発現するDA-WEDニューロンとFB-LALニューロンとのあいだのシナプスに対し微小電極を用いた細胞内記録法を適用し後シナプス電位を解析した.その結果,タンパク質の不足した状態において,FB-LALニューロンから測定した自発的な後シナプス電位は対照と比較して発生の頻度および振幅ともに有意に増加した.また,タンパク質の不足した状態においてもドーパミンD2様受容体をノックダウンした場合には,後シナプス電位の発生の頻度および振幅ともに大幅に減少した.これらの結果から,電気生理学的な解析により,タンパク質の摂取の増加を符号化するドーパミンD2様受容体を発現する分枝におけるDA-WEDニューロンとFB-LALニューロンとのあいだのシナプスの後シナプス電位は,少なくとも部分的には,ドーパミンD2様受容体を介してタンパク質の不足に応答して発生の頻度および振幅ともに大幅に増加することが明らかにされた.
DA-WEDニューロンにdTrpA1とよばれる熱応答性の非選択的な陽イオンチャネル8) を導入することにより,温度に依存してDA-WEDニューロンの神経活動を操作することを試みた.DA-WEDニューロンの神経活動を増加させたところ,タンパク質の摂取量は大幅に増加した.この増加は,温度の操作を停止したのちも6時間にわたり持続した.さらに,このタンパク質の摂取量の増加と相関して,タンパク質の摂取の増加を符号化するドーパミンD2様受容体を発現する分枝の伸長が確認された.この分枝の伸長はドーパミンD2様受容体を発現する分枝に特異的であり,ドーパミンD1様受容体を発現する分枝の伸長は確認されなかった.さらに,DA-WEDニューロンの神経活動を増加により糖質の摂取量は減少したが,この減少は温度の操作を停止したのち約1時間しか持続しなかった.以上の結果から,タンパク質に対する要求を符号化するDA-WEDニューロンの可塑性は分枝に特異的かつ持続的な形態の変化をともなうことが明らかにされた(図1).
筆者らは,DA-WEDニューロンがタンパク質に対する要求を符号化することを明らかにした.このタンパク質に対する要求の符号化は,タンパク質の摂取における恒常性の維持に必要不可欠であり,DA-WEDニューロンは2つの異なる時間スケールにおいて機能を発揮する可能性が示唆された.ひとつは,タンパク質が不足した直後に“糖質嗜好モード”から“タンパク質嗜好モード”に切り替える短い時間スケールでのスイッチ的な機能である.DA-WEDニューロンの神経活動が増加し,FB-LALニューロンへの出力を担うドーパミンD2様受容体を発現する分枝に対し特異的にシナプス伝達が促進されることによりタンパク質の摂取の増加がひき起こされ,一方,PLPニューロンへの出力を担うドーパミンD1様受容体を発現する分枝においてはシナプス伝達が抑制され糖質の摂取の減少がひき起こされる結果,“糖質嗜好モード”から“タンパク質嗜好モード”へのスイッチングが起こる.もうひとつ,長い時間スケールにおけるDA-WEDニューロンによるタンパク質に対する要求の符号化については,分枝に特異的かつ持続的な可塑性の変化により担われており,それらはタンパク質の摂取における恒常性の維持に必要不可欠な機能なのではないだろうか.自然界における生物学的な意義としては,DA-WEDニューロンの一過的な神経活動の増加は採餌活動の際のタンパク質に対する選択性の促進に役だち,DA-WEDニューロンの分枝に特異的かつ持続的な可塑性の変化は採餌活動ののちのタンパク質の消費の維持に寄与するのかもしれない.なお,生理学的な観点において,ニューロンの分枝に特異的な可塑性はおもに樹状突起において報告されているが9,10),今回のDA-WEDニューロンの分枝に特異的な可塑性の変化は神経終末において起こっており,この点でも新規性を含むといえる.現在,筆者らは,DA-WEDニューロンの分枝に特異的な可塑性の分子レベルおよび細胞レベルでの神経機構について,細部にわたりさらなる検討を進めている.
略歴:2013年 東京大学大学院工学系研究科博士課程 修了,同年より米国Johns Hopkins大学 博士研究員.
研究テーマ:脳の機能の解明およびその制御.
抱負:どのような現象が脳の性能を決めるのか,その現象にはどんな分子が関与するのか,その分子を制御すれば脳の性能を意のままに操れるのか,明らかにしていきたい.
Mark N. Wu
米国Johns Hopkins大学 准教授.
研究室URL:http://www.markwulab.net/home
© 2017 田渕理史・Mark N. Wu Licensed under CC 表示 2.1 日本
(米国Johns Hopkins大学Department of Neurology)
email:田渕理史
DOI: 10.7875/first.author.2017.039
Branch-specific plasticity of a bifunctional dopamine circuit encodes protein hunger.
Qili Liu, Masashi Tabuchi, Sha Liu, Lay Kodama, Wakako Horiuchi, Jay Daniels, Lucinda Chiu, Daniel Baldoni, Mark N. Wu
Science, 356, 534-539 (2017)
要 約
食物の摂取においてはつねに“何をどのくらい食べるか”という重要な選択が存在する.栄養成分に特異的な要求に由来する食物の選択は生物の生存戦略においてとくに重要であると考えられるが,これに関する神経基盤についてはよくわかっていない.筆者らは,ショウジョウバエにおいて,タンパク質に対する要求は特定のドーパミン作動性ニューロンの分枝に特異的な可塑性の変化により符号化されることを見い出した.同定された特定のドーパミン作動性ニューロンの神経活動はタンパク質の不足に依存して増大し,この神経活動の増大はタンパク質の摂取の増加をひき起こすと同時に糖質の摂取の減少をもひき起こした.さらに,このような栄養に特異的な嗜好性の変化は,このニューロンの出力先である2つのニューロンとのあいだのシナプスにおける分枝に特異的な可塑性の変化および持続性の変化に起因した.この研究により,食物の摂取におけるタンパク質の摂取における恒常性の維持のためのニューロンの分枝に特異的な可塑性にもとづく神経基盤の一端が明らかにされた.
はじめに
食物の摂取においては“どのくらい食べるか”というカロリーに対する要求をみたすための選択があるが,これにくわえ,“何を食べるか”という栄養成分に特異的な要求に由来する選択も存在し,これは生物の生存戦略においてとくに重要であると考えられる.各種の栄養成分のなかでも,タンパク質は生物にとり欠くことのできない重要な栄養素である1).とりわけ,ヒトを含め生物の幼年期や妊娠期にはタンパク質の要求量が増加することが知られている2,3).近年,ショウジョウバエをモデルとしてタンパク質に対する要求の神経機構がさかんに研究されている.しかし,これまで,タンパク質に対する要求を脳において符号化する特定のニューロンは同定されていない.近年,交尾ののちの妊娠したショウジョウバエにおいてタンパク質に対する要求量が増加することが明らかにされており4,5),筆者らは,これをタンパク質に対する要求の神経機構のモデルとして用いた.
1.タンパク質の不足に依存して神経活動の増大するドーパミン作動性ニューロンの同定
ショウジョウバエにおいてタンパク質の不足に依存して神経活動の増大するニューロンを同定するため,行動実験による網羅的なスクリーニングを実施した.交尾したメスのショウジョウバエにタンパク質源として酵母を摂取させ,同時に,ショウジョウバエにおいて豊富にある遺伝学的なツールを用いて各種のニューロンのタイプごとに神経活動を停止させた.もし,標的としたニューロンがタンパク質の不足に依存して神経活動を増大させるニューロンだとすると,その神経活動を人為的に停止させることによりタンパク質に対する要求量は減少する.その結果,脳の片方の半球に1組ずつ存在する特定のドーパミン作動性ニューロンが同定され,DA-WEDニューロンと命名された.実際に,このDA-WEDニューロンの膜活動性を穿孔パッチクランプ法6) により測定したところ,自発的なスパイク発火および電流の注入に対する内因的な応答において,タンパク質の不足に依存して増大した.
2.DA-WEDニューロンの神経活動の増大は糖質の摂取の減少をも誘発する
DA-WEDニューロンの神経活動を人為的に停止させた場合,交尾したメスのショウジョウバエにおいてタンパク質に対する要求量が低下する同時に,糖質に対する要求量も増大した.すなわち,DA-WEDニューロンの神経活動の増大はタンパク質の摂取の増加をひき起こすと同時に,糖質の摂取の減少をもひき起こすという2つの機能をもつことが示唆された.そこで,DA-WEDニューロンの下流においてシナプスを形成するニューロンおよびそのシナプス受容体を同定するため,GRASP(GFP reconstitution across synaptic partners)法7) とよばれる網羅的なスクリーニングを実施した.この方法を用いると,同定されたひとつのニューロンと単シナプス結合する可能性のあるニューロンを遺伝学的に標識することができる.その結果,DA-WEDニューロンの下流においてシナプスを形成する2つのニューロンが同定され,それぞれ,FB-LALニューロンおよびPLPニューロンと命名された.
3.DA-WEDニューロンにおけるシナプスの特性は2つの分枝それぞれに正反対である
DA-WEDニューロンとFB-LALニューロンあるいはPLPニューロンとのあいだにどのようなシナプス受容体が存在するかマイクロRNAを用いたノックダウン法により調べた.その結果,DA-WEDニューロンにおけるFB-LALニューロンあるいはPLPニューロンを出力先とする2つの分枝それぞれに異なるシナプス受容体が存在した.具体的には,DA-WEDニューロンとPLPニューロンとのあいだのシナプスにはドーパミンD1様受容体が,DA-WEDニューロンとFB-LALニューロンとのあいだのシナプスにはドーパミンD2様受容体が機能的に発現していた.さらに,行動学的な解析により,DA-WEDニューロンにおける2つの分枝それぞれが下流に位置するFB-LALニューロンおよびPLPニューロンに特異的にシグナルを伝達することによりタンパク質の摂取の増加および糖質の摂取の減少の両方を担うことが示された.すなわち,ドーパミンD1様受容体を発現する分枝がDA-WEDニューロンとPLPニューロンとのあいだのシナプス伝達を抑制することにより糖質の摂取の減少をひき起こし,ドーパミンD2様受容体を発現する分枝がDA-WEDニューロンとFB-LALニューロンとのあいだのシナプス伝達を促進することによりタンパク質の摂取の増加をひき起こしている可能性が示唆された(図1).
4.DA-WEDニューロンとFB-LALニューロンとのあいだのシナプスの電気生理学的な特性
タンパク質の摂取の増加を符号化するドーパミンD2様受容体を発現するDA-WEDニューロンとFB-LALニューロンとのあいだのシナプスに対し微小電極を用いた細胞内記録法を適用し後シナプス電位を解析した.その結果,タンパク質の不足した状態において,FB-LALニューロンから測定した自発的な後シナプス電位は対照と比較して発生の頻度および振幅ともに有意に増加した.また,タンパク質の不足した状態においてもドーパミンD2様受容体をノックダウンした場合には,後シナプス電位の発生の頻度および振幅ともに大幅に減少した.これらの結果から,電気生理学的な解析により,タンパク質の摂取の増加を符号化するドーパミンD2様受容体を発現する分枝におけるDA-WEDニューロンとFB-LALニューロンとのあいだのシナプスの後シナプス電位は,少なくとも部分的には,ドーパミンD2様受容体を介してタンパク質の不足に応答して発生の頻度および振幅ともに大幅に増加することが明らかにされた.
5.DA-WEDニューロンの可塑性は分枝に特異的かつ持続的な形態の変化をともなう
DA-WEDニューロンにdTrpA1とよばれる熱応答性の非選択的な陽イオンチャネル8) を導入することにより,温度に依存してDA-WEDニューロンの神経活動を操作することを試みた.DA-WEDニューロンの神経活動を増加させたところ,タンパク質の摂取量は大幅に増加した.この増加は,温度の操作を停止したのちも6時間にわたり持続した.さらに,このタンパク質の摂取量の増加と相関して,タンパク質の摂取の増加を符号化するドーパミンD2様受容体を発現する分枝の伸長が確認された.この分枝の伸長はドーパミンD2様受容体を発現する分枝に特異的であり,ドーパミンD1様受容体を発現する分枝の伸長は確認されなかった.さらに,DA-WEDニューロンの神経活動を増加により糖質の摂取量は減少したが,この減少は温度の操作を停止したのち約1時間しか持続しなかった.以上の結果から,タンパク質に対する要求を符号化するDA-WEDニューロンの可塑性は分枝に特異的かつ持続的な形態の変化をともなうことが明らかにされた(図1).
おわりに
筆者らは,DA-WEDニューロンがタンパク質に対する要求を符号化することを明らかにした.このタンパク質に対する要求の符号化は,タンパク質の摂取における恒常性の維持に必要不可欠であり,DA-WEDニューロンは2つの異なる時間スケールにおいて機能を発揮する可能性が示唆された.ひとつは,タンパク質が不足した直後に“糖質嗜好モード”から“タンパク質嗜好モード”に切り替える短い時間スケールでのスイッチ的な機能である.DA-WEDニューロンの神経活動が増加し,FB-LALニューロンへの出力を担うドーパミンD2様受容体を発現する分枝に対し特異的にシナプス伝達が促進されることによりタンパク質の摂取の増加がひき起こされ,一方,PLPニューロンへの出力を担うドーパミンD1様受容体を発現する分枝においてはシナプス伝達が抑制され糖質の摂取の減少がひき起こされる結果,“糖質嗜好モード”から“タンパク質嗜好モード”へのスイッチングが起こる.もうひとつ,長い時間スケールにおけるDA-WEDニューロンによるタンパク質に対する要求の符号化については,分枝に特異的かつ持続的な可塑性の変化により担われており,それらはタンパク質の摂取における恒常性の維持に必要不可欠な機能なのではないだろうか.自然界における生物学的な意義としては,DA-WEDニューロンの一過的な神経活動の増加は採餌活動の際のタンパク質に対する選択性の促進に役だち,DA-WEDニューロンの分枝に特異的かつ持続的な可塑性の変化は採餌活動ののちのタンパク質の消費の維持に寄与するのかもしれない.なお,生理学的な観点において,ニューロンの分枝に特異的な可塑性はおもに樹状突起において報告されているが9,10),今回のDA-WEDニューロンの分枝に特異的な可塑性の変化は神経終末において起こっており,この点でも新規性を含むといえる.現在,筆者らは,DA-WEDニューロンの分枝に特異的な可塑性の分子レベルおよび細胞レベルでの神経機構について,細部にわたりさらなる検討を進めている.
文 献
- Berthoud, H. R., Munzberg, H., Richards, B. K. et al.: Neural and metabolic regulation of macronutrient intake and selection. Proc. Nutr. Soc., 71, 390-400 (2012)[PubMed]
- Deutsch, J. A., Moore, B. O. & Heinrichs, S. C.: Unlearned specific appetite for protein. Physiol. Behav., 46, 619-624 (1989)[PubMed]
- White, B. D., Porter, M. H. & Martin, R. J.: Effects of age on the feeding response to moderately low dietary protein in rats. Physiol. Behav., 68, 673-681 (2000)[PubMed]
- Ribeiro, C. & Dickson, B. J.: Sex peptide receptor and neuronal TOR/S6K signaling modulate nutrient balancing in Drosophila. Curr. Biol., 20, 1000-1005 (2010)[PubMed]
- Toshima, N. & Tanimura, T.: Taste preference for amino acids is dependent on internal nutritional state in Drosophila melanogaster. J. Exp. Biol., 215, 2827-2832 (2012)[PubMed]
- Liu, S., Liu, Q., Tabuchi, M. et al.: Sleep drive is encoded by neural plastic changes in a dedicated circuit. Cell, 165, 1347-1360 (2016)[PubMed]
- Gordon, M. D. & Scott, K.: Motor control in a Drosophila taste circuit. Neuron, 61, 373-384 (2009)[PubMed]
- Aso, Y., Sitaraman, D., Ichinose, T. et al.: Mushroom body output neurons encode valence and guide memory-based action selection in Drosophila. ELife, 3, e04580 (2014)[PubMed]
- Cichon, J. & Gan, W. B.: Branch-specific dendritic Ca2+ spikes cause persistent synaptic plasticity. Nature, 520, 180-185 (2015)[PubMed]
- Fauth, M. & Tetzlaff, C.: Opposing effects of neuronal activity on structural plasticity. Front. Neuroanat., 10, 75 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2013年 東京大学大学院工学系研究科博士課程 修了,同年より米国Johns Hopkins大学 博士研究員.
研究テーマ:脳の機能の解明およびその制御.
抱負:どのような現象が脳の性能を決めるのか,その現象にはどんな分子が関与するのか,その分子を制御すれば脳の性能を意のままに操れるのか,明らかにしていきたい.
Mark N. Wu
米国Johns Hopkins大学 准教授.
研究室URL:http://www.markwulab.net/home
© 2017 田渕理史・Mark N. Wu Licensed under CC 表示 2.1 日本