ReelinシグナルとStk25による神経極性およびゴルジ体の形態の制御
松木 亨・Brian W. Howell
(米国New York州立大学Upstate Medical University,Department of Neuroscience and Physiology)
email:松木 亨
DOI: 10.7875/first.author.2010.067
Reelin and Stk25 have opposing roles in neuronal polarization and dendritic Golgi deployment.
Tohru Matsuki, Russell T. Matthews, Jonathan A. Cooper, Marcel P. van der Brug, Mark R. Cookson, John A. Hardy, Eric C. Olson, Brian W. Howell
Cell, 143, 826-836 (2010)
Reelin-Dab1シグナル伝達系は脳の層構造の形成や樹状突起の伸長など多くの神経発達イベントに重要で,その主要な構成タンパク質であるDab1の変異マウスではさまざまな発達障害の生じることが知られている.これまで筆者らは,細胞極性の制御への関与が示唆されていたStk25がReelin-Dab1シグナル伝達系の修飾タンパク質であることを見い出していた.したがって,神経極性の制御においてReelin-Dab1シグナル伝達系およびStk25の関与する機構の解明は,軸索や樹状突起の形成をも含む神経極性の制御機構を理解するために重要である.この研究で筆者らは,Stk25が神経極性の制御において中心的な役割を担うLKB1シグナル伝達系およびゴルジ体タンパク質GM130と相互作用し,ゴルジ体の形態制御とともに軸索の形成に関与することを明らかにした.一方,Reelin-Dab1シグナル伝達系はこれら2つの機構においてStk25と拮抗作用を示すことがわかった.以上の結果は,Reelin-Dab1シグナル伝達機構の解明とともに,Stk25の関与する神経極性の制御機構の解明に貢献するだけでなく,ニューロンの発達におけるゴルジ体の重要性を示すものでもあった.
神経伝達物質を介し行われるシグナル伝達は脳の担う機能のなかでももっとも重要なもののひとつである.この機能をおもに担うニューロンは極性を示す典型的な細胞のひとつであり,通常,1本の軸索と複数の樹状突起とをもつ1).樹状突起によって受信された神経伝達シグナルはニューロンにおいて統合,処理され,軸索から標的細胞へと神経伝達物質を放出することでシグナル伝達が制御されている.ニューロンの発達過程における未分化の神経突起からの軸索や樹状突起の形成機構に関してはこれまでにも多くの報告がなされてきた.それらに関する知見から,in vitro,in vivoともに,未分化状態の神経突起が分化する際にはまず軸索の形成が生じ,ついで,樹状突起の形成の生じることがわかっている2).このような神経極性の制御機構においてゴルジ体は軸索となる神経突起のそばに位置しており,軸索の決定ののちは先端樹状突起へと分化する神経突起の近傍へと細胞質を移動する現象が報告されている3).そのため,神経極性の制御におけるゴルジ体の関与が示唆されている.
Reelin-Dab1シグナル伝達系は脳の発達期においてニューロンの位置決定に重要な役割をはたしているだけでなく4),樹状突起の伸長や5,6),長期増強の誘導および維持など7),さまざまな生理現象に重要である.一方,Stk25はste20様キナーゼファミリーに属するセリン・スレオニンキナーゼであり細胞移動や細胞極性の制御に関与することが示唆されている8).また,細胞極性の制御機構において機能するタンパク質としてLKB1がよく知られており,STRADα,Mo25とともに複合体を形成して神経極性を制御している9).
Stk25は細胞極性と移動に関与することがHeLa細胞を用いた研究から示唆されていたことにくわえ,Ste20様キナーゼファミリーに属するタンパク質のなかには細胞極性の制御に関与するものが複数あることがわかっていた.そこで,Stk25の神経極性の制御における関与を明らかにするため,レンチウイルスを使用して海馬初代培養ニューロンにおいてStk25をノックダウンまたは過剰発現させた.その結果,Stk25のノックダウンによりニューロンに軸索の形成障害が現われた(図1).興味深いことに,Stk25をニューロンに過剰発現させるとキナーゼ活性の有無にかかわらず複数の軸索の形成が誘導された(図1).しかし,軸索の長さ自体には変化がみられなかったことから,Stk25は軸索の形成機構に関与していると示唆された.
Stk25は,大脳皮質,海馬,小脳においておもにReelin-Dab1シグナル応答性のニューロンで発現がみられること,Dab1ノックアウトマウスにおける修飾タンパク質として同定されていることから,Reelin-Dab1シグナル伝達系が軸索の形成に関与しているのかどうかを初代培養ニューロンを用いて確認した.その結果,Dab1をノックアウトしたニューロンでは野生型ニューロンに比べ複数の軸索の形成されている割合の高いことがわかった.さらに,Dab1をノックアウトしたニューロンにおいてStk25をノックダウンすると複数の軸索をもつニューロンの割合の低下することも明らかになった.興味深いことに,Stk25の過剰発現による複数の軸索の形成はReelinを添加した培地を用いて培養を行うことで阻害され,正常細胞のレベルにまで低下することがわかった.これらの一連の結果から,Reelin-Dab1シグナル伝達系とStk25とは軸索の形成機構において拮抗的に作用していることがわかった(図1).
つぎに,Stk25が生体でも軸索の形成を制御しているのかどうか確認するため,マウス胎仔の海馬CA1錐体細胞においてStk25をノックダウンして生後7日目の錐体細胞における軸索の起始部の有無を確認した.その結果,Stk25をノックダウンした錐体細胞のうち約40%の細胞において軸索の起始部のみられないことがわかった.初代培養ニューロンで得られた結果とあわせることで,Stk25は錐体細胞の軸索の形成に関与していることがわかった.一方,正常なCA1錐体細胞では細胞体から太い先端樹状突起と複数の細い基底樹状突起とが伸長している.興味深いことに,Stk25をノックダウンした錐体細胞では基底樹状突起の直径が先端樹状突起のように太くなり,樹状突起の非対称性の低下していることがわかった.さらに,Stk25をノックダウンした錐体細胞では先端樹状突起が野生型の錐体細胞に比べ有意に長く伸びていることも明らかになった.以上の結果から,Stk25は正常な軸索の形成と非対称性をともなう樹状突起の形成に必要なことがわかった.
Stk25の神経極性の制御における役割はLKB1シグナル伝達系の示す役割と非常に似ていることがわかった.すなわち,LKB1シグナル伝達系は細胞極性の制御において中心的な役割を担っており,その阻害は軸索の形成障害や大脳皮質におけるニューロンの移動障害を誘導する9).そこで,Stk25とLKB1シグナル伝達系との関連性について調べるため,LKB1シグナル伝達系の各構成タンパク質とStk25との結合実験を行った.その結果,Stk25はSTRADαと直接に結合することがわかった.LKB1の関与する細胞極性の制御機構にはLKB1シグナル伝達系の構成タンパク質のひとつであるSTRADαの発現の必要なことがわかっている.そこで,Stk25の細胞極性の制御への影響を調べるため,STRADαの発現を調節できるW4細胞を用いて細胞極性の誘導実験を行った.その結果,Stk25をノックダウンしたW4細胞ではLKB1とSTRADαとがともに発現していても細胞極性の制御のできないことがわかった.ニューロンではLKB1をノックダウンすると軸索の形成不全の誘導されることがわかっているが,Stk25の過剰発現によってLKB1ノックダウンによる軸索の形成不全の回復することがわかった.以上の結果から,Stk25はLKB1シグナル伝達系の下流ではたらき,軸索の形成を制御していることがわかった.
野生型Stk25はゴルジ体タンパク質であるGM130と直接に結合し,それらの細胞での局在も一致する.しかし,キナーゼ活性を失ったStk25変異体は野生型とは異なり細胞質の全体に局在することが報告されていた8).しかし,この研究の結果から,Stk25のキナーゼ活性は神経極性の制御に必要ではないことがわかったため,GM130との結合についてあらためて確認した.その結果,キナーゼ活性の有無に関係なくStk25はGM130に直接に結合することが明らかとなった.HeLa細胞で示されたStk25の細胞での局在性がニューロンにおいても同様であるかどうか調べるため,Stk25に特異的な抗体を用いてニューロンにおける局在を確認した.その結果,ニューロンにおける内在性Stk25もまたおもにゴルジ体に局在していることがわかった.そこで,GM130の神経極性の制御への関与を調べるため内在性のGM130をノックダウンしたところ,Stk25やLKB1をノックダウンした場合と同じように軸索の形成不全を生じることがわかった.一方,GM130をノックダウンした細胞にStk25を強制発現しても軸索の形成不全を解消できないことから,GM130はStk25の下流で神経極性の制御に関与しているものと推測された.
ニューロンの発達において細胞質におけるゴルジ体の位置は軸索の決定に関与すると示唆される3).そのため,ゴルジ体の形態制御は神経発生において重要であるものと考えられる.また,Stk25またはGM130のノックダウンはゴルジ体の断片化を誘導することもわかっている8,10).そこで,Stk25,GM130,LKB1のゴルジ体の形態制御への影響を調べるため,ニューロンにおいてそれぞれをノックダウン,または,Stk25の過剰発現を行った.その結果,それぞれをノックダウンするとニューロンのゴルジ体が断片化を起こすことがわかった.とくに,LKB1のノックダウンにより誘導されるゴルジ体の断片化はStk25の過剰発現により回復することがわかった.一方,正常なCA1錐体細胞ではゴルジ体は先端樹状突起の近傍に局在しているが,Stk25をノックダウンするとゴルジ体は断片化を生じるとともに細胞質の全域に分散して局在することがわかった.以上の結果から,Stk25,LKB1,GM130がゴルジ体の正常な形態形成に必要であることがわかった.
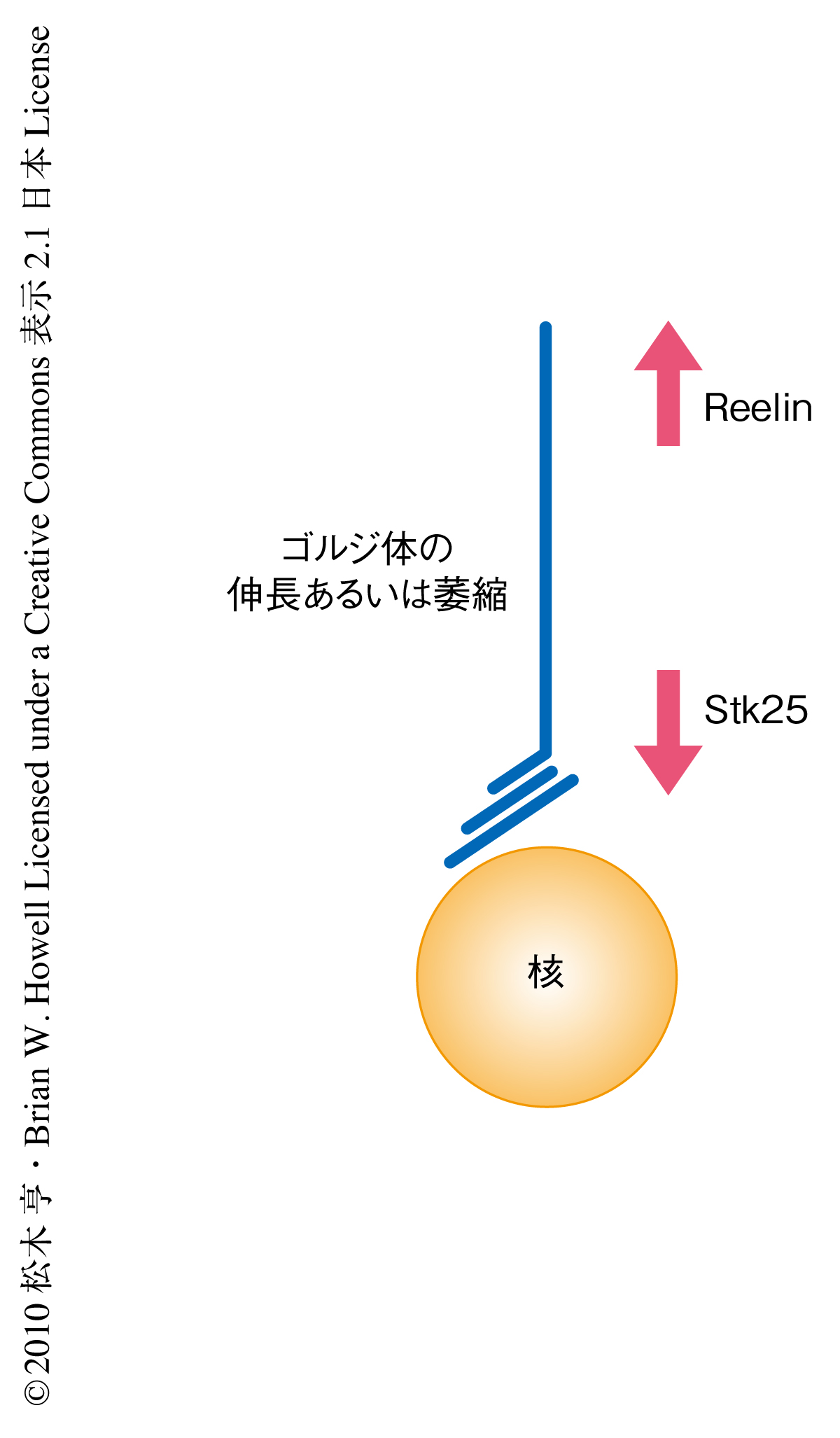
さきに述べたように,Stk25とReelin-Dab1シグナル伝達系とは軸索の形成機構において拮抗的にはたらいている.そこで,Stk25とReelin-Dab1シグナル伝達系のゴルジ体の形態形成および維持への影響を生体において調べるため,ReelinノックアウトマウスまたはDab1ノックアウトマウスおよび野生型マウスの新生仔の海馬CA1錐体細胞におけるゴルジ体の形態観察を行った.この結果,野生型マウスのゴルジ体は先端樹状突起内に長く伸長しているのに対して,ReelinノックアウトマウスまたはDab1ノックアウトマウスではゴルジ体の伸長が弱く樹状突起への伸長の十分にみられない錐体細胞も多くみられた.この結果から,Reelin-Dab1シグナル伝達系は生体で直接的あるいは間接的にゴルジ体の伸長を制御していることが示唆された.そこで,Reelin-Dab1シグナル伝達系のゴルジ体の伸長機構の制御への関与を調べるため,海馬初代培養ニューロンを用いてReelin刺激によるゴルジ体の構造変化を調べた.その結果,驚くべきことに,30分間のReelin刺激によりゴルジ体は樹状突起内に長く伸長することがわかった.一連の実験結果から,ゴルジ体の先端樹状突起内への伸長はReelin-Dab1シグナル伝達系に応答した現象であることが明らかとなった.そこで,Reelin-Dab1シグナル伝達系とStk25のゴルジ体の構造への影響を調べるため,Stk25を過剰発現させたニューロンをReelinを含む培地で培養した.この結果,キナーゼ活性の有無にかかわらずStk25を過剰発現させたニューロンのゴルジ体は萎縮した形態を示すことがわかった.また,このようなゴルジ体の構造の変化はReelinを含む培地で培養することにより抑制され,Stk25の過剰発現の有無にかかわらずゴルジ体は正常な構造をとることがわかった.以上の結果から,ゴルジ体の伸長あるいは萎縮にみられる構造変化は生体で拮抗的にはたらくReelin-Dab1シグナル伝達系とStk25とのバランスによって決定される現象であると示唆された(図2).
今回,Reelin-Dab1シグナル伝達系およびStk25がゴルジ体の形態の制御および神経極性の制御にはたす役割の一端が明らかになった.しかしながら,神経極性の制御機構にはゴルジ体の移動機構などまだ多くの不明な点が残されており,今後の研究の課題である.Reelin-Dab1シグナル伝達系およびStk25を軸にゴルジ体の神経極性の制御にはたす役割についてより研究を進めることによって,ニューロンの発達のみならず脳の発達機構についてより理解の進むものと期待される.
略歴:2000年 大阪大学大学院理学研究科博士後期課程 修了,同年 理化学研究所脳科学総合研究センター 研究員.2004年 米国NIH客員研究員を経て,2008年より米国New York州立大学Upstate Medical UniversityにてPostdoctoral Associate.
研究テーマ:シグナル伝達系の研究をとおし脳形成の分子機構を理解する.
抱負:生命を理解するための根幹となる研究を心がけたい.
Brian W. Howell
米国New York州立大学Upstate Medical UniversityにてAssistant Professor.
© 2010 松木 亨・Brian W. Howell Licensed under CC 表示 2.1 日本
(米国New York州立大学Upstate Medical University,Department of Neuroscience and Physiology)
email:松木 亨
DOI: 10.7875/first.author.2010.067
Reelin and Stk25 have opposing roles in neuronal polarization and dendritic Golgi deployment.
Tohru Matsuki, Russell T. Matthews, Jonathan A. Cooper, Marcel P. van der Brug, Mark R. Cookson, John A. Hardy, Eric C. Olson, Brian W. Howell
Cell, 143, 826-836 (2010)
要 約
Reelin-Dab1シグナル伝達系は脳の層構造の形成や樹状突起の伸長など多くの神経発達イベントに重要で,その主要な構成タンパク質であるDab1の変異マウスではさまざまな発達障害の生じることが知られている.これまで筆者らは,細胞極性の制御への関与が示唆されていたStk25がReelin-Dab1シグナル伝達系の修飾タンパク質であることを見い出していた.したがって,神経極性の制御においてReelin-Dab1シグナル伝達系およびStk25の関与する機構の解明は,軸索や樹状突起の形成をも含む神経極性の制御機構を理解するために重要である.この研究で筆者らは,Stk25が神経極性の制御において中心的な役割を担うLKB1シグナル伝達系およびゴルジ体タンパク質GM130と相互作用し,ゴルジ体の形態制御とともに軸索の形成に関与することを明らかにした.一方,Reelin-Dab1シグナル伝達系はこれら2つの機構においてStk25と拮抗作用を示すことがわかった.以上の結果は,Reelin-Dab1シグナル伝達機構の解明とともに,Stk25の関与する神経極性の制御機構の解明に貢献するだけでなく,ニューロンの発達におけるゴルジ体の重要性を示すものでもあった.
はじめに
神経伝達物質を介し行われるシグナル伝達は脳の担う機能のなかでももっとも重要なもののひとつである.この機能をおもに担うニューロンは極性を示す典型的な細胞のひとつであり,通常,1本の軸索と複数の樹状突起とをもつ1).樹状突起によって受信された神経伝達シグナルはニューロンにおいて統合,処理され,軸索から標的細胞へと神経伝達物質を放出することでシグナル伝達が制御されている.ニューロンの発達過程における未分化の神経突起からの軸索や樹状突起の形成機構に関してはこれまでにも多くの報告がなされてきた.それらに関する知見から,in vitro,in vivoともに,未分化状態の神経突起が分化する際にはまず軸索の形成が生じ,ついで,樹状突起の形成の生じることがわかっている2).このような神経極性の制御機構においてゴルジ体は軸索となる神経突起のそばに位置しており,軸索の決定ののちは先端樹状突起へと分化する神経突起の近傍へと細胞質を移動する現象が報告されている3).そのため,神経極性の制御におけるゴルジ体の関与が示唆されている.
Reelin-Dab1シグナル伝達系は脳の発達期においてニューロンの位置決定に重要な役割をはたしているだけでなく4),樹状突起の伸長や5,6),長期増強の誘導および維持など7),さまざまな生理現象に重要である.一方,Stk25はste20様キナーゼファミリーに属するセリン・スレオニンキナーゼであり細胞移動や細胞極性の制御に関与することが示唆されている8).また,細胞極性の制御機構において機能するタンパク質としてLKB1がよく知られており,STRADα,Mo25とともに複合体を形成して神経極性を制御している9).
1.Stk25は神経極性を制御する
Stk25は細胞極性と移動に関与することがHeLa細胞を用いた研究から示唆されていたことにくわえ,Ste20様キナーゼファミリーに属するタンパク質のなかには細胞極性の制御に関与するものが複数あることがわかっていた.そこで,Stk25の神経極性の制御における関与を明らかにするため,レンチウイルスを使用して海馬初代培養ニューロンにおいてStk25をノックダウンまたは過剰発現させた.その結果,Stk25のノックダウンによりニューロンに軸索の形成障害が現われた(図1).興味深いことに,Stk25をニューロンに過剰発現させるとキナーゼ活性の有無にかかわらず複数の軸索の形成が誘導された(図1).しかし,軸索の長さ自体には変化がみられなかったことから,Stk25は軸索の形成機構に関与していると示唆された.
2.Reelin-Dab1シグナル伝達系は複数の軸索の形成を防いでいる
Stk25は,大脳皮質,海馬,小脳においておもにReelin-Dab1シグナル応答性のニューロンで発現がみられること,Dab1ノックアウトマウスにおける修飾タンパク質として同定されていることから,Reelin-Dab1シグナル伝達系が軸索の形成に関与しているのかどうかを初代培養ニューロンを用いて確認した.その結果,Dab1をノックアウトしたニューロンでは野生型ニューロンに比べ複数の軸索の形成されている割合の高いことがわかった.さらに,Dab1をノックアウトしたニューロンにおいてStk25をノックダウンすると複数の軸索をもつニューロンの割合の低下することも明らかになった.興味深いことに,Stk25の過剰発現による複数の軸索の形成はReelinを添加した培地を用いて培養を行うことで阻害され,正常細胞のレベルにまで低下することがわかった.これらの一連の結果から,Reelin-Dab1シグナル伝達系とStk25とは軸索の形成機構において拮抗的に作用していることがわかった(図1).
3.Stk25は生体で軸索の形成と樹状突起の非対称性を制御している
つぎに,Stk25が生体でも軸索の形成を制御しているのかどうか確認するため,マウス胎仔の海馬CA1錐体細胞においてStk25をノックダウンして生後7日目の錐体細胞における軸索の起始部の有無を確認した.その結果,Stk25をノックダウンした錐体細胞のうち約40%の細胞において軸索の起始部のみられないことがわかった.初代培養ニューロンで得られた結果とあわせることで,Stk25は錐体細胞の軸索の形成に関与していることがわかった.一方,正常なCA1錐体細胞では細胞体から太い先端樹状突起と複数の細い基底樹状突起とが伸長している.興味深いことに,Stk25をノックダウンした錐体細胞では基底樹状突起の直径が先端樹状突起のように太くなり,樹状突起の非対称性の低下していることがわかった.さらに,Stk25をノックダウンした錐体細胞では先端樹状突起が野生型の錐体細胞に比べ有意に長く伸びていることも明らかになった.以上の結果から,Stk25は正常な軸索の形成と非対称性をともなう樹状突起の形成に必要なことがわかった.
4.Stk25はSTRADαと相互作用してLKB1シグナル伝達系により細胞極性を制御する
Stk25の神経極性の制御における役割はLKB1シグナル伝達系の示す役割と非常に似ていることがわかった.すなわち,LKB1シグナル伝達系は細胞極性の制御において中心的な役割を担っており,その阻害は軸索の形成障害や大脳皮質におけるニューロンの移動障害を誘導する9).そこで,Stk25とLKB1シグナル伝達系との関連性について調べるため,LKB1シグナル伝達系の各構成タンパク質とStk25との結合実験を行った.その結果,Stk25はSTRADαと直接に結合することがわかった.LKB1の関与する細胞極性の制御機構にはLKB1シグナル伝達系の構成タンパク質のひとつであるSTRADαの発現の必要なことがわかっている.そこで,Stk25の細胞極性の制御への影響を調べるため,STRADαの発現を調節できるW4細胞を用いて細胞極性の誘導実験を行った.その結果,Stk25をノックダウンしたW4細胞ではLKB1とSTRADαとがともに発現していても細胞極性の制御のできないことがわかった.ニューロンではLKB1をノックダウンすると軸索の形成不全の誘導されることがわかっているが,Stk25の過剰発現によってLKB1ノックダウンによる軸索の形成不全の回復することがわかった.以上の結果から,Stk25はLKB1シグナル伝達系の下流ではたらき,軸索の形成を制御していることがわかった.
5.GM130はStk25と相互作用して軸索の形成を制御している
野生型Stk25はゴルジ体タンパク質であるGM130と直接に結合し,それらの細胞での局在も一致する.しかし,キナーゼ活性を失ったStk25変異体は野生型とは異なり細胞質の全体に局在することが報告されていた8).しかし,この研究の結果から,Stk25のキナーゼ活性は神経極性の制御に必要ではないことがわかったため,GM130との結合についてあらためて確認した.その結果,キナーゼ活性の有無に関係なくStk25はGM130に直接に結合することが明らかとなった.HeLa細胞で示されたStk25の細胞での局在性がニューロンにおいても同様であるかどうか調べるため,Stk25に特異的な抗体を用いてニューロンにおける局在を確認した.その結果,ニューロンにおける内在性Stk25もまたおもにゴルジ体に局在していることがわかった.そこで,GM130の神経極性の制御への関与を調べるため内在性のGM130をノックダウンしたところ,Stk25やLKB1をノックダウンした場合と同じように軸索の形成不全を生じることがわかった.一方,GM130をノックダウンした細胞にStk25を強制発現しても軸索の形成不全を解消できないことから,GM130はStk25の下流で神経極性の制御に関与しているものと推測された.
6.Stk25,GM130,LKB1はともにゴルジ体の局在を制御している
ニューロンの発達において細胞質におけるゴルジ体の位置は軸索の決定に関与すると示唆される3).そのため,ゴルジ体の形態制御は神経発生において重要であるものと考えられる.また,Stk25またはGM130のノックダウンはゴルジ体の断片化を誘導することもわかっている8,10).そこで,Stk25,GM130,LKB1のゴルジ体の形態制御への影響を調べるため,ニューロンにおいてそれぞれをノックダウン,または,Stk25の過剰発現を行った.その結果,それぞれをノックダウンするとニューロンのゴルジ体が断片化を起こすことがわかった.とくに,LKB1のノックダウンにより誘導されるゴルジ体の断片化はStk25の過剰発現により回復することがわかった.一方,正常なCA1錐体細胞ではゴルジ体は先端樹状突起の近傍に局在しているが,Stk25をノックダウンするとゴルジ体は断片化を生じるとともに細胞質の全域に分散して局在することがわかった.以上の結果から,Stk25,LKB1,GM130がゴルジ体の正常な形態形成に必要であることがわかった.
7.Reelin-Dab1シグナル伝達系はゴルジ体の形態を制御している
さきに述べたように,Stk25とReelin-Dab1シグナル伝達系とは軸索の形成機構において拮抗的にはたらいている.そこで,Stk25とReelin-Dab1シグナル伝達系のゴルジ体の形態形成および維持への影響を生体において調べるため,ReelinノックアウトマウスまたはDab1ノックアウトマウスおよび野生型マウスの新生仔の海馬CA1錐体細胞におけるゴルジ体の形態観察を行った.この結果,野生型マウスのゴルジ体は先端樹状突起内に長く伸長しているのに対して,ReelinノックアウトマウスまたはDab1ノックアウトマウスではゴルジ体の伸長が弱く樹状突起への伸長の十分にみられない錐体細胞も多くみられた.この結果から,Reelin-Dab1シグナル伝達系は生体で直接的あるいは間接的にゴルジ体の伸長を制御していることが示唆された.そこで,Reelin-Dab1シグナル伝達系のゴルジ体の伸長機構の制御への関与を調べるため,海馬初代培養ニューロンを用いてReelin刺激によるゴルジ体の構造変化を調べた.その結果,驚くべきことに,30分間のReelin刺激によりゴルジ体は樹状突起内に長く伸長することがわかった.一連の実験結果から,ゴルジ体の先端樹状突起内への伸長はReelin-Dab1シグナル伝達系に応答した現象であることが明らかとなった.そこで,Reelin-Dab1シグナル伝達系とStk25のゴルジ体の構造への影響を調べるため,Stk25を過剰発現させたニューロンをReelinを含む培地で培養した.この結果,キナーゼ活性の有無にかかわらずStk25を過剰発現させたニューロンのゴルジ体は萎縮した形態を示すことがわかった.また,このようなゴルジ体の構造の変化はReelinを含む培地で培養することにより抑制され,Stk25の過剰発現の有無にかかわらずゴルジ体は正常な構造をとることがわかった.以上の結果から,ゴルジ体の伸長あるいは萎縮にみられる構造変化は生体で拮抗的にはたらくReelin-Dab1シグナル伝達系とStk25とのバランスによって決定される現象であると示唆された(図2).
おわりに
今回,Reelin-Dab1シグナル伝達系およびStk25がゴルジ体の形態の制御および神経極性の制御にはたす役割の一端が明らかになった.しかしながら,神経極性の制御機構にはゴルジ体の移動機構などまだ多くの不明な点が残されており,今後の研究の課題である.Reelin-Dab1シグナル伝達系およびStk25を軸にゴルジ体の神経極性の制御にはたす役割についてより研究を進めることによって,ニューロンの発達のみならず脳の発達機構についてより理解の進むものと期待される.
文 献
- Arimura, N. & Kaibuchi, K.: Neuronal polarity: from extracellular signals to intracellular mechanisms. Nat. Rev. Neurosci., 8, 194-205 (2007)[PubMed]
- Barnes, A. P. & Polleux, F.: Establishment of axon-dendrite polarity in developing neurons. Annu. Rev. Neurosci., 32, 347-381 (2009)[PubMed]
- de Anda, F. C., Pollarolo, G., Da Silva, J. S. et al.: Centrosome localization determines neuronal polarity. Nature, 436, 704-708 (2005)[PubMed]
- Howell, B. W., Hawkes, R., Soriano, P. et al.: Neuronal position in the developing brain is regulated by mouse disabled-1. Nature, 389, 733-737 (1997)[PubMed]
- Niu, S., Renfro, A., Quattrocchi, C. C. et al.: Reelin promotes hippocampal dendrite development through the VLDLR/ApoER2-Dab1 pathway. Neuron, 41, 71-84 (2004)[PubMed]
- Matsuki, T., Pramatarova, A. & Howell, B. W.: Reduction of Crk and CrkL expression blocks reelin-induced dendritogenesis. J. Cell Sci., 121, 1869-1875 (2008)[PubMed]
- Weeber, E. J., Beffert, U., Jones, C. et al.: Reelin and ApoE receptors cooperate to enhance hippocampal synaptic plasticity and learning. J. Biol. Chem., 277, 39944-39952 (2002)[PubMed]
- Preisinger, C., Short, B., De Corte, V. et al.: YSK1 is activated by the Golgi matrix protein GM130 and plays a role in cell migration through its substrate 14-3-3ζ. J. Cell Biol., 164, 1009-1020 (2004)[PubMed]
- Shelly, M., Cancedda, L., Heilshorn, S. et al.: LKB1/STRAD promotes axon initiation during neuronal polarization. Cell, 129, 565-577 (2007)[PubMed]
- Puthenveedu, M. A., Bachert, C., Puri, S. et al.: GM130 and GRASP65-dependent lateral cisternal fusion allows uniform Golgi-enzyme distribution. Nat. Cell Biol., 8, 238-248 (2006)[PubMed]
著者プロフィール
略歴:2000年 大阪大学大学院理学研究科博士後期課程 修了,同年 理化学研究所脳科学総合研究センター 研究員.2004年 米国NIH客員研究員を経て,2008年より米国New York州立大学Upstate Medical UniversityにてPostdoctoral Associate.
研究テーマ:シグナル伝達系の研究をとおし脳形成の分子機構を理解する.
抱負:生命を理解するための根幹となる研究を心がけたい.
Brian W. Howell
米国New York州立大学Upstate Medical UniversityにてAssistant Professor.
© 2010 松木 亨・Brian W. Howell Licensed under CC 表示 2.1 日本