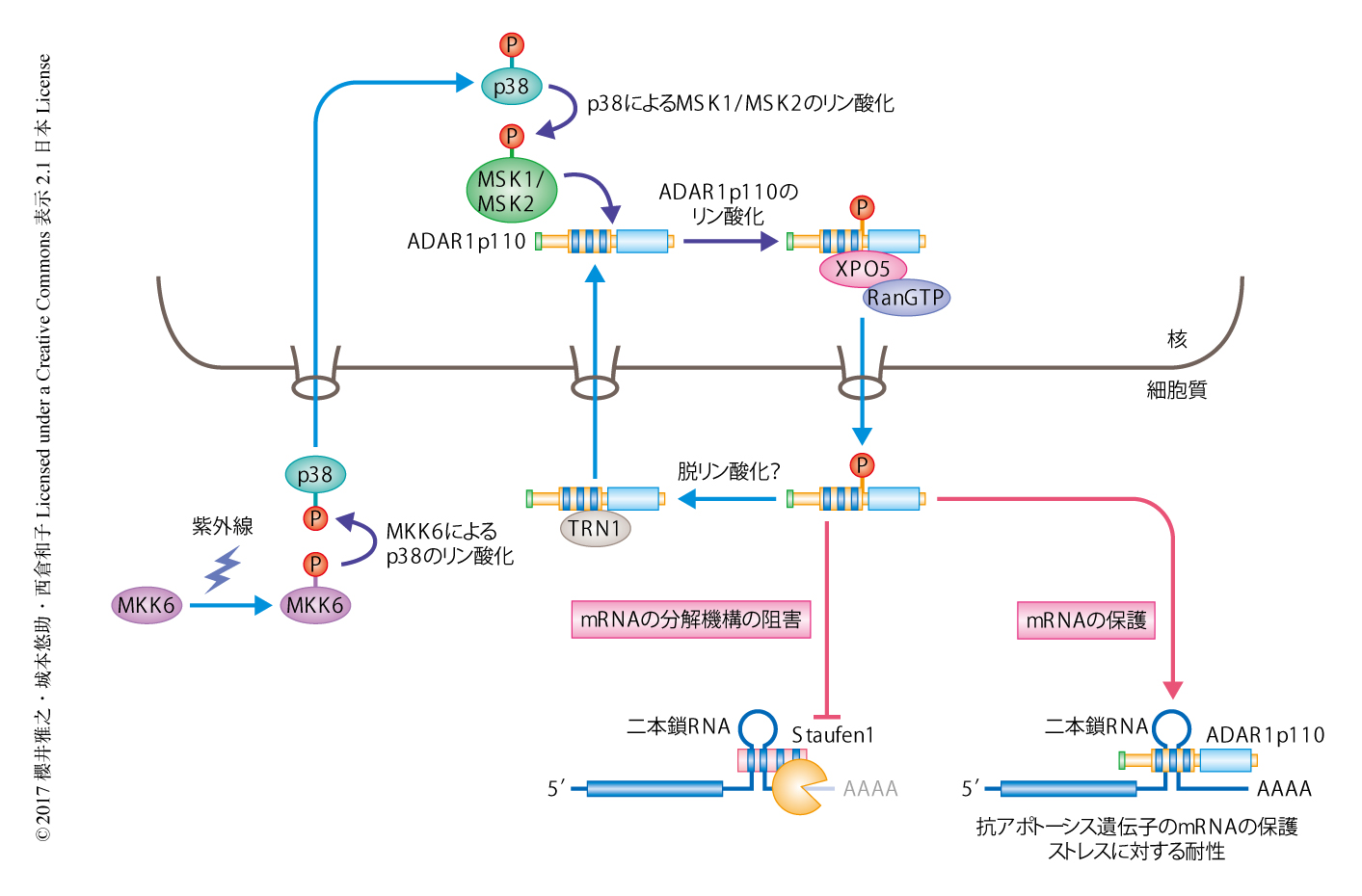
RNA編集酵素ADAR1はストレス下においてmRNA分解からの保護機構によりアポトーシスを抑制する
櫻井雅之・城本悠助・西倉和子
(米国Wistar Institute,Gene Expression and Regulation Program)
email:櫻井雅之,城本悠助,西倉和子
DOI: 10.7875/first.author.2017.038
ADAR1 controls apoptosis of stressed cells by inhibiting Staufen1-mediated mRNA decay.
Masayuki Sakurai, Yusuke Shiromoto, Hiromitsu Ota, Chunzi Song, Andrew V. Kossenkov, Jayamanna Wickramasinghe, Louise C. Showe, Emmanuel Skordalakes, Hsin-Yao Tang, David W. Speicher, Kazuko Nishikura
Nature Structural & Molecular Biology, 24, 534-543 (2017)
ADAR1は二本鎖RNAと結合しアデノシンをイノシンへと変換するRNA編集酵素であり,ADAR1遺伝子座からは転写開始部位および翻訳開始部位の異なるADAR1p150とADAR1p110の2つのタンパク質が産生される.ADAR1p150は細胞質に局在し,インターフェロン応答を誘導するMDA5-MAVS経路を抑制することが報告されている.一方,おもに核に局在するADAR1p110はmRNA編集を担うことが知られているが,その生物学的な機能の多くは不明なままであった.この研究において,ADAR1p110はストレス下においてMKK6-p38-MSK1&2経路によりリン酸化され,XPO5により細胞質へと輸送されることが見い出された.ADAR1p110は細胞質においてmRNAの3’側非翻訳領域の二本鎖領域と結合し,同じく二本鎖領域を認識してmRNAの分解をひき起こすStaufen1と排他的に競合する.この作用により,ADAR1p110は抗アポトーシス遺伝子のmRNAを保護し,その結果,ストレス下における細胞の生存に寄与する.
ADAR(adenosine deaminases acting on RNA)は二本鎖RNAと結合しアデノシンをイノシンへと変換するRNA編集酵素である1).ADAR1遺伝子座からは転写開始部位および翻訳開始部位の異なるADAR1p150およびADAR1p110の2つのタンパク質が産生され,ADAR1p150はインターフェロンに応答して発現するがADAR1p110は恒常的に発現する2).ADAR1p150の発現は脾臓や免疫系の細胞を除き微弱であり,おもに細胞質に局在する.細胞はウイルスなどの外来性の二本鎖RNAを感知してMAVS-MDA5経路によりインターフェロン応答を誘導する機構をもつが,ADAR1p150はRNA編集により内在性の二本鎖RNAがこの機構を刺激しないようにする役割を担うと考えられている3).一方,おもに核に局在し,ほぼすべての細胞において高い発現を示すADAR1p110は,多くのmRNAおよび一部のmiRNAのRNA編集に機能するが,その生物学的な機能の大部分は不明であった4,5).
細胞には多数の二本鎖RNA結合タンパク質が存在する.その大半が細胞質に局在し,ウイルスなどの外来性の二本鎖RNAやmRNAの3’側非翻訳領域の二本鎖領域を認識する.一方,広く高い発現を示すADAR1p110はおもに核に局在することから,ADAR1p110はなんらかの刺激により局在を変えて細胞質の二本鎖RNA結合タンパク質と相互作用するのではないかと考えた.そこで,ADAR1と蛍光タンパク質であるmCherryとの融合タンパク質を用いて,さまざまな刺激による局在の変化について解析した.その結果,紫外線の弱い照射あるいは熱による刺激により核質および核小体に存在するADAR1p110の約3/4が細胞質へと局在を変化させた.また,経時的な変化について解析したところ,紫外線の照射の場合,1時間後からADAR1p110の核から細胞質への移行が観察され,4時間後をピークに12時間後にはふたたび核に局在した.一方,ADAR1p150は刺激のまえには細胞質に局在し,紫外線の照射ののちにもストレス小胞体への凝集がややみられたほか局在の大きな変化は認められなかった.
ADAR1p110の局在の変化はリン酸化によりひき起こされているのではないかと考え,細胞の生存にかかわるMAPキナーゼ経路として知られるERK経路,p38経路,JNK経路とのかかわりに着目した6).おのおののMAPキナーゼ経路を活性化するため,上流のMAPキナーゼキナーゼであるMKK1,MKK6,JNKKの活性型変異体を細胞に発現させたところ,MKK6の存在のもとADAR1p110の細胞質への局在の移行が顕著に認められた.また,MKK6の発現,紫外線の照射,熱による刺激によるADAR1p110の細胞質への移行はp38の阻害剤の添加により阻害された.さらに,紫外線を照射したときのADAR1p110のリン酸化を担うキナーゼを同定するため,p38の下流のキナーゼをノックダウンした.その結果,ADAR1p110は核に局在するMSK1およびMSK2を同時にノックダウンすると細胞質へと移行しなかったことから,ADAR1p110のリン酸化にともなう細胞質への移行はMKK6-p38-MSK1&2経路によりひき起こされていることが示された.
ADAR1p110がリン酸化されているかどうか調べるため,Phos-tagを含むゲルを用いて細胞のタンパク質画分を電気泳動した.このゲルにおいて,リン酸化されたタンパク質は移動度が低下するため,リン酸化されていないタンパク質よりも高分子の側に遅延したバンドとして検出される.その結果,紫外線を照射した試料およびMKK6を発現させた試料でのみ,通常のADAR1p110のバンドにくわえ遅延バンドが検出された.さらに,この遅延バンドはタンパク質画分の脱リン酸処理により消失した.また,p38の阻害剤の添加あるいはMSK1およびMSK2の同時のノックダウンにより同様に遅延バンドが消失したことから,この遅延バンドはMKK6-p38-MSK1&2経路によりリン酸化されたADAR1p110であることが示された.
この遅延バンドは過剰に発現させたFlagタグ融合ADAR1p110においても認められた.そこで,Flagタグ融合ADAR1p110を発現させ紫外線を照射したHEK293T細胞から,抗Flag抗体を用いた免疫沈降法によりADAR1p110を精製し,質量分析法により解析した.その結果,紫外線の照射ののち,ADAR1p110のC末端側に位置する二本鎖RNA結合ドメインの近傍に存在するThrおよびSerのあわせて5残基がリン酸化されていた.そこで,これら5残基のリン酸化部位をAlaに置換した非リン酸化変異体およびAspに置換したリン酸化模倣変異体を構築しそれらの局在を解析した.その結果,非リン酸化変異体は核に,リン酸化模倣変異体は細胞質に局在したことから,これらの5残基のリン酸化がADAR1p110の細胞における局在を制御することが判明した.
ADAR1p110のリン酸化が細胞における局在をどのように制御するのか解析した.ADAR1p110は核と細胞質とをシャトルすることが報告されており,細胞質から核への輸送はTRN1,核から細胞質への輸送はXPO5とRan-GTPとの複合体が担う7).そこで,ADAR1p110のリン酸化部位の変異体をベイトとしたTRN1あるいはXPO5-Ran-GTP複合体とのin vitroにおけるプルダウンアッセイにより解析した.その結果,非リン酸化変異体とリン酸化模倣変異体とのあいだにTRN1との結合量の差は認められなかった一方,リン酸化模倣変異体は非リン酸化変異体に比べ10~20倍の量のXPO5-Ran-GTP複合体と結合した.以上の結果から,ADAR1p110はリン酸化されることによりXPO5-Ran-GTP複合体との結合が促進され,細胞質へと輸送されると考えられた.
なぜADAR1p110はストレスに応答して細胞質に局在するのだろうか? MAPキナーゼ経路は細胞の生死を制御する機構でもあり紫外線などのストレスに応答することから,ADAR1p110のアポトーシスへの関与について解析した8).紫外線の照射のときにADAR1をノックダウンすると細胞は対照の5倍ものアポトーシスを示し,これはDNA障害誘導剤であるカンプトテシンを添加したときと同じ程度であった.また,ADAR1p150を特異的にノックダウンしたときにはこのアポトーシスの上昇は認められなかったことから,紫外線の照射によるアポトーシスはADAR1p110により抑制されることが明らかにされた.
内在性のADAR1のみをノックダウンしたのちADAR1p110を発現させそのレスキューを解析した.その結果,野生型のADAR1p110だけでなく,RNA編集活性をもたないADAR1p110変異体によってもアポトーシスの抑制が認められたことから,ADAR1p110の抗アポトーシス作用はRNA編集に非依存的であることが判明した.他方,XPO5を単独でノックダウンした場合も対照の約3倍のアポトーシスを示したことから,ADAR1p110の抗アポトーシス作用には細胞質への輸送が重要であると考えられた.
ADAR1p150は細胞において内在性の二本鎖RNAと結合しMDA5-MAVS経路によるインターフェロン応答を抑制すると考えられている.そこで,ADAR1のノックダウンによるアポトーシスの上昇がインターフェロン応答に起因するかどうか検証するため,MDA5あるいはMAVSとADAR1を同時にノックダウンしたところ,MDA5あるいはMAVSのいずれをノックダウンしてもアポトーシスの程度に変化は認められなかった.
ADAR1p110は細胞質においてどのような機構を介してアポトーシスを抑制するのだろうか? ADAR1をノックダウンした細胞に紫外線を照射し,次世代シークエンサーを用いてmRNAの発現について解析した.その結果,3’側非翻訳領域に二本鎖構造をもつ抗アポトーシス遺伝子のmRNAが有意に減少することに気がついた.他方,細胞質に局在する二本鎖RNA結合タンパク質であるStaufen1について,近年,RNA免疫沈降-網羅的シークエンス法による解析が報告されているが,Staufen1の結合部位はADAR1の結合部位と重複していた9).Staufen1は細胞質においてUPF1と複合体を形成し,mRNAと結合してその分解を誘導する10).そこで,ADAR1p110が細胞質においてこのStaufen1に依存的なmRNAの分解機構と拮抗することにより,抗アポトーシス遺伝子のmRNAを分解から保護するのではないかと考えた.ADRA1にくわえStaufen1あるいはUPF1をそれぞれノックダウンしたところ,ADAR1の単独でのノックダウンによりひき起こされたアポトーシスの上昇がStaufen1あるいはUPF1のノックダウンにより抑制された.さらに,mRNAの発現プロファイル解析から,ADAR1およびStaufen1を同時にノックダウンすると,ADAR1の単独でのノックダウンにおいて観察された3’側非翻訳領域に二本鎖構造をもつ抗アポトーシス遺伝子のmRNAの減少が回復することが判明した.また,この傾向に該当した488遺伝子のうち,52遺伝子のmRNAの量について定量RT-PCR法により再検証された.さらに,代表例として選別されたCCNG1遺伝子,CASC5遺伝子,ATM遺伝子,RAD51遺伝子について,ADAR1のノックダウンによるmRNAの減少は転写制御に起因するものでないことが,定量RT-PCR法を用いたmRNA前駆体の解析により確認された.くわえて,これらの遺伝子については,ADAR1の単独でのノックダウンによるmRNAの減少と,ADAR1およびStaufen1あるいはUPF1の同時のノックダウンによるmRNAの減少の回復の傾向が定量RT-PCR法により確認され,イムノブロッティング法によりその変化がタンパク質の発現レベルに反映されていることが確認された.以上の結果から,細胞質に輸送されたADAR1p110がStaufen1に依存的なmRNAの分解機構からこれらのmRNAを保護することが示された.
mRNAの3’側非翻訳領域の二本鎖領域におけるADAR1p110とStaufen1-UPF1複合体との競合阻害について直接的な検証を試みた.細胞にHAタグ融合Staufen1を発現させ,これを免疫沈降法により精製して,定量RT-PCR法によりStufen1と結合したmRNAの3’側非翻訳領域の二本鎖領域を解析した.その結果,ADAR1をノックダウンした細胞においてはStaufen1と結合するmRNAの3’側非翻訳領域の二本鎖領域の増加が認められた.以上の結果から,ADAR1p110はmRNAの3’側非翻訳領域の二本鎖領域に排他的に結合し,Staufen1の結合を阻害することが証明された.
この研究により,紫外線などのストレスにより活性化されたMKK6-p38-MSK1&2経路によりADAR1p110はリン酸化され,XPO5-Ran-GTP複合体と結合し細胞質へと輸送されることが判明した.細胞質においてADAR1p110は抗アポトーシス遺伝子のmRNAのもつ3’側非翻訳領域の二本鎖領域と結合することにより,Staufen1に依存的なmRNAの分解機構からこれらのmRNAを保護する(図1).このmRNAの保護機構がストレスに対する細胞のアポトーシス抵抗性を亢進させ生存に寄与すると考えられた.今回,明らかにされた,ADAR1p110による培養細胞におけるストレスに応答したmRNAの保護機構は,生体においても重要な機能をもつことが推察される.また,この研究においては,細胞質におけるADAR1p110の機能について示したが,核に存在するADAR1p110の生物学的な機能については不明なままであり,今後のさらなる解析が期待される.
略歴:2006年 東京大学大学院新領域創成科学研究科博士課程 修了,同年 東京大学大学院工学系研究科 特別研究員,2010年 米国Wistar Instituteポストドクトラルフェロー,同Staff Scientistを経て,同Senior Staff Scientist.
研究テーマ:RNA編集酵素の介する遺伝子発現の制御機構および細胞の応答.
城本 悠助(Yusuke Shiromoto)
略歴:2014年 大阪大学大学院医学系研究科博士課程 修了,同年より米国Wistar Instituteポストドクトラルフェロー.
研究テーマ:RNAの制御機構と生命現象とのかかわり.
西倉 和子(Kazuko Nishikura)
米国Wistar Institute教授.
研究室URL:http://www.wistar.org/lab/kazuko-nishikura-phd
© 2017 櫻井雅之・城本悠助・西倉和子 Licensed under CC 表示 2.1 日本
(米国Wistar Institute,Gene Expression and Regulation Program)
email:櫻井雅之,城本悠助,西倉和子
DOI: 10.7875/first.author.2017.038
ADAR1 controls apoptosis of stressed cells by inhibiting Staufen1-mediated mRNA decay.
Masayuki Sakurai, Yusuke Shiromoto, Hiromitsu Ota, Chunzi Song, Andrew V. Kossenkov, Jayamanna Wickramasinghe, Louise C. Showe, Emmanuel Skordalakes, Hsin-Yao Tang, David W. Speicher, Kazuko Nishikura
Nature Structural & Molecular Biology, 24, 534-543 (2017)
要 約
ADAR1は二本鎖RNAと結合しアデノシンをイノシンへと変換するRNA編集酵素であり,ADAR1遺伝子座からは転写開始部位および翻訳開始部位の異なるADAR1p150とADAR1p110の2つのタンパク質が産生される.ADAR1p150は細胞質に局在し,インターフェロン応答を誘導するMDA5-MAVS経路を抑制することが報告されている.一方,おもに核に局在するADAR1p110はmRNA編集を担うことが知られているが,その生物学的な機能の多くは不明なままであった.この研究において,ADAR1p110はストレス下においてMKK6-p38-MSK1&2経路によりリン酸化され,XPO5により細胞質へと輸送されることが見い出された.ADAR1p110は細胞質においてmRNAの3’側非翻訳領域の二本鎖領域と結合し,同じく二本鎖領域を認識してmRNAの分解をひき起こすStaufen1と排他的に競合する.この作用により,ADAR1p110は抗アポトーシス遺伝子のmRNAを保護し,その結果,ストレス下における細胞の生存に寄与する.
はじめに
ADAR(adenosine deaminases acting on RNA)は二本鎖RNAと結合しアデノシンをイノシンへと変換するRNA編集酵素である1).ADAR1遺伝子座からは転写開始部位および翻訳開始部位の異なるADAR1p150およびADAR1p110の2つのタンパク質が産生され,ADAR1p150はインターフェロンに応答して発現するがADAR1p110は恒常的に発現する2).ADAR1p150の発現は脾臓や免疫系の細胞を除き微弱であり,おもに細胞質に局在する.細胞はウイルスなどの外来性の二本鎖RNAを感知してMAVS-MDA5経路によりインターフェロン応答を誘導する機構をもつが,ADAR1p150はRNA編集により内在性の二本鎖RNAがこの機構を刺激しないようにする役割を担うと考えられている3).一方,おもに核に局在し,ほぼすべての細胞において高い発現を示すADAR1p110は,多くのmRNAおよび一部のmiRNAのRNA編集に機能するが,その生物学的な機能の大部分は不明であった4,5).
1.ADAR1p110はストレスにより細胞質に局在する
細胞には多数の二本鎖RNA結合タンパク質が存在する.その大半が細胞質に局在し,ウイルスなどの外来性の二本鎖RNAやmRNAの3’側非翻訳領域の二本鎖領域を認識する.一方,広く高い発現を示すADAR1p110はおもに核に局在することから,ADAR1p110はなんらかの刺激により局在を変えて細胞質の二本鎖RNA結合タンパク質と相互作用するのではないかと考えた.そこで,ADAR1と蛍光タンパク質であるmCherryとの融合タンパク質を用いて,さまざまな刺激による局在の変化について解析した.その結果,紫外線の弱い照射あるいは熱による刺激により核質および核小体に存在するADAR1p110の約3/4が細胞質へと局在を変化させた.また,経時的な変化について解析したところ,紫外線の照射の場合,1時間後からADAR1p110の核から細胞質への移行が観察され,4時間後をピークに12時間後にはふたたび核に局在した.一方,ADAR1p150は刺激のまえには細胞質に局在し,紫外線の照射ののちにもストレス小胞体への凝集がややみられたほか局在の大きな変化は認められなかった.
2.ADAR1p110はMKK6-p38-MSK1&2経路によりリン酸化される
ADAR1p110の局在の変化はリン酸化によりひき起こされているのではないかと考え,細胞の生存にかかわるMAPキナーゼ経路として知られるERK経路,p38経路,JNK経路とのかかわりに着目した6).おのおののMAPキナーゼ経路を活性化するため,上流のMAPキナーゼキナーゼであるMKK1,MKK6,JNKKの活性型変異体を細胞に発現させたところ,MKK6の存在のもとADAR1p110の細胞質への局在の移行が顕著に認められた.また,MKK6の発現,紫外線の照射,熱による刺激によるADAR1p110の細胞質への移行はp38の阻害剤の添加により阻害された.さらに,紫外線を照射したときのADAR1p110のリン酸化を担うキナーゼを同定するため,p38の下流のキナーゼをノックダウンした.その結果,ADAR1p110は核に局在するMSK1およびMSK2を同時にノックダウンすると細胞質へと移行しなかったことから,ADAR1p110のリン酸化にともなう細胞質への移行はMKK6-p38-MSK1&2経路によりひき起こされていることが示された.
3.ADAR1p110のリン酸化はXPO5との結合を促進する
ADAR1p110がリン酸化されているかどうか調べるため,Phos-tagを含むゲルを用いて細胞のタンパク質画分を電気泳動した.このゲルにおいて,リン酸化されたタンパク質は移動度が低下するため,リン酸化されていないタンパク質よりも高分子の側に遅延したバンドとして検出される.その結果,紫外線を照射した試料およびMKK6を発現させた試料でのみ,通常のADAR1p110のバンドにくわえ遅延バンドが検出された.さらに,この遅延バンドはタンパク質画分の脱リン酸処理により消失した.また,p38の阻害剤の添加あるいはMSK1およびMSK2の同時のノックダウンにより同様に遅延バンドが消失したことから,この遅延バンドはMKK6-p38-MSK1&2経路によりリン酸化されたADAR1p110であることが示された.
この遅延バンドは過剰に発現させたFlagタグ融合ADAR1p110においても認められた.そこで,Flagタグ融合ADAR1p110を発現させ紫外線を照射したHEK293T細胞から,抗Flag抗体を用いた免疫沈降法によりADAR1p110を精製し,質量分析法により解析した.その結果,紫外線の照射ののち,ADAR1p110のC末端側に位置する二本鎖RNA結合ドメインの近傍に存在するThrおよびSerのあわせて5残基がリン酸化されていた.そこで,これら5残基のリン酸化部位をAlaに置換した非リン酸化変異体およびAspに置換したリン酸化模倣変異体を構築しそれらの局在を解析した.その結果,非リン酸化変異体は核に,リン酸化模倣変異体は細胞質に局在したことから,これらの5残基のリン酸化がADAR1p110の細胞における局在を制御することが判明した.
ADAR1p110のリン酸化が細胞における局在をどのように制御するのか解析した.ADAR1p110は核と細胞質とをシャトルすることが報告されており,細胞質から核への輸送はTRN1,核から細胞質への輸送はXPO5とRan-GTPとの複合体が担う7).そこで,ADAR1p110のリン酸化部位の変異体をベイトとしたTRN1あるいはXPO5-Ran-GTP複合体とのin vitroにおけるプルダウンアッセイにより解析した.その結果,非リン酸化変異体とリン酸化模倣変異体とのあいだにTRN1との結合量の差は認められなかった一方,リン酸化模倣変異体は非リン酸化変異体に比べ10~20倍の量のXPO5-Ran-GTP複合体と結合した.以上の結果から,ADAR1p110はリン酸化されることによりXPO5-Ran-GTP複合体との結合が促進され,細胞質へと輸送されると考えられた.
4.細胞質に輸送されたADAR1p110はストレスによるアポトーシスを抑制する
なぜADAR1p110はストレスに応答して細胞質に局在するのだろうか? MAPキナーゼ経路は細胞の生死を制御する機構でもあり紫外線などのストレスに応答することから,ADAR1p110のアポトーシスへの関与について解析した8).紫外線の照射のときにADAR1をノックダウンすると細胞は対照の5倍ものアポトーシスを示し,これはDNA障害誘導剤であるカンプトテシンを添加したときと同じ程度であった.また,ADAR1p150を特異的にノックダウンしたときにはこのアポトーシスの上昇は認められなかったことから,紫外線の照射によるアポトーシスはADAR1p110により抑制されることが明らかにされた.
内在性のADAR1のみをノックダウンしたのちADAR1p110を発現させそのレスキューを解析した.その結果,野生型のADAR1p110だけでなく,RNA編集活性をもたないADAR1p110変異体によってもアポトーシスの抑制が認められたことから,ADAR1p110の抗アポトーシス作用はRNA編集に非依存的であることが判明した.他方,XPO5を単独でノックダウンした場合も対照の約3倍のアポトーシスを示したことから,ADAR1p110の抗アポトーシス作用には細胞質への輸送が重要であると考えられた.
ADAR1p150は細胞において内在性の二本鎖RNAと結合しMDA5-MAVS経路によるインターフェロン応答を抑制すると考えられている.そこで,ADAR1のノックダウンによるアポトーシスの上昇がインターフェロン応答に起因するかどうか検証するため,MDA5あるいはMAVSとADAR1を同時にノックダウンしたところ,MDA5あるいはMAVSのいずれをノックダウンしてもアポトーシスの程度に変化は認められなかった.
5.ADAR1p110はStaufen1と拮抗して3’側非翻訳領域に二本鎖構造をもつmRNAを保護する
ADAR1p110は細胞質においてどのような機構を介してアポトーシスを抑制するのだろうか? ADAR1をノックダウンした細胞に紫外線を照射し,次世代シークエンサーを用いてmRNAの発現について解析した.その結果,3’側非翻訳領域に二本鎖構造をもつ抗アポトーシス遺伝子のmRNAが有意に減少することに気がついた.他方,細胞質に局在する二本鎖RNA結合タンパク質であるStaufen1について,近年,RNA免疫沈降-網羅的シークエンス法による解析が報告されているが,Staufen1の結合部位はADAR1の結合部位と重複していた9).Staufen1は細胞質においてUPF1と複合体を形成し,mRNAと結合してその分解を誘導する10).そこで,ADAR1p110が細胞質においてこのStaufen1に依存的なmRNAの分解機構と拮抗することにより,抗アポトーシス遺伝子のmRNAを分解から保護するのではないかと考えた.ADRA1にくわえStaufen1あるいはUPF1をそれぞれノックダウンしたところ,ADAR1の単独でのノックダウンによりひき起こされたアポトーシスの上昇がStaufen1あるいはUPF1のノックダウンにより抑制された.さらに,mRNAの発現プロファイル解析から,ADAR1およびStaufen1を同時にノックダウンすると,ADAR1の単独でのノックダウンにおいて観察された3’側非翻訳領域に二本鎖構造をもつ抗アポトーシス遺伝子のmRNAの減少が回復することが判明した.また,この傾向に該当した488遺伝子のうち,52遺伝子のmRNAの量について定量RT-PCR法により再検証された.さらに,代表例として選別されたCCNG1遺伝子,CASC5遺伝子,ATM遺伝子,RAD51遺伝子について,ADAR1のノックダウンによるmRNAの減少は転写制御に起因するものでないことが,定量RT-PCR法を用いたmRNA前駆体の解析により確認された.くわえて,これらの遺伝子については,ADAR1の単独でのノックダウンによるmRNAの減少と,ADAR1およびStaufen1あるいはUPF1の同時のノックダウンによるmRNAの減少の回復の傾向が定量RT-PCR法により確認され,イムノブロッティング法によりその変化がタンパク質の発現レベルに反映されていることが確認された.以上の結果から,細胞質に輸送されたADAR1p110がStaufen1に依存的なmRNAの分解機構からこれらのmRNAを保護することが示された.
mRNAの3’側非翻訳領域の二本鎖領域におけるADAR1p110とStaufen1-UPF1複合体との競合阻害について直接的な検証を試みた.細胞にHAタグ融合Staufen1を発現させ,これを免疫沈降法により精製して,定量RT-PCR法によりStufen1と結合したmRNAの3’側非翻訳領域の二本鎖領域を解析した.その結果,ADAR1をノックダウンした細胞においてはStaufen1と結合するmRNAの3’側非翻訳領域の二本鎖領域の増加が認められた.以上の結果から,ADAR1p110はmRNAの3’側非翻訳領域の二本鎖領域に排他的に結合し,Staufen1の結合を阻害することが証明された.
おわりに
この研究により,紫外線などのストレスにより活性化されたMKK6-p38-MSK1&2経路によりADAR1p110はリン酸化され,XPO5-Ran-GTP複合体と結合し細胞質へと輸送されることが判明した.細胞質においてADAR1p110は抗アポトーシス遺伝子のmRNAのもつ3’側非翻訳領域の二本鎖領域と結合することにより,Staufen1に依存的なmRNAの分解機構からこれらのmRNAを保護する(図1).このmRNAの保護機構がストレスに対する細胞のアポトーシス抵抗性を亢進させ生存に寄与すると考えられた.今回,明らかにされた,ADAR1p110による培養細胞におけるストレスに応答したmRNAの保護機構は,生体においても重要な機能をもつことが推察される.また,この研究においては,細胞質におけるADAR1p110の機能について示したが,核に存在するADAR1p110の生物学的な機能については不明なままであり,今後のさらなる解析が期待される.
文 献
- Nishikura, K.: A-to-I editing of coding and non-coding RNAs by ADARs. Nat. Rev. Mol. Cell Biol., 17, 83-96 (2016)[PubMed]
- Patterson, J. B. & Samuel, C. E.: Expression and regulation by interferon of a double-stranded-RNA-specific adenosine deaminase from human cells: evidence for two forms of the deaminase. Mol. Cell. Biol., 15, 5376-5388 (1995)[PubMed]
- Pestal, K., Funk, C. C., Snyder, J. M. et al.: Isoforms of RNA-editing enzyme ADAR1 independently control nucleic acid sensor MDA5-driven autoimmunity and multi-organ development. Immunity, 43, 933-944 (2015)[PubMed]
- Ramaswami, G., Lin, W., Piskol, R. et al.: Accurate identification of human Alu and non-Alu RNA editing sites. Nat. Methods, 9, 579-581 (2012)[PubMed]
- Kawahara, Y., Zinshteyn, B., Sethupathy, P. et al.: Redirection of silencing targets by adenosine-to-inosine editing of miRNAs. Science, 315, 1137-1140 (2007)[PubMed]
- Coulthard, L.R., White, D. E., Jones, D. L. et al.: p38MAPK: stress responses from molecular mechanisms to therapeutics. Trends Mol. Med., 15, 369-379 (2009)[PubMed]
- Fritz, J., Strehblow, A., Taschner, A. et al.: RNA-regulated interaction of transportin-1 and exportin-5 with the double-stranded RNA-binding domain regulates nucleocytoplasmic shuttling of ADAR1. Mol. Cell. Biol., 29, 1487-1497 (2009)[PubMed]
- Wada, T. & Penninger, J. M.: Mitogen-activated protein kinases in apoptosis regulation. Oncogene, 23, 2838-2849 (2004)[PubMed]
- Gong, C. & Maquat, L. E.: lncRNAs transactivate STAU1-mediated mRNA decay by duplexing with 3' UTRs via Alu elements. Nature, 470, 284-288 (2011)[PubMed]
- Kim, Y. K., Furic, L., Desgroseillers, L. et al.: Mammalian Staufen1 recruits Upf1 to specific mRNA 3'UTRs so as to elicit mRNA decay. Cell, 120, 195-208 (2005)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2006年 東京大学大学院新領域創成科学研究科博士課程 修了,同年 東京大学大学院工学系研究科 特別研究員,2010年 米国Wistar Instituteポストドクトラルフェロー,同Staff Scientistを経て,同Senior Staff Scientist.
研究テーマ:RNA編集酵素の介する遺伝子発現の制御機構および細胞の応答.
城本 悠助(Yusuke Shiromoto)
略歴:2014年 大阪大学大学院医学系研究科博士課程 修了,同年より米国Wistar Instituteポストドクトラルフェロー.
研究テーマ:RNAの制御機構と生命現象とのかかわり.
西倉 和子(Kazuko Nishikura)
米国Wistar Institute教授.
研究室URL:http://www.wistar.org/lab/kazuko-nishikura-phd
© 2017 櫻井雅之・城本悠助・西倉和子 Licensed under CC 表示 2.1 日本