心臓-脳-腎臓の連携を介した組織マクロファージの活性化による心臓における恒常性の維持
藤生克仁1・真鍋一郎2
(1東京大学大学院医学系研究科 循環器内科学,2千葉大学大学院医学研究院 長寿医学)
email:藤生克仁
DOI: 10.7875/first.author.2017.037
A heart-brain-kidney network controls adaptation to cardiac stress through tissue macrophage activation.
Katsuhito Fujiu, Munehiko Shibata, Yukiteru Nakayama, Fusa Ogata, Sahohime Matsumoto, Koji Noshita, Shingo Iwami, Susumu Nakae, Issei Komuro, Ryozo Nagai, Ichiro Manabe
Nature Medicine, 23, 611-622 (2017)
古くから,心臓が悪くなると腎臓が悪くなる,逆に,腎臓が悪くなると心臓が悪くなることが臨床的に観察されている.心血管疾患の発症における最大のリスク因子は腎疾患であり,以前から,心腎連関とよばれる心臓と腎臓とが互いに保護しあうという概念が考えられていたが,その機構は明らかではなかった.今回,筆者らは,心臓に圧負荷がかかるとその刺激は神経を介して脳さらに腎臓へと伝達され,腎臓の組織マクロファージおよび血管内皮細胞が活性化され血中にコロニー刺激因子2が分泌されることを見い出した.そして,コロニー刺激因子2が心臓の組織マクロファージを活性化することによりアンフィレグリンが分泌され,心筋細胞に作用して心臓への圧負荷に対し適応することが明らかにされた.これらの経路のいずれかを遮断すると,心臓への圧負荷により心臓の機能は低下し心不全による死が起こった.今後,この新しい経路は心不全における新たな治療の標的になりうることが示唆された.
心不全は肺あるいは全身に血液のうっ血が生じたり末梢の臓器に酸素が供給できなくなったりする症候群である.心不全は心機能の異常によりひき起こされるが,腎機能の障害をはじめとするさまざまな合併症が心不全を進展させ予後を悪化させる1).とくに,心臓と腎臓とが互いを保護しあい,どちらかの臓器の異常がもう一方の臓器の異常をひき起こすことが臨床において日常的に観察され,これは心腎連関とよばれるが,その実態は明らかではなかった2).
心臓の機能をつかさどる細胞として心筋細胞以外の細胞が注目されている.これまで,線維芽細胞や新生した血管が心臓の圧負荷への適応に必要であることが報告されている3,4).心臓における免疫細胞としては組織マクロファージがもっとも主たる細胞であり,組織マクロファージは古典的には血中の単球が組織に移行したものとされるが,近年,心臓の組織マクロファージは胎児期の肝臓の単球に由来すると報告されている5).一方で,老化や心筋梗塞の際には単球に由来する組織マクロファージが心臓に集積し,障害を惹起したり保護的にはたらいたりと二面性のあることが報告されている6,7).このような報告は,心臓の組織マクロファージには起源や機能に多様性のあることを示す.これまで,心臓への圧負荷により生じる心肥大や心不全における心臓の組織マクロファージの機能についてはよくわかっていなかった.
以前に,筆者らは,腎臓病の発症において水の再吸収のみがその役割であると考えられていた腎臓の集合管上皮細胞が腎臓へのマクロファージの遊走を惹起し,腎臓病を進展させる最初のステップであることを見い出した8).今回,心腎連関の機構を明らかにすることが心臓病における新たな治療の標的の発見に結びつくことを期待し,心臓に圧負荷のかかった際の腎臓の集合管上皮細胞の活性化について検討したところ,腎臓に障害が生じたときと共通して,腎臓の集合管上皮細胞において転写因子KLF5が増加した.このため,心臓への刺激により活性化される腎臓の集合管上皮細胞が心腎連関において重要なはたらきをするのではないかと仮説をたてた.
腎臓の集合管上皮細胞に特異的なKLF5ノックアウトマウスを作製した.このノックアウトマウスは腎臓集合管上皮細胞の主たる機能である水の再吸収には異常は認められず,通常の飼育においては心機能および腎機能ともに正常であった.筆者らは,心不全のモデルとして大動脈を軽く結紮し心臓内の圧力を高める圧負荷モデルを使用している.このモデルでは,心臓への圧負荷に対し代償性の心肥大が生じることにより心臓において恒常性が維持される.半年以上の長期間にわたり観察すると心機能は軽度に低下するものの,心不全により死亡することはない.しかし,腎臓の集合管上皮細胞に特異的なKLF5ノックアウトマウスにおいては心臓への圧負荷により心機能は急激に低下し,心不全を発症して多くのマウスは死亡した.このことから,腎臓の集合管上皮細胞は心臓への圧負荷に対する代償性の機構に必須であることが示された.
腎臓における特異的な遺伝子改変により心臓にどのような変化が生じるかを検討したところ,野生型のマウスにおいては心臓への圧負荷により心臓の組織マクロファージが著明に増加したが,腎臓の集合管上皮細胞に特異的なKLF5ノックアウトマウスにおいて増加はまったく認められなかった.そこで,心臓の組織マクロファージが増加しないことが心不全の原因ではないかと考え,野生型のマウスから心臓の組織マクロファージを単離して腎臓の集合管上皮細胞に特異的なKLF5ノックアウトマウスの心臓に移植したところ,心臓への圧負荷をくわえても心不全を発症しなくなった.このことから,心臓に圧負荷のかかった際には腎臓の集合管上皮細胞の関与する心臓の組織マクロファージの増加が心臓における恒常性の維持に必須であることが示された.
心臓に圧負荷のかかった際に腎臓の集合管上皮細胞と心臓の組織マクロファージとをつなぐタンパク質としてコロニー刺激因子2が同定された.心臓への圧負荷により腎臓の集合管上皮細胞においてKLF5が増加し,その下流にあるS100a8遺伝子およびS100a9遺伝子の転写が増加し腎臓にS100A8およびS100A9が分泌される.S100A8およびS100A9が腎臓の組織マクロファージを活性化し,そこから腎臓にTNFが分泌され,TNFにより腎臓の血管内皮細胞から血中にコロニー刺激因子2が分泌される.野生型のマウスにコロニー刺激因子2の中和抗体の投与することにより,心臓への圧負荷による心臓の組織マクロファージの増加がみられなくなり心不全が発症したことから,コロニー刺激因子2が増加し心臓の組織マクロファージが増加することが心臓に圧負荷のかかった際の重要な保護的な機構であると考えられた.
心臓に圧負荷のかかった際の心臓の組織マクロファージの増加が心臓にとり保護的にはたらくとすると,つぎの疑問は,心臓の組織マクロファージはどのような機構により心筋細胞にはたらきかけて保護的な機能を発揮するかである.さまざまな臓器から組織マクロファージを採取して,心臓の組織マクロファージにおいて特異的に発現し心臓への圧負荷により増加するタンパク質を網羅的に探索したところ,アンフィレグリンが同定された.このアンフィレグリンは心筋細胞に作用させると心臓への圧負荷への適応に必須である心筋細胞の代償性の肥大をひき起こした.アンフィレグリンのノックアウトマウスの骨髄を野生型のマウスに移植し,心臓の組織マクロファージにおいてアンフィレグリンをノックアウトしたところ,心臓への圧負荷により心機能が低下し心不全による死が起こった.さらに,心臓への圧負荷により心臓の組織マクロファージが増加しない腎臓の集合管上皮細胞に特異的なKLF5ノックアウトマウスにアンフィレグリンを投与したところ,心臓の組織マクロファージが増加しないにもかかわらず,アンフィレグリンの投与のみで心不全は発症しなくなり,治療の効果があった.このことは,心臓の組織マクロファージがアンフィレグリンを分泌し,これが心筋細胞に作用しその肥大を惹起することにより心臓に対し保護的にはたらくことを意味した.
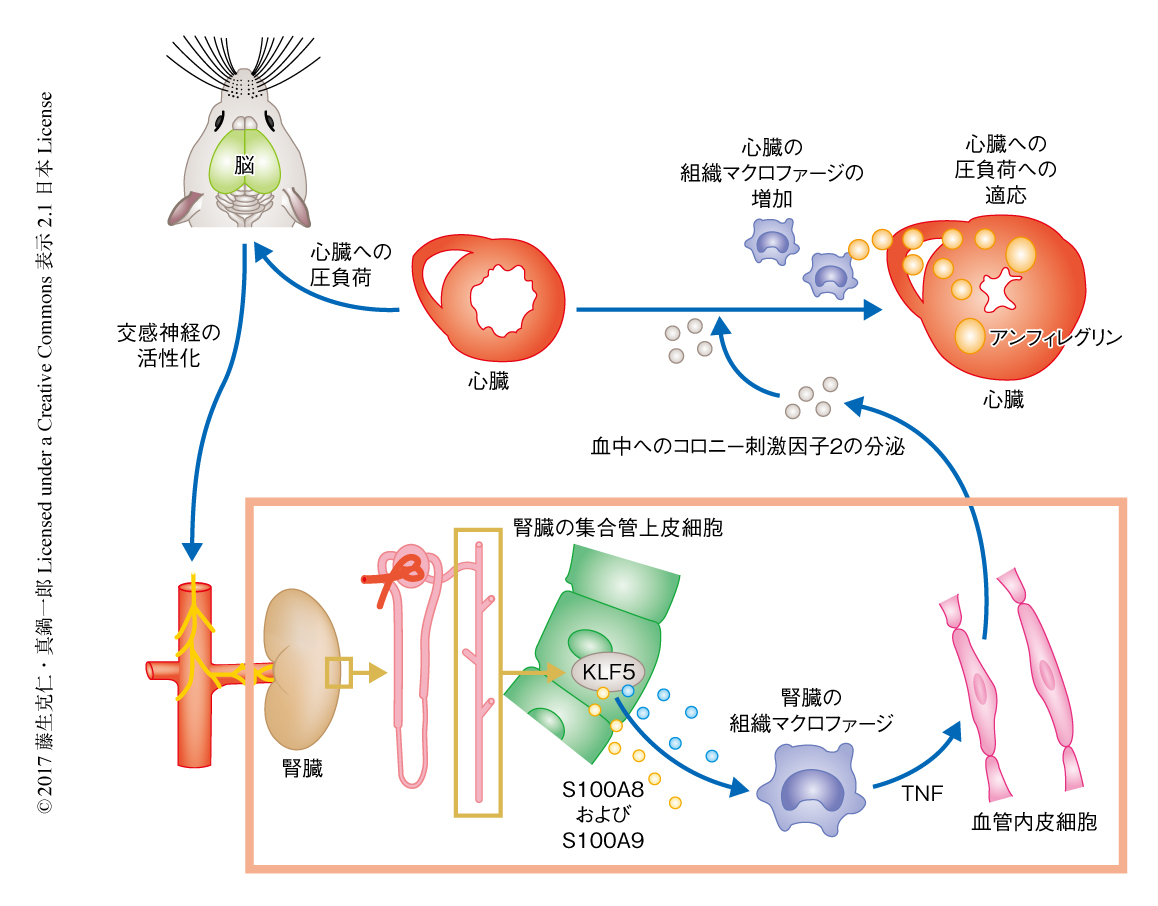
心臓への圧負荷がどのように腎臓の活性化につながるか検討した.さまざまな神経を切断することにより,心臓への圧負荷は脳へと迷走神経求心路および脊髄後根を介して求心性に伝達し,そののち,腎臓へと交感神経遠心路を介して遠心性に伝達された.このように,心臓,脳,腎臓は神経系と組織の免疫細胞(組織マクロファージ)の活性化を介しネットワークを形成し,心臓への圧負荷に対し保護的にはたらくことにより恒常性を維持しており,心不全からの保護において新しい経路のあることが明らかにされた(図1).
この研究において,少なくとも3つの臓器が連携して心不全におちいらないようにする機構のあること,さらに,心臓および腎臓においてこのネットワークがはたらく際には組織マクロファージの活性化が鍵となることが明らかにされた.おそらく,このように臓器間ネットワークにおいて組織マクロファージの活性化が鍵となることは,ほかの臓器においてもあることが予想される.また,今回,心臓においては心臓の組織マクロファージが心筋細胞に対し保護的にはたらくことが示されたが,心臓の組織マクロファージは心臓の線維芽細胞や血管を構成する細胞への保護的な作用ももつことが予想される.今後,心臓の組織マクロファージが病因となる病態が存在するか,また,実際の腎臓病において,同定された新規の臓器間ネットワーク,あるいは,腎臓における組織マクロファージの活性化がどのように変容しているかなど,マウスおよびヒトにおいて解明すべきことが残されている.
略歴:2005年 東京大学大学院医学系研究科 修了,2007年 東京大学医学部附属病院 助教,2013年 科学技術振興機構 さきがけ研究者を経て,2015年より東京大学大学院医学系研究科 特任助教.
研究テーマ:細胞間および臓器間の相互作用を介したストレス応答の機構.
関心事:心血管疾患の病態の解明につながる新しい恒常性の維持およびその破綻の機構.
真鍋 一郎(Ichiro Manabe)
千葉大学大学院医学研究院 教授.
研究室URL:http://plaza.umin.ac.jp/manabe
© 2017 藤生克仁・真鍋一郎 Licensed under CC 表示 2.1 日本
(1東京大学大学院医学系研究科 循環器内科学,2千葉大学大学院医学研究院 長寿医学)
email:藤生克仁
DOI: 10.7875/first.author.2017.037
A heart-brain-kidney network controls adaptation to cardiac stress through tissue macrophage activation.
Katsuhito Fujiu, Munehiko Shibata, Yukiteru Nakayama, Fusa Ogata, Sahohime Matsumoto, Koji Noshita, Shingo Iwami, Susumu Nakae, Issei Komuro, Ryozo Nagai, Ichiro Manabe
Nature Medicine, 23, 611-622 (2017)
要 約
古くから,心臓が悪くなると腎臓が悪くなる,逆に,腎臓が悪くなると心臓が悪くなることが臨床的に観察されている.心血管疾患の発症における最大のリスク因子は腎疾患であり,以前から,心腎連関とよばれる心臓と腎臓とが互いに保護しあうという概念が考えられていたが,その機構は明らかではなかった.今回,筆者らは,心臓に圧負荷がかかるとその刺激は神経を介して脳さらに腎臓へと伝達され,腎臓の組織マクロファージおよび血管内皮細胞が活性化され血中にコロニー刺激因子2が分泌されることを見い出した.そして,コロニー刺激因子2が心臓の組織マクロファージを活性化することによりアンフィレグリンが分泌され,心筋細胞に作用して心臓への圧負荷に対し適応することが明らかにされた.これらの経路のいずれかを遮断すると,心臓への圧負荷により心臓の機能は低下し心不全による死が起こった.今後,この新しい経路は心不全における新たな治療の標的になりうることが示唆された.
はじめに
心不全は肺あるいは全身に血液のうっ血が生じたり末梢の臓器に酸素が供給できなくなったりする症候群である.心不全は心機能の異常によりひき起こされるが,腎機能の障害をはじめとするさまざまな合併症が心不全を進展させ予後を悪化させる1).とくに,心臓と腎臓とが互いを保護しあい,どちらかの臓器の異常がもう一方の臓器の異常をひき起こすことが臨床において日常的に観察され,これは心腎連関とよばれるが,その実態は明らかではなかった2).
心臓の機能をつかさどる細胞として心筋細胞以外の細胞が注目されている.これまで,線維芽細胞や新生した血管が心臓の圧負荷への適応に必要であることが報告されている3,4).心臓における免疫細胞としては組織マクロファージがもっとも主たる細胞であり,組織マクロファージは古典的には血中の単球が組織に移行したものとされるが,近年,心臓の組織マクロファージは胎児期の肝臓の単球に由来すると報告されている5).一方で,老化や心筋梗塞の際には単球に由来する組織マクロファージが心臓に集積し,障害を惹起したり保護的にはたらいたりと二面性のあることが報告されている6,7).このような報告は,心臓の組織マクロファージには起源や機能に多様性のあることを示す.これまで,心臓への圧負荷により生じる心肥大や心不全における心臓の組織マクロファージの機能についてはよくわかっていなかった.
以前に,筆者らは,腎臓病の発症において水の再吸収のみがその役割であると考えられていた腎臓の集合管上皮細胞が腎臓へのマクロファージの遊走を惹起し,腎臓病を進展させる最初のステップであることを見い出した8).今回,心腎連関の機構を明らかにすることが心臓病における新たな治療の標的の発見に結びつくことを期待し,心臓に圧負荷のかかった際の腎臓の集合管上皮細胞の活性化について検討したところ,腎臓に障害が生じたときと共通して,腎臓の集合管上皮細胞において転写因子KLF5が増加した.このため,心臓への刺激により活性化される腎臓の集合管上皮細胞が心腎連関において重要なはたらきをするのではないかと仮説をたてた.
1.腎臓の集合管上皮細胞は心臓における恒常性の維持に関与する
腎臓の集合管上皮細胞に特異的なKLF5ノックアウトマウスを作製した.このノックアウトマウスは腎臓集合管上皮細胞の主たる機能である水の再吸収には異常は認められず,通常の飼育においては心機能および腎機能ともに正常であった.筆者らは,心不全のモデルとして大動脈を軽く結紮し心臓内の圧力を高める圧負荷モデルを使用している.このモデルでは,心臓への圧負荷に対し代償性の心肥大が生じることにより心臓において恒常性が維持される.半年以上の長期間にわたり観察すると心機能は軽度に低下するものの,心不全により死亡することはない.しかし,腎臓の集合管上皮細胞に特異的なKLF5ノックアウトマウスにおいては心臓への圧負荷により心機能は急激に低下し,心不全を発症して多くのマウスは死亡した.このことから,腎臓の集合管上皮細胞は心臓への圧負荷に対する代償性の機構に必須であることが示された.
腎臓における特異的な遺伝子改変により心臓にどのような変化が生じるかを検討したところ,野生型のマウスにおいては心臓への圧負荷により心臓の組織マクロファージが著明に増加したが,腎臓の集合管上皮細胞に特異的なKLF5ノックアウトマウスにおいて増加はまったく認められなかった.そこで,心臓の組織マクロファージが増加しないことが心不全の原因ではないかと考え,野生型のマウスから心臓の組織マクロファージを単離して腎臓の集合管上皮細胞に特異的なKLF5ノックアウトマウスの心臓に移植したところ,心臓への圧負荷をくわえても心不全を発症しなくなった.このことから,心臓に圧負荷のかかった際には腎臓の集合管上皮細胞の関与する心臓の組織マクロファージの増加が心臓における恒常性の維持に必須であることが示された.
心臓に圧負荷のかかった際に腎臓の集合管上皮細胞と心臓の組織マクロファージとをつなぐタンパク質としてコロニー刺激因子2が同定された.心臓への圧負荷により腎臓の集合管上皮細胞においてKLF5が増加し,その下流にあるS100a8遺伝子およびS100a9遺伝子の転写が増加し腎臓にS100A8およびS100A9が分泌される.S100A8およびS100A9が腎臓の組織マクロファージを活性化し,そこから腎臓にTNFが分泌され,TNFにより腎臓の血管内皮細胞から血中にコロニー刺激因子2が分泌される.野生型のマウスにコロニー刺激因子2の中和抗体の投与することにより,心臓への圧負荷による心臓の組織マクロファージの増加がみられなくなり心不全が発症したことから,コロニー刺激因子2が増加し心臓の組織マクロファージが増加することが心臓に圧負荷のかかった際の重要な保護的な機構であると考えられた.
2.心臓の組織マクロファージの分泌するアンフィレグリンにより心臓における恒常性が維持される
心臓に圧負荷のかかった際の心臓の組織マクロファージの増加が心臓にとり保護的にはたらくとすると,つぎの疑問は,心臓の組織マクロファージはどのような機構により心筋細胞にはたらきかけて保護的な機能を発揮するかである.さまざまな臓器から組織マクロファージを採取して,心臓の組織マクロファージにおいて特異的に発現し心臓への圧負荷により増加するタンパク質を網羅的に探索したところ,アンフィレグリンが同定された.このアンフィレグリンは心筋細胞に作用させると心臓への圧負荷への適応に必須である心筋細胞の代償性の肥大をひき起こした.アンフィレグリンのノックアウトマウスの骨髄を野生型のマウスに移植し,心臓の組織マクロファージにおいてアンフィレグリンをノックアウトしたところ,心臓への圧負荷により心機能が低下し心不全による死が起こった.さらに,心臓への圧負荷により心臓の組織マクロファージが増加しない腎臓の集合管上皮細胞に特異的なKLF5ノックアウトマウスにアンフィレグリンを投与したところ,心臓の組織マクロファージが増加しないにもかかわらず,アンフィレグリンの投与のみで心不全は発症しなくなり,治療の効果があった.このことは,心臓の組織マクロファージがアンフィレグリンを分泌し,これが心筋細胞に作用しその肥大を惹起することにより心臓に対し保護的にはたらくことを意味した.
3.心臓-脳-腎臓の連携により心臓における恒常性が維持される
心臓への圧負荷がどのように腎臓の活性化につながるか検討した.さまざまな神経を切断することにより,心臓への圧負荷は脳へと迷走神経求心路および脊髄後根を介して求心性に伝達し,そののち,腎臓へと交感神経遠心路を介して遠心性に伝達された.このように,心臓,脳,腎臓は神経系と組織の免疫細胞(組織マクロファージ)の活性化を介しネットワークを形成し,心臓への圧負荷に対し保護的にはたらくことにより恒常性を維持しており,心不全からの保護において新しい経路のあることが明らかにされた(図1).
おわりに
この研究において,少なくとも3つの臓器が連携して心不全におちいらないようにする機構のあること,さらに,心臓および腎臓においてこのネットワークがはたらく際には組織マクロファージの活性化が鍵となることが明らかにされた.おそらく,このように臓器間ネットワークにおいて組織マクロファージの活性化が鍵となることは,ほかの臓器においてもあることが予想される.また,今回,心臓においては心臓の組織マクロファージが心筋細胞に対し保護的にはたらくことが示されたが,心臓の組織マクロファージは心臓の線維芽細胞や血管を構成する細胞への保護的な作用ももつことが予想される.今後,心臓の組織マクロファージが病因となる病態が存在するか,また,実際の腎臓病において,同定された新規の臓器間ネットワーク,あるいは,腎臓における組織マクロファージの活性化がどのように変容しているかなど,マウスおよびヒトにおいて解明すべきことが残されている.
文 献
- Hillege, H. L., Girbes, A. R. J., de Kam, P. J. et al.: Renal function, neurohormonal activation, and survival in patients with chronic heart failure. Circulation, 102, 203-210 (2000)[PubMed]
- McCullough, P. A., Kellum, J. A., Haase, M. et al.: Pathophysiology of the cardiorenal syndromes: executive summary from the eleventh consensus conference of the Acute Dialysis Quality Initiative (ADQI). Blood Purif., 37(suppl.2), 2-13 (2014)
- Takeda, N., Manabe, I., Uchino, Y. et al.: Cardiac fibroblasts are essential for the adaptive response of the murine heart to pressure overload. J. Clin. Invest., 120, 254-265 (2010)[PubMed]
- Sano, M., Minamino, T., Toko, H. et al.: p53-induced inhibition of Hif-1 causes cardiac dysfunction during pressure overload. Nature, 446, 444-448 (2007)[PubMed]
- Epelman, S., Lavine, K. J., Beaudin, A. E. et al.: Embryonic and adult-derived resident cardiac macrophages are maintained through distinct mechanisms at steady state and during inflammation. Immunity, 40, 91-104 (2014)[PubMed]
- Heidt, T., Courties, G., Dutta, P. et al.: Differential contribution of monocytes to heart macrophages in steady-state and after myocardial infarction. Circ. Res., 115, 284-295 (2014)[PubMed]
- Molawi, K., Wolf, Y., Kandalla, P. K. et al.: Progressive replacement of embryo-derived cardiac macrophages with age. J. Exp. Med., 211, 2151-2158 (2014)[PubMed]
- Fujiu, K., Manabe, I. & Nagai, R.: Renal collecting duct epithelial cells regulate inflammation in tubulointerstitial damage in mice. J. Clin. Invest., 121, 3425-3441 (2011)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2005年 東京大学大学院医学系研究科 修了,2007年 東京大学医学部附属病院 助教,2013年 科学技術振興機構 さきがけ研究者を経て,2015年より東京大学大学院医学系研究科 特任助教.
研究テーマ:細胞間および臓器間の相互作用を介したストレス応答の機構.
関心事:心血管疾患の病態の解明につながる新しい恒常性の維持およびその破綻の機構.
真鍋 一郎(Ichiro Manabe)
千葉大学大学院医学研究院 教授.
研究室URL:http://plaza.umin.ac.jp/manabe
© 2017 藤生克仁・真鍋一郎 Licensed under CC 表示 2.1 日本