精子の形成の際のヒストンH2A.L.2を介したクロマチンリモデリングの機構
両角佑一1・胡桃坂仁志2・Saadi Khochbin 1
(1フランスGrenoble Alpes大学Institute for Advanced Biosciences,2早稲田大学大学院先進理工学研究科 電気・情報生命専攻構造生物学研究室)
email:両角佑一
DOI: 10.7875/first.author.2017.035
Histone variant H2A.L.2 guides transition protein-dependent protamine assembly in male germ cells.
Sophie Barral, Yuichi Morozumi, Hiroki Tanaka, Emilie Montellier, Jérôme Govin, Maud de Dieuleveult, Guillaume Charbonnier, Yohann Couté, Denis Puthier, Thierry Buchou, Fayçal Boussouar, Takashi Urahama, François Fenaille, Sandrine Curtet, Patrick Héry, Nicolas Fernandez-Nunez, Hitoshi Shiota, Matthieu Gérard, Sophie Rousseaux, Hitoshi Kurumizaka, Saadi Khochbin
Molecular Cell, 66, 89-101.e8 (2017)
精子の形成の過程において,ヌクレオソームを基本としたクロマチンはヌクレオプロタミンを基本としたクロマチンへと大規模な構造変換を起こす.このクロマチンリモデリングは正常な精子の形成に必須であり,クロマチンに存在するヒストンがTPやプロタミンと置き換わることによりゲノムDNAのきわめて高度な凝縮が起こる.しかし,これらのタンパク質のあいだの機能的な関連やクロマチンリモデリングの分子機構についてはいまだ不明な点が多い.この研究において,筆者らは,精巣に特異的なヒストンバリアントのひとつであるヒストンH2A.L.2が,凝縮精子細胞においてTPと同じタイミングで共発現し,ヌクレオソームに取り込まれることによりTPのクロマチンへの結合が促進されることを見い出した.また,クロマチンと結合したTPを目印としてさらにプロタミンが集積することにより,ヌクレオプロタミンが効率的に形成されることがわかった.この研究により,ヒストン,TP,プロタミンの協調的なはたらきにより起こるクロマチンリモデリングの機構の一端が明らかにされた.
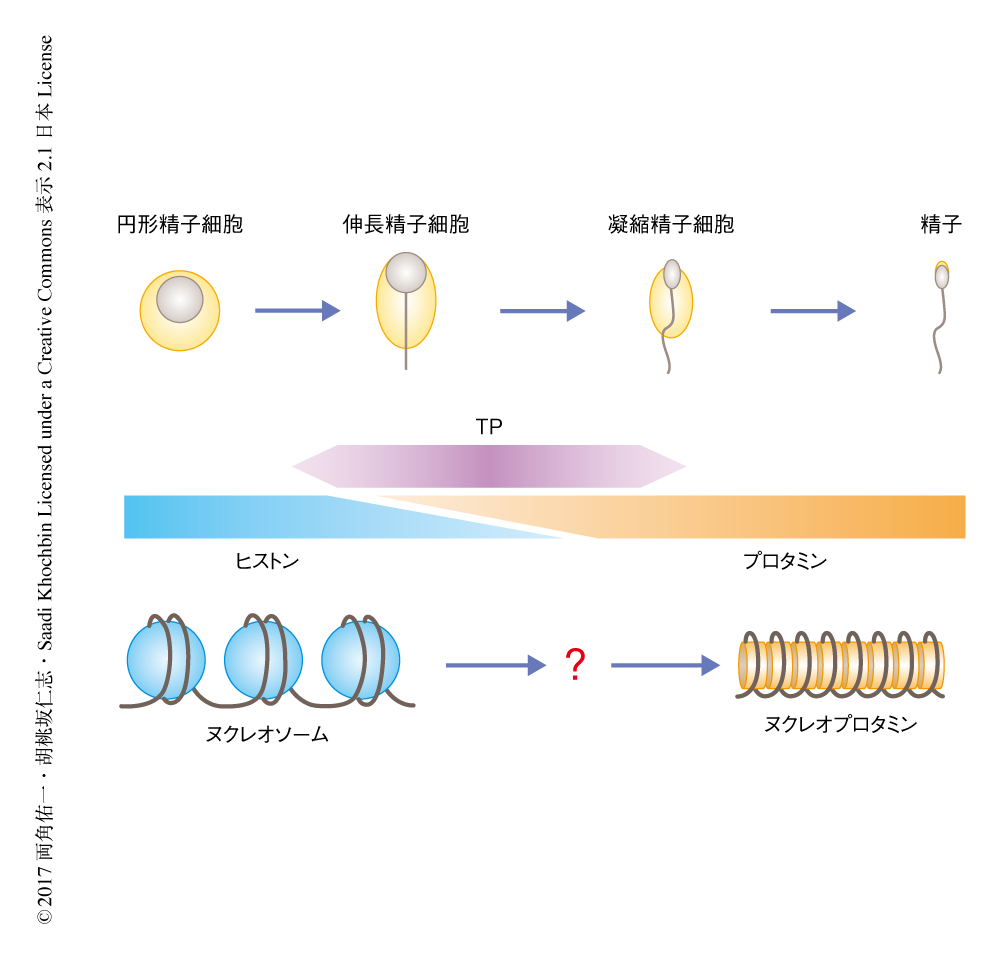
精子は父方の遺伝情報を母方の卵へととどける役割を担い,ヒトを含む多くの生物は精子と卵との受精により次世代へ遺伝情報を継承する.精子は精原細胞が一連の分化の過程をへることにより産生される.体細胞分裂により増殖した精原細胞の一部が精母細胞へと分化したのち,減数分裂により半数体の円形精子細胞になる.円形精子細胞はさらに伸長精子細胞,凝縮精子細胞へと形態が変化し,最終的に精子へと成熟する(図1).この精子の成熟の過程において,ヒストンからなるヌクレオソームを基本としたクロマチンは,プロタミンからなるヌクレオプロタミンを基本としたクロマチンへと大規模な構造変換を起こす1)(図1).
このクロマチンリモデリングについては,クロマチンに存在するヒストンがいったんTPと置き換わり,そののち,TPがさらにプロタミンと置き換わるというモデルが提唱されている2).しかし,伸長精子細胞および凝縮精子細胞においてTPおよびプロタミンの発現は同じ時期にはじまる.くわえて,その段階ではまだヒストンも存在するため,このモデルが正しいのかどうかははっきりとしていない.マウスに存在する2種類のプロタミンPrm1およびPrm2はゲノムDNAの高密度な凝縮に必須であり,そのノックアウトマウスはいずれもハプロ不全を示し雄性不妊となる3,4).一方で,TPも同じくTP1およびTP2の2種類が存在するが,TP1とTP2のダブルノックアウトマウスは雄性不妊を示すもののヌクレオプロタミンは形成される5-7).これらのことから,ヒストンからプロタミンへの置き換えにおけるTPの重要性については疑問の余地があり,クロマチンに存在するヒストンがどのようにしてTP,さらにはプロタミンへと置き換わるのか,その分子機構は依然として不明である(図1).
筆者らの研究室においては,成熟の過程の精子に存在するヒストンを網羅的に解析し,ヒストンH2AおよびヒストンH2Bの新規のバリアントをいくつか同定している8).この研究においては,そのなかでもクロマチンリモデリングの起こるタイミングにおいて発現するヒストンH2A.L.2に着目した.
精子の形成の過程においてヒストンH2A.L.2の発現する正確なタイミングを調べるため,マウスを用いて精子の形成の第1波におけるヒストンH2A.L.2の発現について解析した.その結果,産後28日まではヒストンH2A.L.2の発現は確認されず,産後29日においてはじめて発現が確認された.また,TPもヒストンH2A.L.2と同様に産後29日においてはじめて発現し,同一の細胞においてヒストンH2.L.2と共発現していた.
ヒストンH2A.L.2の精子の形成における役割について明らかにするため,ヒストンH2A.L.2のノックアウトマウスを作製しその表現型を解析した.その結果,ヒストンH2A.L.2ノックアウトマウスの精巣の組織に異常は認められず,プロタミンの発現も正常であった.また,ヒストンH2A.L.2ノックアウトマウスの精巣上体における精子の数は野生型のマウスとほぼ同じであった.にもかかわらず,ヒストンH2A.L.2ノックアウトマウスのオスを野生型マウスのメスと交配させても受精卵は得られず,ヒストンH2A.L.2ノックアウトマウスは雄性不妊を示すことが明らかにされた.同様に,体外受精においても,ヒストンH2A.L.2を欠損した精子を用いた場合には受精卵はほとんど得られなかった.また,成熟した精子におけるクロマチンの状態を電子顕微鏡により解析したところ,ヒストンH2A.L.2を欠損した精子においてゲノムDNAの凝縮は不十分であり,この表現型はTP1とTP2のダブルノックアウトマウスの表現型とよく似ていた.2種類のプロタミンのうちPrm2は前駆体として合成され,クロマチンに集積したのちプロセシングされることにより機能的なPrm2へと成熟するが,TP1 TP2ダブルノックアウトマウスの精子においてはPrm2前駆体のプロセシングの抑制が観察される5,6).そこで,ヒストンH2A.L.2ノックアウトマウスの精子に含まれるPrm2について調べたところ,TP1 TP2ダブルノックアウトマウスと同様にPrm2前駆体のプロセシングが抑制されていた.これらのことから,ヒストンH2A.L.2は正常な精子の形成に必須であり,TPと協調的にはたらくことが示唆された.
ヒストンH2A.L.2の欠損がTPの発現に影響をおよぼすのかどうか調べたところ,ヒストンH2A.L.2を欠損してもTP1あるいはTP2の発現そのものに変化はみられなかった.しかし,細胞における局在を高解像度で解析すると,野生型のマウスの凝縮精子細胞ではTP1およびTP2はいずれも核においてクロマチンと均一に結合する一方,ヒストンH2A.L.2ノックアウトマウスの凝縮精子細胞ではTP1およびTP2はいずれも核の周辺部への異常な蓄積を示した.このことから,TPとクロマチンとの相互作用にはヒストンH2A.L.2が必要であることが示唆された.また,凝縮精子細胞の核可溶性画分を用いてTP2と相互作用するタンパク質について調べた結果,野生型の凝縮精子細胞においてはほとんどみられないPrm2前駆体との相互作用が,ヒストンH2A.L.2を欠損した凝縮精子細胞において検出された.このことから,ヒストンH2A.L.2を欠損すると,Prm2前駆体がクロマチンと正常に結合していないTP2にトラップされることによりPrm2がクロマチンに取り込まれなくなるため,結果として,Prm2前駆体のプロセシングが抑制されると考えられた.
ヒストンH2A.L.2を含むヌクレオソームの生化学的な性質について解析するため,組換え体のヒストンを用いて試験管内においてヒストンH2A.L.2を含むヌクレオソームを再構成した.このヒストンH2A.L.2ヌクレオソームのミクロコッカスヌクレアーゼに対する感受性について調べたところ,ヒストンH2A.L.2ヌクレオソームに含まれるDNAは通常のヒストンH2Aを含むヌクレオソームに含まれるDNAと比較して急速に消化された.このことから,ヒストンH2A.L.2ヌクレオソームに含まれるDNAの両方の末端はフレキシブルで大きく開いた構造を形成することが示唆された.また,TPとヌクレオソームとの相互作用について解析した結果,TPは通常のヒストンH2Aヌクレオソームと比較してヒストンH2A.L.2ヌクレオソームに優位に結合し,また,結合のモードも異なることが明らかにされた.これは,ヒストンH2A.L.2ヌクレオソームに含まれるDNAの両方の末端がヒストンH2Aヌクレオソームと比べ大きく開いた構造をとることにより,TPがより多く結合するようになったためと考えられた.
以前に,筆者らは,凝縮精子細胞のクロマチンをミクロコッカスヌクレアーゼにより処理すると,ヌクレオソームにくわえヌクレオプロタミンへと移行する状態と思われるより低分子の構造体が検出され,そのなかにはTPおよびヒストンH2A.L.2が含まれることを見い出した8,9).今回,野生型のマウスおよびヒストンH2A.L.2ノックアウトマウスから得られた凝縮精子細胞を用いて同様に解析した結果,この低分子の構造体は野生型だけでなくヒストンH2A.L.2を欠損した凝縮精子細胞からも検出された.しかし,野生型の凝縮精子細胞においてTPおよびヒストンH2A.L.2は低分子の構造体の画分にのみ含まれた一方,ヒストンH2A.L.2を欠損した凝縮精子細胞においてTPは低分子の構造体の画分だけでなくヌクレオソームの画分にも含まれた.この結果は,試験管内においてTPとヌクレオソームとの結合を解析した結果を支持し,凝縮精子細胞においてヒストンH2A.L.2の取り込まれたヌクレオソームにTPが集積することにより,ヌクレオソームからこの低分子の構造体への移行が促進されることが示唆された.
野生型およびヒストンH2A.L.2を欠損した凝縮精子細胞のクロマチンをミクロコッカスヌクレアーゼで処理し,ヌクレオソーム画分および低分子の構造体の画分から得られたDNA断片の長さおよびゲノムにおける位置を次世代シークエンサーを用いて調べた.また,精母細胞および円形精子細胞から得られたヌクレオソーム画分に含まれるDNA断片についても同様に解析した.その結果,低分子の構造体に含まれるDNA断片のゲノムにおける分布は,精母細胞および円形精子細胞のヌクレオソーム画分に含まれるDNA断片と全体的に似ていた.このことから,円形精子細胞において形成されたヌクレオソームが凝縮精子細胞において低分子の構造体へと移行することが示された.また,ヌクレオソーム画分に含まれるDNA断片の長さは精母細胞,円形精子細胞,凝縮精子細胞のいずれにおいても,野生型とヒストンH2A.L.2欠損とのあいだに差異はなかった一方,ヒストンH2A.L.2欠損において低分子の構造体に含まれるDNA断片は野生型と比較して短かった.このことから,ヒストンH2A.L.2の欠損により低分子の構造体の構成が変化することが示唆され,この違いが精子におけるゲノムDNAの不十分な凝縮の原因になると推測された.
クロマチンリモデリングにおいてヒストンH2A.L.2のクロマチンへの取り込みが重要であることが明らかにされたことから,ヒストンH2A.L.2のヌクレオソームへの取り込みにかかわるタンパク質を探索した.筆者らは,先行研究において,精巣に特異的なヒストンバリアントであるヒストンTH2BがヒストンH2A.L.2と優位に複合体を形成することを見い出している8).そこで,ヒストンTH2Bにタグを付加したノックインマウス9) を利用してヒストンTH2Bと相互作用するタンパク質を網羅的に探索した.その結果,ヒストンのヌクレオソームへの取り込みにかかわるヒストンシャペロンがいくつか同定された.同定されたヒストンシャペロンとヒストンH2A.L.2との相互作用を個別に解析した結果,Nap1L4のみがヒストンH2A.L.2との相互作用を示した.このことから,ヒストンH2A.L.2はNap1L4によりクロマチンに取り込まれることが示唆された.
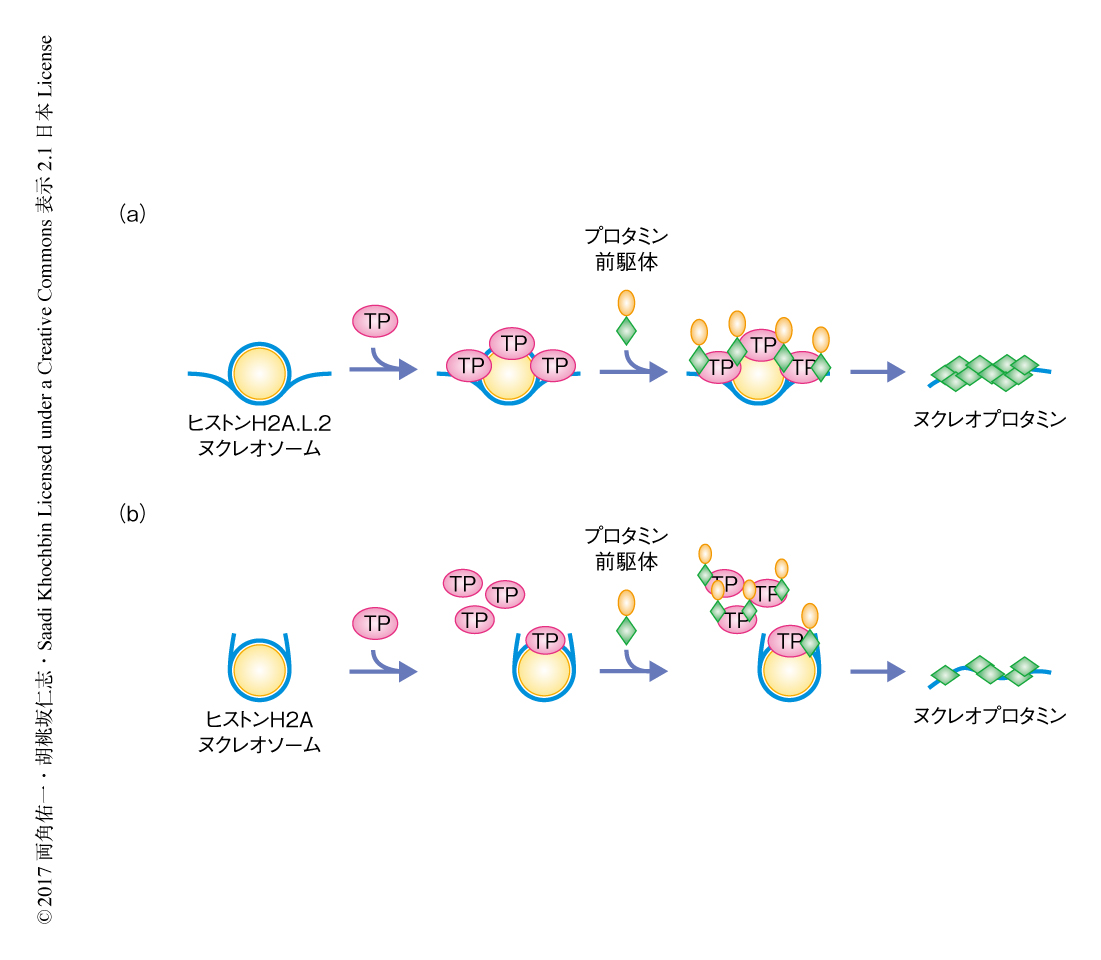
精子の形成の際の大規模なクロマチンリモデリングにおけるヒストン,TP,プロタミンの機能的な関連についての知見は,2004年にTP1 TP2ダブルノックアウトマウスの表現型の解析が報告されて以降,あまり蓄積されていない.今回の研究により,ヒストンH2A.L.2のヌクレオソームへの取り込みがTPのクロマチンへの結合を促進するうえで重要であることが明らかにされた(図2).また,クロマチンと結合したTPにさらにプロタミンが集積することにより,ヌクレオソームからヌクレオプロタミンへのクロマチンの構造変換が起こることがわかった(図2).精子の形成の際のクロマチンリモデリングにおいては,ヒストンがいったんTPと置き換わり,TPがさらにプロタミンと置き換わるというモデルが考えられてきた.しかし,この研究により,TPはあくまでヒストンとプロタミンとの橋渡し役として機能し,ヒストンはプロタミンにより直接に取り除かれるというモデルが考えられた(図2).実際に,このモデルはTP1 TP2ダブルノックアウトマウスの表現型からも支持された5,6).精子の形成における異常なクロマチンリモデリングは精子の形成不全による雄性不妊をひき起こす.今回,得られた知見をもとにクロマチンリモデリングの機構の理解をさらに深めることが,精子の形成不全に対する治療法の開発などにつながると期待される.
略歴:2011年 早稲田大学大学院先進理工学研究科博士後期課程 修了,同 助手,2013年 フランスInsutite Albert Bonniot博士研究員,フランスGrenoble Alpes大学 博士研究員などを経て,2017年より奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:がんや精子の形成におけるエピジェネティックなDNAの機能の発現する機構.
胡桃坂 仁志(Hitoshi Kurumizaka)
早稲田大学大学院先進理工学研究科 教授.
Saadi Khochbin
フランスGrenoble Alpes大学Team Leader.
© 2017 両角佑一・胡桃坂仁志・Saadi Khochbin Licensed under CC 表示 2.1 日本
(1フランスGrenoble Alpes大学Institute for Advanced Biosciences,2早稲田大学大学院先進理工学研究科 電気・情報生命専攻構造生物学研究室)
email:両角佑一
DOI: 10.7875/first.author.2017.035
Histone variant H2A.L.2 guides transition protein-dependent protamine assembly in male germ cells.
Sophie Barral, Yuichi Morozumi, Hiroki Tanaka, Emilie Montellier, Jérôme Govin, Maud de Dieuleveult, Guillaume Charbonnier, Yohann Couté, Denis Puthier, Thierry Buchou, Fayçal Boussouar, Takashi Urahama, François Fenaille, Sandrine Curtet, Patrick Héry, Nicolas Fernandez-Nunez, Hitoshi Shiota, Matthieu Gérard, Sophie Rousseaux, Hitoshi Kurumizaka, Saadi Khochbin
Molecular Cell, 66, 89-101.e8 (2017)
要 約
精子の形成の過程において,ヌクレオソームを基本としたクロマチンはヌクレオプロタミンを基本としたクロマチンへと大規模な構造変換を起こす.このクロマチンリモデリングは正常な精子の形成に必須であり,クロマチンに存在するヒストンがTPやプロタミンと置き換わることによりゲノムDNAのきわめて高度な凝縮が起こる.しかし,これらのタンパク質のあいだの機能的な関連やクロマチンリモデリングの分子機構についてはいまだ不明な点が多い.この研究において,筆者らは,精巣に特異的なヒストンバリアントのひとつであるヒストンH2A.L.2が,凝縮精子細胞においてTPと同じタイミングで共発現し,ヌクレオソームに取り込まれることによりTPのクロマチンへの結合が促進されることを見い出した.また,クロマチンと結合したTPを目印としてさらにプロタミンが集積することにより,ヌクレオプロタミンが効率的に形成されることがわかった.この研究により,ヒストン,TP,プロタミンの協調的なはたらきにより起こるクロマチンリモデリングの機構の一端が明らかにされた.
はじめに
精子は父方の遺伝情報を母方の卵へととどける役割を担い,ヒトを含む多くの生物は精子と卵との受精により次世代へ遺伝情報を継承する.精子は精原細胞が一連の分化の過程をへることにより産生される.体細胞分裂により増殖した精原細胞の一部が精母細胞へと分化したのち,減数分裂により半数体の円形精子細胞になる.円形精子細胞はさらに伸長精子細胞,凝縮精子細胞へと形態が変化し,最終的に精子へと成熟する(図1).この精子の成熟の過程において,ヒストンからなるヌクレオソームを基本としたクロマチンは,プロタミンからなるヌクレオプロタミンを基本としたクロマチンへと大規模な構造変換を起こす1)(図1).
このクロマチンリモデリングについては,クロマチンに存在するヒストンがいったんTPと置き換わり,そののち,TPがさらにプロタミンと置き換わるというモデルが提唱されている2).しかし,伸長精子細胞および凝縮精子細胞においてTPおよびプロタミンの発現は同じ時期にはじまる.くわえて,その段階ではまだヒストンも存在するため,このモデルが正しいのかどうかははっきりとしていない.マウスに存在する2種類のプロタミンPrm1およびPrm2はゲノムDNAの高密度な凝縮に必須であり,そのノックアウトマウスはいずれもハプロ不全を示し雄性不妊となる3,4).一方で,TPも同じくTP1およびTP2の2種類が存在するが,TP1とTP2のダブルノックアウトマウスは雄性不妊を示すもののヌクレオプロタミンは形成される5-7).これらのことから,ヒストンからプロタミンへの置き換えにおけるTPの重要性については疑問の余地があり,クロマチンに存在するヒストンがどのようにしてTP,さらにはプロタミンへと置き換わるのか,その分子機構は依然として不明である(図1).
筆者らの研究室においては,成熟の過程の精子に存在するヒストンを網羅的に解析し,ヒストンH2AおよびヒストンH2Bの新規のバリアントをいくつか同定している8).この研究においては,そのなかでもクロマチンリモデリングの起こるタイミングにおいて発現するヒストンH2A.L.2に着目した.
1.ヒストンH2A.L.2は正常な精子の形成に必須である
精子の形成の過程においてヒストンH2A.L.2の発現する正確なタイミングを調べるため,マウスを用いて精子の形成の第1波におけるヒストンH2A.L.2の発現について解析した.その結果,産後28日まではヒストンH2A.L.2の発現は確認されず,産後29日においてはじめて発現が確認された.また,TPもヒストンH2A.L.2と同様に産後29日においてはじめて発現し,同一の細胞においてヒストンH2.L.2と共発現していた.
ヒストンH2A.L.2の精子の形成における役割について明らかにするため,ヒストンH2A.L.2のノックアウトマウスを作製しその表現型を解析した.その結果,ヒストンH2A.L.2ノックアウトマウスの精巣の組織に異常は認められず,プロタミンの発現も正常であった.また,ヒストンH2A.L.2ノックアウトマウスの精巣上体における精子の数は野生型のマウスとほぼ同じであった.にもかかわらず,ヒストンH2A.L.2ノックアウトマウスのオスを野生型マウスのメスと交配させても受精卵は得られず,ヒストンH2A.L.2ノックアウトマウスは雄性不妊を示すことが明らかにされた.同様に,体外受精においても,ヒストンH2A.L.2を欠損した精子を用いた場合には受精卵はほとんど得られなかった.また,成熟した精子におけるクロマチンの状態を電子顕微鏡により解析したところ,ヒストンH2A.L.2を欠損した精子においてゲノムDNAの凝縮は不十分であり,この表現型はTP1とTP2のダブルノックアウトマウスの表現型とよく似ていた.2種類のプロタミンのうちPrm2は前駆体として合成され,クロマチンに集積したのちプロセシングされることにより機能的なPrm2へと成熟するが,TP1 TP2ダブルノックアウトマウスの精子においてはPrm2前駆体のプロセシングの抑制が観察される5,6).そこで,ヒストンH2A.L.2ノックアウトマウスの精子に含まれるPrm2について調べたところ,TP1 TP2ダブルノックアウトマウスと同様にPrm2前駆体のプロセシングが抑制されていた.これらのことから,ヒストンH2A.L.2は正常な精子の形成に必須であり,TPと協調的にはたらくことが示唆された.
2.ヒストンH2A.L2はTPのクロマチンへの結合およびプロタミンの効率的な取り込みに必要である
ヒストンH2A.L.2の欠損がTPの発現に影響をおよぼすのかどうか調べたところ,ヒストンH2A.L.2を欠損してもTP1あるいはTP2の発現そのものに変化はみられなかった.しかし,細胞における局在を高解像度で解析すると,野生型のマウスの凝縮精子細胞ではTP1およびTP2はいずれも核においてクロマチンと均一に結合する一方,ヒストンH2A.L.2ノックアウトマウスの凝縮精子細胞ではTP1およびTP2はいずれも核の周辺部への異常な蓄積を示した.このことから,TPとクロマチンとの相互作用にはヒストンH2A.L.2が必要であることが示唆された.また,凝縮精子細胞の核可溶性画分を用いてTP2と相互作用するタンパク質について調べた結果,野生型の凝縮精子細胞においてはほとんどみられないPrm2前駆体との相互作用が,ヒストンH2A.L.2を欠損した凝縮精子細胞において検出された.このことから,ヒストンH2A.L.2を欠損すると,Prm2前駆体がクロマチンと正常に結合していないTP2にトラップされることによりPrm2がクロマチンに取り込まれなくなるため,結果として,Prm2前駆体のプロセシングが抑制されると考えられた.
3.TPはヒストンH2A.L.2を含むヌクレオソームに優位に結合する
ヒストンH2A.L.2を含むヌクレオソームの生化学的な性質について解析するため,組換え体のヒストンを用いて試験管内においてヒストンH2A.L.2を含むヌクレオソームを再構成した.このヒストンH2A.L.2ヌクレオソームのミクロコッカスヌクレアーゼに対する感受性について調べたところ,ヒストンH2A.L.2ヌクレオソームに含まれるDNAは通常のヒストンH2Aを含むヌクレオソームに含まれるDNAと比較して急速に消化された.このことから,ヒストンH2A.L.2ヌクレオソームに含まれるDNAの両方の末端はフレキシブルで大きく開いた構造を形成することが示唆された.また,TPとヌクレオソームとの相互作用について解析した結果,TPは通常のヒストンH2Aヌクレオソームと比較してヒストンH2A.L.2ヌクレオソームに優位に結合し,また,結合のモードも異なることが明らかにされた.これは,ヒストンH2A.L.2ヌクレオソームに含まれるDNAの両方の末端がヒストンH2Aヌクレオソームと比べ大きく開いた構造をとることにより,TPがより多く結合するようになったためと考えられた.
以前に,筆者らは,凝縮精子細胞のクロマチンをミクロコッカスヌクレアーゼにより処理すると,ヌクレオソームにくわえヌクレオプロタミンへと移行する状態と思われるより低分子の構造体が検出され,そのなかにはTPおよびヒストンH2A.L.2が含まれることを見い出した8,9).今回,野生型のマウスおよびヒストンH2A.L.2ノックアウトマウスから得られた凝縮精子細胞を用いて同様に解析した結果,この低分子の構造体は野生型だけでなくヒストンH2A.L.2を欠損した凝縮精子細胞からも検出された.しかし,野生型の凝縮精子細胞においてTPおよびヒストンH2A.L.2は低分子の構造体の画分にのみ含まれた一方,ヒストンH2A.L.2を欠損した凝縮精子細胞においてTPは低分子の構造体の画分だけでなくヌクレオソームの画分にも含まれた.この結果は,試験管内においてTPとヌクレオソームとの結合を解析した結果を支持し,凝縮精子細胞においてヒストンH2A.L.2の取り込まれたヌクレオソームにTPが集積することにより,ヌクレオソームからこの低分子の構造体への移行が促進されることが示唆された.
4.ヌクレオソームから低分子の構造体への移行においてヒストンH2A.L.2のおよぼす影響
野生型およびヒストンH2A.L.2を欠損した凝縮精子細胞のクロマチンをミクロコッカスヌクレアーゼで処理し,ヌクレオソーム画分および低分子の構造体の画分から得られたDNA断片の長さおよびゲノムにおける位置を次世代シークエンサーを用いて調べた.また,精母細胞および円形精子細胞から得られたヌクレオソーム画分に含まれるDNA断片についても同様に解析した.その結果,低分子の構造体に含まれるDNA断片のゲノムにおける分布は,精母細胞および円形精子細胞のヌクレオソーム画分に含まれるDNA断片と全体的に似ていた.このことから,円形精子細胞において形成されたヌクレオソームが凝縮精子細胞において低分子の構造体へと移行することが示された.また,ヌクレオソーム画分に含まれるDNA断片の長さは精母細胞,円形精子細胞,凝縮精子細胞のいずれにおいても,野生型とヒストンH2A.L.2欠損とのあいだに差異はなかった一方,ヒストンH2A.L.2欠損において低分子の構造体に含まれるDNA断片は野生型と比較して短かった.このことから,ヒストンH2A.L.2の欠損により低分子の構造体の構成が変化することが示唆され,この違いが精子におけるゲノムDNAの不十分な凝縮の原因になると推測された.
5.ヒストンH2A.L.2はヒストンシャペロンNap1L4によりクロマチンに取り込まれる
クロマチンリモデリングにおいてヒストンH2A.L.2のクロマチンへの取り込みが重要であることが明らかにされたことから,ヒストンH2A.L.2のヌクレオソームへの取り込みにかかわるタンパク質を探索した.筆者らは,先行研究において,精巣に特異的なヒストンバリアントであるヒストンTH2BがヒストンH2A.L.2と優位に複合体を形成することを見い出している8).そこで,ヒストンTH2Bにタグを付加したノックインマウス9) を利用してヒストンTH2Bと相互作用するタンパク質を網羅的に探索した.その結果,ヒストンのヌクレオソームへの取り込みにかかわるヒストンシャペロンがいくつか同定された.同定されたヒストンシャペロンとヒストンH2A.L.2との相互作用を個別に解析した結果,Nap1L4のみがヒストンH2A.L.2との相互作用を示した.このことから,ヒストンH2A.L.2はNap1L4によりクロマチンに取り込まれることが示唆された.
おわりに
精子の形成の際の大規模なクロマチンリモデリングにおけるヒストン,TP,プロタミンの機能的な関連についての知見は,2004年にTP1 TP2ダブルノックアウトマウスの表現型の解析が報告されて以降,あまり蓄積されていない.今回の研究により,ヒストンH2A.L.2のヌクレオソームへの取り込みがTPのクロマチンへの結合を促進するうえで重要であることが明らかにされた(図2).また,クロマチンと結合したTPにさらにプロタミンが集積することにより,ヌクレオソームからヌクレオプロタミンへのクロマチンの構造変換が起こることがわかった(図2).精子の形成の際のクロマチンリモデリングにおいては,ヒストンがいったんTPと置き換わり,TPがさらにプロタミンと置き換わるというモデルが考えられてきた.しかし,この研究により,TPはあくまでヒストンとプロタミンとの橋渡し役として機能し,ヒストンはプロタミンにより直接に取り除かれるというモデルが考えられた(図2).実際に,このモデルはTP1 TP2ダブルノックアウトマウスの表現型からも支持された5,6).精子の形成における異常なクロマチンリモデリングは精子の形成不全による雄性不妊をひき起こす.今回,得られた知見をもとにクロマチンリモデリングの機構の理解をさらに深めることが,精子の形成不全に対する治療法の開発などにつながると期待される.
文 献
- Gaucher, J., Reynoird, N., Montellier, E. et al.: From meiosis to postmeiotic events: the secrets of histone disappearance. FEBS J., 277, 599-604 (2010)[PubMed]
- Rathke, C., Baarends, W. M., Awe, S. et al.: Chromatin dynamics during spermiogenesis. Biochim. Biophys. Acta, 1839, 155-168 (2014)[PubMed]
- Cho, C., Willis, W. D., Goulding, E. H, et al.: Haploinsufficiency of protamine-1 or -2 causes infertility in mice. Nat. Genet., 28, 82-86 (2001)[PubMed]
- Cho, C., Jung-Ha, H., Willis, W. D. et al.: Protamine 2 deficiency leads to sperm DNA damage and embryo death in mice. Biol. Reprod., 69, 211-217 (2003)[PubMed]
- Shirley, C. R., Hayashi, S., Mounsey, S. et al.: Abnormalities and reduced reproductive potential of sperm from Tnp1- and Tnp2-null double mutant mice. Biol. Reprod., 71, 1220-1229 (2004)[PubMed]
- Zhao, M., Shirley, C. R., Hayashi, S. et al.: Transition nuclear proteins are required for normal chromatin condensation and functional sperm development. Genesis, 38, 200-213 (2004)[PubMed]
- Zhao, M., Shirley, C. R., Mounsey, S. et al.: Nucleoprotein transitions during spermiogenesis in mice with transition nuclear protein Tnp1 and Tnp2 mutations. Biol. Reprod., 71, 1016-1025 (2004)[PubMed]
- Govin, J., Escoffier, E., Rousseaux, S. et al.: Pericentric heterochromatin reprogramming by new histone variants during mouse spermiogenesis. J. Cell Biol., 176, 283-294 (2007)[PubMed]
- Montellier, E., Boussouar, F., Rousseaux, S. et al.: Chromatin-to-nucleoprotamine transition is controlled by the histone H2B variant TH2B. Genes Dev., 27, 1680-1692 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 早稲田大学大学院先進理工学研究科博士後期課程 修了,同 助手,2013年 フランスInsutite Albert Bonniot博士研究員,フランスGrenoble Alpes大学 博士研究員などを経て,2017年より奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:がんや精子の形成におけるエピジェネティックなDNAの機能の発現する機構.
胡桃坂 仁志(Hitoshi Kurumizaka)
早稲田大学大学院先進理工学研究科 教授.
Saadi Khochbin
フランスGrenoble Alpes大学Team Leader.
© 2017 両角佑一・胡桃坂仁志・Saadi Khochbin Licensed under CC 表示 2.1 日本