マウスにおける転写因子SoxCファミリーによる視神経の交差を担う網膜神経芽細胞の分化および軸索ガイダンスの制御機構
桑島孝明・Carol Mason
(米国Columbia大学College of Physicians and Surgeons,Department of Pathology and Cell Biology)
email:桑島孝明
DOI: 10.7875/first.author.2017.024
SoxC transcription factors promote contralateral retinal ganglion cell differentiation and axon guidance in the mouse visual system.
Takaaki Kuwajima, Célia A. Soares, Austen A. Sitko, Véronique Lefebvre, Carol Mason
Neuron, 93, 1110-1125.e5 (2017)
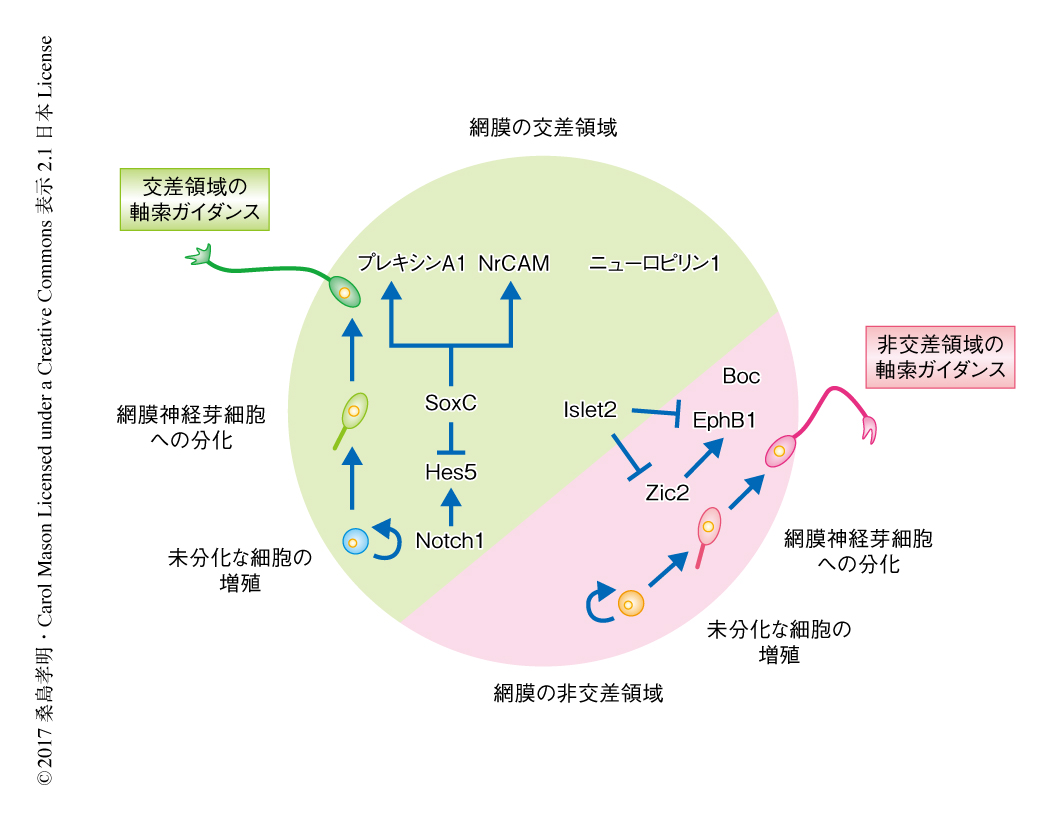
片目を閉じると両目で見るより物の空間的な位置を正確に把握することがむずかしくなる.それは,動物はひとつの物体を2つの眼で両眼視することにより正確に認識するからである.哺乳類の両眼視は,網膜神経節細胞から伸びる軸索が間脳の腹側において交差せずに同側に投射,および,交差して反対側に投射し,視交差を形成することにより達成される.この網膜からの軸索の視交差における投射の方向は,網膜神経節細胞の軸索の表面に特異的に発現するガイダンス受容体と,視交差の細胞に発現するガイダンスタンパク質が結合することにより制御される.これまでの研究により,非交差領域における軸索ガイダンスの分子機構,さらに,ガイダンス受容体の発現の制御機構については明らかにされ,また,交差領域における軸索ガイダンスの分子機構についても明らかにされているが,それを制御する転写因子およびガイダンス受容体の発現の制御機構については明らかにされていない.筆者らは,Sox4,Sox11,Sox12からなる転写因子SoxCファミリーが網膜の交差領域において発現して交差の形成を担う網膜神経芽細胞の分化を促進し,さらに,分化ののちの軸索の伸長を制御するガイダンス受容体の発現の制御,および,交差領域における軸索ガイダンスを制御することを明らかにした.また,このSoxCファミリーによる網膜神経芽細胞の分化および軸索の伸長は異なる遺伝子を介して制御されることも明らかにされた.この研究により,網膜の交差領域における網膜神経芽細胞の分化,および,交差領域における軸索ガイダンスにはたらく特異的な転写因子およびその制御機構がはじめて明らかにされた.
マウスにおける両眼視のための神経回路の形成においては,発生期において網膜の腹側領域からの軸索が視交差を介して同じ側の脳へと投射し,ほかの領域からの軸索が反対側の脳へと投射する必要がある.以前の研究より,非交差領域における軸索ガイダンスの分子機構およびガイダンス受容体の発現を制御する転写因子について明らかにされている.チロシンキナーゼ受容体EphB1は胎生14~17日目の網膜の非交差領域において発現し,そのリガンドであるエフリンB2が視交差の正中に発現してEphB1陽性の視細胞の軸索の伸長を阻害することにより視神経を非交差に誘導する1).転写因子Zic2は同様に網膜の非交差領域において発現しEphB1の発現を誘導する2,3).一方,筆者らの以前の研究により,交差領域における軸索ガイダンスの分子機構については,ガイダンスタンパク質であるセマフォリン6D,NrCAM,プレキシンA1が視交差において発現し,交差領域の軸索においてセマフォリン6Dの受容体であるNrCAMとプレキシンA1が相互作用することにより視交差に軸索を誘引することが明らかにされた4)(新着論文レビュー でも掲載).しかし,交差領域においてガイダンス受容体の発現を制御する転写因子は明らかにされていない.そこで,この研究においては,NrCAMをコードする遺伝子およびプレキシンA1をコードする遺伝子のプロモーター領域に結合する転写因子SoxCファミリーについて,網膜の交差領域における発現,網膜神経芽細胞の分化および交差領域における軸索ガイダンスへの作用,さらに,標的となる遺伝子の発現の制御機構を明らかにすることを目的とした.
以前の研究により,Sox4,Sox11,Sox12からなる転写因子SoxCファミリーがマウスの発生期の視覚系において網膜神経芽細胞に発現することが知られている5).しかし,SoxCファミリーが交差領域の網膜神経芽細胞に特異的に発現するかどうかは明らかにされていない.胎生14~17日目のマウスにおいては,網膜の交差領域と非交差領域を空間的あるいは分子的に区別することが容易である.SoxCファミリーの発現について調べたところ,非交差領域に発現する転写因子Zic2とほとんど共存しないことが明らかにされた.さらに,交差領域に発現するガイダンス受容体プレキシンA1と発現の分布が類似していたことから,SoxCファミリーは交差領域の網膜神経芽細胞に特異的に発現することが明らかにされた.
SoxCファミリーの網膜神経芽細胞における機能を解析するため,胎生14日目の網膜の交差領域においてSoxCファミリーを欠損するコンディショナルノックアウトマウスを作製した.生体においても網膜神経芽細胞の分散培養においてもSoxCファミリーを欠損させた網膜神経芽細胞は未分化な状態を保ったままで,ニューロンへと分化する割合が対照に比べ非常に低かった.しかし,胎生14日目の網膜の非交差領域においてSoxCファミリーを欠損するコンディショナルノックアウトマウスを作製し同様に網膜神経芽細胞を分散培養したところ,ニューロンへと正常に分化した.したがって,SoxCファミリーは網膜の交差領域において特異的に網膜神経芽細胞の分化を制御することが示された.
以前の研究により,Sox21が転写因子Hes5をコードする遺伝子のプロモーター領域と結合することにより,Notch1によるHes5の転写活性の上昇を抑制し,成体のマウスにおいて海馬におけるニューロンの新生を制御することが知られている6).そこで,同様にSoxCファミリーも発生期における網膜神経芽細胞の分化をNotchシグナルを介して制御するのかどうか検討した.その結果,SoxCファミリーは分化した網膜神経芽細胞において高く発現するが,Hes5およびNotch1はおもに未分化な細胞において高く発現していた.さらに,SoxCファミリーもSox21と同様に,Notch1によるHes5の転写活性の上昇を抑制した.網膜神経芽細胞の分散培養を用いてHes5の機能を解析したところ,Hes5を網膜の交差領域の未分化な細胞に強制発現させると未分化な状態を保ったままで,網膜神経芽細胞へと分化する割合が対照に比べ非常に低いことが明らかにされた.しかし,Hes5を網膜の非交差領域の未分化な細胞に強制発現させると網膜神経芽細胞へと正常に分化した.これらの現象は,SoxCファミリーを欠損させた網膜細胞と非常によく似ていた.そこで,Notch1の下流のシグナルを阻害する薬剤DAPTをSoxCファミリーを欠損させた網膜細胞に添加すると,未分化の状態を保っていた網膜細胞が網膜神経芽細胞へと正常に分化した.SoxCファミリーを欠損させた網膜細胞においてNotch1の下流のシグナルの発現を調べたところ,Hes5の発現がほかのシグナルタンパク質に比べもっとも高いことがわかった.以上のことから,SoxCファミリーはHes5をコードする遺伝子を標的とし,その発現を低下させることにより交差領域の網膜神経芽細胞の分化を促進することが示唆された.
さきに述べたように,胎生14日目の網膜の交差領域においてSoxCファミリーを欠損するコンディショナルノックアウトマウスにおいて,網膜細胞は未分化な状態を保ったまま分化しなかった.この方法では,分化ののちに起こる軸索の伸長あるいは軸索ガイダンスをSoxCファミリーが制御するかどうか機能解析は不可能である.しかしながら,成熟した網膜神経芽細胞においてSoxCファミリーを欠損させたところ,ニューロンへの分化および神経突起を維持したまま細胞死することもなく正常であった.そこで,SoxCファミリーの軸索ガイダンスへの作用について調べた.成熟した網膜神経芽細胞においてSoxCファミリーを欠損させて48時間培養しても,軸索の長さは対照と比べ変化がなかった.しかし,野生型の分散した視交差の細胞と共培養すると,SoxCファミリーを欠損させた成熟した網膜神経芽細胞の軸索の長さは対照と比べ短くなった.つまり,SoxCファミリーはたんに網膜神経芽細胞の軸索の伸長を制御するわけではなく,視交差からのなんらかの軸索ガイダンスシグナルを介して軸索の伸長に関与することが示唆された.
成熟した網膜神経芽細胞においてSoxCファミリーを欠損するコンディショナルノックアウトマウスを用いて,生体においてSoxCファミリーが網膜の交差領域における軸索ガイダンスに関与するかどうか調べた.野生型のマウスにおいてはほとんどすべての軸索が視交差を介して反対側の脳に投射するのに対し,成熟した網膜神経芽細胞においてSoxCファミリーを欠損させると,同じ側の脳に投射する軸索が観察された.これには2つの理由が考えられた.SoxCファミリーを欠損させた網膜神経芽細胞において交差領域におけるガイダンスシグナルが低下していること,あるいは,非交差領域におけるガイダンスシグナルが上昇していること,である.網膜の交差領域におけるガイダンス受容体であるNrCAM,プレキシンA1,ニューロピリン1 7) の発現を調べたところ,SoxCファミリーを欠損させたマウスの網膜神経芽細胞においてNrCAMおよびプレキシンA1が減少していた.網膜の非交差領域におけるガイダンス受容体であるEphB1およびZic2の発現を調べたところ,SoxCファミリーを欠損させたマウスの網膜神経芽細胞において異所的な発現の上昇はみられなかった.以上の結果から,SoxCファミリーは網膜の交差領域におけるガイダンス受容体NrCAMおよびプレキシンA1の発現を上昇させることにより交差領域における軸索ガイダンスを制御することが明らかにされた.
以上の結果から,転写因子SoxCファミリーは発生期のマウスにおいて網膜の交差領域の網膜神経芽細胞に発現し,Notch1-Hes5シグナルを低下させることにより分化を促進し,さらに,網膜の交差領域におけるガイダンス受容体であるNrCAMおよびプレキシンA1の発現を上昇させることにより交差領域における軸索ガイダンスを制御することが明らかにされた(図1).すべての網膜神経芽細胞ではなく,交差領域の網膜神経芽細胞にだけ特異的にはたらいている点,また,非交差領域のガイダンスシグナルあるいは網膜神経芽細胞の分化にはたらきかけて交差領域の軸索ガイダンスやニューロンへの分化を間接的に制御しているわけではないという点は興味深い.たとえば,交差領域の網膜神経芽細胞に発現する転写因子Islet2は,非交差領域のガイダンス受容体であるEphB1およびZic2の発現を低下させることにより交差領域の軸索ガイダンスを制御する8).
プレキシンA1とNrCAMのダブルノックアウトマウスおよびSoxCファミリーのノックアウトマウスにおいては網膜の交差領域からの軸索のうち一部のみが同じ側の脳に投射することから,ほかのタンパク質も交差領域における軸索ガイダンスを制御していることが考えられる.また,SoxCファミリーが標的となる遺伝子の発現をどのように制御するのか,たとえば,すべて同時に標的となる遺伝子の発現量を制御するのか,あるいは,時系列的に標的となる遺伝子と結合し制御するのかは不明である.今後,こういった交差領域における軸索ガイダンスを制御する分子機構,および,転写因子による細胞の特異性の獲得の分子機構の研究が,哺乳類が獲得した両眼視の分子機構を知るうえで重要であろう.
略歴:2006年 大阪大学大学院理学研究科 修了,同年より米国Columbia大学College of Physicians and SurgeonsにてAssociate Research Scientist.
研究テーマ:視神経の軸索ガイダンスの制御機構の解明およびその応用.
抱負:眼を“知る”ことから,将来,眼を“治す”こと,再生にむけて眼を“創る”ことに焦点をあてたい.
Carol Mason
米国Columbia大学College of Physicians and SurgeonsにてProfessor.
© 2017 桑島孝明・Carol Mason Licensed under CC 表示 2.1 日本
(米国Columbia大学College of Physicians and Surgeons,Department of Pathology and Cell Biology)
email:桑島孝明
DOI: 10.7875/first.author.2017.024
SoxC transcription factors promote contralateral retinal ganglion cell differentiation and axon guidance in the mouse visual system.
Takaaki Kuwajima, Célia A. Soares, Austen A. Sitko, Véronique Lefebvre, Carol Mason
Neuron, 93, 1110-1125.e5 (2017)
要 約
片目を閉じると両目で見るより物の空間的な位置を正確に把握することがむずかしくなる.それは,動物はひとつの物体を2つの眼で両眼視することにより正確に認識するからである.哺乳類の両眼視は,網膜神経節細胞から伸びる軸索が間脳の腹側において交差せずに同側に投射,および,交差して反対側に投射し,視交差を形成することにより達成される.この網膜からの軸索の視交差における投射の方向は,網膜神経節細胞の軸索の表面に特異的に発現するガイダンス受容体と,視交差の細胞に発現するガイダンスタンパク質が結合することにより制御される.これまでの研究により,非交差領域における軸索ガイダンスの分子機構,さらに,ガイダンス受容体の発現の制御機構については明らかにされ,また,交差領域における軸索ガイダンスの分子機構についても明らかにされているが,それを制御する転写因子およびガイダンス受容体の発現の制御機構については明らかにされていない.筆者らは,Sox4,Sox11,Sox12からなる転写因子SoxCファミリーが網膜の交差領域において発現して交差の形成を担う網膜神経芽細胞の分化を促進し,さらに,分化ののちの軸索の伸長を制御するガイダンス受容体の発現の制御,および,交差領域における軸索ガイダンスを制御することを明らかにした.また,このSoxCファミリーによる網膜神経芽細胞の分化および軸索の伸長は異なる遺伝子を介して制御されることも明らかにされた.この研究により,網膜の交差領域における網膜神経芽細胞の分化,および,交差領域における軸索ガイダンスにはたらく特異的な転写因子およびその制御機構がはじめて明らかにされた.
はじめに
マウスにおける両眼視のための神経回路の形成においては,発生期において網膜の腹側領域からの軸索が視交差を介して同じ側の脳へと投射し,ほかの領域からの軸索が反対側の脳へと投射する必要がある.以前の研究より,非交差領域における軸索ガイダンスの分子機構およびガイダンス受容体の発現を制御する転写因子について明らかにされている.チロシンキナーゼ受容体EphB1は胎生14~17日目の網膜の非交差領域において発現し,そのリガンドであるエフリンB2が視交差の正中に発現してEphB1陽性の視細胞の軸索の伸長を阻害することにより視神経を非交差に誘導する1).転写因子Zic2は同様に網膜の非交差領域において発現しEphB1の発現を誘導する2,3).一方,筆者らの以前の研究により,交差領域における軸索ガイダンスの分子機構については,ガイダンスタンパク質であるセマフォリン6D,NrCAM,プレキシンA1が視交差において発現し,交差領域の軸索においてセマフォリン6Dの受容体であるNrCAMとプレキシンA1が相互作用することにより視交差に軸索を誘引することが明らかにされた4)(新着論文レビュー でも掲載).しかし,交差領域においてガイダンス受容体の発現を制御する転写因子は明らかにされていない.そこで,この研究においては,NrCAMをコードする遺伝子およびプレキシンA1をコードする遺伝子のプロモーター領域に結合する転写因子SoxCファミリーについて,網膜の交差領域における発現,網膜神経芽細胞の分化および交差領域における軸索ガイダンスへの作用,さらに,標的となる遺伝子の発現の制御機構を明らかにすることを目的とした.
1.SoxCファミリーは交差領域の網膜神経芽細胞に発現する
以前の研究により,Sox4,Sox11,Sox12からなる転写因子SoxCファミリーがマウスの発生期の視覚系において網膜神経芽細胞に発現することが知られている5).しかし,SoxCファミリーが交差領域の網膜神経芽細胞に特異的に発現するかどうかは明らかにされていない.胎生14~17日目のマウスにおいては,網膜の交差領域と非交差領域を空間的あるいは分子的に区別することが容易である.SoxCファミリーの発現について調べたところ,非交差領域に発現する転写因子Zic2とほとんど共存しないことが明らかにされた.さらに,交差領域に発現するガイダンス受容体プレキシンA1と発現の分布が類似していたことから,SoxCファミリーは交差領域の網膜神経芽細胞に特異的に発現することが明らかにされた.
2.SoxCファミリーは交差領域の網膜神経芽細胞の分化を制御する
SoxCファミリーの網膜神経芽細胞における機能を解析するため,胎生14日目の網膜の交差領域においてSoxCファミリーを欠損するコンディショナルノックアウトマウスを作製した.生体においても網膜神経芽細胞の分散培養においてもSoxCファミリーを欠損させた網膜神経芽細胞は未分化な状態を保ったままで,ニューロンへと分化する割合が対照に比べ非常に低かった.しかし,胎生14日目の網膜の非交差領域においてSoxCファミリーを欠損するコンディショナルノックアウトマウスを作製し同様に網膜神経芽細胞を分散培養したところ,ニューロンへと正常に分化した.したがって,SoxCファミリーは網膜の交差領域において特異的に網膜神経芽細胞の分化を制御することが示された.
3.SoxCファミリーはNotchシグナルを制御することにより網膜神経芽細胞の分化を促進する
以前の研究により,Sox21が転写因子Hes5をコードする遺伝子のプロモーター領域と結合することにより,Notch1によるHes5の転写活性の上昇を抑制し,成体のマウスにおいて海馬におけるニューロンの新生を制御することが知られている6).そこで,同様にSoxCファミリーも発生期における網膜神経芽細胞の分化をNotchシグナルを介して制御するのかどうか検討した.その結果,SoxCファミリーは分化した網膜神経芽細胞において高く発現するが,Hes5およびNotch1はおもに未分化な細胞において高く発現していた.さらに,SoxCファミリーもSox21と同様に,Notch1によるHes5の転写活性の上昇を抑制した.網膜神経芽細胞の分散培養を用いてHes5の機能を解析したところ,Hes5を網膜の交差領域の未分化な細胞に強制発現させると未分化な状態を保ったままで,網膜神経芽細胞へと分化する割合が対照に比べ非常に低いことが明らかにされた.しかし,Hes5を網膜の非交差領域の未分化な細胞に強制発現させると網膜神経芽細胞へと正常に分化した.これらの現象は,SoxCファミリーを欠損させた網膜細胞と非常によく似ていた.そこで,Notch1の下流のシグナルを阻害する薬剤DAPTをSoxCファミリーを欠損させた網膜細胞に添加すると,未分化の状態を保っていた網膜細胞が網膜神経芽細胞へと正常に分化した.SoxCファミリーを欠損させた網膜細胞においてNotch1の下流のシグナルの発現を調べたところ,Hes5の発現がほかのシグナルタンパク質に比べもっとも高いことがわかった.以上のことから,SoxCファミリーはHes5をコードする遺伝子を標的とし,その発現を低下させることにより交差領域の網膜神経芽細胞の分化を促進することが示唆された.
4.SoxCファミリーは視交差からのガイダンスシグナルを介して網膜の交差領域における軸索の伸長を制御する
さきに述べたように,胎生14日目の網膜の交差領域においてSoxCファミリーを欠損するコンディショナルノックアウトマウスにおいて,網膜細胞は未分化な状態を保ったまま分化しなかった.この方法では,分化ののちに起こる軸索の伸長あるいは軸索ガイダンスをSoxCファミリーが制御するかどうか機能解析は不可能である.しかしながら,成熟した網膜神経芽細胞においてSoxCファミリーを欠損させたところ,ニューロンへの分化および神経突起を維持したまま細胞死することもなく正常であった.そこで,SoxCファミリーの軸索ガイダンスへの作用について調べた.成熟した網膜神経芽細胞においてSoxCファミリーを欠損させて48時間培養しても,軸索の長さは対照と比べ変化がなかった.しかし,野生型の分散した視交差の細胞と共培養すると,SoxCファミリーを欠損させた成熟した網膜神経芽細胞の軸索の長さは対照と比べ短くなった.つまり,SoxCファミリーはたんに網膜神経芽細胞の軸索の伸長を制御するわけではなく,視交差からのなんらかの軸索ガイダンスシグナルを介して軸索の伸長に関与することが示唆された.
5.SoxCファミリーはガイダンス受容体NrCAMおよびプレキシンA1の発現を上昇させることにより網膜の交差領域における軸索ガイダンスを制御する
成熟した網膜神経芽細胞においてSoxCファミリーを欠損するコンディショナルノックアウトマウスを用いて,生体においてSoxCファミリーが網膜の交差領域における軸索ガイダンスに関与するかどうか調べた.野生型のマウスにおいてはほとんどすべての軸索が視交差を介して反対側の脳に投射するのに対し,成熟した網膜神経芽細胞においてSoxCファミリーを欠損させると,同じ側の脳に投射する軸索が観察された.これには2つの理由が考えられた.SoxCファミリーを欠損させた網膜神経芽細胞において交差領域におけるガイダンスシグナルが低下していること,あるいは,非交差領域におけるガイダンスシグナルが上昇していること,である.網膜の交差領域におけるガイダンス受容体であるNrCAM,プレキシンA1,ニューロピリン1 7) の発現を調べたところ,SoxCファミリーを欠損させたマウスの網膜神経芽細胞においてNrCAMおよびプレキシンA1が減少していた.網膜の非交差領域におけるガイダンス受容体であるEphB1およびZic2の発現を調べたところ,SoxCファミリーを欠損させたマウスの網膜神経芽細胞において異所的な発現の上昇はみられなかった.以上の結果から,SoxCファミリーは網膜の交差領域におけるガイダンス受容体NrCAMおよびプレキシンA1の発現を上昇させることにより交差領域における軸索ガイダンスを制御することが明らかにされた.
おわりに
以上の結果から,転写因子SoxCファミリーは発生期のマウスにおいて網膜の交差領域の網膜神経芽細胞に発現し,Notch1-Hes5シグナルを低下させることにより分化を促進し,さらに,網膜の交差領域におけるガイダンス受容体であるNrCAMおよびプレキシンA1の発現を上昇させることにより交差領域における軸索ガイダンスを制御することが明らかにされた(図1).すべての網膜神経芽細胞ではなく,交差領域の網膜神経芽細胞にだけ特異的にはたらいている点,また,非交差領域のガイダンスシグナルあるいは網膜神経芽細胞の分化にはたらきかけて交差領域の軸索ガイダンスやニューロンへの分化を間接的に制御しているわけではないという点は興味深い.たとえば,交差領域の網膜神経芽細胞に発現する転写因子Islet2は,非交差領域のガイダンス受容体であるEphB1およびZic2の発現を低下させることにより交差領域の軸索ガイダンスを制御する8).
プレキシンA1とNrCAMのダブルノックアウトマウスおよびSoxCファミリーのノックアウトマウスにおいては網膜の交差領域からの軸索のうち一部のみが同じ側の脳に投射することから,ほかのタンパク質も交差領域における軸索ガイダンスを制御していることが考えられる.また,SoxCファミリーが標的となる遺伝子の発現をどのように制御するのか,たとえば,すべて同時に標的となる遺伝子の発現量を制御するのか,あるいは,時系列的に標的となる遺伝子と結合し制御するのかは不明である.今後,こういった交差領域における軸索ガイダンスを制御する分子機構,および,転写因子による細胞の特異性の獲得の分子機構の研究が,哺乳類が獲得した両眼視の分子機構を知るうえで重要であろう.
文 献
- Williams, S. E., Mann, F., Erskine, L. et al.: Ephrin-B2 and EphB1 mediate retinal axon divergence at the optic chiasm. Neuron, 39, 919-935 (2003)[PubMed]
- Herrera, E., Brown, L., Aruga, J. et al.: Zic2 patterns binocular vision by specifying the uncrossed retinal projection. Cell, 114, 545-557 (2003)[PubMed]
- Lee, R., Petros, T. J. & Mason, C. A.: Zic2 regulates retinal ganglion cell axon avoidance of ephrinB2 through inducing expression of the guidance receptor EphB1. J. Neurosci., 28, 5910-5919 (2004)[PubMed]
- Kuwajima, T., Yoshida, Y., Takegahara, N. et al.: Optic chiasm presentation of Semaphorin6D in the context of Plexin-A1 and Nr-CAM promotes retinal axon midline crossing. Neuron, 74, 676-690 (2012)[PubMed] [新着論文レビュー]
- Usui, A., Mochizuki, Y., Iida, A. et al.: The early retinal progenitor-expressed gene Sox11 regulates the timing of the differentiation of retinal cells. Development, 140, 740-750 (2013)[PubMed]
- Matsuda, S., Kuwako, K., Okano, H. J. et al.: Sox21 promotes hippocampal adult neurogenesis via the transcriptional repression of the Hes5 gene. J. Neurosci., 32, 12543-12557 (2012)[PubMed]
- Erskine, L., Reijntjes, S., Pratt, T. et al.: VEGF signaling through neuropilin 1 guides commissural axon crossing at the optic chiasm. Neuron, 70, 951-965 (2011)[PubMed]
- Pak, W., Hindges, R., Lim, Y. S. et al.: Magnitude of binocular vision controlled by Islet-2 repression of a genetic program that specifies laterality of retinal axon pathfinding. Cell, 119, 567-578 (2004)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2006年 大阪大学大学院理学研究科 修了,同年より米国Columbia大学College of Physicians and SurgeonsにてAssociate Research Scientist.
研究テーマ:視神経の軸索ガイダンスの制御機構の解明およびその応用.
抱負:眼を“知る”ことから,将来,眼を“治す”こと,再生にむけて眼を“創る”ことに焦点をあてたい.
Carol Mason
米国Columbia大学College of Physicians and SurgeonsにてProfessor.
© 2017 桑島孝明・Carol Mason Licensed under CC 表示 2.1 日本