血管性ニッチにおけるAkt-mTOR経路の活性化は造血幹細胞および前駆細胞の維持と分化を調節する
小林英毅・Shahin Rafii
(米国Weill Cornell Medical College,Department of Genetic Medicine)
email:小林英毅
DOI: 10.7875/first.author.2010.057
Angiocrine factors from Akt-activated endothelial cells balance self-renewal and differentiation of haematopoietic stem cells.
Hideki Kobayashi, Jason M. Butler, Rebekah O'Donnell, Mariko Kobayashi, Bi-Sen Ding, Bryant Bonner, Vi K. Chiu, Daniel J. Nolan, Koji Shido, Laura Benjamin, Shahin Rafii
Nature Cell Biology, 11, 1046-1056 (2010)
血管内皮細胞は骨髄において幹細胞を維持するニッチとよばれる微小環境を形成し,angiocrine因子と総称される因子の産生をとおして造血幹細胞および前駆細胞の維持と調節に機能している.しかし,血管内皮細胞がいかにして造血幹細胞および前駆細胞の調節を行っているのかは明らかではない.この研究では,血管内皮細胞におけるAkt-mTOR経路がangiocrine因子の産生の制御をとおして造血幹細胞および前駆細胞の維持と増殖に重要な役割をはたすことを見い出した.血管内皮細胞と造血幹細胞および前駆細胞のin vitro共培養系において,血管内皮細胞におけるAktの活性化はFGF2,IGFBP2などの発現を誘導して長期の骨髄再構築能をもつ造血幹細胞および前駆細胞の増幅を促進した.一方,MAPキナーゼの活性化は造血幹細胞の増幅を抑制した.成体マウスにおける血管内皮細胞に特異的なAktの活性化は骨髄の造血幹細胞および前駆細胞の数と短期および長期の骨髄再構築能を増加させた.血管性ニッチにおけるAktとMAPキナーゼの活性化のバランスによるangiocrine因子の発現調節により,造血幹細胞および前駆細胞の維持,増幅,分化が制御されていることが考えられた.
造血幹細胞は骨髄の“ニッチ”とよばれる特別な微小環境によって維持されている.ニッチには大きく分けて,特殊な骨芽細胞により構成される骨内膜ニッチ1,2) と,血管内皮細胞により構成される血管性ニッチ3) とが知られている.骨内膜ニッチは造血幹細胞を静止状態にとどめて幹細胞の未分化性を保つことで幹細胞の長期維持に貢献しているのに対し,血管性ニッチは幹細胞の維持にくわえ,増殖や分化,末梢への動員など動的な過程の調節をしているものと想定されている4).たとえば,骨髄の血管内皮細胞は造血前駆細胞,とくに,巨核球前駆細胞の増殖と分化を支持し,骨髄の血管を傷害すると血小板の産生に異常が生じる5).近年,造血幹細胞のみならず,神経幹細胞6),脂肪幹細胞7) など,さまざまな組織幹細胞と血管内皮細胞とが近接して存在していることが明らかになり,幹細胞ニッチとしての血管内皮細胞の役割が注目されている.しかし,血管内皮細胞がいかにして幹細胞の維持と分化を制御しているかについては十分には明らかにされていない.
血管内皮細胞は酸素と栄養の供給を行う血管の主要な構成細胞である一方,さまざまな生理活性因子や生理活性物質(ここでは,angiocrine因子とよぶ)を産生して種々の生理現象を調節している8).組織障害,炎症,低酸素,抗がん剤による治療などの刺激に応じて,血管内皮細胞は活性化の状態を変化させてangiocrine因子を産生し,たとえば,接着因子の発現を誘導して免疫細胞の局在を制御し正常な炎症応答を調節したりする.同様に,血管性ニッチにおいても血管内皮細胞の活性化の状態に応じたangiocrine因子の発現の変動が造血幹細胞の活性と運命を制御しているものと考えられる.この研究では,血管性ニッチにおけるAkt-mTOR経路とp42/p44 MAPキナーゼ経路の活性化のはたす役割を解析した.血管内皮細胞と造血幹細胞との共培養系において,Aktの活性化した血管内皮細胞が長期の骨髄再構築能をもつ造血幹細胞の増幅を支持した一方,MAPキナーゼの活性化は分化を誘導することを見い出した.さらに,成体マウスにおける血管に特異的なAktの活性化は造血幹細胞の増加をひき起こすことを明らかにした.
まず,血管内皮細胞による造血幹細胞および造血前駆細胞の調節機構の解析のため,両者のin vitro共培養系を確立した.血管内皮細胞の培養の維持には高濃度の血清やFGF2などの増殖因子が必要であるが,これらは造血幹細胞および造血前駆細胞の増殖や分化を誘導するためこの共培養系への添加は適切ではない.そこで,アデノウイルスに由来するE4ORF1遺伝子を導入することで血管内皮細胞の無血清培地での長期にわたる維持が可能となった.E4ORF1遺伝子を導入したヒト臍帯静脈血管内皮細胞と,比較的未分化な造血幹細胞および造血前駆細胞の画分であるマウスlineage(Lin)陰性細胞とを共培養すると,分化血液細胞のみならず造血幹細胞が濃縮された細胞画分の増幅が認められた.増幅したマウスLin陰性細胞は致死量の放射線を照射したマウスに移植すると血液系を再構築することから,長期の骨髄再構築能を維持していることが確認された.これらの結果は,血管内皮細胞が造血幹細胞および造血前駆細胞の維持や増殖を支持するangiocrine因子を産生することを示しており,この共培養系はこれらの因子の同定および作用の解析に有効であると考えられた.
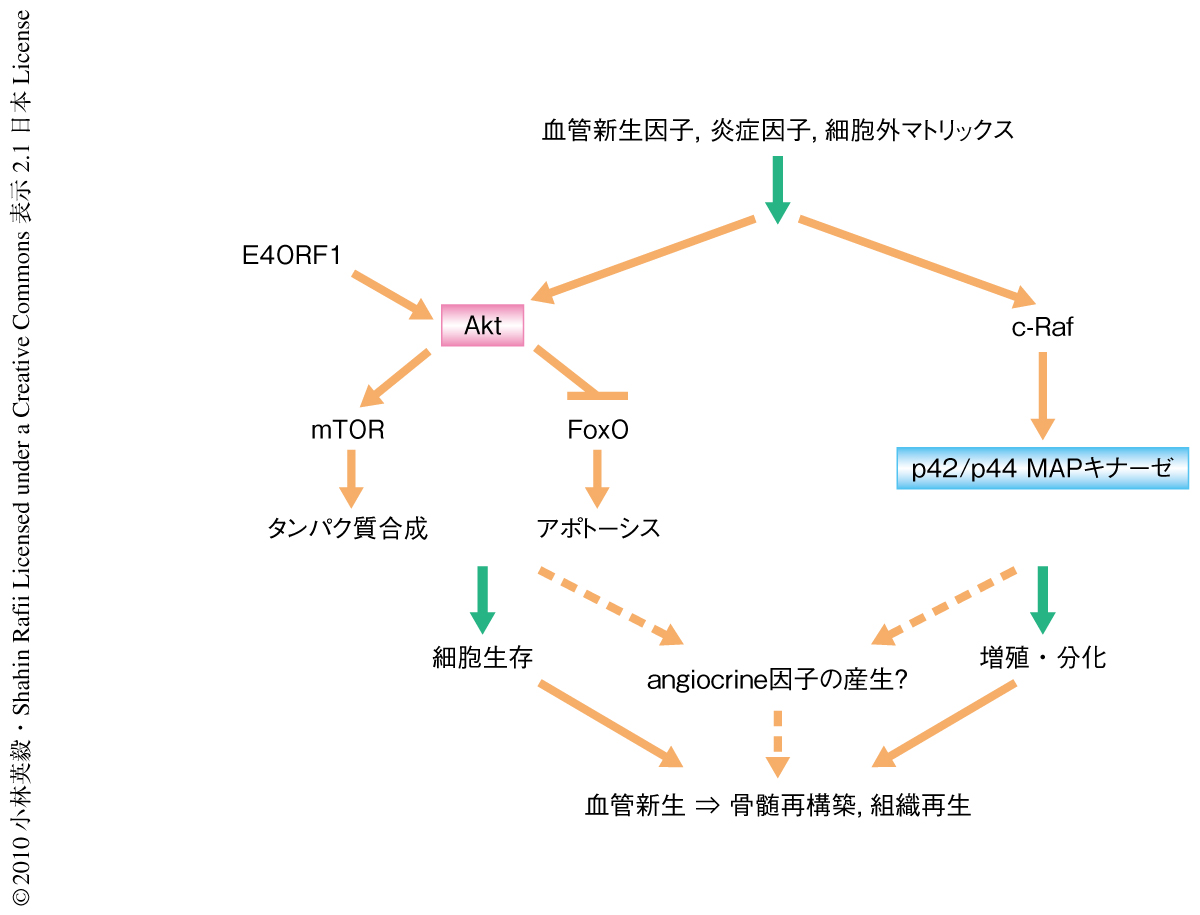
つぎに,この共培養系を用いて血管内皮細胞にて造血幹細胞および造血前駆細胞のangiocrine因子の産生を調節する経路の同定を進めた.E4ORF1遺伝子は血管内皮細胞において生存シグナルであるAktの活性化をひき起こした.また,骨髄障害ののちの血液系の回復には血管系の再構築(血管新生)が必要であるが,この過程にはAkt経路とp42/p44 MAPキナーゼ経路の活性化が重要である.そこで,この2つの経路が血管性ニッチにおける造血幹細胞および造血前駆細胞のangiocrine因子の産生の調節においても重要な役割を担っているのではないかと推論し共培養系にて検討した(図1).
レンチウイルスによりヒト臍帯静脈血管内皮細胞にE4ORF1遺伝子,構成的活性化Akt1変異体,構成的活性化c-Raf変異体,また,これまで血管内皮細胞の不死化に汎用されてきた構成的活性化K-Ras変異体,そして,ポリオーマミドルT抗原を導入して,Akt単独,AktとMAPキナーゼの両者,MAPキナーゼ単独,のそれぞれが構成的に活性化した血管内皮細胞を作製した.これらの血管内皮細胞で比較的未分化な造血幹細胞および造血前駆細胞の画分であるマウスLin陰性細胞を培養すると,Akt単独の活性化した血管内皮細胞が造血幹細胞および造血前駆細胞を効率的に増幅するのに対して,AktとMAPキナーゼの両者の活性化した血管内皮細胞ではその増幅活性は約1/10に低下しており,MAPキナーゼ単独の活性化した血管内皮細胞ではさらに低下していた.これら異なる血管内皮細胞で増殖した同数のマウスLin陰性細胞を放射線を照射したマウスに移植して長期の骨髄再構築能を評価した.すると,Aktを活性化した血管内皮細胞で培養したLin陰性細胞は,MAPキナーゼを活性化した血管内皮細胞で培養したLin陰性細胞と比較して,より骨髄再構築能を維持していた.これらの結果は,Aktの活性化した血管内皮細胞は,MAPキナーゼの活性化と比較して,造血幹細胞および造血前駆細胞の維持と増殖いずれの面でも支持能力の高いことを示した.
細胞周期の解析から,骨髄に存在する造血幹細胞および造血前駆細胞,もしくは,Aktの活性化した血管内皮細胞で培養した造血幹細胞および造血前駆細胞に対して,MAPキナーゼの活性化した血管内皮細胞で培養した造血幹細胞および造血前駆細胞では,G0期からG1期にある細胞の割合が減少してG2期の細胞の割合が増加していた.さらに,MAPキナーゼの活性化した血管内皮細胞の細胞上清をAktの活性化した血管内皮細胞とマウスLin陰性細胞との共培養系に添加すると,造血幹細胞および造血前駆細胞の増幅を顕著に抑制した.これらの結果は,血管内皮細胞におけるMAPキナーゼの活性化は造血幹細胞および造血前駆細胞の増殖を支持すると同時に分化をも促進することを示唆した.Aktの活性化した血管ニッチが造血幹細胞および造血前駆細胞の維持および増幅を支持する一方,MAPキナーゼの活性化によりその活性は抑制され,両者の活性化の強度のバランスにより造血幹細胞および造血前駆細胞の維持と分化の方向が決定されるものと考えられた.
血管内皮細胞の産生する造血幹細胞および造血前駆細胞のangiocrine因子を解析するためマイクロアレイ解析を行った.Aktの活性化とMAPキナーゼの活性化はそれぞれ多数の遺伝子の発現調節を行ったが,造血幹細胞の維持,増幅,分化に関与することが報告されている53の遺伝子を抽出した比較において,両者は異なる発現調節プロファイルを示した.すなわち,Aktの活性化によりFGF2遺伝子,IGFBP2遺伝子など造血幹細胞および造血前駆細胞の維持作用および増幅作用をもつ遺伝子の発現が誘導されていた一方,MAPキナーゼの活性化によってangiopoietin-2遺伝子,IL-6遺伝子など造血幹細胞および造血前駆細胞の分化を促進する遺伝子の発現が誘導されていた.また,造血幹細胞および造血前駆細胞の未分化性の維持および分化の制御に重要なはたらきを担うNotchリガンド9) については,delta-like 1遺伝子がAktの活性化により,jagged-1遺伝子とdelta-like 4遺伝子がMAPキナーゼの活性化により,誘導された.
これらの遺伝子が血管内皮細胞による造血幹細胞および造血前駆細胞の増幅に重要であるかどうかを解析するため,血管内皮細胞においてshRNAを用いたノックダウン実験を行い,共培養系によって造血幹細胞および造血前駆細胞の増幅活性を評価した.すると,FGF2遺伝子,IGFBP2遺伝子,jagged-1遺伝子のノックダウンにより造血幹細胞および造血前駆細胞の増幅活性が減弱した.これらの結果から,Akt経路によって発現誘導されるFGF2やIGFBP2,また,Notchリガンドなどが協調して血管性ニッチにおける造血幹細胞および造血前駆細胞の維持や増殖に貢献していることが考えられた.
Akt経路の下流おいて造血幹細胞および造血前駆細胞のangiocrine因子の産生に寄与する経路を絞り込むためmTORとFoxO1の関与について解析した.Aktの活性化した血管内皮細胞において,mTOR阻害剤であるラパマイシン処理,または,Akt抵抗性FoxO1の強制発現をしたうえでマイクロアレイ解析を行った.すると,Aktによって調節されている造血幹細胞および造血前駆細胞のangiocrine因子の多くがmTORによって制御されていることが明らかになった.shRNAを用いてmTORをノックダウンするとAktの活性化した血管内皮細胞においてIGFBP2の発現量が減少し,造血幹細胞および造血前駆細胞の増幅支持活性および増幅した細胞の長期の骨髄再構築能が減弱した.一方,FoxO1の高発現はこれらに変化をあたえなかった.血管性ニッチにおいてAkt-mTOR経路が造血幹細胞および造血前駆細胞の支持に重要であるものと考えられた.
生体の血管ニッチにおいても血管内皮細胞でのAkt-mTOR経路が造血幹細胞および造血前駆細胞の増幅に重要であるかどうかを調べるため,成体において血管内皮細胞に特異的に構成的活性化Akt変異体を発現するトランスジェニックマウスを作製した.その結果,血管内皮細胞に特異的な構成的活性化Akt変異体の発現誘導は骨髄および脾臓の造血幹細胞および造血前駆細胞の総数と存在頻度を増加させた.また,骨髄移植実験により,構成的活性化Akt変異体を発現したマウスに由来する骨髄細胞は放射線障害ののちの短期の血液系再構築能および長期の骨髄再構築能の顕著に高いことが示された.これらの結果により,血管性ニッチにおけるAktの活性化が造血幹細胞の維持および増殖を支持することが明らかとなった.
血管内皮細胞は血管の主要な構成細胞として酸素と栄養の供給を行う一方で,種々の刺激に応じて活性化の状態を変化させ,生理活性物質の産生をとおしてさまざまな生理現象を調節している.この研究では,血管性ニッチにおけるAktの活性化がangiocrine因子の産生を介して造血幹細胞および造血前駆細胞の維持や増殖を促進していることを示した.Akt-mTOR経路とp42/p44 MAPキナーゼ経路の活性化のバランスがangiocrine因子の産生の調節を介して造血幹細胞の維持と分化の決定を行っているものと考えられる(図2).では,血管性ニッチより産生される多数のangiocrine因子のうちどれがどのように幹細胞性の制御や維持に寄与しているのか,また,Akt-mTOR経路以外の経路の寄与やそれらの活性化のバランスはどのように制御されているのかについては,今後,解明されるべき課題である.この研究で用いた共培養系はこれら因子の同定と機能の解明に有用と期待される.障害のときの組織修復の過程や抗がん剤による治療ののちの血液系の回復において血管系の再構築は必須である.血管性ニッチにおける組織幹細胞の制御機構のさらなる解明は血管性ニッチ状態の制御による修復促進治療法の開発のための一助となるものと考えられる.
略歴:1997年 東京大学大学院理学系研究科修士課程 修了,同年 三共 研究員,2001~2003年 大阪大学医学部 客員研究員,2005年 同 医学博士,2008~2009年 米国Weill Cornell Medical College客員研究員を経て,2010年より第一三共 研究員.
研究テーマ:血管機能の再生,血管性ニッチの制御による薬剤の開発.
関心事:血管老化と再生を標的とした新規な機構による治療薬の開発を精力的に行っています.
Shahin Rafii
米国Weill Cornell Medical College教授.
© 2010 小林英毅・Shahin Rafii Licensed under CC 表示 2.1 日本
(米国Weill Cornell Medical College,Department of Genetic Medicine)
email:小林英毅
DOI: 10.7875/first.author.2010.057
Angiocrine factors from Akt-activated endothelial cells balance self-renewal and differentiation of haematopoietic stem cells.
Hideki Kobayashi, Jason M. Butler, Rebekah O'Donnell, Mariko Kobayashi, Bi-Sen Ding, Bryant Bonner, Vi K. Chiu, Daniel J. Nolan, Koji Shido, Laura Benjamin, Shahin Rafii
Nature Cell Biology, 11, 1046-1056 (2010)
要 約
血管内皮細胞は骨髄において幹細胞を維持するニッチとよばれる微小環境を形成し,angiocrine因子と総称される因子の産生をとおして造血幹細胞および前駆細胞の維持と調節に機能している.しかし,血管内皮細胞がいかにして造血幹細胞および前駆細胞の調節を行っているのかは明らかではない.この研究では,血管内皮細胞におけるAkt-mTOR経路がangiocrine因子の産生の制御をとおして造血幹細胞および前駆細胞の維持と増殖に重要な役割をはたすことを見い出した.血管内皮細胞と造血幹細胞および前駆細胞のin vitro共培養系において,血管内皮細胞におけるAktの活性化はFGF2,IGFBP2などの発現を誘導して長期の骨髄再構築能をもつ造血幹細胞および前駆細胞の増幅を促進した.一方,MAPキナーゼの活性化は造血幹細胞の増幅を抑制した.成体マウスにおける血管内皮細胞に特異的なAktの活性化は骨髄の造血幹細胞および前駆細胞の数と短期および長期の骨髄再構築能を増加させた.血管性ニッチにおけるAktとMAPキナーゼの活性化のバランスによるangiocrine因子の発現調節により,造血幹細胞および前駆細胞の維持,増幅,分化が制御されていることが考えられた.
はじめに
造血幹細胞は骨髄の“ニッチ”とよばれる特別な微小環境によって維持されている.ニッチには大きく分けて,特殊な骨芽細胞により構成される骨内膜ニッチ1,2) と,血管内皮細胞により構成される血管性ニッチ3) とが知られている.骨内膜ニッチは造血幹細胞を静止状態にとどめて幹細胞の未分化性を保つことで幹細胞の長期維持に貢献しているのに対し,血管性ニッチは幹細胞の維持にくわえ,増殖や分化,末梢への動員など動的な過程の調節をしているものと想定されている4).たとえば,骨髄の血管内皮細胞は造血前駆細胞,とくに,巨核球前駆細胞の増殖と分化を支持し,骨髄の血管を傷害すると血小板の産生に異常が生じる5).近年,造血幹細胞のみならず,神経幹細胞6),脂肪幹細胞7) など,さまざまな組織幹細胞と血管内皮細胞とが近接して存在していることが明らかになり,幹細胞ニッチとしての血管内皮細胞の役割が注目されている.しかし,血管内皮細胞がいかにして幹細胞の維持と分化を制御しているかについては十分には明らかにされていない.
血管内皮細胞は酸素と栄養の供給を行う血管の主要な構成細胞である一方,さまざまな生理活性因子や生理活性物質(ここでは,angiocrine因子とよぶ)を産生して種々の生理現象を調節している8).組織障害,炎症,低酸素,抗がん剤による治療などの刺激に応じて,血管内皮細胞は活性化の状態を変化させてangiocrine因子を産生し,たとえば,接着因子の発現を誘導して免疫細胞の局在を制御し正常な炎症応答を調節したりする.同様に,血管性ニッチにおいても血管内皮細胞の活性化の状態に応じたangiocrine因子の発現の変動が造血幹細胞の活性と運命を制御しているものと考えられる.この研究では,血管性ニッチにおけるAkt-mTOR経路とp42/p44 MAPキナーゼ経路の活性化のはたす役割を解析した.血管内皮細胞と造血幹細胞との共培養系において,Aktの活性化した血管内皮細胞が長期の骨髄再構築能をもつ造血幹細胞の増幅を支持した一方,MAPキナーゼの活性化は分化を誘導することを見い出した.さらに,成体マウスにおける血管に特異的なAktの活性化は造血幹細胞の増加をひき起こすことを明らかにした.
1.血管内皮細胞は造血幹細胞と造血前駆細胞のex vivoでの増幅と分化を支持する
まず,血管内皮細胞による造血幹細胞および造血前駆細胞の調節機構の解析のため,両者のin vitro共培養系を確立した.血管内皮細胞の培養の維持には高濃度の血清やFGF2などの増殖因子が必要であるが,これらは造血幹細胞および造血前駆細胞の増殖や分化を誘導するためこの共培養系への添加は適切ではない.そこで,アデノウイルスに由来するE4ORF1遺伝子を導入することで血管内皮細胞の無血清培地での長期にわたる維持が可能となった.E4ORF1遺伝子を導入したヒト臍帯静脈血管内皮細胞と,比較的未分化な造血幹細胞および造血前駆細胞の画分であるマウスlineage(Lin)陰性細胞とを共培養すると,分化血液細胞のみならず造血幹細胞が濃縮された細胞画分の増幅が認められた.増幅したマウスLin陰性細胞は致死量の放射線を照射したマウスに移植すると血液系を再構築することから,長期の骨髄再構築能を維持していることが確認された.これらの結果は,血管内皮細胞が造血幹細胞および造血前駆細胞の維持や増殖を支持するangiocrine因子を産生することを示しており,この共培養系はこれらの因子の同定および作用の解析に有効であると考えられた.
2.血管内皮細胞におけるAktの活性化はMAPキナーゼの活性化より造血幹細胞および造血前駆細胞の増幅を支持する
つぎに,この共培養系を用いて血管内皮細胞にて造血幹細胞および造血前駆細胞のangiocrine因子の産生を調節する経路の同定を進めた.E4ORF1遺伝子は血管内皮細胞において生存シグナルであるAktの活性化をひき起こした.また,骨髄障害ののちの血液系の回復には血管系の再構築(血管新生)が必要であるが,この過程にはAkt経路とp42/p44 MAPキナーゼ経路の活性化が重要である.そこで,この2つの経路が血管性ニッチにおける造血幹細胞および造血前駆細胞のangiocrine因子の産生の調節においても重要な役割を担っているのではないかと推論し共培養系にて検討した(図1).
レンチウイルスによりヒト臍帯静脈血管内皮細胞にE4ORF1遺伝子,構成的活性化Akt1変異体,構成的活性化c-Raf変異体,また,これまで血管内皮細胞の不死化に汎用されてきた構成的活性化K-Ras変異体,そして,ポリオーマミドルT抗原を導入して,Akt単独,AktとMAPキナーゼの両者,MAPキナーゼ単独,のそれぞれが構成的に活性化した血管内皮細胞を作製した.これらの血管内皮細胞で比較的未分化な造血幹細胞および造血前駆細胞の画分であるマウスLin陰性細胞を培養すると,Akt単独の活性化した血管内皮細胞が造血幹細胞および造血前駆細胞を効率的に増幅するのに対して,AktとMAPキナーゼの両者の活性化した血管内皮細胞ではその増幅活性は約1/10に低下しており,MAPキナーゼ単独の活性化した血管内皮細胞ではさらに低下していた.これら異なる血管内皮細胞で増殖した同数のマウスLin陰性細胞を放射線を照射したマウスに移植して長期の骨髄再構築能を評価した.すると,Aktを活性化した血管内皮細胞で培養したLin陰性細胞は,MAPキナーゼを活性化した血管内皮細胞で培養したLin陰性細胞と比較して,より骨髄再構築能を維持していた.これらの結果は,Aktの活性化した血管内皮細胞は,MAPキナーゼの活性化と比較して,造血幹細胞および造血前駆細胞の維持と増殖いずれの面でも支持能力の高いことを示した.
細胞周期の解析から,骨髄に存在する造血幹細胞および造血前駆細胞,もしくは,Aktの活性化した血管内皮細胞で培養した造血幹細胞および造血前駆細胞に対して,MAPキナーゼの活性化した血管内皮細胞で培養した造血幹細胞および造血前駆細胞では,G0期からG1期にある細胞の割合が減少してG2期の細胞の割合が増加していた.さらに,MAPキナーゼの活性化した血管内皮細胞の細胞上清をAktの活性化した血管内皮細胞とマウスLin陰性細胞との共培養系に添加すると,造血幹細胞および造血前駆細胞の増幅を顕著に抑制した.これらの結果は,血管内皮細胞におけるMAPキナーゼの活性化は造血幹細胞および造血前駆細胞の増殖を支持すると同時に分化をも促進することを示唆した.Aktの活性化した血管ニッチが造血幹細胞および造血前駆細胞の維持および増幅を支持する一方,MAPキナーゼの活性化によりその活性は抑制され,両者の活性化の強度のバランスにより造血幹細胞および造血前駆細胞の維持と分化の方向が決定されるものと考えられた.
3.血管内皮細胞は活性化の状態に応じて異なるangiocrine因子を産生する
血管内皮細胞の産生する造血幹細胞および造血前駆細胞のangiocrine因子を解析するためマイクロアレイ解析を行った.Aktの活性化とMAPキナーゼの活性化はそれぞれ多数の遺伝子の発現調節を行ったが,造血幹細胞の維持,増幅,分化に関与することが報告されている53の遺伝子を抽出した比較において,両者は異なる発現調節プロファイルを示した.すなわち,Aktの活性化によりFGF2遺伝子,IGFBP2遺伝子など造血幹細胞および造血前駆細胞の維持作用および増幅作用をもつ遺伝子の発現が誘導されていた一方,MAPキナーゼの活性化によってangiopoietin-2遺伝子,IL-6遺伝子など造血幹細胞および造血前駆細胞の分化を促進する遺伝子の発現が誘導されていた.また,造血幹細胞および造血前駆細胞の未分化性の維持および分化の制御に重要なはたらきを担うNotchリガンド9) については,delta-like 1遺伝子がAktの活性化により,jagged-1遺伝子とdelta-like 4遺伝子がMAPキナーゼの活性化により,誘導された.
これらの遺伝子が血管内皮細胞による造血幹細胞および造血前駆細胞の増幅に重要であるかどうかを解析するため,血管内皮細胞においてshRNAを用いたノックダウン実験を行い,共培養系によって造血幹細胞および造血前駆細胞の増幅活性を評価した.すると,FGF2遺伝子,IGFBP2遺伝子,jagged-1遺伝子のノックダウンにより造血幹細胞および造血前駆細胞の増幅活性が減弱した.これらの結果から,Akt経路によって発現誘導されるFGF2やIGFBP2,また,Notchリガンドなどが協調して血管性ニッチにおける造血幹細胞および造血前駆細胞の維持や増殖に貢献していることが考えられた.
4.mTORはAktの活性化した血管内皮細胞における造血幹細胞および造血前駆細胞のangiocrine因子の産生の制御に重要である
Akt経路の下流おいて造血幹細胞および造血前駆細胞のangiocrine因子の産生に寄与する経路を絞り込むためmTORとFoxO1の関与について解析した.Aktの活性化した血管内皮細胞において,mTOR阻害剤であるラパマイシン処理,または,Akt抵抗性FoxO1の強制発現をしたうえでマイクロアレイ解析を行った.すると,Aktによって調節されている造血幹細胞および造血前駆細胞のangiocrine因子の多くがmTORによって制御されていることが明らかになった.shRNAを用いてmTORをノックダウンするとAktの活性化した血管内皮細胞においてIGFBP2の発現量が減少し,造血幹細胞および造血前駆細胞の増幅支持活性および増幅した細胞の長期の骨髄再構築能が減弱した.一方,FoxO1の高発現はこれらに変化をあたえなかった.血管性ニッチにおいてAkt-mTOR経路が造血幹細胞および造血前駆細胞の支持に重要であるものと考えられた.
5.成体マウス血管におけるAktの活性化は造血幹細胞および造血前駆細胞の増加をひき起こす
生体の血管ニッチにおいても血管内皮細胞でのAkt-mTOR経路が造血幹細胞および造血前駆細胞の増幅に重要であるかどうかを調べるため,成体において血管内皮細胞に特異的に構成的活性化Akt変異体を発現するトランスジェニックマウスを作製した.その結果,血管内皮細胞に特異的な構成的活性化Akt変異体の発現誘導は骨髄および脾臓の造血幹細胞および造血前駆細胞の総数と存在頻度を増加させた.また,骨髄移植実験により,構成的活性化Akt変異体を発現したマウスに由来する骨髄細胞は放射線障害ののちの短期の血液系再構築能および長期の骨髄再構築能の顕著に高いことが示された.これらの結果により,血管性ニッチにおけるAktの活性化が造血幹細胞の維持および増殖を支持することが明らかとなった.
おわりに
血管内皮細胞は血管の主要な構成細胞として酸素と栄養の供給を行う一方で,種々の刺激に応じて活性化の状態を変化させ,生理活性物質の産生をとおしてさまざまな生理現象を調節している.この研究では,血管性ニッチにおけるAktの活性化がangiocrine因子の産生を介して造血幹細胞および造血前駆細胞の維持や増殖を促進していることを示した.Akt-mTOR経路とp42/p44 MAPキナーゼ経路の活性化のバランスがangiocrine因子の産生の調節を介して造血幹細胞の維持と分化の決定を行っているものと考えられる(図2).では,血管性ニッチより産生される多数のangiocrine因子のうちどれがどのように幹細胞性の制御や維持に寄与しているのか,また,Akt-mTOR経路以外の経路の寄与やそれらの活性化のバランスはどのように制御されているのかについては,今後,解明されるべき課題である.この研究で用いた共培養系はこれら因子の同定と機能の解明に有用と期待される.障害のときの組織修復の過程や抗がん剤による治療ののちの血液系の回復において血管系の再構築は必須である.血管性ニッチにおける組織幹細胞の制御機構のさらなる解明は血管性ニッチ状態の制御による修復促進治療法の開発のための一助となるものと考えられる.
文 献
- Calvi, L. M., Adams, G. B., Weibrecht, K. W. et al.: Osteoblastic cells regulate the haematopoietic stem cell niche. Nature, 425, 841-846 (2003)[PubMed]
- Zhang, J., Niu, C., Ye, L. et al.: Identification of the haematopoietic stem cell niche and control of the niche size. Nature, 425, 836-841 (2003)[PubMed]
- Kiel, M. J., Yilmaz, O. H., Iwashita, T. et al.: SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell, 121, 1109-1121 (2005)[PubMed]
- Yin, T. & Li, L.: The stem cell niches in bone. J. Clin. Invest., 116, 1195-1201 (2006)[PubMed]
- Avecilla, S. T., Hattori, K., Heissig, B. et al.: Chemokine-mediated interaction of hematopoietic progenitors with the bone marrow vascular niche is required for thrombopoiesis. Nat. Med., 10, 64-71 (2004)[PubMed]
- Shen, Q., Goderie, S. K., Jin, L. et al.: Endothelial cells stimulate self-renewal and expand neurogenesis of neural stem cells. Science, 304, 1338-1340 (2004)[PubMed]
- Tang, W., Zeve, D., Suh, J. M. et al.: White fat progenitor cells reside in the adipose vasculature. Science, 322, 583-586 (2008)[PubMed]
- Butler, J. M., Kobayashi, H. & Rafii, S.: Instructive role of the vascular niche in promoting tumour growth and tissue repair by angiocrine factors. Nat. Rev. Cancer., 10, 138-146 (2010)[PubMed]
- Butler, J. M., Nolan, D. J., Vertes, E. L. et al.: Endothelial cells are essential for the self-renewal and repopulation of Notch-dependent hematopoietic stem cells. Cell Stem Cell, 6, 251-264 (2010)[PubMed]
著者プロフィール
略歴:1997年 東京大学大学院理学系研究科修士課程 修了,同年 三共 研究員,2001~2003年 大阪大学医学部 客員研究員,2005年 同 医学博士,2008~2009年 米国Weill Cornell Medical College客員研究員を経て,2010年より第一三共 研究員.
研究テーマ:血管機能の再生,血管性ニッチの制御による薬剤の開発.
関心事:血管老化と再生を標的とした新規な機構による治療薬の開発を精力的に行っています.
Shahin Rafii
米国Weill Cornell Medical College教授.
© 2010 小林英毅・Shahin Rafii Licensed under CC 表示 2.1 日本