骨髄異形成症候群におけるクローン進化は2次性白血病への進展と関連する
牧島秀樹・小川誠司
(京都大学大学院医学研究科 腫瘍生物学講座)
email:牧島秀樹
DOI: 10.7875/first.author.2017.005
Dynamics of clonal evolution in myelodysplastic syndromes.
Hideki Makishima, Tetsuichi Yoshizato, Kenichi Yoshida, Mikkael A. Sekeres, Tomas Radivoyevitch, Hiromichi Suzuki, Bartlomiej Przychodzen, Yasunobu Nagata, Manja Meggendorfer, Masashi Sanada, Yusuke Okuno, Cassandra Hirsch, Teodora Kuzmanovic, Yusuke Sato, Aiko Sato-Otsubo, Thomas LaFramboise, Naoko Hosono, Yuichi Shiraishi, Kenichi Chiba, Claudia Haferlach, Wolfgang Kern, Hiroko Tanaka, Yusuke Shiozawa, Inés Gómez-Seguí, Holleh D. Husseinzadeh, Swapna Thota, Kathryn M. Guinta, Brittney Dienes, Tsuyoshi Nakamaki, Shuichi Miyawaki, Yogen Saunthararajah, Shigeru Chiba, Satoru Miyano, Lee-Yung Shih, Torsten Haferlach, Seishi Ogawa, Jaroslaw P. Maciejewski
Nature Genetics, 49, 204-212 (2017)
骨髄異形成症候群は代表的な慢性骨髄腫瘍であり,およそ20%が急性骨髄性白血病へと進展する.この研究においては,病期の進展にかかわるクローン進化を明らかにすることを目的として,計2250例の骨髄異形成症候群の患者を対象とした全エキソンおよび標的となる遺伝子を網羅的に解析した.そのうち122例については,時系列で採取した複数の検体を経時的に解析した.骨髄異形成症候群におけるゲノムの異常は病期の進行にともない蓄積し,クローンのサイズは増大し,変異をきたす遺伝子の多様性は増大した.さらに,白血病へと進展したときにはタイプ1変異の頻度が高くなり,高リスクの骨髄異形成症候群においてはタイプ2変異の頻度が高くなった.タイプ1変異は白血病への進展までの期間を有意に短縮しもっとも不良な予後因子であった.この研究における詳細なゲノム解析により,骨髄異形成症候群におけるクローン進化の詳細が明らかにされ,急性白血病の進展をモニターするのに有用なバイオマーカーとなる遺伝子変異のリストが得られた.
代表的な慢性の骨髄腫瘍である骨髄異形成症候群は高率に急性骨髄性白血病に移行することが知られている1,2).次世代シークエンサーの発達により,骨髄異形成症候群において高頻度に変異している遺伝子はほぼ明らかにされ3,4),ディープシークエンシングによりおのおのの変異のアレル頻度を正確に見積もることにより急性骨髄性白血病への移行に関連する腫瘍における多様性に関する理解は深まった5,6).しかしながら,症例あたりたった1回の遺伝子の解析ではクローンの正確な構造を推定することは困難であった3,4).そして,これまで時系列で複数回の遺伝子解析がされた研究においては少数の症例が検討されたにすぎず,白血病への進展に関する詳細はいまだ不明である5,6).
そこで,この研究においては,多数の骨髄異形成症候群および急性骨髄性白血病への移行例を集積し,全エキソンシークエンス解析および標的遺伝子シークエンス解析の結果を検討することにより,病期の進展にかかわるクローン進化を明らかにすることを試みた.つづいて,過去に報告された遺伝子タイピングの結果とあわせ3-5,7),これまでになく多数の計2250例を集積し,おのおのの病期においてドライバー変異の頻度を比較することにより白血病への進展において重要なはたらきをする遺伝子を抽出した.さらに,これらの結果を自験例の122例において時系列で複数の検体を用いて確認した.以上により,骨髄異形成症候群から急性骨髄性白血病への移行の際のおのおののドライバー変異の臨床的な意義の詳細が明らかにされた.
193例の骨髄異形成症候群および関連する疾患の症例の204検体について全エキソンシークエンス解析した.11例においては時系列で2回ずつ解析した.45例は骨髄芽球の増加をともなう高リスクの骨髄異形成症候群の症例,79例はそれ以外の低リスクの骨髄異形成症候群の症例,45例は関連する疾患である骨髄異形成/骨髄増殖性疾患の症例,24例の2次性急性骨髄性白血病の症例である.合計で1383遺伝子に2322の変異が認められ,そのうち49遺伝子が有意に高頻度に変異するドライバー遺伝子として抽出された.変異のシグニチャー解析においては年齢とともに蓄積するDNAメチル化部位のシトシンからチミンへの変化が特徴的であった.アミノ酸配列の変化する非同義変異の平均数は11.4個であり,低リスクの骨髄異形成症候群における6.4個と比較して2次性急性骨髄性白血病においては12.7個と有意に増加していた.この結果は,11例において時系列で2回の解析により再現され,前後の変異数の検討により有意に増加していた.変異遺伝子の多様性は病期の進行にしたがい増加することも明らかにされた.クローンの構造の解析において病期ごとに変異のアレル頻度を比較したところ,骨髄異形成症候群の病期が進むほどクローンのサイズが大きくなることが判明した.複数の変異が認められた症例について変異のクローンのサイズにもとづくクラスター解析をしたところ8),これまでに標的遺伝子シークエンスによる解析において報告されていたよりも高率に,少なくとも2つの変異クラスターが認められた.以上のように,これまでになく多数の症例における全エキソンシークエンス解析によりはじめて,骨髄異形成症候群および関連する疾患の臨床における遺伝子変異の蓄積の詳細が解明された.
骨髄異形成症候群および関連する疾患11例において時系列で複数回の全エキソンシークエンス解析によりクローン進化の過程が詳細に明らかにされた.その結果,クローン進化には,主要なクローンのなかにサブクローンの変異が連続的に獲得されて拡大し新たな主要なクローンを形成するパターンと,複数のサブクローンのうちのひとつがほかのサブクローンを排除して主要なクローンを形成するパターンの2つが存在した.どちらのパターンにおいても,新たなサブクローンが出現することは高頻度に認められた.ただし,複数のサブクローンのうちのひとつがほかのサブクローンを排除するパターンにおいて,排除されるクローンにドライバー変異が認められることはまれであった.変異のアレル頻度の検討においては,1回目より2回目のサンプリングにおいて変異アレル頻度の範囲はせまい傾向にあった.これは,サブクローンの拡大を示唆する結果であった.
122例の骨髄異形成症候群において時系列で複数回にわたり標的となるドライバー遺伝子をシークエンシングした.このうち,109例において401個のドライバー変異が認められ,97例においては複数の変異をもっていた.変異の数については,2回目の解析では1症例あたり平均2.7個のドライバー変異が認められ,1回目の解析の1.9個と比較して有意に増加していた.変異のアレル頻度も前後のサンプリングのあいだで有意に増加しており,138の変異は新規に獲得され143の変異はサイズが増加していた.一方,66の変異はサイズが減少あるいは消失していた.これらの変化は造血幹細胞移植や化学療法にともない起こる場合もあった.
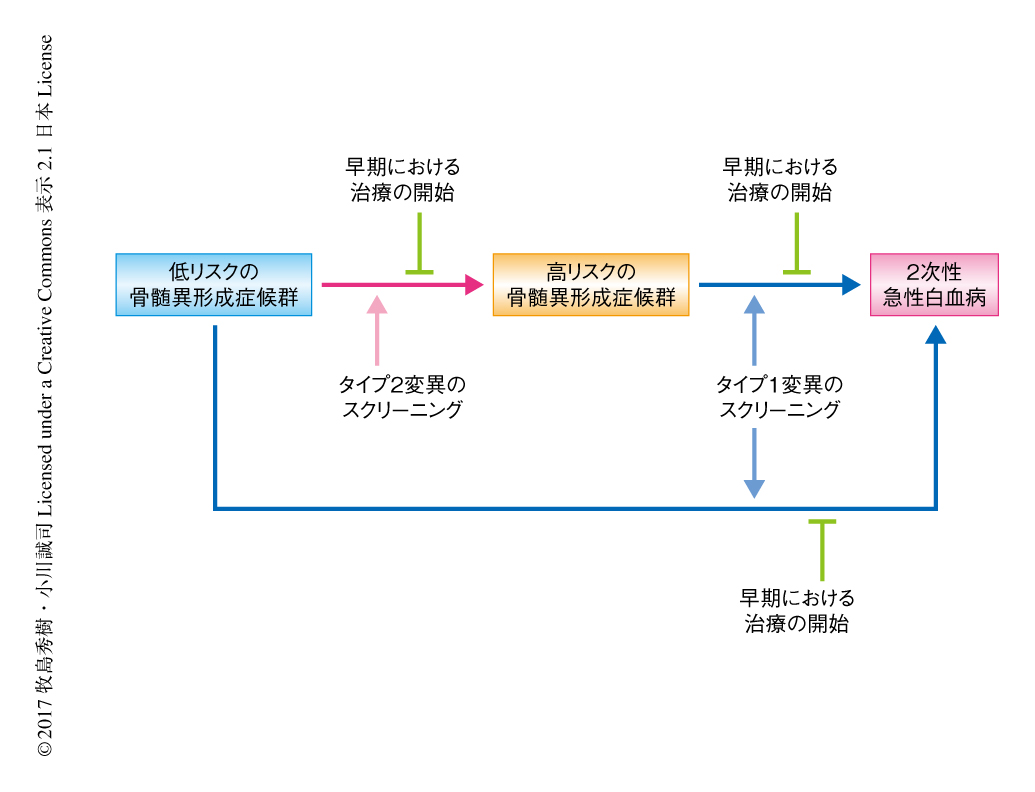
ここまでの検討により,骨髄異形成症候群において遺伝子変異が蓄積しそのクローンのサイズが増加することが明らかにされたが,病型が進行する際に具体的にどの遺伝子が重要であるかは不明であった.そこで,合計2250例の骨髄異形成症候群および2次性急性骨髄性白血病の症例の標的遺伝子シークエンス解析の結果を過去に解析された症例を含め収集しあわせて解析した.急性白血病に進展する機構を解明するため,683例の高リスクの骨髄異形成症候群と360例の2次性急性骨髄性白血病とのあいだで,それぞれの遺伝子変異の頻度を比較した.多変量解析により,FLT3遺伝子,PTPN11遺伝子,WT1遺伝子,IDH1遺伝子,NPM1遺伝子,IDH2遺伝子,NRAS遺伝子について2次性急性骨髄性白血病において変異が有意に高頻度に認められた.そこで,これらの7つの遺伝子における変異をタイプ1変異と定義した.より初期の変化をとらえるため,1207例の低リスクの骨髄異形成症候群とさきの683例の高リスクの骨髄異形成症候群について同様に検討した.タイプ1変異の遺伝子であったDH2遺伝子およびNRAS遺伝子にくわえ,GATA2遺伝子,KRAS遺伝子,TP53遺伝子,RUNX1遺伝子,STAG2遺伝子,ASXL1遺伝子,ZRSR2遺伝子,TET2遺伝子について高リスクの骨髄異形成症候群において変異が有意に高頻度に認められた.そこで,これらの8つの遺伝子における変異をタイプ2変異と定義した.これ以外に,低リスクの骨髄異形成症候群においてより高頻度に変異する遺伝子として鉄芽球性不応性貧血の原因とされているSF3B1遺伝子が抽出された.これらタイプ1変異およびタイプ2変異の遺伝子は骨髄異形成症候群の病期の進行や2次性白血病の進展にかかわる可能性が示唆された.
時系列で複数回のサンプリングをした122例について,タイプ1変異の遺伝子,タイプ2変異の遺伝子,SF3B1遺伝子のクローン進化における役割を検討した.122例のうち90例が2次性急性骨髄性白血病へと進展し,いずれも,骨髄異形成症候群から移行していた.時系列の検討においては,一般的に,ドライバー変異のクローンのサイズは消失あるいは減少するよりも,むしろ,獲得あるいは増加する傾向にあった.2250例の検討から2次性急性骨髄性白血病において高頻度であったタイプ1変異は,時系列で複数回のサンプリングをしたすべての症例の検討においては,獲得されるかクローンのサイズが増加する傾向がもっとも著明であり,変異が消失することは非常にまれであった.この傾向は,高リスクの骨髄異形成症候群から白血病へと進展する場合,骨髄異形成症候群の全体から白血病へと進展する場合のいずれも有意な所見として確認された.一方,高リスクの骨髄異形成症候群において高頻度であったタイプ2変異については,獲得あるいは増加する傾向はすべての症例を対象とした検討においてはタイプ1変異に比較すると著明ではなかったが,2回目のサンプリングのときに高リスクの骨髄異形成症候群であった場合にかぎるとタイプ2変異の88%が獲得あるいは増加の傾向を示した.同様に,タイプ2変異は,2回目のサンプリングのときに低リスクの骨髄異形成症候群であったまま定常状態にあり進展しなかった症例と比較して,1回目のサンプリングのときに低リスクの骨髄異形成症候群だったが2回目のサンプリングのときに高リスクの骨髄異形成症候群あるいは2次性白血病へと進展した症例においてクローンのサイズが有意に高頻度に増加していた.逆に,SF3B1遺伝子の変異が2回目のサンプリングのときに新たに獲得されたことは非常にまれであり,このうち,2次性白血病へと進展した症例では1例においてのみ変異が獲得されていた.
白血病への進展と関連し骨髄異形成症候群のより後期に獲得される傾向があるタイプ1変異は,それ以外の変異と比較してクローンのサイズは有意に小さかった.実際,2次性急性骨髄性白血病への進展のときに認められたタイプ1変異は,ほかのサブクローンを排除して主要なクローンを形成するパターンのクローン進化を必ずしも示さなかった.しかも,白血病へと進展した症例においては増加した骨髄芽球の割合とタイプ1変異のクローンのサイズはほぼ一致しており,主要なクローンの全体が白血病へと進展するのではなく,タイプ1変異が陽性のサブクローンが2次性白血病の本態である可能性が示唆された.
以上のように,2次性白血病において認められるタイプ1変異は白血病への進展の際に獲得され,一方,タイプ2変異は白血病への進展の以前に獲得され進展ののちまでもちこされている可能性があった.この仮説を検証するため,白血病への進展までの期間を429例の骨髄異形成症候群において比較した.その結果,タイプ1変異をもつ症例は,タイプ2変異をもちタイプ1変異をもたない症例と比較して,白血病への進展までの期間が有意に短かったことから,タイプ1変異は白血病への進展に深くかかわることが明らかにされた.このように,タイプ2変異をもちタイプ1変異をもたない症例は,タイプ1変異をもつ症例と比較すると白血病への進展に対する効果は少ないものの,タイプ1変異,タイプ2変異,SF3B1遺伝子の変異がいずれも陰性の症例と比較すると,白血病への進展までの期間が有意に短かった.時系列での複数回のサンプリングのあいだに白血病へと進展した症例のうち,1回目のサンプリングにおいてタイプ2変異をもちタイプ1変異をもたなかった35例を詳細に検討したところ,43%にタイプ1変異が認められた.したがって,タイプ2変異をもちタイプ1変異をもたない症例においても,タイプ1変異は白血病への進展に関与する可能性が示唆された.白血病への進展までの期間について多変量解析したところ,タイプ1変異をもつ症例,および,タイプ2変異をもちタイプ1変異をもたない症例は独立した予後因子として抽出された.
さらに,全生存期間についてより大きなコホート1347例において検討したところ,タイプ1変異をもつ症例は,タイプ2変異をもちタイプ1変異をもたない症例と比較して,有意に不良な予後を示した.白血病への進展までの期間の解析の結果と同様に,タイプ2変異をもちタイプ1変異をもたない症例は,タイプ1変異,タイプ2変異,SF3B1遺伝子の変異がいずれも陰性の症例と比較すると,やはり予後不良因子であった.全生存期間について多変量解析したところ,タイプ1変異をもつ症例は独立した予後不良因子として抽出された.
タイプ1変異およびタイプ2変異の役割をさらに明らかにするため,クローンのサイズが予後におよぼす影響について検討した.クローンのサイズを大小に分け対応する症例のあいだで生存期間を比較したところ,タイプ1変異をもつ症例においてはクローンのサイズが大きいと白血病への進展までの期間が有意に短縮した.一方,全生存期間はクローンのサイズにより差は認められなかった.タイプ2変異について検討したところ,クローンのサイズにより白血病への進展までの期間に差は認められなかったが,全生存期間はクローンのサイズが大きいと有意に短縮した.よって,タイプ1変異はタイプ2変異と比較してより白血病への進展に関与する可能性が示唆された.
遺伝子変異の組合せについて検討した.さまざまな悪性腫瘍において変異の組合せはランダムに検出されるわけではなく,高頻度に合併する場合や逆に相互排他的に認められる場合がある.骨髄異形成症候群においては独立した2つの数百例を対象とした変異解析の報告があり3,4),34対の合併する変異の組合せと17対の排他的な変異の組合せが明らかにされている.今回は,2000例以上での検討により,合併する75対,排他的な20対の変異の組合せが新たに検出された.とくに,SF3B1遺伝子の変異は多くの変異と排他的に認められた.タイプ1変異およびタイプ2変異のうち75%の遺伝子の変異はSF3B1遺伝子の変異と排他的であり,SF3B1遺伝子の変異をもつ症例は白血病へと進展しにくいことと矛盾しなかった.さらに,タイプ1変異およびタイプ2変異は一部の遺伝子の変異を除くと互いに高頻度に合併していた.そこで,タイプ1変異およびタイプ2変異の両方をもつ症例93例を対象として,それぞれの変異のクローンのサイズを比較した.すると,合併した変異のうち,タイプ1変異に比較して,タイプ2変異において有意にクローンのサイズが拡大していた.これは,タイプ2変異がタイプ1変異よりもさきに獲得される傾向のあることと矛盾しなかった.
この研究により,骨髄異形成症候群が2次性白血病へと進展する際に認められるクローン進化の詳細が明らかにされた.これまで病理学的に定義されてきたリスク分類や2次性白血病と骨髄異形成症候群との区別9-11) などが再現されるとともに,遺伝子変異が病期の進展において重要な役割をはたすことが示唆された.この研究におけるもっとも大きな成果は,骨髄異形成症候群のドライバー遺伝子が新たに分類されたことである.白血病の進展にもっとも影響しもっとも不良な予後と関連のあったタイプ1変異,ややインパクトは弱いものの白血病への進展に有意に関与するタイプ2変異は,2000例以上の症例の検討により変異をもつ症例が十分数に確保されたこの研究によりはじめて明らかにされた.今後,これらの遺伝子のリストをスクリーニングなどに使用するためには,前向き臨床試験などにより結果が検証されることが必要である(図1).将来,さらに多くの症例において遺伝子が網羅的に解析されることによりこの研究が再現され,より包括的な遺伝子のリストの得られることが期待される.
略歴:2003年 信州大学大学院医学研究科博士課程 修了,同年 信州大学医学部附属病院 医員,2008年 米国Cleveland Clinicポストドクトラルフェロー,2012年 同 リサーチアソシエイトを経て,2015年 京都大学大学院医学研究科 講師.
研究テーマ:骨髄腫瘍におけるゲノムの異常.
抱負:骨髄腫瘍の原因遺伝子を明らかにする.
小川 誠司(Seishi Ogawa)
京都大学大学院医学研究科 教授.
研究室URL:http://www.med.kyoto-u.ac.jp/organization-staff/research/doctoral_course/r-006/
© 2017 牧島秀樹・小川誠司 Licensed under CC 表示 2.1 日本
(京都大学大学院医学研究科 腫瘍生物学講座)
email:牧島秀樹
DOI: 10.7875/first.author.2017.005
Dynamics of clonal evolution in myelodysplastic syndromes.
Hideki Makishima, Tetsuichi Yoshizato, Kenichi Yoshida, Mikkael A. Sekeres, Tomas Radivoyevitch, Hiromichi Suzuki, Bartlomiej Przychodzen, Yasunobu Nagata, Manja Meggendorfer, Masashi Sanada, Yusuke Okuno, Cassandra Hirsch, Teodora Kuzmanovic, Yusuke Sato, Aiko Sato-Otsubo, Thomas LaFramboise, Naoko Hosono, Yuichi Shiraishi, Kenichi Chiba, Claudia Haferlach, Wolfgang Kern, Hiroko Tanaka, Yusuke Shiozawa, Inés Gómez-Seguí, Holleh D. Husseinzadeh, Swapna Thota, Kathryn M. Guinta, Brittney Dienes, Tsuyoshi Nakamaki, Shuichi Miyawaki, Yogen Saunthararajah, Shigeru Chiba, Satoru Miyano, Lee-Yung Shih, Torsten Haferlach, Seishi Ogawa, Jaroslaw P. Maciejewski
Nature Genetics, 49, 204-212 (2017)
要 約
骨髄異形成症候群は代表的な慢性骨髄腫瘍であり,およそ20%が急性骨髄性白血病へと進展する.この研究においては,病期の進展にかかわるクローン進化を明らかにすることを目的として,計2250例の骨髄異形成症候群の患者を対象とした全エキソンおよび標的となる遺伝子を網羅的に解析した.そのうち122例については,時系列で採取した複数の検体を経時的に解析した.骨髄異形成症候群におけるゲノムの異常は病期の進行にともない蓄積し,クローンのサイズは増大し,変異をきたす遺伝子の多様性は増大した.さらに,白血病へと進展したときにはタイプ1変異の頻度が高くなり,高リスクの骨髄異形成症候群においてはタイプ2変異の頻度が高くなった.タイプ1変異は白血病への進展までの期間を有意に短縮しもっとも不良な予後因子であった.この研究における詳細なゲノム解析により,骨髄異形成症候群におけるクローン進化の詳細が明らかにされ,急性白血病の進展をモニターするのに有用なバイオマーカーとなる遺伝子変異のリストが得られた.
はじめに
代表的な慢性の骨髄腫瘍である骨髄異形成症候群は高率に急性骨髄性白血病に移行することが知られている1,2).次世代シークエンサーの発達により,骨髄異形成症候群において高頻度に変異している遺伝子はほぼ明らかにされ3,4),ディープシークエンシングによりおのおのの変異のアレル頻度を正確に見積もることにより急性骨髄性白血病への移行に関連する腫瘍における多様性に関する理解は深まった5,6).しかしながら,症例あたりたった1回の遺伝子の解析ではクローンの正確な構造を推定することは困難であった3,4).そして,これまで時系列で複数回の遺伝子解析がされた研究においては少数の症例が検討されたにすぎず,白血病への進展に関する詳細はいまだ不明である5,6).
そこで,この研究においては,多数の骨髄異形成症候群および急性骨髄性白血病への移行例を集積し,全エキソンシークエンス解析および標的遺伝子シークエンス解析の結果を検討することにより,病期の進展にかかわるクローン進化を明らかにすることを試みた.つづいて,過去に報告された遺伝子タイピングの結果とあわせ3-5,7),これまでになく多数の計2250例を集積し,おのおのの病期においてドライバー変異の頻度を比較することにより白血病への進展において重要なはたらきをする遺伝子を抽出した.さらに,これらの結果を自験例の122例において時系列で複数の検体を用いて確認した.以上により,骨髄異形成症候群から急性骨髄性白血病への移行の際のおのおののドライバー変異の臨床的な意義の詳細が明らかにされた.
1.骨髄異形成症候群および関連する疾患における全エキソンシークエンス解析
193例の骨髄異形成症候群および関連する疾患の症例の204検体について全エキソンシークエンス解析した.11例においては時系列で2回ずつ解析した.45例は骨髄芽球の増加をともなう高リスクの骨髄異形成症候群の症例,79例はそれ以外の低リスクの骨髄異形成症候群の症例,45例は関連する疾患である骨髄異形成/骨髄増殖性疾患の症例,24例の2次性急性骨髄性白血病の症例である.合計で1383遺伝子に2322の変異が認められ,そのうち49遺伝子が有意に高頻度に変異するドライバー遺伝子として抽出された.変異のシグニチャー解析においては年齢とともに蓄積するDNAメチル化部位のシトシンからチミンへの変化が特徴的であった.アミノ酸配列の変化する非同義変異の平均数は11.4個であり,低リスクの骨髄異形成症候群における6.4個と比較して2次性急性骨髄性白血病においては12.7個と有意に増加していた.この結果は,11例において時系列で2回の解析により再現され,前後の変異数の検討により有意に増加していた.変異遺伝子の多様性は病期の進行にしたがい増加することも明らかにされた.クローンの構造の解析において病期ごとに変異のアレル頻度を比較したところ,骨髄異形成症候群の病期が進むほどクローンのサイズが大きくなることが判明した.複数の変異が認められた症例について変異のクローンのサイズにもとづくクラスター解析をしたところ8),これまでに標的遺伝子シークエンスによる解析において報告されていたよりも高率に,少なくとも2つの変異クラスターが認められた.以上のように,これまでになく多数の症例における全エキソンシークエンス解析によりはじめて,骨髄異形成症候群および関連する疾患の臨床における遺伝子変異の蓄積の詳細が解明された.
2.時系列で複数回のシークエンス解析
骨髄異形成症候群および関連する疾患11例において時系列で複数回の全エキソンシークエンス解析によりクローン進化の過程が詳細に明らかにされた.その結果,クローン進化には,主要なクローンのなかにサブクローンの変異が連続的に獲得されて拡大し新たな主要なクローンを形成するパターンと,複数のサブクローンのうちのひとつがほかのサブクローンを排除して主要なクローンを形成するパターンの2つが存在した.どちらのパターンにおいても,新たなサブクローンが出現することは高頻度に認められた.ただし,複数のサブクローンのうちのひとつがほかのサブクローンを排除するパターンにおいて,排除されるクローンにドライバー変異が認められることはまれであった.変異のアレル頻度の検討においては,1回目より2回目のサンプリングにおいて変異アレル頻度の範囲はせまい傾向にあった.これは,サブクローンの拡大を示唆する結果であった.
122例の骨髄異形成症候群において時系列で複数回にわたり標的となるドライバー遺伝子をシークエンシングした.このうち,109例において401個のドライバー変異が認められ,97例においては複数の変異をもっていた.変異の数については,2回目の解析では1症例あたり平均2.7個のドライバー変異が認められ,1回目の解析の1.9個と比較して有意に増加していた.変異のアレル頻度も前後のサンプリングのあいだで有意に増加しており,138の変異は新規に獲得され143の変異はサイズが増加していた.一方,66の変異はサイズが減少あるいは消失していた.これらの変化は造血幹細胞移植や化学療法にともない起こる場合もあった.
3.骨髄異形成症候群および2次性急性骨髄性白血病における関連する遺伝子変異の比較
ここまでの検討により,骨髄異形成症候群において遺伝子変異が蓄積しそのクローンのサイズが増加することが明らかにされたが,病型が進行する際に具体的にどの遺伝子が重要であるかは不明であった.そこで,合計2250例の骨髄異形成症候群および2次性急性骨髄性白血病の症例の標的遺伝子シークエンス解析の結果を過去に解析された症例を含め収集しあわせて解析した.急性白血病に進展する機構を解明するため,683例の高リスクの骨髄異形成症候群と360例の2次性急性骨髄性白血病とのあいだで,それぞれの遺伝子変異の頻度を比較した.多変量解析により,FLT3遺伝子,PTPN11遺伝子,WT1遺伝子,IDH1遺伝子,NPM1遺伝子,IDH2遺伝子,NRAS遺伝子について2次性急性骨髄性白血病において変異が有意に高頻度に認められた.そこで,これらの7つの遺伝子における変異をタイプ1変異と定義した.より初期の変化をとらえるため,1207例の低リスクの骨髄異形成症候群とさきの683例の高リスクの骨髄異形成症候群について同様に検討した.タイプ1変異の遺伝子であったDH2遺伝子およびNRAS遺伝子にくわえ,GATA2遺伝子,KRAS遺伝子,TP53遺伝子,RUNX1遺伝子,STAG2遺伝子,ASXL1遺伝子,ZRSR2遺伝子,TET2遺伝子について高リスクの骨髄異形成症候群において変異が有意に高頻度に認められた.そこで,これらの8つの遺伝子における変異をタイプ2変異と定義した.これ以外に,低リスクの骨髄異形成症候群においてより高頻度に変異する遺伝子として鉄芽球性不応性貧血の原因とされているSF3B1遺伝子が抽出された.これらタイプ1変異およびタイプ2変異の遺伝子は骨髄異形成症候群の病期の進行や2次性白血病の進展にかかわる可能性が示唆された.
4.臨床において認められた変異クローンの進化
時系列で複数回のサンプリングをした122例について,タイプ1変異の遺伝子,タイプ2変異の遺伝子,SF3B1遺伝子のクローン進化における役割を検討した.122例のうち90例が2次性急性骨髄性白血病へと進展し,いずれも,骨髄異形成症候群から移行していた.時系列の検討においては,一般的に,ドライバー変異のクローンのサイズは消失あるいは減少するよりも,むしろ,獲得あるいは増加する傾向にあった.2250例の検討から2次性急性骨髄性白血病において高頻度であったタイプ1変異は,時系列で複数回のサンプリングをしたすべての症例の検討においては,獲得されるかクローンのサイズが増加する傾向がもっとも著明であり,変異が消失することは非常にまれであった.この傾向は,高リスクの骨髄異形成症候群から白血病へと進展する場合,骨髄異形成症候群の全体から白血病へと進展する場合のいずれも有意な所見として確認された.一方,高リスクの骨髄異形成症候群において高頻度であったタイプ2変異については,獲得あるいは増加する傾向はすべての症例を対象とした検討においてはタイプ1変異に比較すると著明ではなかったが,2回目のサンプリングのときに高リスクの骨髄異形成症候群であった場合にかぎるとタイプ2変異の88%が獲得あるいは増加の傾向を示した.同様に,タイプ2変異は,2回目のサンプリングのときに低リスクの骨髄異形成症候群であったまま定常状態にあり進展しなかった症例と比較して,1回目のサンプリングのときに低リスクの骨髄異形成症候群だったが2回目のサンプリングのときに高リスクの骨髄異形成症候群あるいは2次性白血病へと進展した症例においてクローンのサイズが有意に高頻度に増加していた.逆に,SF3B1遺伝子の変異が2回目のサンプリングのときに新たに獲得されたことは非常にまれであり,このうち,2次性白血病へと進展した症例では1例においてのみ変異が獲得されていた.
白血病への進展と関連し骨髄異形成症候群のより後期に獲得される傾向があるタイプ1変異は,それ以外の変異と比較してクローンのサイズは有意に小さかった.実際,2次性急性骨髄性白血病への進展のときに認められたタイプ1変異は,ほかのサブクローンを排除して主要なクローンを形成するパターンのクローン進化を必ずしも示さなかった.しかも,白血病へと進展した症例においては増加した骨髄芽球の割合とタイプ1変異のクローンのサイズはほぼ一致しており,主要なクローンの全体が白血病へと進展するのではなく,タイプ1変異が陽性のサブクローンが2次性白血病の本態である可能性が示唆された.
5.ドライバー変異の白血病への進展および予後に対する影響
以上のように,2次性白血病において認められるタイプ1変異は白血病への進展の際に獲得され,一方,タイプ2変異は白血病への進展の以前に獲得され進展ののちまでもちこされている可能性があった.この仮説を検証するため,白血病への進展までの期間を429例の骨髄異形成症候群において比較した.その結果,タイプ1変異をもつ症例は,タイプ2変異をもちタイプ1変異をもたない症例と比較して,白血病への進展までの期間が有意に短かったことから,タイプ1変異は白血病への進展に深くかかわることが明らかにされた.このように,タイプ2変異をもちタイプ1変異をもたない症例は,タイプ1変異をもつ症例と比較すると白血病への進展に対する効果は少ないものの,タイプ1変異,タイプ2変異,SF3B1遺伝子の変異がいずれも陰性の症例と比較すると,白血病への進展までの期間が有意に短かった.時系列での複数回のサンプリングのあいだに白血病へと進展した症例のうち,1回目のサンプリングにおいてタイプ2変異をもちタイプ1変異をもたなかった35例を詳細に検討したところ,43%にタイプ1変異が認められた.したがって,タイプ2変異をもちタイプ1変異をもたない症例においても,タイプ1変異は白血病への進展に関与する可能性が示唆された.白血病への進展までの期間について多変量解析したところ,タイプ1変異をもつ症例,および,タイプ2変異をもちタイプ1変異をもたない症例は独立した予後因子として抽出された.
さらに,全生存期間についてより大きなコホート1347例において検討したところ,タイプ1変異をもつ症例は,タイプ2変異をもちタイプ1変異をもたない症例と比較して,有意に不良な予後を示した.白血病への進展までの期間の解析の結果と同様に,タイプ2変異をもちタイプ1変異をもたない症例は,タイプ1変異,タイプ2変異,SF3B1遺伝子の変異がいずれも陰性の症例と比較すると,やはり予後不良因子であった.全生存期間について多変量解析したところ,タイプ1変異をもつ症例は独立した予後不良因子として抽出された.
6.クローンのサイズおよび変異の組合せがクローン進化におよぼす効果
タイプ1変異およびタイプ2変異の役割をさらに明らかにするため,クローンのサイズが予後におよぼす影響について検討した.クローンのサイズを大小に分け対応する症例のあいだで生存期間を比較したところ,タイプ1変異をもつ症例においてはクローンのサイズが大きいと白血病への進展までの期間が有意に短縮した.一方,全生存期間はクローンのサイズにより差は認められなかった.タイプ2変異について検討したところ,クローンのサイズにより白血病への進展までの期間に差は認められなかったが,全生存期間はクローンのサイズが大きいと有意に短縮した.よって,タイプ1変異はタイプ2変異と比較してより白血病への進展に関与する可能性が示唆された.
遺伝子変異の組合せについて検討した.さまざまな悪性腫瘍において変異の組合せはランダムに検出されるわけではなく,高頻度に合併する場合や逆に相互排他的に認められる場合がある.骨髄異形成症候群においては独立した2つの数百例を対象とした変異解析の報告があり3,4),34対の合併する変異の組合せと17対の排他的な変異の組合せが明らかにされている.今回は,2000例以上での検討により,合併する75対,排他的な20対の変異の組合せが新たに検出された.とくに,SF3B1遺伝子の変異は多くの変異と排他的に認められた.タイプ1変異およびタイプ2変異のうち75%の遺伝子の変異はSF3B1遺伝子の変異と排他的であり,SF3B1遺伝子の変異をもつ症例は白血病へと進展しにくいことと矛盾しなかった.さらに,タイプ1変異およびタイプ2変異は一部の遺伝子の変異を除くと互いに高頻度に合併していた.そこで,タイプ1変異およびタイプ2変異の両方をもつ症例93例を対象として,それぞれの変異のクローンのサイズを比較した.すると,合併した変異のうち,タイプ1変異に比較して,タイプ2変異において有意にクローンのサイズが拡大していた.これは,タイプ2変異がタイプ1変異よりもさきに獲得される傾向のあることと矛盾しなかった.
おわりに
この研究により,骨髄異形成症候群が2次性白血病へと進展する際に認められるクローン進化の詳細が明らかにされた.これまで病理学的に定義されてきたリスク分類や2次性白血病と骨髄異形成症候群との区別9-11) などが再現されるとともに,遺伝子変異が病期の進展において重要な役割をはたすことが示唆された.この研究におけるもっとも大きな成果は,骨髄異形成症候群のドライバー遺伝子が新たに分類されたことである.白血病の進展にもっとも影響しもっとも不良な予後と関連のあったタイプ1変異,ややインパクトは弱いものの白血病への進展に有意に関与するタイプ2変異は,2000例以上の症例の検討により変異をもつ症例が十分数に確保されたこの研究によりはじめて明らかにされた.今後,これらの遺伝子のリストをスクリーニングなどに使用するためには,前向き臨床試験などにより結果が検証されることが必要である(図1).将来,さらに多くの症例において遺伝子が網羅的に解析されることによりこの研究が再現され,より包括的な遺伝子のリストの得られることが期待される.
文 献
- Harris, N. L., Jaffe, E. S., Diebold, J. et al.: World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues: report of the Clinical Advisory Committee meeting-Airlie House, Virginia, November 1997. J. Clin. Oncol., 17, 3835-3849 (1997)[PubMed]
- Vardiman, J. W., Thiele, J., Arber, D. A. et al.: The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood, 114, 937-951 (2008)[PubMed]
- Haferlach, T., Nagata, Y., Grossmann, V. et al.: Landscape of genetic lesions in 944 patients with myelodysplastic syndromes. Leukemia, 28, 241-247 (2014)[PubMed]
- Papaemmanuil, E., Gerstung, M., Malcovati, L. et al.: Clinical and biological implications of driver mutations in myelodysplastic syndromes. Blood, 122, 3616-3627 (2013)[PubMed]
- Walter, M. J., Shen, D., Ding, L. et al.: Clonal architecture of secondary acute myeloid leukemia. N. Engl. J. Med., 366, 1090-1098 (2012)[PubMed]
- Walter, M. J., Shen, D., Shao, J. et al.: Clonal diversity of recurrently mutated genes in myelodysplastic syndromes. Leukemia, 27, 1275-1282 (2013)[PubMed]
- Lindsley, R. C., Mar, B. G., Mazzola, E. et al.: Acute myeloid leukemia ontogeny is defined by distinct somatic mutations. Blood, 125, 1367-1376 (2015)[PubMed]
- Roth, A., Khattra, J., Yap, D. et al.: PyClone: statistical inference of clonal population structure in cancer. Nat. Methods, 11, 396-398 (2014)[PubMed]
- Greenberg, P., Cox, C., LeBeau, M. M. et al.: International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood, 89, 2079-2088 (1997)[PubMed]
- Arber, D. A., Orazi, A., Hasserjian, R. et al.: The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood, 127, 2391-2405 (2016)[PubMed]
- Bejar, R., Stevenson, K., Abdel-Wahab, O. et al.: Clinical effect of point mutations in myelodysplastic syndromes. N. Engl. J. Med., 364, 2496-2506 (2011)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2003年 信州大学大学院医学研究科博士課程 修了,同年 信州大学医学部附属病院 医員,2008年 米国Cleveland Clinicポストドクトラルフェロー,2012年 同 リサーチアソシエイトを経て,2015年 京都大学大学院医学研究科 講師.
研究テーマ:骨髄腫瘍におけるゲノムの異常.
抱負:骨髄腫瘍の原因遺伝子を明らかにする.
小川 誠司(Seishi Ogawa)
京都大学大学院医学研究科 教授.
研究室URL:http://www.med.kyoto-u.ac.jp/organization-staff/research/doctoral_course/r-006/
© 2017 牧島秀樹・小川誠司 Licensed under CC 表示 2.1 日本