植物は細胞外の糖を減少させることにより病原細菌の増殖を抑制する
山田晃嗣・高野義孝
(京都大学大学院農学研究科 応用生物科学専攻植物病理学分野)
email:山田晃嗣
DOI: 10.7875/first.author.2016.130
Regulation of sugar transporter activity for antibacterial defense in Arabidopsis.
Kohji Yamada, Yusuke Saijo, Hirofumi Nakagami, Yoshitaka Takano
Science, 354, 1427-1430 (2016)
病原体は宿主より栄養を摂取することにより増殖する.植物は光合成により糖を合成し,植物の病原体の多くは植物から炭素源として糖を摂取することが知られている.しかしその一方で,植物が病原体による糖の摂取に対抗する防御策を備えているかどうかは不明であった.今回,筆者らは,植物は細胞外の糖を減少させることにより病原体による糖の摂取を阻害することを見い出した.モデル植物であるシロイヌナズナの糖輸送体STP13は,防御応答の活性化によりリン酸化されその糖輸送の活性が上昇した.また,STP13の制御による細胞外の糖の減少は,病原体による病原性因子の分泌を低下させ病原性の抑制につながった.この研究により,糖輸送体の制御という植物の防御応答における新たな一面が見い出されたとともに,宿主と病原体とのあいだの相互作用の形成において糖が重要な役割を担うことが示された.
有機物を摂取することでしか炭素を得ることができない従属栄養生物とは異なり,独立栄養生物である植物は光合成により二酸化炭素から糖を合成することができる.そのため,従属栄養生物である植物の病原体は,植物から炭素源としておもに糖を摂取することが知られている.たとえば,病原糸状菌であるトウモロコシ黒穂病菌(Ustilago maydis)は侵入菌糸の内部にスクロース輸送体を特異的に発現させており1),また,病原細菌であるイネ白葉枯病菌(Xanthomonas oryzae pv. oryzae)は植物の細胞に転写因子様のタンパク質を導入し糖輸送体の遺伝子を強制的に発現させることにより細胞内の糖を細胞外に排出させる2).しかし,このような病原体における糖の摂取の戦略が解析される一方,植物が病原体による糖の摂取に対しなにかしらの防御策を備えているかどうかは明らかにされていなかった.そこで,この研究においては,植物は細胞外の糖を減少させることにより病原体による糖の摂取を阻害するのではないかと考え,植物において防御応答が活性化したときの糖の吸収活性に着目した.
植物の細胞膜を介した糖の輸送は糖輸送体であるSTPおよびSWEETにより制御される.SWEETにより二糖であるスクロースは細胞外へ排出され,インベルターゼにより単糖であるグルコースおよびフルクトースへと加水分解され,STPにより細胞内へ吸収される3)(図1).
モデル植物であるシロイヌナズナのゲノムには14個のSTP相同遺伝子が存在する.以前に,筆者らは,そのうちおもにSTP1およびSTP13が細胞外からの単糖の吸収に関与することを報告している4).そこで,STP1およびSTP13を介した糖の吸収がシロイヌナズナの病原細菌に対する抵抗性に関与するかどうか検討した.STP1遺伝子およびSTP13遺伝子を破壊したシロイヌナズナに病原細菌Pseudomonas syringae pv. tomato DC3000を接種したところ,野生型のシロイヌナズナと比べ病原細菌はいちじるしく増殖した.このことより,STP1およびSTP13を介した糖の吸収は病原細菌の増殖の抑制に貢献すると考えられた.
植物において防御応答が活性化したときに糖の吸収活性が変化するかどうか解析した.免疫応答は微生物に由来する分子が細胞膜に局在する受容体により認識されることにより発動する5).シロイヌナズナにおいては,細菌の鞭毛タンパク質であるフラジェリンに由来するflg22ペプチドを認識するFLS2を介した免疫シグナル伝達の研究が進んでいる.そこで,flg22ペプチドの処理によりシロイヌナズナにおいて防御応答を活性化させグルコースおよびフルクトースの吸収活性を測定したところ,これら単糖の吸収活性が上昇した.この結果から,植物において防御応答が活性化したとき細胞外の糖は積極的に吸収されることが示唆された.シロイヌナズナにおけるflg22ペプチドの処理に依存的な単糖の吸収活性の上昇とSTP1あるいはSTP13による糖の輸送活性との関連性について調べるため,stp1遺伝子破壊株およびstp13遺伝子破壊株において単糖の吸収活性を測定した.その結果,stp13遺伝子破壊株においてflg22ペプチドの処理により単糖の吸収活性は上昇しなかったことから,防御応答が活性化したときの単糖の吸収活性の上昇はSTP13に依存的な制御であることが示された.
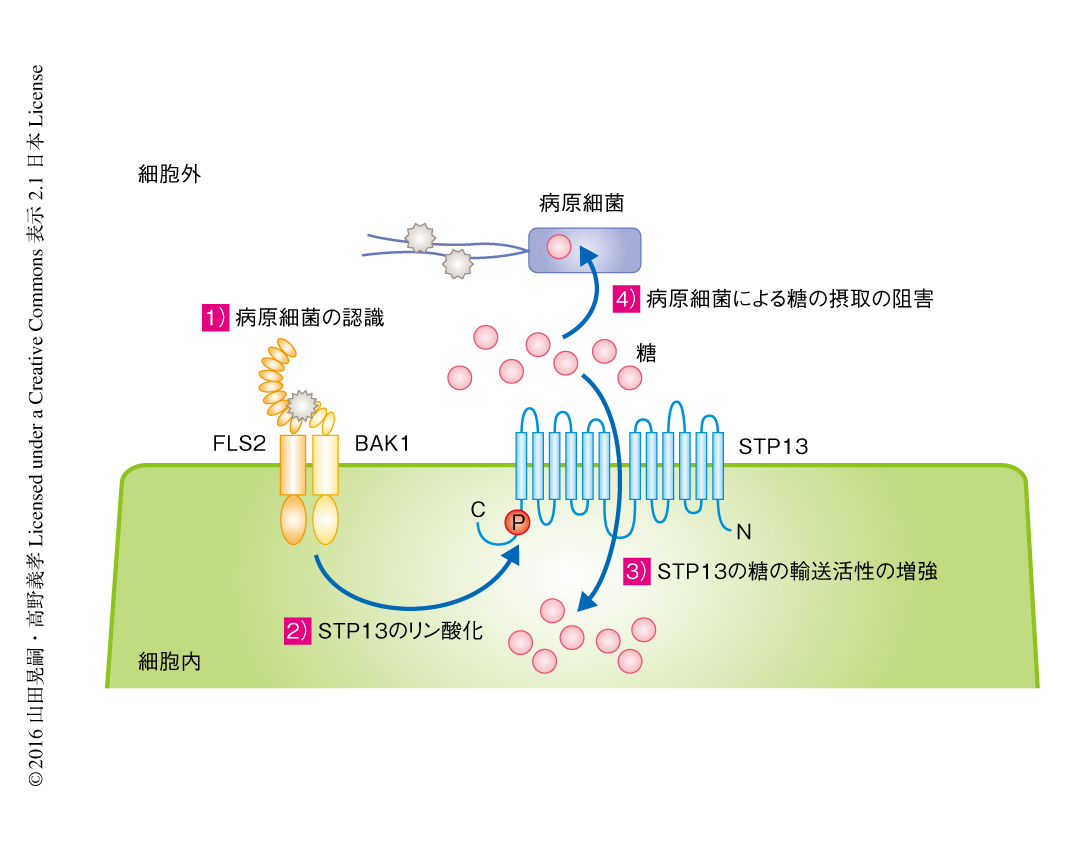
flg22ペプチドを認識するFLS2は細胞膜において共受容体キナーゼBAK1や受容体様細胞質キナーゼBIK1などと複合体を形成し,リン酸化を介したシグナル伝達により免疫応答を活性化させる5).STP13もFLS2と同様に細胞膜に局在するタンパク質であり,さらには,flg22ペプチドの処理により糖の吸収活性が上昇することから,STP13はFLS2複合体により直接的に活性の制御をうけている可能性が考えられた.そこで,共免疫沈降法によりタンパク質間相互作用について調べた結果,植物の細胞においてSTP13はFLS2およびBAK1と結合することが示された.さらに,in vitroキナーゼ解析により,12回膜貫通タンパク質であるSTP13のC末端側の細胞質領域に位置するThr485がBAK1によりリン酸化されることが見い出された.
STP13のThr485のリン酸化が糖輸送の活性に対し影響をおよぼすかどうか検討した.STP13のThr485を疑似リン酸化残基であるAspあるいは非リン酸化残基であるAlaと置換し,単糖の輸送能を欠失させた出芽酵母株に導入して単糖の吸収活性を測定した.その結果,Thr485をAspと置換したSTP13は野生型のSTP13よりも高い糖輸送の活性を示したことから,T485のリン酸化はSTP13の単糖の吸収活性を増強させることが示唆された.一方で,Thr485をAlaと置換したSTP13は野生型のSTP13と糖輸送の活性に違いはなかった.
Thr485のリン酸化を介したSTP13の活性の制御がシロイヌナズナにおいて病原細菌に対する抵抗性に関与するかどうか,stp1 stp13二重遺伝子破壊株における病原細菌に対する高感受性の相補実験により解析した.野生型のSTP13をstp1 stp13二重遺伝子破壊株に導入したところその感受性は野生型と同じ程度に抑制されたが,Thr485をAlaに置換したSTP13の導入では抑制されなかった.Thr485のAlaへの置換はSTP13の糖輸送の活性を阻害しなかったことから,Thr485のリン酸化によるSTP13の単糖の吸収活性の上昇が病原細菌との糖の吸収の競合において必須であり,病原細菌に対する抵抗性に寄与することが示された(図2).
植物における糖の吸収の制御が病原細菌に対する抵抗性にどのように関与するかについて解析した.病原微生物は宿主の免疫系を撹乱するためエフェクターとよばれる病原性因子を分泌する.その機構として,とくに細菌のIII型分泌装置を介したエフェクターの分泌の機構がよく解析されており,III型分泌装置を破壊した細菌の病原性はいちじるしく低下することからも,エフェクターの分泌は病原性の発現の鍵であると考えられている.通常の培養においてIII型分泌装置に関連する遺伝子の発現は検出されないが,植物に感染した際にはそれらの発現は強く活性化される.病原細菌P. syringae pv. tomato DC3000におけるIII型分泌装置に関連する遺伝子の発現は,植物に蓄積する糖であるフルクトース,グルコース,スクロースの存在により強く活性化されることが報告されている6).そこで,STP1およびSTP13による糖の吸収がP. syringae pv. tomato DC3000におけるIII型分泌装置の活性化に影響するのではないかと考え,シロイヌナズナstp1 stp13二重遺伝子破壊株に感染させたときのP. syringae pv. tomato DC3000からのエフェクターの分泌を測定した.
P. syringae pv. tomato DC3000においてIII型分泌装置を介するエフェクターのひとつであるavrPtoをカルモジュリン依存型アデニル酸シクラーゼとの融合タンパク質としてP. syringae pv. tomato DC3000に発現させた.細菌はカルモジュリンをもたないため,カルモジュリン依存型アデニル酸シクラーゼはIII型分泌装置によりavrPtoとともに植物の細胞に移行したときのみ活性化する.よって,アデニル酸シクラーゼにより産生されるcAMPを測定することにより,avrPtoの植物の細胞への移行を測定できる.その結果,stp1 stp13二重遺伝子破壊株においては野生型に比べてcAMPの蓄積が増加しており,avrPtoの移行が増大していることが示された.このことから,STP1およびSTP13を介した糖の吸収が病原細菌のIII型分泌装置の活性化を抑制することが示唆された.このcAMPの増加はstp1 stp13二重遺伝子破壊株にSTP13を導入することにより抑制されたが,Thr485をAlaと置換したSTP13の導入では抑制されなかった.この結果から,Thr485のリン酸化を介したSTP13の糖輸送の活性の上昇は,細胞外の糖を減少させることによりIII型分泌装置の活性化を抑制し,病原細菌の病原性を抑制することに貢献すると考えられた.しかし,stp1 stp13二重遺伝子破壊株はIII型分泌装置を破壊した病原細菌に対する抵抗性の低下も示したことから,糖は病原細菌によるエフェクターの分泌におけるシグナル分子として機能するだけではなく,それ以外の要因,おそらく,細菌の炭素源としても寄与することが示唆された.以上のことより,植物における糖輸送体の制御を介した細胞外の糖の減少は,病原細菌に対し病原性の低下や炭素源の枯渇をひき起こすことにより病原細菌の増殖の抑制につながることが考えられた.
今回の研究において,植物における新規の防御応答として,リン酸化により糖輸送体を活性化し細胞外の糖を減少させることが新たに見い出された.さらに,細胞外の糖の含量が宿主と病原体とのあいだの相互作用を形成するための重要な要因であることが示された.糖の吸収を介した生物のあいだの相互作用は,病原体のみならず植物と共生微生物とのあいだの相互作用にも密接に関与する.病原体に感染したときと共生微生物と共存したときの宿主における糖の吸収の制御が異なるのかどうかも今後の展開として興味深い.また,病原体は糖のほかアミノ酸やイオンの供給も宿主に依存する.それらの輸送を制御する輸送体も糖輸送体STP13と同様に制御されているのかもしれない.宿主と病原体とのあいだの栄養の吸収の競合については不明な点が多いが,今回の結果をうけ解析の進むことが期待される.
略歴:2010年 東京大学大学院農学生命科学研究科博士課程 修了,同年 ドイツMax Planck Institute for Plant Breeding Research博士研究員,2014年 京都大学大学院農学研究科 研究員を経て,2016年より徳島大学大学院生物資源産業学研究部 特任助教.
研究テーマ:植物と微生物とのインターフェイスにおいてくりひろげられる栄養の吸収の競合.
高野 義孝(Yoshitaka Takano)
京都大学大学院農学研究科 教授.
研究室URL:http://www.plant-pathology.kais.kyoto-u.ac.jp/
© 2016 山田晃嗣・高野義孝 Licensed under CC 表示 2.1 日本
(京都大学大学院農学研究科 応用生物科学専攻植物病理学分野)
email:山田晃嗣
DOI: 10.7875/first.author.2016.130
Regulation of sugar transporter activity for antibacterial defense in Arabidopsis.
Kohji Yamada, Yusuke Saijo, Hirofumi Nakagami, Yoshitaka Takano
Science, 354, 1427-1430 (2016)
要 約
病原体は宿主より栄養を摂取することにより増殖する.植物は光合成により糖を合成し,植物の病原体の多くは植物から炭素源として糖を摂取することが知られている.しかしその一方で,植物が病原体による糖の摂取に対抗する防御策を備えているかどうかは不明であった.今回,筆者らは,植物は細胞外の糖を減少させることにより病原体による糖の摂取を阻害することを見い出した.モデル植物であるシロイヌナズナの糖輸送体STP13は,防御応答の活性化によりリン酸化されその糖輸送の活性が上昇した.また,STP13の制御による細胞外の糖の減少は,病原体による病原性因子の分泌を低下させ病原性の抑制につながった.この研究により,糖輸送体の制御という植物の防御応答における新たな一面が見い出されたとともに,宿主と病原体とのあいだの相互作用の形成において糖が重要な役割を担うことが示された.
はじめに
有機物を摂取することでしか炭素を得ることができない従属栄養生物とは異なり,独立栄養生物である植物は光合成により二酸化炭素から糖を合成することができる.そのため,従属栄養生物である植物の病原体は,植物から炭素源としておもに糖を摂取することが知られている.たとえば,病原糸状菌であるトウモロコシ黒穂病菌(Ustilago maydis)は侵入菌糸の内部にスクロース輸送体を特異的に発現させており1),また,病原細菌であるイネ白葉枯病菌(Xanthomonas oryzae pv. oryzae)は植物の細胞に転写因子様のタンパク質を導入し糖輸送体の遺伝子を強制的に発現させることにより細胞内の糖を細胞外に排出させる2).しかし,このような病原体における糖の摂取の戦略が解析される一方,植物が病原体による糖の摂取に対しなにかしらの防御策を備えているかどうかは明らかにされていなかった.そこで,この研究においては,植物は細胞外の糖を減少させることにより病原体による糖の摂取を阻害するのではないかと考え,植物において防御応答が活性化したときの糖の吸収活性に着目した.
1.植物による糖の吸収は病原細菌に対する抵抗性に寄与し防御応答により制御される
植物の細胞膜を介した糖の輸送は糖輸送体であるSTPおよびSWEETにより制御される.SWEETにより二糖であるスクロースは細胞外へ排出され,インベルターゼにより単糖であるグルコースおよびフルクトースへと加水分解され,STPにより細胞内へ吸収される3)(図1).
モデル植物であるシロイヌナズナのゲノムには14個のSTP相同遺伝子が存在する.以前に,筆者らは,そのうちおもにSTP1およびSTP13が細胞外からの単糖の吸収に関与することを報告している4).そこで,STP1およびSTP13を介した糖の吸収がシロイヌナズナの病原細菌に対する抵抗性に関与するかどうか検討した.STP1遺伝子およびSTP13遺伝子を破壊したシロイヌナズナに病原細菌Pseudomonas syringae pv. tomato DC3000を接種したところ,野生型のシロイヌナズナと比べ病原細菌はいちじるしく増殖した.このことより,STP1およびSTP13を介した糖の吸収は病原細菌の増殖の抑制に貢献すると考えられた.
植物において防御応答が活性化したときに糖の吸収活性が変化するかどうか解析した.免疫応答は微生物に由来する分子が細胞膜に局在する受容体により認識されることにより発動する5).シロイヌナズナにおいては,細菌の鞭毛タンパク質であるフラジェリンに由来するflg22ペプチドを認識するFLS2を介した免疫シグナル伝達の研究が進んでいる.そこで,flg22ペプチドの処理によりシロイヌナズナにおいて防御応答を活性化させグルコースおよびフルクトースの吸収活性を測定したところ,これら単糖の吸収活性が上昇した.この結果から,植物において防御応答が活性化したとき細胞外の糖は積極的に吸収されることが示唆された.シロイヌナズナにおけるflg22ペプチドの処理に依存的な単糖の吸収活性の上昇とSTP1あるいはSTP13による糖の輸送活性との関連性について調べるため,stp1遺伝子破壊株およびstp13遺伝子破壊株において単糖の吸収活性を測定した.その結果,stp13遺伝子破壊株においてflg22ペプチドの処理により単糖の吸収活性は上昇しなかったことから,防御応答が活性化したときの単糖の吸収活性の上昇はSTP13に依存的な制御であることが示された.
2.STP13の糖輸送の活性はFLS2複合体によるリン酸化により制御される
flg22ペプチドを認識するFLS2は細胞膜において共受容体キナーゼBAK1や受容体様細胞質キナーゼBIK1などと複合体を形成し,リン酸化を介したシグナル伝達により免疫応答を活性化させる5).STP13もFLS2と同様に細胞膜に局在するタンパク質であり,さらには,flg22ペプチドの処理により糖の吸収活性が上昇することから,STP13はFLS2複合体により直接的に活性の制御をうけている可能性が考えられた.そこで,共免疫沈降法によりタンパク質間相互作用について調べた結果,植物の細胞においてSTP13はFLS2およびBAK1と結合することが示された.さらに,in vitroキナーゼ解析により,12回膜貫通タンパク質であるSTP13のC末端側の細胞質領域に位置するThr485がBAK1によりリン酸化されることが見い出された.
STP13のThr485のリン酸化が糖輸送の活性に対し影響をおよぼすかどうか検討した.STP13のThr485を疑似リン酸化残基であるAspあるいは非リン酸化残基であるAlaと置換し,単糖の輸送能を欠失させた出芽酵母株に導入して単糖の吸収活性を測定した.その結果,Thr485をAspと置換したSTP13は野生型のSTP13よりも高い糖輸送の活性を示したことから,T485のリン酸化はSTP13の単糖の吸収活性を増強させることが示唆された.一方で,Thr485をAlaと置換したSTP13は野生型のSTP13と糖輸送の活性に違いはなかった.
Thr485のリン酸化を介したSTP13の活性の制御がシロイヌナズナにおいて病原細菌に対する抵抗性に関与するかどうか,stp1 stp13二重遺伝子破壊株における病原細菌に対する高感受性の相補実験により解析した.野生型のSTP13をstp1 stp13二重遺伝子破壊株に導入したところその感受性は野生型と同じ程度に抑制されたが,Thr485をAlaに置換したSTP13の導入では抑制されなかった.Thr485のAlaへの置換はSTP13の糖輸送の活性を阻害しなかったことから,Thr485のリン酸化によるSTP13の単糖の吸収活性の上昇が病原細菌との糖の吸収の競合において必須であり,病原細菌に対する抵抗性に寄与することが示された(図2).
3.細胞外における糖の減少は病原細菌による病原性タンパク質の分泌を減少させる
植物における糖の吸収の制御が病原細菌に対する抵抗性にどのように関与するかについて解析した.病原微生物は宿主の免疫系を撹乱するためエフェクターとよばれる病原性因子を分泌する.その機構として,とくに細菌のIII型分泌装置を介したエフェクターの分泌の機構がよく解析されており,III型分泌装置を破壊した細菌の病原性はいちじるしく低下することからも,エフェクターの分泌は病原性の発現の鍵であると考えられている.通常の培養においてIII型分泌装置に関連する遺伝子の発現は検出されないが,植物に感染した際にはそれらの発現は強く活性化される.病原細菌P. syringae pv. tomato DC3000におけるIII型分泌装置に関連する遺伝子の発現は,植物に蓄積する糖であるフルクトース,グルコース,スクロースの存在により強く活性化されることが報告されている6).そこで,STP1およびSTP13による糖の吸収がP. syringae pv. tomato DC3000におけるIII型分泌装置の活性化に影響するのではないかと考え,シロイヌナズナstp1 stp13二重遺伝子破壊株に感染させたときのP. syringae pv. tomato DC3000からのエフェクターの分泌を測定した.
P. syringae pv. tomato DC3000においてIII型分泌装置を介するエフェクターのひとつであるavrPtoをカルモジュリン依存型アデニル酸シクラーゼとの融合タンパク質としてP. syringae pv. tomato DC3000に発現させた.細菌はカルモジュリンをもたないため,カルモジュリン依存型アデニル酸シクラーゼはIII型分泌装置によりavrPtoとともに植物の細胞に移行したときのみ活性化する.よって,アデニル酸シクラーゼにより産生されるcAMPを測定することにより,avrPtoの植物の細胞への移行を測定できる.その結果,stp1 stp13二重遺伝子破壊株においては野生型に比べてcAMPの蓄積が増加しており,avrPtoの移行が増大していることが示された.このことから,STP1およびSTP13を介した糖の吸収が病原細菌のIII型分泌装置の活性化を抑制することが示唆された.このcAMPの増加はstp1 stp13二重遺伝子破壊株にSTP13を導入することにより抑制されたが,Thr485をAlaと置換したSTP13の導入では抑制されなかった.この結果から,Thr485のリン酸化を介したSTP13の糖輸送の活性の上昇は,細胞外の糖を減少させることによりIII型分泌装置の活性化を抑制し,病原細菌の病原性を抑制することに貢献すると考えられた.しかし,stp1 stp13二重遺伝子破壊株はIII型分泌装置を破壊した病原細菌に対する抵抗性の低下も示したことから,糖は病原細菌によるエフェクターの分泌におけるシグナル分子として機能するだけではなく,それ以外の要因,おそらく,細菌の炭素源としても寄与することが示唆された.以上のことより,植物における糖輸送体の制御を介した細胞外の糖の減少は,病原細菌に対し病原性の低下や炭素源の枯渇をひき起こすことにより病原細菌の増殖の抑制につながることが考えられた.
おわりに
今回の研究において,植物における新規の防御応答として,リン酸化により糖輸送体を活性化し細胞外の糖を減少させることが新たに見い出された.さらに,細胞外の糖の含量が宿主と病原体とのあいだの相互作用を形成するための重要な要因であることが示された.糖の吸収を介した生物のあいだの相互作用は,病原体のみならず植物と共生微生物とのあいだの相互作用にも密接に関与する.病原体に感染したときと共生微生物と共存したときの宿主における糖の吸収の制御が異なるのかどうかも今後の展開として興味深い.また,病原体は糖のほかアミノ酸やイオンの供給も宿主に依存する.それらの輸送を制御する輸送体も糖輸送体STP13と同様に制御されているのかもしれない.宿主と病原体とのあいだの栄養の吸収の競合については不明な点が多いが,今回の結果をうけ解析の進むことが期待される.
文 献
- Wahl, R., Wippel, K., Goos, S. et al.: A novel high-affinity sucrose transporter is required for virulence of the plant pathogen Ustilago maydis. PLoS Biol., 8, e1000303 (2010)[PubMed]
- Chen, L. Q., Hou, B. H., Lalonde, S. et al.: Sugar transporters for intercellular exchange and nutrition of pathogens. Nature, 468, 527-532 (2010)[PubMed]
- Eom, J. S., Chen, L. Q., Sosso, D. et al.: SWEETs, transporters for intracellular and intercellular sugar translocation. Curr. Opin. Plant Biol., 25, 53-62 (2015)[PubMed]
- Yamada, K., Kanai, M., Osakabe, Y. et al.: Monosaccharide absorption activity of Arabidopsis roots depends on expression profiles of transporter genes under high salinity conditions. J. Biol. Chem., 286, 43577-43586 (2011)[PubMed]
- Couto, D. & Zipfel, C.: Regulation of pattern recognition receptor signalling in plants. Nat. Rev. Immunol., 16, 537-552 (2016)[PubMed]
- Stauber, J. L., Loginicheva, E. & Schechter, L. M.: Carbon source and cell density-dependent regulation of type III secretion system gene expression in Pseudomonas syringae pathovar tomato DC3000. Res. Microbiol., 163, 531-539 (2012)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 東京大学大学院農学生命科学研究科博士課程 修了,同年 ドイツMax Planck Institute for Plant Breeding Research博士研究員,2014年 京都大学大学院農学研究科 研究員を経て,2016年より徳島大学大学院生物資源産業学研究部 特任助教.
研究テーマ:植物と微生物とのインターフェイスにおいてくりひろげられる栄養の吸収の競合.
高野 義孝(Yoshitaka Takano)
京都大学大学院農学研究科 教授.
研究室URL:http://www.plant-pathology.kais.kyoto-u.ac.jp/
© 2016 山田晃嗣・高野義孝 Licensed under CC 表示 2.1 日本