Hippoシグナル伝達系はがん細胞において宿主の腫瘍免疫を抑制する
諸石 寿朗
(米国California大学San Diego校Department of Pharmacology)
email:諸石寿朗
DOI: 10.7875/first.author.2016.122
The Hippo pathway kinases LATS1/2 suppress cancer immunity.
Toshiro Moroishi, Tomoko Hayashi, Wei-Wei Pan, Yu Fujita, Matthew V. Holt, Jun Qin, Dennis A. Carson, Kun-Liang Guan
Cell, 167, 1525-1539.e17 (2016)
近年,Hippoシグナル伝達系は正常な細胞のがん化をふせぐシグナル伝達系として注目されているが,筆者らは,がん細胞においてHippoシグナル伝達系は宿主の腫瘍免疫を抑制することを発見した.Hippoシグナル伝達経路の中心となるキナーゼであるLATS1およびLATS2をがん細胞において欠損させると,宿主の腫瘍に対する免疫応答が増強されて腫瘍の増殖が強力に抑制された.さらに,LATS1およびLATS2を欠損させることによりがん細胞の免疫原性が向上し,がんに対するワクチンとしての効果が飛躍的に増強された.これらの結果から,Hippoシグナル伝達系は腫瘍に対する免疫原性を制御すること,また,LATS1およびLATS2はがん免疫療法において創薬の新たな標的になりうることが示唆された.
悪性腫瘍は細胞の形質転換,腫瘍の増大,転移といったいくつもの過程において細胞のシグナル伝達系を多様に変化させ,がん細胞と宿主の相互作用のなかで進行する.近年,Hippoシグナル伝達系はこれらのがん細胞の特性を制御するシグナル伝達系として注目されてきた1).また,Hippoシグナル伝達系はがんの生物学にとどまらず,臓器の発生や大きさの制御,組織の再生,また,幹細胞の生物学においても重要な役割を担っている2).
Hippoシグナル伝達経路の中心はMST1およびMST2,MAP4Kファミリーキナーゼ(MAP4K1~MAP4K7),LATS1およびLATS2を含むキナーゼカスケードから構成される3).Hippoシグナルがオンになると,上流のキナーゼであるMST1およびMST2またはMAP4Kファミリーキナーゼが下流のキナーゼであるLATS1およびLATS2をリン酸化し活性化する4).活性化したLATS1およびLATS2はHippoシグナル伝達系において転写を制御する機能を担う転写因子YAPおよびTAZをリン酸化し,このリン酸化によりYAPおよびTAZは細胞質に局在し転写因子としては不活性化される.逆に,LATS1およびLATS2が不活性化した(Hippoシグナルがオフになった)場合には,YAPおよびTAZは脱リン酸化されて核に局在し転写因子として活性化する.すなわち,Hippoシグナル伝達系のおもな役割はLATS1およびLATS2の活性化と,それによる転写因子YAPおよびTAZの不活性化である.
これまでの研究において,Hippoシグナル伝達系は正常な細胞のがん化をふせぐシグナル伝達系として注目されてきた.たとえば,マウスの肝臓における上流のキナーゼMST1およびMST2の欠損,あるいは,下流の転写因子YAPの過剰な発現は,ともに肝臓がんの発がんを促進する5).これらの研究は,発がんを抑制するシグナル伝達系としてのHippoシグナル伝達系の役割を確立させた.しかしながら,腫瘍は複雑な過程をへてがん細胞と宿主との相互作用のなかで悪性腫瘍へと進行する.これまでの研究においては,Hippoシグナル伝達系のがんの進行の過程,とくに,がん細胞と宿主の腫瘍に対する免疫応答との相互作用における役割は明らかにされていなかった.
腫瘍免疫におけるHippoシグナル伝達系の役割について調べるため,同系マウスモデルを用いて3つの異なるがん種をそれぞれ3つの異なる遺伝的な背景をもつマウスに移植し腫瘍の増殖能を調べた.これらのがん細胞におけるHippoシグナル伝達系の応答について調べたところ,血清飢餓やストレスシグナルなどHippoシグナル伝達系に影響をおよぼす生理的な刺激に応じてYAPおよびTAZのリン酸化および細胞における局在が制御された.すなわち,これらのがん細胞においてHippoシグナル伝達系は正常に機能しており,これらの細胞のがんとしての特性はHippoシグナル伝達系のほかの変異によりもたらされると考えられた.
これらのがん細胞においてHippoシグナル伝達系を破綻させるため,CRISPR-Cas9系を利用した遺伝子編集技術を用いてLATS1およびLATS2を同時に欠損したがん細胞を作出した.すると,野生型のがん細胞においては生理的な刺激に応じてYAPおよびTAZのリン酸化および細胞における局在が制御されたのに対し,LATS1およびLATS2を欠損したがん細胞においてはYAPおよびTAZがつねに脱リン酸化して核に局在し恒常的に活性化した.これらのがん細胞のがんとしての性質を調べるため,in vitroにおける足場に依存しない増殖能について調べた.YAPおよびTAZによる転写の活性化は基本的に細胞の増殖を正に制御する方向にはたらくことが知られている.この知見と合致して,LATS1およびLATS2を欠損したがん細胞においてはがん細胞の足場に依存しない増殖能が増強された.以上の結果から,がん細胞におけるLATS1およびLATS2の欠損はYAPおよびTAZを恒常的に活性化させ,がん細胞のもつ足場に依存しない増殖能をさらに増強させることがわかった.
野生型のがん細胞とLATS1およびLATS2を欠損したがん細胞をそれぞれ対応する遺伝的な背景をもつマウスに移植し腫瘍の増殖能について調べた.すると,すべてのがんモデルにおいて,LATS1およびLATS2の欠損はin vivoにおけるがん細胞の増殖を強力に抑制した.とくに,SCC7頭頸部扁平上皮がんモデルにおいては,野生型のSCC7細胞を移植したすべてのマウスは腫瘍を形成し,移植ののち20日ほどで死亡したのに対し,LATS1およびLATS2を欠損したSCC7細胞を移植したすべてのマウスはがん細胞を完全に拒絶し生存した.すなわち,LATS1およびLATS2の欠損はがん細胞の足場に依存しない増殖能を増強するにもかかわらず,生体における腫瘍の形成能を強力に抑制することが明らかにされた.これまで,Hippoシグナル伝達系はがんを抑制するシグナル伝達系と考えられていたため,これらの実験の結果はまったく予想外であった.
がん細胞におけるLATS1およびLATS2の欠損ががん細胞の増殖に対しin vitroとin vivoとでまったく逆の効果をもたらしたため,宿主のもつ要因がこのいっけん矛盾するようにみえる実験の結果に関与するのではないかと考えた.実際に,移植したがん細胞の組織切片を調べたところ,LATS1およびLATS2を欠損したがん細胞には多くの免疫細胞が浸潤していた.そこで,宿主の腫瘍に対する免疫応答をB16悪性黒色腫モデルにおいて調べたところ,LATS1およびLATS2を欠損したがん細胞を移植したマウスにおいては体液性免疫および細胞性免疫がともに増強されていた.さらに,獲得免疫系に異常のあるRAG-1ノックアウトマウスを宿主として,野生型のB16細胞あるいはLATS1およびLATS2を欠損するB16細胞を移植したところ,LATS1およびLATS2を欠損したB16細胞は野生型のB16細胞と同様に腫瘍を形成しすべてのマウスが死亡した.これらの結果から,がん細胞におけるLATS1およびLATS2の欠損が宿主の獲得免疫系を増強し,それによりがん細胞を破壊することが示唆された.そこで,LATS1およびLATS2を欠損したB16細胞を放射線を照射したうえでワクチンとしてマウスに投与し,そののち,獲得免疫系の成立をまってこのマウスに野生型のB16細胞を移植したところ,ワクチンを投与したマウスにおいては野生型のB16細胞からの腫瘍の形成が強力に抑制された.以上の結果から,がん細胞におけるLATS1およびLATS2の欠損は腫瘍の免疫原性を向上させ,宿主の獲得免疫系を増強しがん細胞を破壊することが明らかにされた.
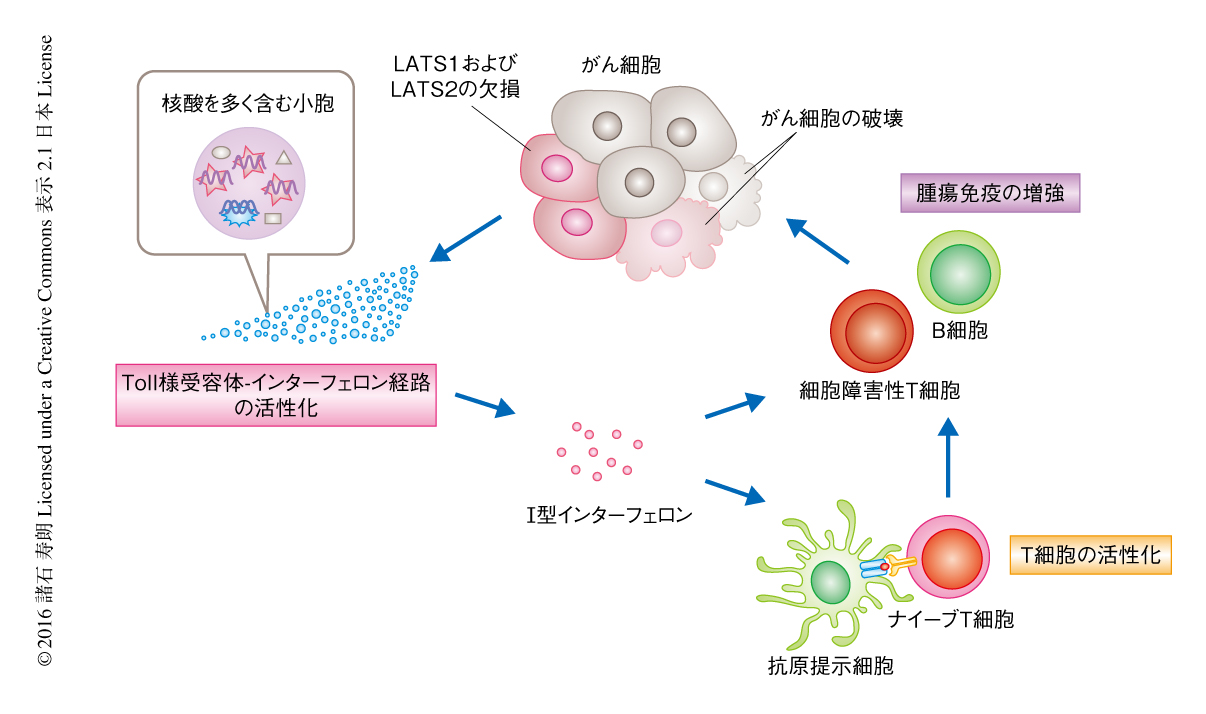
LATS1およびLATS2の欠損はYAPおよびTAZを恒常的に活性化させるため,YAPあるいはTAZの過剰な発現により同様の現象が観察されるかどうか調べた.その結果,活性型YAPあるいは活性型TAZを過剰に発現したB16細胞においても,LATS1およびLATS2を欠損したB16細胞と同様に,in vivoにおける腫瘍の形成能が抑制された.がん細胞におけるLATS1およびLATS2の欠損が宿主の腫瘍免疫を刺激する機構について調べるため,獲得免疫系の成立に重要な抗原の提示の過程をin vitroの実験系において精査したところ,LATS1およびLATS2を欠損したがん細胞が細胞外に分泌する小胞により抗原提示細胞である樹状細胞が活性化されることがつきとめられた.さらに,プロテオミクス解析により,LATS1およびLATS2を欠損したがん細胞の分泌する小胞には核酸が多く含まれることが示唆された.核酸には免疫応答を刺激する作用のあることが知られており6),これらの結果から,LATS1およびLATS2を欠損したがん細胞は核酸を多く含む小胞を分泌することにより宿主の腫瘍に対する免疫応答を惹起するのではないかと仮説をたてた.
この仮説を検証するため,宿主の核酸感知系において必須な一連のタンパク質のノックアウトマウスを用い,宿主の核酸感知系の異常がLATS1およびLATS2を欠損したがん細胞の増殖におよぼす影響について調べた.その結果,エンドソームを介したToll様受容体-インターフェロン経路がはたらかないマウスにおいて,LATS1およびLATS2の欠損による腫瘍の抑制の効果が障害された.これらの結果から,LATS1およびLATS2を欠損したがん細胞は,核酸を多く含む小胞を分泌することにより宿主の核酸感知系を刺激し,Toll様受容体-インターフェロン経路を活性化することにより腫瘍免疫を増強することが明らかにされた(図1).
これまで,Hippoシグナル伝達系は正常な細胞のがん化をふせぐ,がんを抑制するシグナル伝達系と考えられてきた.しかしながら,この研究においては,がん細胞においてHippoシグナル伝達系を障害することにより腫瘍の増殖が抑制されることが明らかにされた.この結果は,いっけんするとHippoシグナル伝達系ががんを抑制するシグナル伝達系とされてきたことと矛盾するように思える.
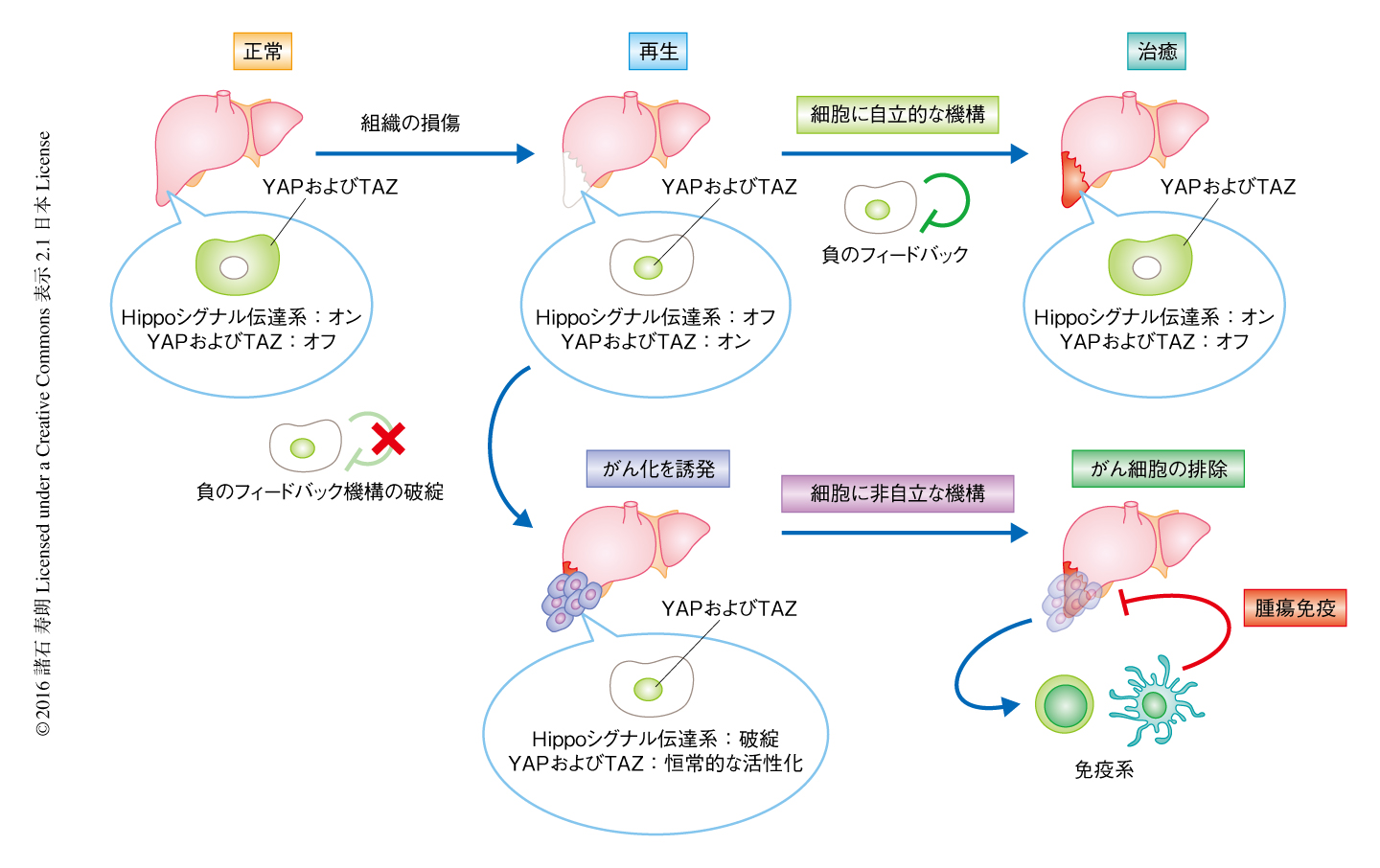
筆者らは,Hippoシグナル伝達系は細胞の増殖を負に制御することにより正常な細胞のがん化をふせぐと同時に細胞の免疫原性を抑制することを提唱する.これらの2つのHippoシグナル伝達系の特性は,組織における恒常性の維持に必要と考える(図2).たとえば,正常な組織においてはHippoシグナル伝達系がYAPおよびTAZの過剰な活性化を抑制し恒常性が維持されているが,組織が損傷したのちの再生の過程など細胞の増殖が必要な状況においては,Hippoシグナル伝達系をオフにしYAPおよびTAZを活性化する必要がある.筆者らは,過去の研究において,YAPおよびTAZの活性化は細胞に自立的にHippoシグナル伝達系の負のフィードバック機構を惹起することを明らかにした7).そのため,YAPおよびTAZの活性化は一過性であり,損傷の治癒が完了すると再度Hippoシグナル伝達系が機能し組織において恒常性が維持される.しかしながら,LATS1およびLATS2の欠損などにより細胞に自立的なHippoシグナル伝達系の負のフィードバック機構がはたらかなくなると,YAPおよびTAZが恒常的に活性化するため細胞の増殖が異常に亢進しがん化してしまう.しかしながら,この場合も,免疫系がHippoシグナル伝達系の障害を感知し腫瘍免疫を増強することにより,細胞に非自立的な機構によりがん細胞を排除することが可能になる.したがって,Hippoシグナル伝達系による細胞の増殖と免疫原性の抑制は,組織において恒常性を維持するというHippoシグナル伝達系の生理的な役割と矛盾しない.
近年,がん治療の新しい選択肢としてがん免疫療法が脚光をあびており,いくつかの免疫チェックポイント阻害剤は実際のがん患者を対象としてめざましい成績をあげている8).しかしながら,個々の患者におけるがん免疫療法への応答性はさまざまで,がんの免疫原性をいかに向上させるかが今後の課題のひとつとなっている.この研究において,がん細胞においてLATS1およびLATS2を欠損させるとがん細胞の免疫原性が向上し,宿主の腫瘍免疫が増強されることによりがん細胞が破壊されることが明らかにされた.そこで,がん細胞においてLATS1およびLATS2を阻害する薬剤を開発することが,がん免疫療法の新たな治療の戦略になることが期待される.注目すべきことに,がんを抑制するシグナル伝達系としての重要性を示唆する多くの結果にもかかわらず,ヒトのがんにおいてHippoシグナル伝達系の遺伝子の変異は非常にまれである1,5).したがって,LATS1およびLATS2の阻害剤を用いたがん免疫療法はヒトの多くのがん種に応用が可能であると考えられる.しかしながら,マウスとヒトの免疫系は多くの点で異なっており,今回の発見をいかにヒトに応用していくかが今後の課題である.
略歴:2012年 九州大学大学院医学系学府博士課程 修了,同年 九州大学生体防御医学研究所 学術研究員を経て,2013年より米国California大学San Diego校 博士研究員.
研究テーマ:Hippoシグナル伝達系の全貌の解明と腫瘍免疫.
関心事:ドラックディスカバリー.
© 2016 諸石 寿朗 Licensed under CC 表示 2.1 日本
(米国California大学San Diego校Department of Pharmacology)
email:諸石寿朗
DOI: 10.7875/first.author.2016.122
The Hippo pathway kinases LATS1/2 suppress cancer immunity.
Toshiro Moroishi, Tomoko Hayashi, Wei-Wei Pan, Yu Fujita, Matthew V. Holt, Jun Qin, Dennis A. Carson, Kun-Liang Guan
Cell, 167, 1525-1539.e17 (2016)
この論文に出現する遺伝子・タンパク質のUniprot ID
LATS1(Q8BYR2), /2(Q7TSJ6), LATS2(Q7TSJ6), MST1(Q13043), MST2(Q13188), MAP4K, MAP4K1(Q92918), MAP4K7, YAP(P46938), TAZ(Q9EPK5), RAG-1(P15919), Toll様受容体, インターフェロン
要 約
近年,Hippoシグナル伝達系は正常な細胞のがん化をふせぐシグナル伝達系として注目されているが,筆者らは,がん細胞においてHippoシグナル伝達系は宿主の腫瘍免疫を抑制することを発見した.Hippoシグナル伝達経路の中心となるキナーゼであるLATS1およびLATS2をがん細胞において欠損させると,宿主の腫瘍に対する免疫応答が増強されて腫瘍の増殖が強力に抑制された.さらに,LATS1およびLATS2を欠損させることによりがん細胞の免疫原性が向上し,がんに対するワクチンとしての効果が飛躍的に増強された.これらの結果から,Hippoシグナル伝達系は腫瘍に対する免疫原性を制御すること,また,LATS1およびLATS2はがん免疫療法において創薬の新たな標的になりうることが示唆された.
はじめに
悪性腫瘍は細胞の形質転換,腫瘍の増大,転移といったいくつもの過程において細胞のシグナル伝達系を多様に変化させ,がん細胞と宿主の相互作用のなかで進行する.近年,Hippoシグナル伝達系はこれらのがん細胞の特性を制御するシグナル伝達系として注目されてきた1).また,Hippoシグナル伝達系はがんの生物学にとどまらず,臓器の発生や大きさの制御,組織の再生,また,幹細胞の生物学においても重要な役割を担っている2).
Hippoシグナル伝達経路の中心はMST1およびMST2,MAP4Kファミリーキナーゼ(MAP4K1~MAP4K7),LATS1およびLATS2を含むキナーゼカスケードから構成される3).Hippoシグナルがオンになると,上流のキナーゼであるMST1およびMST2またはMAP4Kファミリーキナーゼが下流のキナーゼであるLATS1およびLATS2をリン酸化し活性化する4).活性化したLATS1およびLATS2はHippoシグナル伝達系において転写を制御する機能を担う転写因子YAPおよびTAZをリン酸化し,このリン酸化によりYAPおよびTAZは細胞質に局在し転写因子としては不活性化される.逆に,LATS1およびLATS2が不活性化した(Hippoシグナルがオフになった)場合には,YAPおよびTAZは脱リン酸化されて核に局在し転写因子として活性化する.すなわち,Hippoシグナル伝達系のおもな役割はLATS1およびLATS2の活性化と,それによる転写因子YAPおよびTAZの不活性化である.
これまでの研究において,Hippoシグナル伝達系は正常な細胞のがん化をふせぐシグナル伝達系として注目されてきた.たとえば,マウスの肝臓における上流のキナーゼMST1およびMST2の欠損,あるいは,下流の転写因子YAPの過剰な発現は,ともに肝臓がんの発がんを促進する5).これらの研究は,発がんを抑制するシグナル伝達系としてのHippoシグナル伝達系の役割を確立させた.しかしながら,腫瘍は複雑な過程をへてがん細胞と宿主との相互作用のなかで悪性腫瘍へと進行する.これまでの研究においては,Hippoシグナル伝達系のがんの進行の過程,とくに,がん細胞と宿主の腫瘍に対する免疫応答との相互作用における役割は明らかにされていなかった.
1.LATS1およびLATS2を欠損したがん細胞はin vitroにおいて足場に依存しない増殖が増強する
腫瘍免疫におけるHippoシグナル伝達系の役割について調べるため,同系マウスモデルを用いて3つの異なるがん種をそれぞれ3つの異なる遺伝的な背景をもつマウスに移植し腫瘍の増殖能を調べた.これらのがん細胞におけるHippoシグナル伝達系の応答について調べたところ,血清飢餓やストレスシグナルなどHippoシグナル伝達系に影響をおよぼす生理的な刺激に応じてYAPおよびTAZのリン酸化および細胞における局在が制御された.すなわち,これらのがん細胞においてHippoシグナル伝達系は正常に機能しており,これらの細胞のがんとしての特性はHippoシグナル伝達系のほかの変異によりもたらされると考えられた.
これらのがん細胞においてHippoシグナル伝達系を破綻させるため,CRISPR-Cas9系を利用した遺伝子編集技術を用いてLATS1およびLATS2を同時に欠損したがん細胞を作出した.すると,野生型のがん細胞においては生理的な刺激に応じてYAPおよびTAZのリン酸化および細胞における局在が制御されたのに対し,LATS1およびLATS2を欠損したがん細胞においてはYAPおよびTAZがつねに脱リン酸化して核に局在し恒常的に活性化した.これらのがん細胞のがんとしての性質を調べるため,in vitroにおける足場に依存しない増殖能について調べた.YAPおよびTAZによる転写の活性化は基本的に細胞の増殖を正に制御する方向にはたらくことが知られている.この知見と合致して,LATS1およびLATS2を欠損したがん細胞においてはがん細胞の足場に依存しない増殖能が増強された.以上の結果から,がん細胞におけるLATS1およびLATS2の欠損はYAPおよびTAZを恒常的に活性化させ,がん細胞のもつ足場に依存しない増殖能をさらに増強させることがわかった.
2.LATS1およびLATS2を欠損したがん細胞はin vivoにおける腫瘍の増殖が強力に抑制される
野生型のがん細胞とLATS1およびLATS2を欠損したがん細胞をそれぞれ対応する遺伝的な背景をもつマウスに移植し腫瘍の増殖能について調べた.すると,すべてのがんモデルにおいて,LATS1およびLATS2の欠損はin vivoにおけるがん細胞の増殖を強力に抑制した.とくに,SCC7頭頸部扁平上皮がんモデルにおいては,野生型のSCC7細胞を移植したすべてのマウスは腫瘍を形成し,移植ののち20日ほどで死亡したのに対し,LATS1およびLATS2を欠損したSCC7細胞を移植したすべてのマウスはがん細胞を完全に拒絶し生存した.すなわち,LATS1およびLATS2の欠損はがん細胞の足場に依存しない増殖能を増強するにもかかわらず,生体における腫瘍の形成能を強力に抑制することが明らかにされた.これまで,Hippoシグナル伝達系はがんを抑制するシグナル伝達系と考えられていたため,これらの実験の結果はまったく予想外であった.
3.がん細胞におけるLATS1およびLATS2の欠損は宿主の腫瘍に対する免疫応答を増強する
がん細胞におけるLATS1およびLATS2の欠損ががん細胞の増殖に対しin vitroとin vivoとでまったく逆の効果をもたらしたため,宿主のもつ要因がこのいっけん矛盾するようにみえる実験の結果に関与するのではないかと考えた.実際に,移植したがん細胞の組織切片を調べたところ,LATS1およびLATS2を欠損したがん細胞には多くの免疫細胞が浸潤していた.そこで,宿主の腫瘍に対する免疫応答をB16悪性黒色腫モデルにおいて調べたところ,LATS1およびLATS2を欠損したがん細胞を移植したマウスにおいては体液性免疫および細胞性免疫がともに増強されていた.さらに,獲得免疫系に異常のあるRAG-1ノックアウトマウスを宿主として,野生型のB16細胞あるいはLATS1およびLATS2を欠損するB16細胞を移植したところ,LATS1およびLATS2を欠損したB16細胞は野生型のB16細胞と同様に腫瘍を形成しすべてのマウスが死亡した.これらの結果から,がん細胞におけるLATS1およびLATS2の欠損が宿主の獲得免疫系を増強し,それによりがん細胞を破壊することが示唆された.そこで,LATS1およびLATS2を欠損したB16細胞を放射線を照射したうえでワクチンとしてマウスに投与し,そののち,獲得免疫系の成立をまってこのマウスに野生型のB16細胞を移植したところ,ワクチンを投与したマウスにおいては野生型のB16細胞からの腫瘍の形成が強力に抑制された.以上の結果から,がん細胞におけるLATS1およびLATS2の欠損は腫瘍の免疫原性を向上させ,宿主の獲得免疫系を増強しがん細胞を破壊することが明らかにされた.
4.LATS1およびLATS2を欠損したがん細胞は宿主の核酸感知系を刺激し腫瘍免疫を惹起する
LATS1およびLATS2の欠損はYAPおよびTAZを恒常的に活性化させるため,YAPあるいはTAZの過剰な発現により同様の現象が観察されるかどうか調べた.その結果,活性型YAPあるいは活性型TAZを過剰に発現したB16細胞においても,LATS1およびLATS2を欠損したB16細胞と同様に,in vivoにおける腫瘍の形成能が抑制された.がん細胞におけるLATS1およびLATS2の欠損が宿主の腫瘍免疫を刺激する機構について調べるため,獲得免疫系の成立に重要な抗原の提示の過程をin vitroの実験系において精査したところ,LATS1およびLATS2を欠損したがん細胞が細胞外に分泌する小胞により抗原提示細胞である樹状細胞が活性化されることがつきとめられた.さらに,プロテオミクス解析により,LATS1およびLATS2を欠損したがん細胞の分泌する小胞には核酸が多く含まれることが示唆された.核酸には免疫応答を刺激する作用のあることが知られており6),これらの結果から,LATS1およびLATS2を欠損したがん細胞は核酸を多く含む小胞を分泌することにより宿主の腫瘍に対する免疫応答を惹起するのではないかと仮説をたてた.
この仮説を検証するため,宿主の核酸感知系において必須な一連のタンパク質のノックアウトマウスを用い,宿主の核酸感知系の異常がLATS1およびLATS2を欠損したがん細胞の増殖におよぼす影響について調べた.その結果,エンドソームを介したToll様受容体-インターフェロン経路がはたらかないマウスにおいて,LATS1およびLATS2の欠損による腫瘍の抑制の効果が障害された.これらの結果から,LATS1およびLATS2を欠損したがん細胞は,核酸を多く含む小胞を分泌することにより宿主の核酸感知系を刺激し,Toll様受容体-インターフェロン経路を活性化することにより腫瘍免疫を増強することが明らかにされた(図1).
おわりに
これまで,Hippoシグナル伝達系は正常な細胞のがん化をふせぐ,がんを抑制するシグナル伝達系と考えられてきた.しかしながら,この研究においては,がん細胞においてHippoシグナル伝達系を障害することにより腫瘍の増殖が抑制されることが明らかにされた.この結果は,いっけんするとHippoシグナル伝達系ががんを抑制するシグナル伝達系とされてきたことと矛盾するように思える.
筆者らは,Hippoシグナル伝達系は細胞の増殖を負に制御することにより正常な細胞のがん化をふせぐと同時に細胞の免疫原性を抑制することを提唱する.これらの2つのHippoシグナル伝達系の特性は,組織における恒常性の維持に必要と考える(図2).たとえば,正常な組織においてはHippoシグナル伝達系がYAPおよびTAZの過剰な活性化を抑制し恒常性が維持されているが,組織が損傷したのちの再生の過程など細胞の増殖が必要な状況においては,Hippoシグナル伝達系をオフにしYAPおよびTAZを活性化する必要がある.筆者らは,過去の研究において,YAPおよびTAZの活性化は細胞に自立的にHippoシグナル伝達系の負のフィードバック機構を惹起することを明らかにした7).そのため,YAPおよびTAZの活性化は一過性であり,損傷の治癒が完了すると再度Hippoシグナル伝達系が機能し組織において恒常性が維持される.しかしながら,LATS1およびLATS2の欠損などにより細胞に自立的なHippoシグナル伝達系の負のフィードバック機構がはたらかなくなると,YAPおよびTAZが恒常的に活性化するため細胞の増殖が異常に亢進しがん化してしまう.しかしながら,この場合も,免疫系がHippoシグナル伝達系の障害を感知し腫瘍免疫を増強することにより,細胞に非自立的な機構によりがん細胞を排除することが可能になる.したがって,Hippoシグナル伝達系による細胞の増殖と免疫原性の抑制は,組織において恒常性を維持するというHippoシグナル伝達系の生理的な役割と矛盾しない.
近年,がん治療の新しい選択肢としてがん免疫療法が脚光をあびており,いくつかの免疫チェックポイント阻害剤は実際のがん患者を対象としてめざましい成績をあげている8).しかしながら,個々の患者におけるがん免疫療法への応答性はさまざまで,がんの免疫原性をいかに向上させるかが今後の課題のひとつとなっている.この研究において,がん細胞においてLATS1およびLATS2を欠損させるとがん細胞の免疫原性が向上し,宿主の腫瘍免疫が増強されることによりがん細胞が破壊されることが明らかにされた.そこで,がん細胞においてLATS1およびLATS2を阻害する薬剤を開発することが,がん免疫療法の新たな治療の戦略になることが期待される.注目すべきことに,がんを抑制するシグナル伝達系としての重要性を示唆する多くの結果にもかかわらず,ヒトのがんにおいてHippoシグナル伝達系の遺伝子の変異は非常にまれである1,5).したがって,LATS1およびLATS2の阻害剤を用いたがん免疫療法はヒトの多くのがん種に応用が可能であると考えられる.しかしながら,マウスとヒトの免疫系は多くの点で異なっており,今回の発見をいかにヒトに応用していくかが今後の課題である.
文 献
- Moroishi, T., Hansen, C. G. & Guan, K. L.: The emerging roles of YAP and TAZ in cancer. Nat. Rev. Cancer, 15, 73-79 (2015)[PubMed]
- Hansen, C. G., Moroishi, T. & Guan, K. L.: YAP and TAZ: a nexus for Hippo signaling and beyond. Trends Cell Biol., 25, 499-513 (2015)[PubMed]
- Meng, Z., Moroishi, T. & Guan, K. L.: Mechanisms of Hippo pathway regulation. Genes Dev., 30, 1-17 (2016)[PubMed]
- Meng, Z., Moroishi, T., Mottier-Pavie, V. et al.: MAP4K family kinases act in parallel to MST1/2 to activate LATS1/2 in the Hippo pathway. Nat. Commun., 6, 8357 (2015)[PubMed]
- Harvey, K. F., Zhang, X. & Thomas, D. M.: The Hippo pathway and human cancer. Nat. Rev. Cancer, 13, 246-257 (2013)[PubMed]
- Junt, T. & Barchet, W.: Translating nucleic acid-sensing pathways into therapies. Nat. Rev. Immunol., 15, 529-544 (2015)[PubMed]
- Moroishi, T., Park, H. W., Qin, B. et al.: A YAP/TAZ-induced feedback mechanism regulates Hippo pathway homeostasis. Genes Dev., 29, 1271-1284 (2015)[PubMed]
- Sharma, P. & Allison, J. P.: Immune checkpoint targeting in cancer therapy: toward combination strategies with curative potential. Cell, 161, 205-214 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012年 九州大学大学院医学系学府博士課程 修了,同年 九州大学生体防御医学研究所 学術研究員を経て,2013年より米国California大学San Diego校 博士研究員.
研究テーマ:Hippoシグナル伝達系の全貌の解明と腫瘍免疫.
関心事:ドラックディスカバリー.
© 2016 諸石 寿朗 Licensed under CC 表示 2.1 日本