低酸素の環境による成体のマウスにおける心臓の再生
中田祐二・Hesham A. Sadek
(米国Texas大学Southwestern Medical Center,Department of Internal Medicine)
email:中田祐二
DOI: 10.7875/first.author.2016.121
Hypoxia induces heart regeneration in adult mice.
Yuji Nakada, Diana C. Canseco, SuWannee Thet, Salim Abdisalaam, Aroumougame Asaithamby, Celio X Santos, Ajay Shah, Hua Zhang, James E. Faber, Michael T. Kinter, Luke I. Szweda, Chao Xing, Ralph Deberardinis, Orhan Oz, Zhigang Lu, Cheng Cheng Zhang, Wataru Kimura, Hesham A. Sadek
Nature, 541, 222-227 (2017)
哺乳類の成体において心筋細胞は増殖能を失っており,心筋細胞の欠損はただちに重篤な心筋症をひき起こす.近年,哺乳類の心臓は終末分化をとげたわけではないことがわかっており,たとえば,マウスの新生仔の心筋細胞は増殖能および再生能をもつ.また,これらの心筋細胞は既存の心筋細胞から増殖し,ミトコンドリアに由来する活性酸素種によるDNAの損傷により増殖が抑制される.筆者らは,低酸素の環境における呼吸の阻害が酸化的なDNAの損傷を軽減し,さらには,心筋細胞の増殖を誘導するのではないかと考え,成体のマウスを低酸素の環境においた.吸入する酸素の濃度を1日に1%ずつ段階的に低下させ,酸素の濃度が7%に達した時点でこの状態を2週間にわたり維持した.その結果,ミトコンドリアにおける代謝がいちじるしく阻害され,活性酸素種の発生の低下やDNAの損傷の軽減がみられ,さらには,心筋細胞が増殖した.心筋損傷モデルマウスにおいても心筋細胞の増殖がみられ,また,損傷した領域の線維化の軽減,毛細血管の拡張,冠側副血行の発達,さらには,心機能の改善までがみられた.これら新しく増殖した心筋細胞の細胞系譜を追跡したところ,新生仔と同様に,幹細胞などに由来するのではなく既存の心筋細胞から増殖していることがわかった.以上のことから,内在性の心筋細胞の再生能は低酸素の環境におかれることにより活性化されることがわかった.この研究により,低酸素療法が心筋症の治療に有効になる可能性が示された.
ゼブラフィッシュなど一部の真骨魚類や有尾両生類,さらに,哺乳類の新生仔などは心臓のさまざまな損傷から既存の心筋細胞を介して新たな心筋細胞が増殖する1,2).一方で,哺乳類の成体は心筋細胞の増殖能を失っている.つまり,生後まもなく哺乳類の大多数の心筋細胞は細胞周期を停止し,哺乳類の成体の心筋細胞にとり細胞周期への復帰が心筋細胞の再生において重要である.また,ミトコンドリアに由来する活性酸素種は心筋細胞のおもな酸化的なストレス源であり3),2014年,筆者らは,マウスは子宮における低酸素の環境から生後の酸化的な環境にさらされるとミトコンドリアを介した酸化的なDNAの損傷により心筋細胞の細胞周期が停止することを報告した4)(新着論文レビュー でも掲載).さらには,筆者らの最近の研究により,増殖能をもつ心筋細胞は低酸素の環境に局在し活性酸素種によるDNAの損傷から守られていることがわかった5)(新着論文レビュー でも掲載).これらのことから,ミトコンドリアにおける酸素に依存的な代謝が心筋細胞の細胞周期の停止のおもな原因であることが示唆された.しかしながら,これまで,環境における酸素の濃度が心筋細胞の細胞周期の停止にどう影響をおよぼすかは不明であった.そこで,筆者らは,吸入する酸素の濃度を段階的に低下させることにより,低酸素の環境におけるミトコンドリアに由来する活性酸素種の軽減が酸化的なDNAの損傷を軽減し,ひいては,心筋細胞の増殖を誘導するのではないかと考えた.
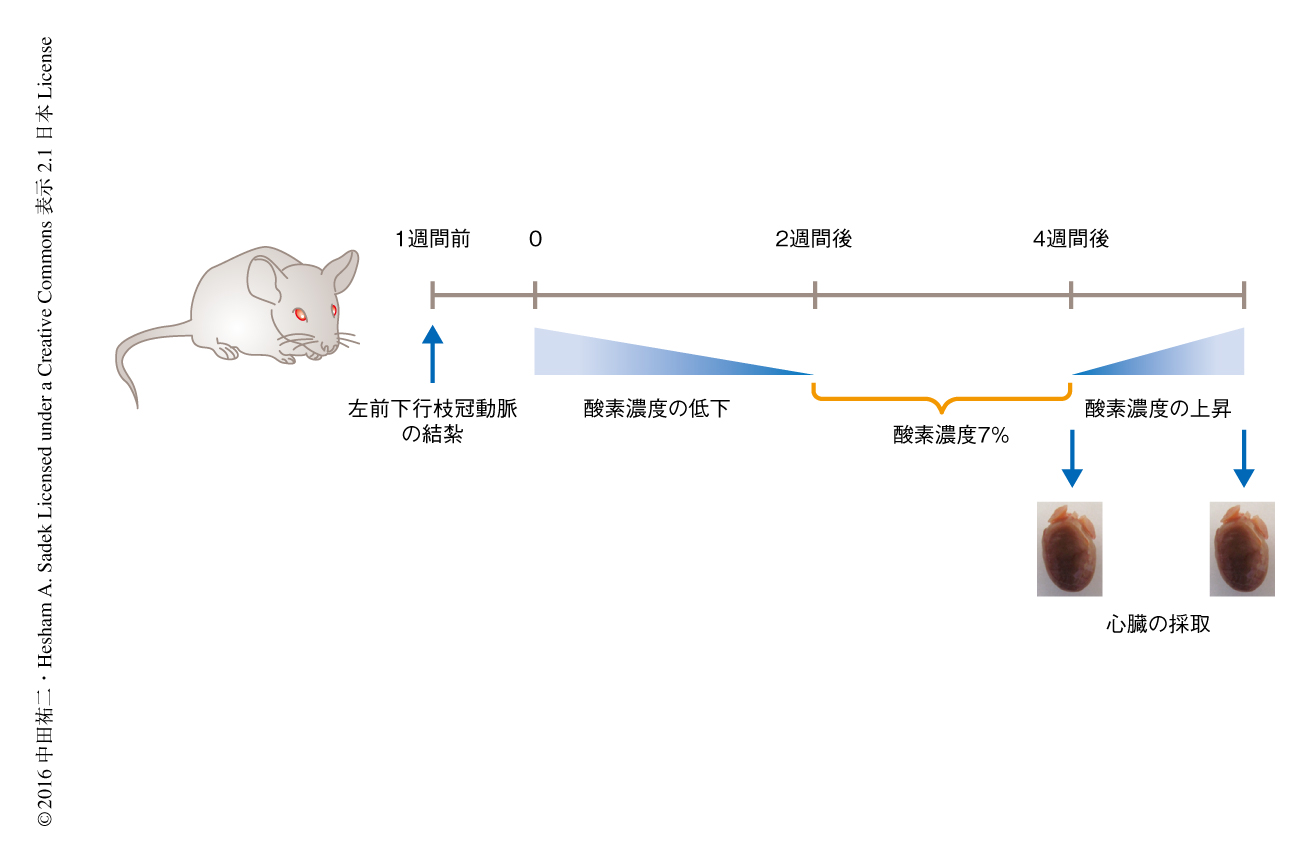
極限の低酸素の環境におけるマウスの心筋細胞のミトコンドリアでの代謝について調べるため低酸素チャンバーを用いた.低酸素ショックをさけるため,1日に1%ずつ吸入する酸素の濃度を低下させ,酸素の濃度が7%に達したところでこれを2週間にわたり維持した6)(図1).血中の酸素の濃度を測定したところ,低酸素の環境においたマウスは通常の環境のマウスより低い値を示した.Hif-1αのODDドメインとタモキシフェンに依存的に活性化するリコンビナーゼCreERT2との融合タンパク質を普遍的な遺伝子プロモーターであるCAGプロモーターの制御のもとで発現するトランスジェニックマウスと,Creに依存して蛍光タンパク質tdTomatoを不可逆的に発現するマウスとを交配したマウスを,低酸素の環境において2日間にわたり維持したところtdTomato陽性の心筋細胞の増加がみられ,これは低酸素の環境によるHif1αのODDドメインの安定化によるものと思われた5).ミトコンドリアの構造を電子顕微鏡により観察したところ低酸素の環境においたマウスでは心筋細胞のクリステの密度が低下しており,また,ミトコンドリアDNAのコピー数が減少していた.また,プロテオーム解析において,低酸素の環境においたマウスの心臓ではクエン酸回路や脂肪酸β酸化にかかわる酵素が顕著に減少していた.さらに,メタボローム解析でも同様に,クエン酸回路にかかわる代謝産物の減少がみられた.くわえて,電子伝達系の活性が低下し,活性酸素の測定においても活性酸素種や過酸化水素のいちじるしい低下がみられた.また,DNAの損傷が軽減していることもわかった.
心筋細胞の増殖について調べたところ,低酸素の環境におかれたマウスにおいて心臓/体重比のいちじるしい上昇がみられた.これは右心室および左心室の両方で上昇しており,さらに,組織学的には右心壁および左心壁とも厚さが増加していた.心筋細胞の大きさを調べたところ右心壁の心筋細胞に肥大がみられ,これは,低酸素の環境により肺動脈の圧力が増加したためと思われた7).左心壁の心筋細胞はむしろ小さくなっており,これにより,心臓/体重比の上昇は心臓の肥大によるものではないことがわかった.くわえて,RNA-seq法により得られたデータも心臓の肥大にかかわる遺伝子の発現の低下を示した.心筋細胞を全心臓から単離し計数したところ低酸素の環境におかれたマウスの心筋細胞の数は約2倍に増加していた.これには,単核の心筋細胞の増加および2核の心筋細胞の低下があいともなっていた.また,心筋細胞の核へのBrdUの取り込みについて調べたところ,低酸素の環境におかれたマウスにおいて約8倍も増加しており,さらには,有糸分裂のマーカーであるpH3に陽性および細胞質分裂のマーカーであるAurora Bに陽性の心筋細胞が増加していた.さらに,RNA-seq法により心筋細胞における代謝や細胞周期にかかわる遺伝子の発現の上昇が確認された.低酸素の環境におかれたマウスにおいて細胞周期を維持する心筋細胞が約3.6倍も増加し,また,それらの細胞はpH3陽性を示した.これは,細胞周期を維持する心筋細胞が増殖していることを意味した.また,新規に増殖した心筋細胞はもともと増殖能をもっていた心筋細胞だけに由来するわけではないこともわかった.活性酸素の発生源である化合物ジクワットを低酸素の環境におかれたマウスに導入したところ,心筋細胞における活性酸素種によるDNAの損傷がいちじしく増大し,さらには,低酸素の環境において誘導される心筋細胞の増殖の活性がいちじるしく阻害された.これらのことにより,ミトコンドリアに由来する活性酸素種による酸化的なDNAの損傷が心筋細胞の増殖に深く影響していることがわかった.
極限の低酸素の環境における心筋細胞の増殖の誘導が心筋の損傷にどのように影響をおよぼすかについて調べた.左前下行枝冠動脈の結紮により心筋梗塞を誘導する心筋損傷モデルマウスを用い,吸入する酸素の濃度を1日に1%ずつ低下させ,酸素の濃度が7%に達したところでこれを2週間にわたり維持したのち,吸入する酸素の濃度を1日に2%ずつ上昇させ,通常の環境における酸素の濃度までもどした(図1).その結果,低酸素の環境におかれたマウスの心臓/体重比は上昇し,組織学的な解析により心筋の損傷が軽減していることがわかった.また,心エコー検査によっても心機能の回復がみられた.心筋細胞の大きさを測定したところ損傷した部位から離れた領域において小さくなっていた.さらに,BrdUの取り込みの上昇,pH3陽性およびAurora B陽性の心筋細胞が増加した.そして,これらにともない,毛細血管の拡張および冠側副血行の発達が観察された.長期的な効果をみるため,心筋損傷モデルマウスを同様に3週間にわたり低酸素の環境においたところ,2週間をこえたあたりから死亡率の上昇がみられたものの,生存したマウスには心機能の回復がみられた.
ヒトの定住の限界となる高度における酸素の濃度は10%であることから,中程度の低酸素の環境として10%の酸素の濃度とミトコンドリアに特異的な活性酸素の除去剤であるMitoTEMPOとを組み合わせた.その結果,酸素の濃度が7%の場合と同様にpH3陽性の心筋細胞が増加する傾向がみられ,統計的に有意ではなかったものの,中程度の低酸素の環境による治療に有効性のあることが示された.同様に,心筋損傷モデルマウスを用いたところ,酸素の濃度が10%では心機能の回復はみられなかった.
新規に増殖した心筋細胞の細胞系譜を酸素の濃度が7%の環境においたマウスにおいて2週間にわたり追跡したところ,心筋の損傷した部位と離れた領域においてほとんどの心筋細胞は低酸素の状態にある心筋細胞に由来した.また,低酸素の状態にある心筋細胞に由来しない心筋細胞は0.01%以下であった.これらのことにより,新規に増殖した心筋細胞は幹細胞や前駆細胞などからではなく,既存の心筋細胞に由来することが判明した.
長年にわたり,心筋細胞は細胞周期を永久に停止していると考えられてきた,しかし,近年の研究により,哺乳類の成体の心筋細胞はふたたび細胞周期に復帰できるという考えが支持されるようになってきた4,5,8-11).筆者らの研究により,環境の酸素がミトコンドリアに依存した酸化的なDNAの損傷をひき起こし哺乳類の新生仔や成体において心筋細胞の増殖を制御することが明らかにされた4).しかしながら,これら環境における酸素の濃度の低下が心筋細胞の増殖にどう影響をおよぼすのかはわかってなかった.つまり,酸素の濃度が高いことによるミトコンドリアにおけるエネルギーの変換効率の上昇と心筋細胞の再生能の喪失とのあいだに可逆性があるのかどうかはわかっていなかった.今回の低酸素の環境におかれたマウスの解析により,このトレードオフの関係にある程度の可逆性のあることが示された.
一般に,心臓における酸素の欠乏は心筋症のおもな起因になっており,心筋細胞の再生のため酸素の濃度を低下させるというのは直感的に相反するように思われる.しかしながら,今回の研究において,吸入する酸素の濃度を徐々に低下させることが成体の心筋細胞におけるミトコンドリアでの代謝や活性酸素の減少につながることが示された.これらはまた,心筋細胞の増殖を誘導するのに十分であり,心筋の損傷からの機能の回復をもたらした.さらに,これらの回復には毛細血管の拡張や冠側副血行の発達がともない,これらはおそらく,心筋の変性の抑制につながり心機能の改善をもたらしたものと思われた.今後の心筋症の治療において,低酸素療法が有効になるかもしれない.
略歴:2000年 大阪大学大学院理学研究科博士課程 修了,2001年 米国Texas大学Southwestern Medical Centerポスドクを経て,現 同 講師.
Hesham A. Sadek
米国Texas大学Southwestern Medical CenterにてAssociate Professor.
研究室URL:http://www.utsouthwestern.edu/labs/sadek/
© 2016 中田祐二・Hesham A. Sadek Licensed under CC 表示 2.1 日本
(米国Texas大学Southwestern Medical Center,Department of Internal Medicine)
email:中田祐二
DOI: 10.7875/first.author.2016.121
Hypoxia induces heart regeneration in adult mice.
Yuji Nakada, Diana C. Canseco, SuWannee Thet, Salim Abdisalaam, Aroumougame Asaithamby, Celio X Santos, Ajay Shah, Hua Zhang, James E. Faber, Michael T. Kinter, Luke I. Szweda, Chao Xing, Ralph Deberardinis, Orhan Oz, Zhigang Lu, Cheng Cheng Zhang, Wataru Kimura, Hesham A. Sadek
Nature, 541, 222-227 (2017)
要 約
哺乳類の成体において心筋細胞は増殖能を失っており,心筋細胞の欠損はただちに重篤な心筋症をひき起こす.近年,哺乳類の心臓は終末分化をとげたわけではないことがわかっており,たとえば,マウスの新生仔の心筋細胞は増殖能および再生能をもつ.また,これらの心筋細胞は既存の心筋細胞から増殖し,ミトコンドリアに由来する活性酸素種によるDNAの損傷により増殖が抑制される.筆者らは,低酸素の環境における呼吸の阻害が酸化的なDNAの損傷を軽減し,さらには,心筋細胞の増殖を誘導するのではないかと考え,成体のマウスを低酸素の環境においた.吸入する酸素の濃度を1日に1%ずつ段階的に低下させ,酸素の濃度が7%に達した時点でこの状態を2週間にわたり維持した.その結果,ミトコンドリアにおける代謝がいちじるしく阻害され,活性酸素種の発生の低下やDNAの損傷の軽減がみられ,さらには,心筋細胞が増殖した.心筋損傷モデルマウスにおいても心筋細胞の増殖がみられ,また,損傷した領域の線維化の軽減,毛細血管の拡張,冠側副血行の発達,さらには,心機能の改善までがみられた.これら新しく増殖した心筋細胞の細胞系譜を追跡したところ,新生仔と同様に,幹細胞などに由来するのではなく既存の心筋細胞から増殖していることがわかった.以上のことから,内在性の心筋細胞の再生能は低酸素の環境におかれることにより活性化されることがわかった.この研究により,低酸素療法が心筋症の治療に有効になる可能性が示された.
はじめに
ゼブラフィッシュなど一部の真骨魚類や有尾両生類,さらに,哺乳類の新生仔などは心臓のさまざまな損傷から既存の心筋細胞を介して新たな心筋細胞が増殖する1,2).一方で,哺乳類の成体は心筋細胞の増殖能を失っている.つまり,生後まもなく哺乳類の大多数の心筋細胞は細胞周期を停止し,哺乳類の成体の心筋細胞にとり細胞周期への復帰が心筋細胞の再生において重要である.また,ミトコンドリアに由来する活性酸素種は心筋細胞のおもな酸化的なストレス源であり3),2014年,筆者らは,マウスは子宮における低酸素の環境から生後の酸化的な環境にさらされるとミトコンドリアを介した酸化的なDNAの損傷により心筋細胞の細胞周期が停止することを報告した4)(新着論文レビュー でも掲載).さらには,筆者らの最近の研究により,増殖能をもつ心筋細胞は低酸素の環境に局在し活性酸素種によるDNAの損傷から守られていることがわかった5)(新着論文レビュー でも掲載).これらのことから,ミトコンドリアにおける酸素に依存的な代謝が心筋細胞の細胞周期の停止のおもな原因であることが示唆された.しかしながら,これまで,環境における酸素の濃度が心筋細胞の細胞周期の停止にどう影響をおよぼすかは不明であった.そこで,筆者らは,吸入する酸素の濃度を段階的に低下させることにより,低酸素の環境におけるミトコンドリアに由来する活性酸素種の軽減が酸化的なDNAの損傷を軽減し,ひいては,心筋細胞の増殖を誘導するのではないかと考えた.
1.極限の低酸素の環境におけるミトコンドリアでの代謝および酸化的なDNAの損傷の軽減
極限の低酸素の環境におけるマウスの心筋細胞のミトコンドリアでの代謝について調べるため低酸素チャンバーを用いた.低酸素ショックをさけるため,1日に1%ずつ吸入する酸素の濃度を低下させ,酸素の濃度が7%に達したところでこれを2週間にわたり維持した6)(図1).血中の酸素の濃度を測定したところ,低酸素の環境においたマウスは通常の環境のマウスより低い値を示した.Hif-1αのODDドメインとタモキシフェンに依存的に活性化するリコンビナーゼCreERT2との融合タンパク質を普遍的な遺伝子プロモーターであるCAGプロモーターの制御のもとで発現するトランスジェニックマウスと,Creに依存して蛍光タンパク質tdTomatoを不可逆的に発現するマウスとを交配したマウスを,低酸素の環境において2日間にわたり維持したところtdTomato陽性の心筋細胞の増加がみられ,これは低酸素の環境によるHif1αのODDドメインの安定化によるものと思われた5).ミトコンドリアの構造を電子顕微鏡により観察したところ低酸素の環境においたマウスでは心筋細胞のクリステの密度が低下しており,また,ミトコンドリアDNAのコピー数が減少していた.また,プロテオーム解析において,低酸素の環境においたマウスの心臓ではクエン酸回路や脂肪酸β酸化にかかわる酵素が顕著に減少していた.さらに,メタボローム解析でも同様に,クエン酸回路にかかわる代謝産物の減少がみられた.くわえて,電子伝達系の活性が低下し,活性酸素の測定においても活性酸素種や過酸化水素のいちじるしい低下がみられた.また,DNAの損傷が軽減していることもわかった.
心筋細胞の増殖について調べたところ,低酸素の環境におかれたマウスにおいて心臓/体重比のいちじるしい上昇がみられた.これは右心室および左心室の両方で上昇しており,さらに,組織学的には右心壁および左心壁とも厚さが増加していた.心筋細胞の大きさを調べたところ右心壁の心筋細胞に肥大がみられ,これは,低酸素の環境により肺動脈の圧力が増加したためと思われた7).左心壁の心筋細胞はむしろ小さくなっており,これにより,心臓/体重比の上昇は心臓の肥大によるものではないことがわかった.くわえて,RNA-seq法により得られたデータも心臓の肥大にかかわる遺伝子の発現の低下を示した.心筋細胞を全心臓から単離し計数したところ低酸素の環境におかれたマウスの心筋細胞の数は約2倍に増加していた.これには,単核の心筋細胞の増加および2核の心筋細胞の低下があいともなっていた.また,心筋細胞の核へのBrdUの取り込みについて調べたところ,低酸素の環境におかれたマウスにおいて約8倍も増加しており,さらには,有糸分裂のマーカーであるpH3に陽性および細胞質分裂のマーカーであるAurora Bに陽性の心筋細胞が増加していた.さらに,RNA-seq法により心筋細胞における代謝や細胞周期にかかわる遺伝子の発現の上昇が確認された.低酸素の環境におかれたマウスにおいて細胞周期を維持する心筋細胞が約3.6倍も増加し,また,それらの細胞はpH3陽性を示した.これは,細胞周期を維持する心筋細胞が増殖していることを意味した.また,新規に増殖した心筋細胞はもともと増殖能をもっていた心筋細胞だけに由来するわけではないこともわかった.活性酸素の発生源である化合物ジクワットを低酸素の環境におかれたマウスに導入したところ,心筋細胞における活性酸素種によるDNAの損傷がいちじしく増大し,さらには,低酸素の環境において誘導される心筋細胞の増殖の活性がいちじるしく阻害された.これらのことにより,ミトコンドリアに由来する活性酸素種による酸化的なDNAの損傷が心筋細胞の増殖に深く影響していることがわかった.
2.極限の低酸素の環境における心筋細胞の増殖および再生
極限の低酸素の環境における心筋細胞の増殖の誘導が心筋の損傷にどのように影響をおよぼすかについて調べた.左前下行枝冠動脈の結紮により心筋梗塞を誘導する心筋損傷モデルマウスを用い,吸入する酸素の濃度を1日に1%ずつ低下させ,酸素の濃度が7%に達したところでこれを2週間にわたり維持したのち,吸入する酸素の濃度を1日に2%ずつ上昇させ,通常の環境における酸素の濃度までもどした(図1).その結果,低酸素の環境におかれたマウスの心臓/体重比は上昇し,組織学的な解析により心筋の損傷が軽減していることがわかった.また,心エコー検査によっても心機能の回復がみられた.心筋細胞の大きさを測定したところ損傷した部位から離れた領域において小さくなっていた.さらに,BrdUの取り込みの上昇,pH3陽性およびAurora B陽性の心筋細胞が増加した.そして,これらにともない,毛細血管の拡張および冠側副血行の発達が観察された.長期的な効果をみるため,心筋損傷モデルマウスを同様に3週間にわたり低酸素の環境においたところ,2週間をこえたあたりから死亡率の上昇がみられたものの,生存したマウスには心機能の回復がみられた.
3.中程度の低酸素の環境による心筋細胞の増殖および再生の可能性
ヒトの定住の限界となる高度における酸素の濃度は10%であることから,中程度の低酸素の環境として10%の酸素の濃度とミトコンドリアに特異的な活性酸素の除去剤であるMitoTEMPOとを組み合わせた.その結果,酸素の濃度が7%の場合と同様にpH3陽性の心筋細胞が増加する傾向がみられ,統計的に有意ではなかったものの,中程度の低酸素の環境による治療に有効性のあることが示された.同様に,心筋損傷モデルマウスを用いたところ,酸素の濃度が10%では心機能の回復はみられなかった.
4.新規に増殖した心筋細胞の細胞系譜の追跡
新規に増殖した心筋細胞の細胞系譜を酸素の濃度が7%の環境においたマウスにおいて2週間にわたり追跡したところ,心筋の損傷した部位と離れた領域においてほとんどの心筋細胞は低酸素の状態にある心筋細胞に由来した.また,低酸素の状態にある心筋細胞に由来しない心筋細胞は0.01%以下であった.これらのことにより,新規に増殖した心筋細胞は幹細胞や前駆細胞などからではなく,既存の心筋細胞に由来することが判明した.
おわりに
長年にわたり,心筋細胞は細胞周期を永久に停止していると考えられてきた,しかし,近年の研究により,哺乳類の成体の心筋細胞はふたたび細胞周期に復帰できるという考えが支持されるようになってきた4,5,8-11).筆者らの研究により,環境の酸素がミトコンドリアに依存した酸化的なDNAの損傷をひき起こし哺乳類の新生仔や成体において心筋細胞の増殖を制御することが明らかにされた4).しかしながら,これら環境における酸素の濃度の低下が心筋細胞の増殖にどう影響をおよぼすのかはわかってなかった.つまり,酸素の濃度が高いことによるミトコンドリアにおけるエネルギーの変換効率の上昇と心筋細胞の再生能の喪失とのあいだに可逆性があるのかどうかはわかっていなかった.今回の低酸素の環境におかれたマウスの解析により,このトレードオフの関係にある程度の可逆性のあることが示された.
一般に,心臓における酸素の欠乏は心筋症のおもな起因になっており,心筋細胞の再生のため酸素の濃度を低下させるというのは直感的に相反するように思われる.しかしながら,今回の研究において,吸入する酸素の濃度を徐々に低下させることが成体の心筋細胞におけるミトコンドリアでの代謝や活性酸素の減少につながることが示された.これらはまた,心筋細胞の増殖を誘導するのに十分であり,心筋の損傷からの機能の回復をもたらした.さらに,これらの回復には毛細血管の拡張や冠側副血行の発達がともない,これらはおそらく,心筋の変性の抑制につながり心機能の改善をもたらしたものと思われた.今後の心筋症の治療において,低酸素療法が有効になるかもしれない.
文 献
- Poss, K. D., Wilson, L. G. & Keating, M. T.: Heart regeneration in zebrafish. Science, 298, 2188-2190 (2002)[PubMed]
- Jopling, C., Sleep, E., Raya, M. et al.: Zebrafish heart regeneration occurs by cardiomyocyte dedifferentiation and proliferation. Nature, 464, 606-609 (2010)[PubMed]
- Adam-Vizi, V. & Chinopoulos, C.: Bioenergetics and the formation of mitochondrial reactive oxygen species. Trends Pharmacol. Sci., 27, 639-645 (2006)[PubMed]
- Puente, B. N. Kimura, W., Muralidhar, S. A. et al.: The oxygen-rich postnatal environment induces cardiomyocyte cell-cycle arrest through DNA damage response. Cell, 157, 565-579 (2014)[PubMed] [新着論文レビュー]
- Kimura, W., Xiao, F., Canseco, D. C. et al.: Hypoxia fate mapping identifies cycling cardiomyocytes in the adult heart. Nature, 523, 226-230 (2015)[PubMed] [新着論文レビュー]
- Roach, R. C. & Hackett, P. H.: Frontiers of hypoxia research: acute mountain sickness. J. Exp. Biol., 204, 3161-3170 (2001)[PubMed]
- Kobs, R. W., Muvarak, N. E., Eickhoff, J. C. et al.: Linked mechanical and biological aspects of remodeling in mouse pulmonary arteries with hypoxia-induced hypertension. Am. J. Physiol. Heart Circ. Physiol., 288, H1209-H1217 (2005)[PubMed]
- Bergmann, O., Bhardwaj, R. D., Bernard, S. et al.: Evidence for cardiomyocyte renewal in humans. Science, 324, 98-102 (2009)[PubMed]
- Porrello, E. R., Mahmoud, A. I., Simpson, E. et al.: Transient regenerative potential of the neonatal mouse heart. Science, 331, 1078-1080 (2011)[PubMed]
- Senyo, S. E., Steinhauser, M. L., Pizzimenti, C. L. et al.: Mammalian heart renewal by pre-existing cardiomyocytes. Nature, 493, 433-436 (2013)[PubMed]
- Bergmann, O., Zdunek, S., Felker, A. et al.: Dynamics of cell generation and turnover in the human heart. Cell, 161, 1566-1575 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2000年 大阪大学大学院理学研究科博士課程 修了,2001年 米国Texas大学Southwestern Medical Centerポスドクを経て,現 同 講師.
Hesham A. Sadek
米国Texas大学Southwestern Medical CenterにてAssociate Professor.
研究室URL:http://www.utsouthwestern.edu/labs/sadek/
© 2016 中田祐二・Hesham A. Sadek Licensed under CC 表示 2.1 日本