バリンの欠乏により体内の造血幹細胞が減少し放射線を照射することなく骨髄移植が可能になる
田矢祐規・山崎 聡
(東京大学医科学研究所 附属幹細胞治療研究センター幹細胞治療分野)
email:田矢祐規,山崎 聡
DOI: 10.7875/first.author.2016.119
Depleting dietary valine permits nonmyeloablative mouse hematopoietic stem cell transplantation.
Yuki Taya, Yasunori Ota, Adam C. Wilkinson, Ayano Kanazawa, Hiroshi Watarai, Masataka Kasai, Hiromitsu Nakauchi, Satoshi Yamazaki
Science, 354, 1152-1155 (2016)
造血幹細胞は骨髄の微小環境において未分化性を維持している.筆者らは,骨髄におけるアミノ酸の濃度は不均一であることを見い出し,おのおののアミノ酸と造血幹細胞の機能との関係について解析した.その結果,バリンを含まない培養液において造血幹細胞はすみやかに未分化性を消失した.マウスをバリンを含まない飼料で長期間にわたり飼育したところ体内の造血幹細胞は減少し,さらに,放射線を照射することなく造血幹細胞の移植が成立した.これらの知見から,アミノ酸の制御が新しい造血幹細胞の移植法となりうる可能性が示唆された.
造血幹細胞は自己複製能および多分化能をもち,骨髄ニッチとよばれる骨髄の特別な微小環境におもに休眠状態で存在し,ときおり対称性あるいは非対称性の細胞分裂をくり返すことにより生涯にわたり血球細胞を供給すると考えられている.この約10年間,骨髄ニッチを構成する細胞および造血幹細胞を支持する因子などにつき多く報告されたが1),骨髄の微小環境を形成する因子および造血幹細胞の恒常性を維持する機構については不明な点が多く,とくに,アミノ酸と造血幹細胞との関係についての報告は非常に少ない.生体に約20種類あるアミノ酸は恒常性の維持のためもっとも重要な因子のひとつであり,細胞種により必須のアミノ酸や分泌するアミノ酸の異なることが知られている.1946年,ラットに低タンパク質の食事をあたえることにより顆粒球の著明な減少と貧血が生じ,精製したアミノ酸を投与することによりそれらの表現型は改善することが報告された2).この知見から,造血をアミノ酸により制御する可能性が示唆された.また,造血幹細胞の移植においては骨髄ニッチの“空き”を確保することがその生着に必要である3).臨床において,骨髄ニッチを空けるための移植の前処置として放射線の照射や大量の抗がん剤の投与が行われているが,前処置による急性期の臓器障害のため移植治療の適応となる患者の数はかぎられてしまう.とくに,若年者においては2次性の発がん,成長の障害,内分泌の障害など晩期の障害も問題になっている4).そこで,アミノ酸が造血環境や造血幹細胞におよぼす影響について解析し,骨髄における造血幹細胞の維持の機構について解明することをめざした.さらに,従来の前処置に代わる新しい移植法としての応用につき検討した.
血液細胞は骨髄に存在する造血幹細胞から分化し成熟して末梢血に供給される.造血幹細胞の存在する骨髄と成熟した細胞の存在する末梢血においてアミノ酸の環境は異なるのかどうかを調べるため,骨髄液および血清に含まれる遊離のアミノ酸の濃度を測定した.その結果,血清と比較して骨髄に含まれる遊離のアミノ酸の量は100倍以上も多く,また,アミノ酸の割合も異なっており,骨髄と末梢血とでまったく異なる,骨髄に特有のアミノ酸の環境が存在することが明らかにされた.造血幹細胞に必須のアミノ酸について調べるため,マウスの造血幹細胞が高濃度に存在する画分を幹細胞因子およびトロンボポエチンの存在のもと1種類のアミノ酸を除いた無血清培養液で1週間にわたり培養した5).その結果,システインあるいはバリンを含まない培養液において造血幹細胞の増殖は有意に阻害された.造血前駆細胞の画分に対し同様に解析したところ,システインあるいはリジンを含まない培養液において増殖は抑制されたが,バリンを含まない培養液において増殖は強く抑制されなかった.培養した造血幹細胞を競合する細胞とともに致死量の放射線を照射したマウスへ移植し長期的なドナーキメリズムを評価したところ,やはり,システインあるいはバリンを含まない培養液で培養した造血幹細胞は生着しなかった.
造血幹前駆細胞を培養し活性酸素種の活性を測定したところ,システインを含まない培養液において活性は著明に上昇したが,バリンを含まない培養液においては上昇しなかった.また,抗酸化物質であるn-アセチルシステインの添加によりシステインを含まない培養液において造血幹細胞の増殖は抑制されなくなったが,バリンを含まない培養液においては抑制されたままだった.システインは抗酸化物質のひとつであるグルタチオンを生体において合成する際の材料であり,システインの不足によりひき起こされる細胞における活性酸素種の蓄積がn-アセチルシステインの添加によりふせがれた可能性が考えられた.さらに,バリンを含まない培養液で培養した造血幹細胞においてオートファジーの活性を測定したが,通常の培養液で培養した造血幹細胞と変わらなかった.さらに詳細な代謝経路の解析には13C代謝フラックスやメタボロームを解析する必要があるが,いちどに採取できる造血幹細胞の数に限界があり困難であった.
生体においてシステインあるいはバリンの欠乏が造血におよぼす影響について調べるため,バリンを含まない飼料,シスチンを含まない飼料,通常の飼料を用意した.おのおのの飼料で4週間にわたり飼育したマウスの末梢血における白血球あるいは赤血球の数は,バリンを含まない飼料で飼育したマウスでのみ有意に低下したが,血小板の数は低下しなかった.シスチン(システイン)はマウスにとり非必須アミノ酸であり体内で合成され代償されたと考え,以後は,バリンを含まない飼料に焦点をあてた結果,in vitroと同様に,骨髄における造血幹細胞の画分6) が著明に低下していた.ところが,この画分の細胞周期を解析したところ,G0期の細胞は対照と変わらなかった.そのほかの血液細胞については,骨髄のB220陽性B細胞,骨髄球性共通前駆細胞,リンパ球性共通前駆細胞が減少していたが,CD3陽性T細胞,顆粒球-マクロファージ前駆細胞,巨核球-赤芽球前駆細胞に差はなかった.これらのことから,バリンの欠乏は造血幹細胞において特異的に作用するとともに,多くの異なる血球細胞の分化の段階に対しても効果を示すと考えられた.また,in vivoにおいてバリンの欠乏の影響が造血幹細胞に高い特異性のあることを示す根拠のひとつとして,バリンを含まない飼料で飼育したマウスにおいて血小板の数は減少しないことがあげられた.つまり,骨髄において自己複製能をもつ巨核球系に限定した前駆細胞の画分はバリンを含まない飼料で飼育したマウスにおいても維持されており,血小板の数は保たれたと考えられた.
バリンを含まない飼料で飼育したマウスのすべての臓器および組織について病理組織学的に解析した.骨髄には細胞数の低下および細胞密度の減少が認められ,脾臓は重量が減少し白脾髄の萎縮とそれにともなう相対的な赤脾髄の拡大が認められた.胸腺も著明に萎縮し皮髄境界が不明瞭になっていた.それ以外の臓器には致死的な異常な所見は認められなかった.また,バリンを含まない飼料から通常の飼料へともどすと体重の減少はすみやかに回復し,萎縮していた胸腺および脾臓ももとの大きさにもどった.しかし,バリンを含まない飼料で長期間にわたり飼育したのち通常の飼料にもどした際には,数日でリフィーディング症候群様の肺水腫をきたし死亡するマウスもあった7).
バリンの欠乏した環境における造血幹細胞の機能について調べるため,バリンを含まない飼料で飼育したマウスおよび通常の飼料で飼育したマウスの骨髄を用いて競合的に骨髄を再構築し,移植ののちのドナーキメリズムを評価した.その結果,移植ののち1~2カ月まではドナーキメリズムは低下しなかったが,バリンを含まない飼料で飼育したマウスにおいては移植から3カ月目にドナーキメリズムは著明に低下した.以上のことから,バリンが欠乏することにより,移植ののち1~2カ月の血球細胞の供給を担う造血前駆細胞の数より,長期の再構築能をもつ造血幹細胞の数が減少することが示された.
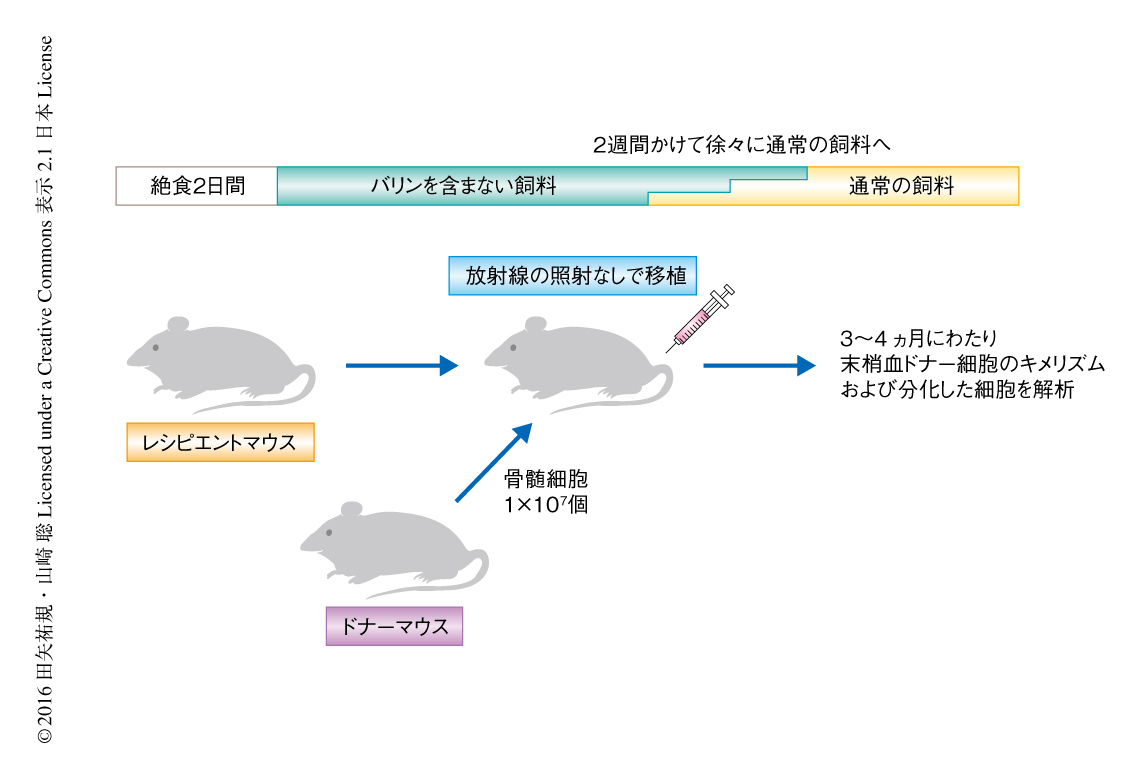
これまでの結果から,造血幹細胞の移植の前処置として,バリンを含まない飼料で飼育することにより骨髄ニッチを空けることができるのではないかと考えた.免疫不全マウスをバリンを含まない飼料で2週間にわたり飼育したのち造血幹細胞を移植し,同時に通常の飼料にもどして経時的に解析した.すると,レシピエントマウスの胸腺は大きくなり,脾臓においては赤脾髄および白脾髄が認められ,リンパ球の再構成が確認された.さらに,バリンを含まない飼料で3週間にわたり飼育したのち造血幹細胞を移植し,リフィーディング症候群を予防するため2週間かけて徐々に通常の飼料にもどした(図1).対照となるマウスにおいて造血幹細胞はまったく生着しなかったが,バリンを含まない飼料で飼育したほとんどすべてのマウスにおいては3カ月以上にわたり末梢血に骨髄球系,T細胞系,B細胞系の3系統が出現し,2次移植においてもドナーの細胞は維持された.また,バリンを含まない飼料で飼育したマウスは生殖の機能が保たれており,発育の障害も認められず長期にわたり生存した.
ヒトの造血細胞も同様にアミノ酸の要求性が異なるのかどうか調べるため,骨髄の造血幹前駆細胞の画分を1種類のアミノ酸を含まない無血清培養液において1週間にわたり培養した8).その結果,バリンを含まない培養液にくわえ,ロイシンを含まない培養液においても細胞の増殖は抑制された.ヒトの骨髄細胞をNOGマウスに移植して末梢血のほぼ100%をヒトの細胞と置換したヒト化マウスを作製し,バリンを含まない飼料,ロイシンを含まない飼料,通常の飼料で飼育してヒトの造血細胞に対する影響について調べた.その結果,バリンを含まない飼料で飼育したマウスにおいて造血幹前駆細胞が減少した.このことから,バリンはヒトの細胞においてもマウスと同様に造血の維持に欠くことのできないアミノ酸であることが示唆された.
骨髄において造血幹細胞の機能を維持するためにはアミノ酸の濃度を適切に制御する必要がある.グリア細胞は近傍のニューロンの恒常性を維持するため数種類のアミノ酸を分泌するという報告があることから9),骨髄の微小環境においても造血幹細胞に対しアミノ酸を供給する細胞が存在するのではないかと考え,骨髄ニッチを構成する細胞がアミノ酸を分泌するかどうか解析した.これまで,骨髄ニッチを構成する細胞として報告のある,血管内皮細胞,間葉系間質細胞,ニューロン,骨芽細胞をアミノ酸を含まない培養液において3日間にわたり培養したのち,上清のアミノ酸の濃度を測定した.その結果,すべての細胞が数種類のアミノ酸を分泌しており,とくに,血管内皮細胞および間葉系間質細胞がバリンを分泌していた.
今回の研究において,造血にアミノ酸のバランスが非常に重要であることが示された.しかし,なぜ造血幹細胞においてバリンのみが重要であるかは依然として不明であり,今後の骨髄ニッチの機能および造血についてのさらなる研究が待たれる.また,造血幹細胞と骨髄ニッチとの相互作用と同様の概念が白血病幹細胞においても提唱されている.これまでに,マウスの白血病細胞株をバリンを含まない培養液で培養するとカスパーゼ3の活性化を介してアポトーシスが誘導されるという報告10),間葉系間質細胞がシスチンの代謝を制御することにより慢性リンパ性白血病細胞においてグルタチオンを増加させ生存および薬剤耐性に寄与するという報告がある11).もし,バリンの欠乏した環境が造血幹細胞と同様に白血病細胞など悪性腫瘍においても効果を示すのであれば,アミノ酸の制御は移植の前処置やがんの分野においても新しい治療法となるかもしれない.
略歴:2016年 東京大学大学院医学系研究科 修了,同年より虎の門病院分院血液内科 医員.
抱負:研究生活で培ったスキルや考え方を活かして,安全な造血細胞の移植法を開発したい.
山崎 聡(Satoshi Yamazaki)
東京大学医科学研究所 特任准教授.
© 2016 田矢祐規・山崎 聡 Licensed under CC 表示 2.1 日本
(東京大学医科学研究所 附属幹細胞治療研究センター幹細胞治療分野)
email:田矢祐規,山崎 聡
DOI: 10.7875/first.author.2016.119
Depleting dietary valine permits nonmyeloablative mouse hematopoietic stem cell transplantation.
Yuki Taya, Yasunori Ota, Adam C. Wilkinson, Ayano Kanazawa, Hiroshi Watarai, Masataka Kasai, Hiromitsu Nakauchi, Satoshi Yamazaki
Science, 354, 1152-1155 (2016)
要 約
造血幹細胞は骨髄の微小環境において未分化性を維持している.筆者らは,骨髄におけるアミノ酸の濃度は不均一であることを見い出し,おのおののアミノ酸と造血幹細胞の機能との関係について解析した.その結果,バリンを含まない培養液において造血幹細胞はすみやかに未分化性を消失した.マウスをバリンを含まない飼料で長期間にわたり飼育したところ体内の造血幹細胞は減少し,さらに,放射線を照射することなく造血幹細胞の移植が成立した.これらの知見から,アミノ酸の制御が新しい造血幹細胞の移植法となりうる可能性が示唆された.
はじめに
造血幹細胞は自己複製能および多分化能をもち,骨髄ニッチとよばれる骨髄の特別な微小環境におもに休眠状態で存在し,ときおり対称性あるいは非対称性の細胞分裂をくり返すことにより生涯にわたり血球細胞を供給すると考えられている.この約10年間,骨髄ニッチを構成する細胞および造血幹細胞を支持する因子などにつき多く報告されたが1),骨髄の微小環境を形成する因子および造血幹細胞の恒常性を維持する機構については不明な点が多く,とくに,アミノ酸と造血幹細胞との関係についての報告は非常に少ない.生体に約20種類あるアミノ酸は恒常性の維持のためもっとも重要な因子のひとつであり,細胞種により必須のアミノ酸や分泌するアミノ酸の異なることが知られている.1946年,ラットに低タンパク質の食事をあたえることにより顆粒球の著明な減少と貧血が生じ,精製したアミノ酸を投与することによりそれらの表現型は改善することが報告された2).この知見から,造血をアミノ酸により制御する可能性が示唆された.また,造血幹細胞の移植においては骨髄ニッチの“空き”を確保することがその生着に必要である3).臨床において,骨髄ニッチを空けるための移植の前処置として放射線の照射や大量の抗がん剤の投与が行われているが,前処置による急性期の臓器障害のため移植治療の適応となる患者の数はかぎられてしまう.とくに,若年者においては2次性の発がん,成長の障害,内分泌の障害など晩期の障害も問題になっている4).そこで,アミノ酸が造血環境や造血幹細胞におよぼす影響について解析し,骨髄における造血幹細胞の維持の機構について解明することをめざした.さらに,従来の前処置に代わる新しい移植法としての応用につき検討した.
1.in vitroにおける造血幹細胞の維持にシステインおよびバリンは必須のアミノ酸である
血液細胞は骨髄に存在する造血幹細胞から分化し成熟して末梢血に供給される.造血幹細胞の存在する骨髄と成熟した細胞の存在する末梢血においてアミノ酸の環境は異なるのかどうかを調べるため,骨髄液および血清に含まれる遊離のアミノ酸の濃度を測定した.その結果,血清と比較して骨髄に含まれる遊離のアミノ酸の量は100倍以上も多く,また,アミノ酸の割合も異なっており,骨髄と末梢血とでまったく異なる,骨髄に特有のアミノ酸の環境が存在することが明らかにされた.造血幹細胞に必須のアミノ酸について調べるため,マウスの造血幹細胞が高濃度に存在する画分を幹細胞因子およびトロンボポエチンの存在のもと1種類のアミノ酸を除いた無血清培養液で1週間にわたり培養した5).その結果,システインあるいはバリンを含まない培養液において造血幹細胞の増殖は有意に阻害された.造血前駆細胞の画分に対し同様に解析したところ,システインあるいはリジンを含まない培養液において増殖は抑制されたが,バリンを含まない培養液において増殖は強く抑制されなかった.培養した造血幹細胞を競合する細胞とともに致死量の放射線を照射したマウスへ移植し長期的なドナーキメリズムを評価したところ,やはり,システインあるいはバリンを含まない培養液で培養した造血幹細胞は生着しなかった.
造血幹前駆細胞を培養し活性酸素種の活性を測定したところ,システインを含まない培養液において活性は著明に上昇したが,バリンを含まない培養液においては上昇しなかった.また,抗酸化物質であるn-アセチルシステインの添加によりシステインを含まない培養液において造血幹細胞の増殖は抑制されなくなったが,バリンを含まない培養液においては抑制されたままだった.システインは抗酸化物質のひとつであるグルタチオンを生体において合成する際の材料であり,システインの不足によりひき起こされる細胞における活性酸素種の蓄積がn-アセチルシステインの添加によりふせがれた可能性が考えられた.さらに,バリンを含まない培養液で培養した造血幹細胞においてオートファジーの活性を測定したが,通常の培養液で培養した造血幹細胞と変わらなかった.さらに詳細な代謝経路の解析には13C代謝フラックスやメタボロームを解析する必要があるが,いちどに採取できる造血幹細胞の数に限界があり困難であった.
2.in vivoにおいてバリンを欠乏させることにより造血能は低下する
生体においてシステインあるいはバリンの欠乏が造血におよぼす影響について調べるため,バリンを含まない飼料,シスチンを含まない飼料,通常の飼料を用意した.おのおのの飼料で4週間にわたり飼育したマウスの末梢血における白血球あるいは赤血球の数は,バリンを含まない飼料で飼育したマウスでのみ有意に低下したが,血小板の数は低下しなかった.シスチン(システイン)はマウスにとり非必須アミノ酸であり体内で合成され代償されたと考え,以後は,バリンを含まない飼料に焦点をあてた結果,in vitroと同様に,骨髄における造血幹細胞の画分6) が著明に低下していた.ところが,この画分の細胞周期を解析したところ,G0期の細胞は対照と変わらなかった.そのほかの血液細胞については,骨髄のB220陽性B細胞,骨髄球性共通前駆細胞,リンパ球性共通前駆細胞が減少していたが,CD3陽性T細胞,顆粒球-マクロファージ前駆細胞,巨核球-赤芽球前駆細胞に差はなかった.これらのことから,バリンの欠乏は造血幹細胞において特異的に作用するとともに,多くの異なる血球細胞の分化の段階に対しても効果を示すと考えられた.また,in vivoにおいてバリンの欠乏の影響が造血幹細胞に高い特異性のあることを示す根拠のひとつとして,バリンを含まない飼料で飼育したマウスにおいて血小板の数は減少しないことがあげられた.つまり,骨髄において自己複製能をもつ巨核球系に限定した前駆細胞の画分はバリンを含まない飼料で飼育したマウスにおいても維持されており,血小板の数は保たれたと考えられた.
バリンを含まない飼料で飼育したマウスのすべての臓器および組織について病理組織学的に解析した.骨髄には細胞数の低下および細胞密度の減少が認められ,脾臓は重量が減少し白脾髄の萎縮とそれにともなう相対的な赤脾髄の拡大が認められた.胸腺も著明に萎縮し皮髄境界が不明瞭になっていた.それ以外の臓器には致死的な異常な所見は認められなかった.また,バリンを含まない飼料から通常の飼料へともどすと体重の減少はすみやかに回復し,萎縮していた胸腺および脾臓ももとの大きさにもどった.しかし,バリンを含まない飼料で長期間にわたり飼育したのち通常の飼料にもどした際には,数日でリフィーディング症候群様の肺水腫をきたし死亡するマウスもあった7).
バリンの欠乏した環境における造血幹細胞の機能について調べるため,バリンを含まない飼料で飼育したマウスおよび通常の飼料で飼育したマウスの骨髄を用いて競合的に骨髄を再構築し,移植ののちのドナーキメリズムを評価した.その結果,移植ののち1~2カ月まではドナーキメリズムは低下しなかったが,バリンを含まない飼料で飼育したマウスにおいては移植から3カ月目にドナーキメリズムは著明に低下した.以上のことから,バリンが欠乏することにより,移植ののち1~2カ月の血球細胞の供給を担う造血前駆細胞の数より,長期の再構築能をもつ造血幹細胞の数が減少することが示された.
3.バリンを含まない食事による前処置のみでマウスの造血幹細胞の移植は成立する
これまでの結果から,造血幹細胞の移植の前処置として,バリンを含まない飼料で飼育することにより骨髄ニッチを空けることができるのではないかと考えた.免疫不全マウスをバリンを含まない飼料で2週間にわたり飼育したのち造血幹細胞を移植し,同時に通常の飼料にもどして経時的に解析した.すると,レシピエントマウスの胸腺は大きくなり,脾臓においては赤脾髄および白脾髄が認められ,リンパ球の再構成が確認された.さらに,バリンを含まない飼料で3週間にわたり飼育したのち造血幹細胞を移植し,リフィーディング症候群を予防するため2週間かけて徐々に通常の飼料にもどした(図1).対照となるマウスにおいて造血幹細胞はまったく生着しなかったが,バリンを含まない飼料で飼育したほとんどすべてのマウスにおいては3カ月以上にわたり末梢血に骨髄球系,T細胞系,B細胞系の3系統が出現し,2次移植においてもドナーの細胞は維持された.また,バリンを含まない飼料で飼育したマウスは生殖の機能が保たれており,発育の障害も認められず長期にわたり生存した.
4.ヒトの造血幹前駆細胞もアミノ酸の欠乏に感受性がある
ヒトの造血細胞も同様にアミノ酸の要求性が異なるのかどうか調べるため,骨髄の造血幹前駆細胞の画分を1種類のアミノ酸を含まない無血清培養液において1週間にわたり培養した8).その結果,バリンを含まない培養液にくわえ,ロイシンを含まない培養液においても細胞の増殖は抑制された.ヒトの骨髄細胞をNOGマウスに移植して末梢血のほぼ100%をヒトの細胞と置換したヒト化マウスを作製し,バリンを含まない飼料,ロイシンを含まない飼料,通常の飼料で飼育してヒトの造血細胞に対する影響について調べた.その結果,バリンを含まない飼料で飼育したマウスにおいて造血幹前駆細胞が減少した.このことから,バリンはヒトの細胞においてもマウスと同様に造血の維持に欠くことのできないアミノ酸であることが示唆された.
5.骨髄ニッチを構成する細胞はバリンを供給する
骨髄において造血幹細胞の機能を維持するためにはアミノ酸の濃度を適切に制御する必要がある.グリア細胞は近傍のニューロンの恒常性を維持するため数種類のアミノ酸を分泌するという報告があることから9),骨髄の微小環境においても造血幹細胞に対しアミノ酸を供給する細胞が存在するのではないかと考え,骨髄ニッチを構成する細胞がアミノ酸を分泌するかどうか解析した.これまで,骨髄ニッチを構成する細胞として報告のある,血管内皮細胞,間葉系間質細胞,ニューロン,骨芽細胞をアミノ酸を含まない培養液において3日間にわたり培養したのち,上清のアミノ酸の濃度を測定した.その結果,すべての細胞が数種類のアミノ酸を分泌しており,とくに,血管内皮細胞および間葉系間質細胞がバリンを分泌していた.
おわりに
今回の研究において,造血にアミノ酸のバランスが非常に重要であることが示された.しかし,なぜ造血幹細胞においてバリンのみが重要であるかは依然として不明であり,今後の骨髄ニッチの機能および造血についてのさらなる研究が待たれる.また,造血幹細胞と骨髄ニッチとの相互作用と同様の概念が白血病幹細胞においても提唱されている.これまでに,マウスの白血病細胞株をバリンを含まない培養液で培養するとカスパーゼ3の活性化を介してアポトーシスが誘導されるという報告10),間葉系間質細胞がシスチンの代謝を制御することにより慢性リンパ性白血病細胞においてグルタチオンを増加させ生存および薬剤耐性に寄与するという報告がある11).もし,バリンの欠乏した環境が造血幹細胞と同様に白血病細胞など悪性腫瘍においても効果を示すのであれば,アミノ酸の制御は移植の前処置やがんの分野においても新しい治療法となるかもしれない.
文 献
- Ding, L. & Morrison, S. J.: Haematopoietic stem cells and early lymphoid progenitors occupy distinct bone marrow niches. Nature, 495, 231-235 (2013)[PubMed]
- Kornberg, A., Daft, F. S. & Sebrell, W. H.: Granulocytopenia and anemia in rats fed diets of low case in content. Science, 103, 646-648 (1946)[PubMed]
- Czechowicz, A., Kraft, D., Weissman, I. L. et al.: Efficient transplantation via antibody-based clearance of hematopoietic stem cell niches. Science, 318, 1296-1299 (2007)[PubMed]
- Gyurkocza, B. & Sandmaier, B. M.: Conditioning regimens for hematopoietic cell transplantation: one size does not fit all. Blood, 124, 344-353 (2014)[PubMed]
- Ema, H., Morita, Y., Yamazaki, S. et al.: Adult mouse hematopoietic stem cells: purification and single-cell assays. Nat Protoc., 1, 2979-2987 (2006)[PubMed]
- Kiel, M. J., Yilmaz, O. H., Iwashita, T. et al.: SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell, 121, 1109-1121 (2005)[PubMed]
- Mehanna, H. M., Moledina, J. & Travis, J.: Refeeding syndrome: what it is, and how to prevent and treat it. BMJ, 336, 1495-1498 (2008)[PubMed]
- Larochelle, A., Vormoor, J., Hanenberg, H. et al.: Identification of primitive human hematopoietic cells capable of repopulating NOD/SCID mouse bone marrow: implications for gene therapy. Nat. Med., 2, 1329-1337 (1996)[PubMed]
- Furuya, S., Tabata, T., Mitoma, J. et al.: L-serine and glycine serve as major astroglia-derived trophic factors for cerebellar Purkinje neurons. Proc. Natl. Acad. Sci. USA, 97, 11528-11533 (2000)[PubMed]
- Ohtawa, K., Ueno, T., Mitsui, K. et al.: Apoptosis of leukemia cells induced by valine-deficient medium. Leukemia, 12, 1651-1652 (1998)[PubMed]
- Zhang, W., Trachootham, D., Liu, J. et al.: Stromal control of cystine metabolism promotes cancer cell survival in chronic lymphocytic leukaemia. Nat. Cell Biol., 14, 276-286 (2012)[PubMed]
著者プロフィール
略歴:2016年 東京大学大学院医学系研究科 修了,同年より虎の門病院分院血液内科 医員.
抱負:研究生活で培ったスキルや考え方を活かして,安全な造血細胞の移植法を開発したい.
山崎 聡(Satoshi Yamazaki)
東京大学医科学研究所 特任准教授.
© 2016 田矢祐規・山崎 聡 Licensed under CC 表示 2.1 日本