高速原子間力顕微鏡による歩行運動中のミオシンVのビデオイメージング
古寺哲幸・安藤敏夫
(金沢大学理工研究域 数物科学系生物物理学研究室)
email:古寺哲幸,安藤敏夫
DOI: 10.7875/first.author.2010.051
Video imaging of walking myosin V by high-speed atomic force microscopy.
Noriyuki Kodera, Daisuke Yamamoto, Ryoki Ishikawa, Toshio Ando
Nature, 468, 72-76 (2010)
タンパク質の機能するメカニズムを包括的に理解するには機能中のタンパク質の“構造”と“動き”とを同時に観察することがもっとも単純明快な方法であるが,そのような技術はこれまで存在しなかった.筆者らは,そのような技術となるべく開発した高速原子間力顕微鏡を用いて,ミオシンVがアクチンフィラメントにそって歩くようすを直接に可視化した.その結果,これまでに予想もしくは実証されていたふるまいに確固たる視覚的な証拠があたえられただけでなく,ミオシンVの詳細な運動機構の理解を導く新規な情報が提供された.高速原子間力顕微鏡による観察は生体分子の機能するメカニズムを解明するための新しい強力な研究手法である.
タンパク質は時々刻々とその構造形態を変化させその機能を発現している.現在,タンパク質の動的なふるまいを理解するのに1分子蛍光顕微鏡が広く利用されている.しかしながら,それで観察できるのはタンパク質の局所につけられた蛍光色素からの蛍光輝点であって,タンパク質分子そのものは見ることができない.一方,タンパク質の構造は電子顕微鏡,X線結晶構造解析,NMRなどによって研究されているが,それらの手法で得られるのは基本的に静止構造である.機能している最中のタンパク質の“構造”と“動き”とを同時に観察することができれば,タンパク質の機能メカニズムの理解は格段に進むだろうが,これまでそのような技術は存在しなかった.そこで,そのような技術を実現すべく,筆者らは,高い空間分解能と時間分解能とをあわせもつ原子間力顕微鏡(atomic force microscopy:AFM)を開発してきた1,2).近年の大幅な改良によって,いくつかのタンパク質系において高速原子間力顕微鏡の有用性が実証されている3-5).
この研究では,高速原子間力顕微鏡を歩行運動中のミオシンVの観察に適用した.ミオシンVは細胞において物質輸送を担うモータータンパク質で,2本の等価な脚状の構造をもっている.それぞれの脚はモーター部位と長いネック部位から構成されている.これまで,蛍光顕微鏡などによりミオシンVの運動は集中的に研究され,アクチンフィラメントにそって滑るようにそこから離れないプロセッシブ運動をすること6,7),2本の脚を交互に振り出しながら前進運動するハンドオーバーハンド様式により約36 nmのステップ運動をすること8,9),1回のステップ運動は1つのATPの加水分解により駆動されていること10),が実証された.しかし,歩行運動中のミオシンVのふるまいや前進運動を駆動する張力の発生機構などの詳細は不明だった.
この研究では,新たに脂質二重層膜を用いたin vitroアッセイ系を開発した.このアッセイ系は目的の分子だけを選択的に基板に固定できるため(タンパク質や蛍光分子などの基板への非特異的な吸着が抑えられる),蛍光顕微鏡観察を含めたさまざまな1分子実験にも有用である5).今回のアッセイ系では,マイカ表面にビオチン化脂質を含んだ脂質二重層膜を張り,その表面にビオチン化したアクチンフィラメントをストレプトアビジンを介し固定した.そこにミオシンV(カーゴ結合部位を除去したミオシンV重メロミオシン)をくわえ,高速原子間力顕微鏡による観察を行った.
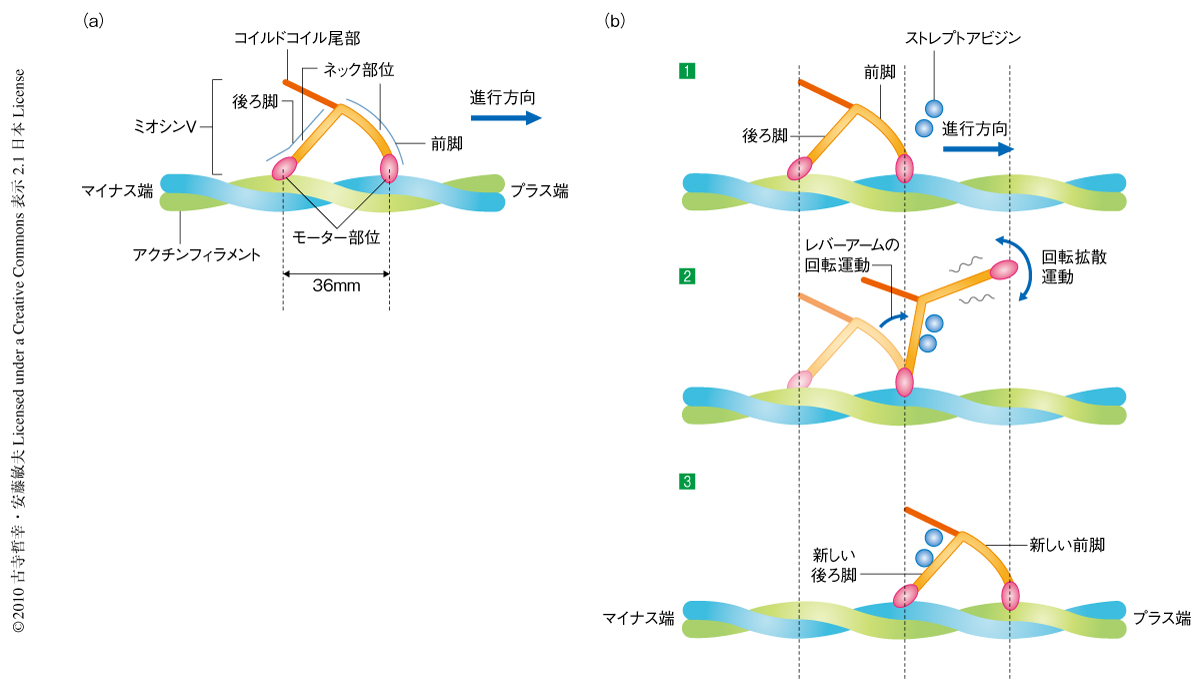
ATP存在下でミオシンVが約36 nmのステップで一方向にプロセッシブ運動するようすを観察することができた.撮影は146.7 ms/フレーム(毎秒7フレーム)の速度で行った.動画は Nature誌のホームページ あるいは 筆者らの研究室のホームページ で見ることができる.ミオシンVがアクチンフィラメントで静止している場合には2本の脚を“ハの字”のような格好に開き,約36 nmへだててアクチンフィラメントに結合していた(図1).また,コイルドコイル尾部は進行方向とは反対側(後方)に傾いて揺れていた.これらの構造的な特徴は電子顕微鏡観察の結果と一致し11,12),そのほかのヌクレオチド条件下でも共通していた.この特徴を利用して,運動を行わないような溶液条件であってもミオシンVの前脚と後ろ脚とを識別できた.また,ミオシンVの運動速度はこれまで蛍光顕微鏡で計測された結果とほぼ同じであった.したがって,試料と観察基板との相互作用,あるいは,試料と原子間力顕微鏡の探針との相互作用は無視できる弱さであるといえた.この速度測定の結果から,後ろ脚でのATP結合やADP解離の速度定数を見積もることができた.
このように約36 nmステップの前進運動は可視化されたが,ステップ運動の途中のミオシンVのふるまいは速すぎて用いた撮影速度では可視化できなかった.そこで,前進運動をおだやかに阻害するため脂質二重層膜上のストレプトアビジンの数を増やしたところ,この運動過程を可視化することができた(図1).後ろ脚がアクチンフィラメントから離れると,前脚が後方に傾いた状態から前方に傾いた状態へと回転した.このふるまいは,筋肉のミオシンの運動を説明するために提唱されていたレバーアームのスイングそのものであった13).離れた後ろ脚は進行方向に移動した股(両脚の付け根)のまわりで回転拡散し,そののち,アクチンフィラメントの前方の結合部位に結合し1歩の運動を完了した.こうして,詳細な一連の過程を含んだハンドオーバーハンド運動8,9) の視覚的な証拠が得られた.
高濃度のADPの存在下でも,ミオシンVは低濃度のATPの存在下と同じようにアクチンフィラメントに両脚で結合した.このような両脚結合状態において,ミオシンVのコイルドコイル部が解けミオシンVが単量体化する現象がときどき観察された.この現象の直後,後方に傾いていた単量体化した前脚は回転し前方に傾いた.この結果は,ミオシンVがアクチンフィラメントに両脚で結合しているときに分子内張力を蓄えており,この張力でコイルドコイルが解けて分子内張力が開放されると前脚は回転運動することを示していた.このことからミオシンVの運動機構についてつぎの結論が導かれた.1)ADPを結合したミオシンVの前脚のモーターとネックとの連結部は十分にフレキシブルで,ATPaseサイクルでのADP-Pi結合状態をへなくても前脚はアクチンフィラメントに強く結合できること,2)このようにしてできた両脚結合状態において後方に傾いた前脚は張力を発生していること,3)この前脚に蓄えられた張力は後ろ脚がアクチンフィラメントから離れることによって開放され,その結果,前脚の前方への回転が起こること,4)したがって,この回転は自発的に起こり化学遷移をともなっていないこと.
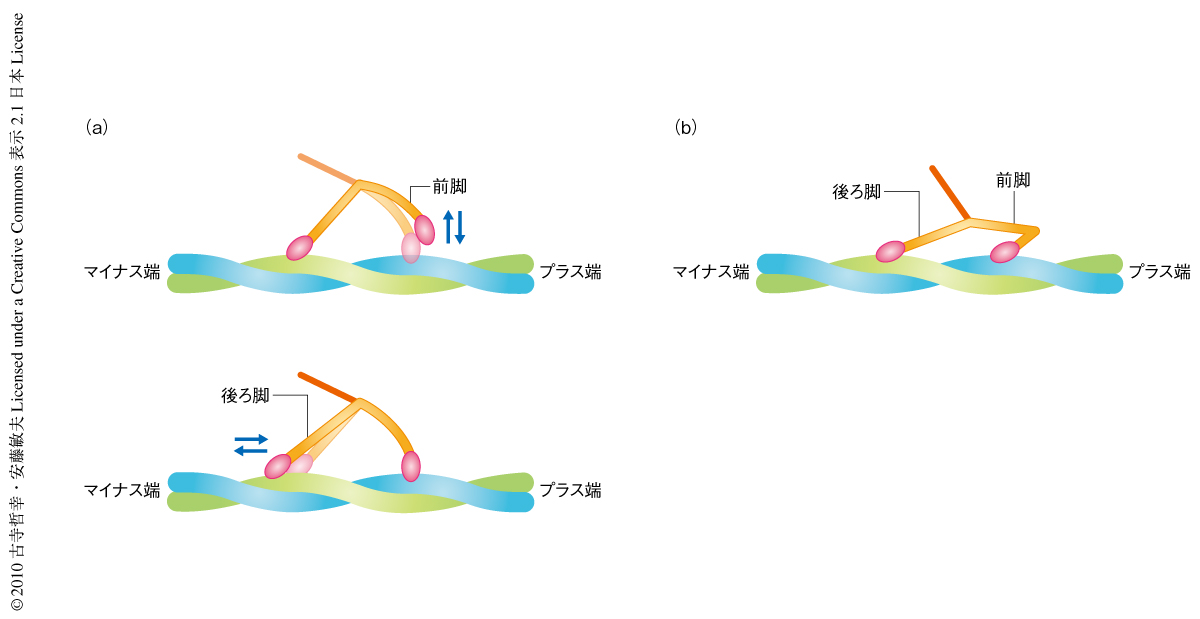
アクトミオシンのATPaseサイクルにおいて,後方傾斜した構造(強結合状態)はADP-Pi結合状態にあるモーター部位がアクチンとの相互作用によりPiを放出したあとでのみ形成され,張力の発生はPiの放出に共役しているものと一般に考えられている.それゆえ,ADP結合状態にあるモーター部位がアクチンフィラメントに直接に結合して形成された後方傾斜の強結合状態では前方回転はできないと考えられた.しかし,前方回転が可能であることを示すミオシンVのふるまいが観察された.すなわち,ミオシンVが両脚でアクチンフィラメントに結合しているとき,短時間,どちらかの脚が同じアクチンフィラメントで解離・再結合をするふるまいである.足踏みするかのようにふたたびもとの位置に,もしくは,±5 nmへだてた隣りのアクチンサブユニットに再結合するふるまいであるため,これをFoot stomp運動とよぶことにした(図2).Foot stomp運動は前脚でより多く観察された(前脚と後ろ脚での頻度の比は約3:1).ADP-Pi結合状態のモーター部位がアクチンと結合すると瞬時にPiが開放されるので14),Foot stomp運動を起こす直前の前脚はADP結合状態にある.それにもかかわらず,ADP結合状態の前脚が後方傾斜してアクチンフィラメントに再結合し,後ろ脚がアクチンフィラメントから解離すると前脚は前方に回転した.Foot stomp運動は蛍光顕微鏡観察でも示唆されていたため15)(どちらの脚で起こっているかは観察できていないが),本来,ミオシンVに備わった分子内張力(前進運動の駆動力)を発生するためのふるまいと考えられた.このような分子内張力の発生機構はミオシンVが負荷をうけているときに積極的に利用されている可能性がある.のちに述べるが,Foot stomp運動はADP存在下やヌクレオチド非存在下の条件でも観察された.
ヌクレオチド非存在下においても,ミオシンVはアクチンフィラメントに両脚で結合することができた.しかし,ATP存在下やADP存在下とは違い,前脚のネック部位はしばしば屈曲構造をとり(図2),また,屈曲構造とほぼまっすぐな構造(ストレート構造)とのあいだを行き来するようすが観察された.2つの構造は平衡状態にあるものと考えられた.この屈曲構造は最近,電子顕微鏡によって報告されていたが,そこでは化学状態は決定されていない12).前脚が屈曲構造をとっているときは両脚のネック部位はモーター部位の前方から突き出ているようにみえた.このことは,両脚がほぼ等価な構造形態にあることを示唆していた.のちに述べるように,この屈曲構造は前方運動のための力発生には関係しないが,前脚の形態をみれば前脚がADP結合状態にあるかどうかを判断することができた.
ミオシンVが両脚結合しているときに前脚がストレート構造をとっている時間の割合は,ヌクレオチド非存在下では36%,1 mM ADP存在下では97%であった.この結果は,片脚(単頭)のミオシンVがアクチンフィラメントと結合したときになす角度を各条件で解析したとき,ヌクレオチド非存在下では30度付近を中心に狭い角度分布をもつのに対し,1 mM ADP存在下では30度付近を中心に広い角度分布をもつという結果と矛盾しなかった.このことは,モーター部位がADP結合状態にあるとモーターとネックとの連結部がフレキシブルになることを意味している.ヌクレオチド非存在下ではこの連結部は硬いため,アクチンフィラメントに両脚で結合しているときに後方に傾いた前脚は強すぎる分子内張力を開放するため屈曲構造をとりやすいものと考えられた.
1μMや0.1μMといった低濃度ATP条件下でさえも前脚はほとんどストレート構造にあった.このことは,後ろ脚にATPが結合してアクチンフィラメントから離れるまでのあいだ前脚はADP結合状態にあることを示唆し,これまでの報告と矛盾しなかった10).ミオシンVが両脚結合しているあいだ前脚がストレート構造をとっている割合と寿命とをADP濃度の関数として測定し,その解析から前脚からのADP解離速度定数を見積もることができた.その値は,前脚からのADPの解離は平均で10秒の時間を要することを示した.10秒間にミオシンVは何歩も歩くので,ADPの解離,ATPの結合,アクチンフィラメントからの解離という一連の現象は後ろ脚でのみ起こっていることになった.この考え方はミオシンVの一方向性運動を説明する統一見解となっているが,この研究において構造的にも確認することができた.以上の結果より,ヌクレオチド非存在下で観察された前脚の屈曲構造は前進運動とは無関係であるという結論も得られた.
ATP存在下のみならず,Foot stomp運動は実験を行ったすべてのADP濃度下やヌクレオチド非存在下で観察され,前脚での頻度が高かった.しかしながら,前脚が屈曲構造をとったときには前脚と後ろ脚での頻度の差は小さくなった.このことは,前脚でのFoot stomp運動の発生頻度は前脚の構造形態に依存していることを示していた.本来,アクチンフィラメントに結合したどちらの脚も前方傾斜の構造をとりたいのだが,前脚は無理矢理に後方傾斜構造をとらされているためアクチンフィラメントから解離しやすく,これがヌクレオチドを結合した前脚がFoot stomp運動を起こしやすい理由になっているものと考えられた.このことは,前脚がアクチンからの触媒効果をうけにくいことと関係しているため,両脚のあいだのATPase反応キネティクスの非対称性にいくらか寄与しているのかもしれない.
筆者らは,歩行運動中のミオシンVを高速原子間力顕微鏡により観察することによって,推測されていたあるいは既知のふるまいに確固とした視覚的な証拠をあたえただけでなく,これまでまったく認識されていなかったふるまいをも映像のなかに見い出すことができた.これまでの手法と異なり,高速原子間力顕微鏡は機能中の生体分子の“構造”と“動き”の情報を同時に提供することができるため,生体分子の機能メカニズムの解明にきわめて有効である.高速原子間力顕微鏡が構造生物学や1分子生物学を革新するものと期待される.
略歴:2005年 金沢大学大学院自然科学研究科博士課程 修了,同年 日本学術振興会 特別研究員,2007年 科学技術振興機構CREST博士研究員を経て,2010年より金沢大学理工研究域 助教.
研究テーマ:高速原子間力顕微鏡の開発と生体分子のナノ動態の観察.
抱負:液中ナノメートルの世界を動画で撮影できる高速原子間力顕微鏡を用いて,生体分子が機能するメカニズムをどんどん解明していきたい.
安藤 敏夫(Ando Toshio)
略歴:1980年 早稲田大学大学院理工学研究科博士課程 修了,同年 米国California大学San Francisco校 博士研究員,1983年 同 助手,1986年 金沢大学理学部 講師を経て,1996年より金沢大学理工研究域 教授.
研究テーマ:モータータンパク質,高速原子間力顕微鏡の開発とバイオ応用の研究.
抱負:生命科学研究を革新する装置を開発し,それを自らの研究に活かすとともに世界に普及させたい.
研究室URL:http://www.s.kanazawa-u.ac.jp/phys/biophys/index.htm
© 2010 古寺哲幸・安藤敏夫 Licensed under CC 表示 2.1 日本
(金沢大学理工研究域 数物科学系生物物理学研究室)
email:古寺哲幸,安藤敏夫
DOI: 10.7875/first.author.2010.051
Video imaging of walking myosin V by high-speed atomic force microscopy.
Noriyuki Kodera, Daisuke Yamamoto, Ryoki Ishikawa, Toshio Ando
Nature, 468, 72-76 (2010)
要 約
タンパク質の機能するメカニズムを包括的に理解するには機能中のタンパク質の“構造”と“動き”とを同時に観察することがもっとも単純明快な方法であるが,そのような技術はこれまで存在しなかった.筆者らは,そのような技術となるべく開発した高速原子間力顕微鏡を用いて,ミオシンVがアクチンフィラメントにそって歩くようすを直接に可視化した.その結果,これまでに予想もしくは実証されていたふるまいに確固たる視覚的な証拠があたえられただけでなく,ミオシンVの詳細な運動機構の理解を導く新規な情報が提供された.高速原子間力顕微鏡による観察は生体分子の機能するメカニズムを解明するための新しい強力な研究手法である.
はじめに
タンパク質は時々刻々とその構造形態を変化させその機能を発現している.現在,タンパク質の動的なふるまいを理解するのに1分子蛍光顕微鏡が広く利用されている.しかしながら,それで観察できるのはタンパク質の局所につけられた蛍光色素からの蛍光輝点であって,タンパク質分子そのものは見ることができない.一方,タンパク質の構造は電子顕微鏡,X線結晶構造解析,NMRなどによって研究されているが,それらの手法で得られるのは基本的に静止構造である.機能している最中のタンパク質の“構造”と“動き”とを同時に観察することができれば,タンパク質の機能メカニズムの理解は格段に進むだろうが,これまでそのような技術は存在しなかった.そこで,そのような技術を実現すべく,筆者らは,高い空間分解能と時間分解能とをあわせもつ原子間力顕微鏡(atomic force microscopy:AFM)を開発してきた1,2).近年の大幅な改良によって,いくつかのタンパク質系において高速原子間力顕微鏡の有用性が実証されている3-5).
この研究では,高速原子間力顕微鏡を歩行運動中のミオシンVの観察に適用した.ミオシンVは細胞において物質輸送を担うモータータンパク質で,2本の等価な脚状の構造をもっている.それぞれの脚はモーター部位と長いネック部位から構成されている.これまで,蛍光顕微鏡などによりミオシンVの運動は集中的に研究され,アクチンフィラメントにそって滑るようにそこから離れないプロセッシブ運動をすること6,7),2本の脚を交互に振り出しながら前進運動するハンドオーバーハンド様式により約36 nmのステップ運動をすること8,9),1回のステップ運動は1つのATPの加水分解により駆動されていること10),が実証された.しかし,歩行運動中のミオシンVのふるまいや前進運動を駆動する張力の発生機構などの詳細は不明だった.
1.一方向プロセッシブ運動
この研究では,新たに脂質二重層膜を用いたin vitroアッセイ系を開発した.このアッセイ系は目的の分子だけを選択的に基板に固定できるため(タンパク質や蛍光分子などの基板への非特異的な吸着が抑えられる),蛍光顕微鏡観察を含めたさまざまな1分子実験にも有用である5).今回のアッセイ系では,マイカ表面にビオチン化脂質を含んだ脂質二重層膜を張り,その表面にビオチン化したアクチンフィラメントをストレプトアビジンを介し固定した.そこにミオシンV(カーゴ結合部位を除去したミオシンV重メロミオシン)をくわえ,高速原子間力顕微鏡による観察を行った.
ATP存在下でミオシンVが約36 nmのステップで一方向にプロセッシブ運動するようすを観察することができた.撮影は146.7 ms/フレーム(毎秒7フレーム)の速度で行った.動画は Nature誌のホームページ あるいは 筆者らの研究室のホームページ で見ることができる.ミオシンVがアクチンフィラメントで静止している場合には2本の脚を“ハの字”のような格好に開き,約36 nmへだててアクチンフィラメントに結合していた(図1).また,コイルドコイル尾部は進行方向とは反対側(後方)に傾いて揺れていた.これらの構造的な特徴は電子顕微鏡観察の結果と一致し11,12),そのほかのヌクレオチド条件下でも共通していた.この特徴を利用して,運動を行わないような溶液条件であってもミオシンVの前脚と後ろ脚とを識別できた.また,ミオシンVの運動速度はこれまで蛍光顕微鏡で計測された結果とほぼ同じであった.したがって,試料と観察基板との相互作用,あるいは,試料と原子間力顕微鏡の探針との相互作用は無視できる弱さであるといえた.この速度測定の結果から,後ろ脚でのATP結合やADP解離の速度定数を見積もることができた.
2.ハンドオーバーハンド運動
このように約36 nmステップの前進運動は可視化されたが,ステップ運動の途中のミオシンVのふるまいは速すぎて用いた撮影速度では可視化できなかった.そこで,前進運動をおだやかに阻害するため脂質二重層膜上のストレプトアビジンの数を増やしたところ,この運動過程を可視化することができた(図1).後ろ脚がアクチンフィラメントから離れると,前脚が後方に傾いた状態から前方に傾いた状態へと回転した.このふるまいは,筋肉のミオシンの運動を説明するために提唱されていたレバーアームのスイングそのものであった13).離れた後ろ脚は進行方向に移動した股(両脚の付け根)のまわりで回転拡散し,そののち,アクチンフィラメントの前方の結合部位に結合し1歩の運動を完了した.こうして,詳細な一連の過程を含んだハンドオーバーハンド運動8,9) の視覚的な証拠が得られた.
3.分子内張力の存在
高濃度のADPの存在下でも,ミオシンVは低濃度のATPの存在下と同じようにアクチンフィラメントに両脚で結合した.このような両脚結合状態において,ミオシンVのコイルドコイル部が解けミオシンVが単量体化する現象がときどき観察された.この現象の直後,後方に傾いていた単量体化した前脚は回転し前方に傾いた.この結果は,ミオシンVがアクチンフィラメントに両脚で結合しているときに分子内張力を蓄えており,この張力でコイルドコイルが解けて分子内張力が開放されると前脚は回転運動することを示していた.このことからミオシンVの運動機構についてつぎの結論が導かれた.1)ADPを結合したミオシンVの前脚のモーターとネックとの連結部は十分にフレキシブルで,ATPaseサイクルでのADP-Pi結合状態をへなくても前脚はアクチンフィラメントに強く結合できること,2)このようにしてできた両脚結合状態において後方に傾いた前脚は張力を発生していること,3)この前脚に蓄えられた張力は後ろ脚がアクチンフィラメントから離れることによって開放され,その結果,前脚の前方への回転が起こること,4)したがって,この回転は自発的に起こり化学遷移をともなっていないこと.
4.ATP存在下でのFoot stomp運動
アクトミオシンのATPaseサイクルにおいて,後方傾斜した構造(強結合状態)はADP-Pi結合状態にあるモーター部位がアクチンとの相互作用によりPiを放出したあとでのみ形成され,張力の発生はPiの放出に共役しているものと一般に考えられている.それゆえ,ADP結合状態にあるモーター部位がアクチンフィラメントに直接に結合して形成された後方傾斜の強結合状態では前方回転はできないと考えられた.しかし,前方回転が可能であることを示すミオシンVのふるまいが観察された.すなわち,ミオシンVが両脚でアクチンフィラメントに結合しているとき,短時間,どちらかの脚が同じアクチンフィラメントで解離・再結合をするふるまいである.足踏みするかのようにふたたびもとの位置に,もしくは,±5 nmへだてた隣りのアクチンサブユニットに再結合するふるまいであるため,これをFoot stomp運動とよぶことにした(図2).Foot stomp運動は前脚でより多く観察された(前脚と後ろ脚での頻度の比は約3:1).ADP-Pi結合状態のモーター部位がアクチンと結合すると瞬時にPiが開放されるので14),Foot stomp運動を起こす直前の前脚はADP結合状態にある.それにもかかわらず,ADP結合状態の前脚が後方傾斜してアクチンフィラメントに再結合し,後ろ脚がアクチンフィラメントから解離すると前脚は前方に回転した.Foot stomp運動は蛍光顕微鏡観察でも示唆されていたため15)(どちらの脚で起こっているかは観察できていないが),本来,ミオシンVに備わった分子内張力(前進運動の駆動力)を発生するためのふるまいと考えられた.このような分子内張力の発生機構はミオシンVが負荷をうけているときに積極的に利用されている可能性がある.のちに述べるが,Foot stomp運動はADP存在下やヌクレオチド非存在下の条件でも観察された.
5.前脚の構造形態変化
ヌクレオチド非存在下においても,ミオシンVはアクチンフィラメントに両脚で結合することができた.しかし,ATP存在下やADP存在下とは違い,前脚のネック部位はしばしば屈曲構造をとり(図2),また,屈曲構造とほぼまっすぐな構造(ストレート構造)とのあいだを行き来するようすが観察された.2つの構造は平衡状態にあるものと考えられた.この屈曲構造は最近,電子顕微鏡によって報告されていたが,そこでは化学状態は決定されていない12).前脚が屈曲構造をとっているときは両脚のネック部位はモーター部位の前方から突き出ているようにみえた.このことは,両脚がほぼ等価な構造形態にあることを示唆していた.のちに述べるように,この屈曲構造は前方運動のための力発生には関係しないが,前脚の形態をみれば前脚がADP結合状態にあるかどうかを判断することができた.
ミオシンVが両脚結合しているときに前脚がストレート構造をとっている時間の割合は,ヌクレオチド非存在下では36%,1 mM ADP存在下では97%であった.この結果は,片脚(単頭)のミオシンVがアクチンフィラメントと結合したときになす角度を各条件で解析したとき,ヌクレオチド非存在下では30度付近を中心に狭い角度分布をもつのに対し,1 mM ADP存在下では30度付近を中心に広い角度分布をもつという結果と矛盾しなかった.このことは,モーター部位がADP結合状態にあるとモーターとネックとの連結部がフレキシブルになることを意味している.ヌクレオチド非存在下ではこの連結部は硬いため,アクチンフィラメントに両脚で結合しているときに後方に傾いた前脚は強すぎる分子内張力を開放するため屈曲構造をとりやすいものと考えられた.
6.前脚からのADPの解離
1μMや0.1μMといった低濃度ATP条件下でさえも前脚はほとんどストレート構造にあった.このことは,後ろ脚にATPが結合してアクチンフィラメントから離れるまでのあいだ前脚はADP結合状態にあることを示唆し,これまでの報告と矛盾しなかった10).ミオシンVが両脚結合しているあいだ前脚がストレート構造をとっている割合と寿命とをADP濃度の関数として測定し,その解析から前脚からのADP解離速度定数を見積もることができた.その値は,前脚からのADPの解離は平均で10秒の時間を要することを示した.10秒間にミオシンVは何歩も歩くので,ADPの解離,ATPの結合,アクチンフィラメントからの解離という一連の現象は後ろ脚でのみ起こっていることになった.この考え方はミオシンVの一方向性運動を説明する統一見解となっているが,この研究において構造的にも確認することができた.以上の結果より,ヌクレオチド非存在下で観察された前脚の屈曲構造は前進運動とは無関係であるという結論も得られた.
7.ADP存在下やヌクレオチド非存在下でのFoot stomp運動
ATP存在下のみならず,Foot stomp運動は実験を行ったすべてのADP濃度下やヌクレオチド非存在下で観察され,前脚での頻度が高かった.しかしながら,前脚が屈曲構造をとったときには前脚と後ろ脚での頻度の差は小さくなった.このことは,前脚でのFoot stomp運動の発生頻度は前脚の構造形態に依存していることを示していた.本来,アクチンフィラメントに結合したどちらの脚も前方傾斜の構造をとりたいのだが,前脚は無理矢理に後方傾斜構造をとらされているためアクチンフィラメントから解離しやすく,これがヌクレオチドを結合した前脚がFoot stomp運動を起こしやすい理由になっているものと考えられた.このことは,前脚がアクチンからの触媒効果をうけにくいことと関係しているため,両脚のあいだのATPase反応キネティクスの非対称性にいくらか寄与しているのかもしれない.
おわりに
筆者らは,歩行運動中のミオシンVを高速原子間力顕微鏡により観察することによって,推測されていたあるいは既知のふるまいに確固とした視覚的な証拠をあたえただけでなく,これまでまったく認識されていなかったふるまいをも映像のなかに見い出すことができた.これまでの手法と異なり,高速原子間力顕微鏡は機能中の生体分子の“構造”と“動き”の情報を同時に提供することができるため,生体分子の機能メカニズムの解明にきわめて有効である.高速原子間力顕微鏡が構造生物学や1分子生物学を革新するものと期待される.
文 献
- Ando, T., Uchihashi, T. & Fukuma, T.: High-speed atomic force microscopy for nano-visualization of dynamic biomolecular processes. Prog. Surf. Sci., 83, 337-437 (2008)
- Ando, T., Kodera, N., Takai, E. et al.: High-speed atomic force microscopy for studying biological macromolecules. Proc. Natl. Acad. Sci. USA, 98, 12468-12472 (2001)[PubMed]
- Shibata, M., Yamashita, H., Uchihashi, T. et al.: High-speed atomic force microscopy shows dynamic molecular processes in photoactivated bacteriorhodopsin. Nat. Nanotechnol., 5, 208-212 (2010)[PubMed]
- Yamashita, H., Voitcohovsky, K., Uchihashi, T. et al.: Dynamics of bacteriorhodopsin 2D crystal observed by high-speed atomic force microscopy. J. Struct. Biol., 167, 153-158 (2009)[PubMed]
- Yamamoto, D., Uchihashi, T., Kodera, N. et al.: Anisotropic diffusion of point defects in a two-dimensional crystal of streptavidin observed by high-speed atomic force microscopy. Nanotechnology, 19, 384009 (2008)
- Mehta, A. D., Rock, R. S., Rief, M. et al.: Myosin-V is a processive actin-based motor. Nature, 400, 590-593 (1999)[PubMed]
- Sakamoto, T., Amitani, I., Yokota, E. et al.: Direct observation of processive movement by individual myosin V molecules. Biochem. Biophys. Res. Commun., 272, 586-590 (2000)[PubMed]
- Yildiz, A., Forkey, J. N., McKinney, S. A. et al.: Myosin V walks hand-over-hand: single fluorophore imaging with 1.5-nm localization. Science, 300, 2061-2065 (2003)[PubMed]
- Forkey, J. N., Quinlan, M. E., Shaw, M. A. et al.: Three-dimensional structural dynamics of myosin V by single-molecule fluorescence polarization. Nature, 422, 399-404 (2003)[PubMed]
- Sakamoto, T., Webb, M. R., Forgacs, E. et al.: Direct observation of the mechanochemical coupling in myosin Va during processive movement. Nature, 455, 128-132 (2008)[PubMed]
- Walker, M. L., Burgess, S. A., Sellers, J. R. et al.: Two-headed binding of a processive myosin to F-actin. Nature, 405, 804-807 (2000)[PubMed]
- Oke, O. A., Burgess, S. A., Forgacs, E. et al.: Influence of lever structure on myosin 5a walking. Proc. Natl. Acad. Sci. USA, 107, 2509-2514 (2010)[PubMed]
- Huxley, H. E.: The mechanism of muscular contraction. Science, 164, 1356-1365 (1969)[PubMed]
- De La Cruz, E. M., Wells, A. L., Rosenfeld, S. S. et al.: The kinetic mechanism of myosin V. Proc. Natl. Acad. Sci. USA, 96, 13726-13731 (1999)[PubMed]
- Syed, S., Snyder, G. E., Franzini-Armstrong, C. et al.: Adaptability of myosin V studied by simultaneous detection of position and orientation. EMBO J., 25, 1795-1803 (2006)[PubMed]
著者プロフィール
略歴:2005年 金沢大学大学院自然科学研究科博士課程 修了,同年 日本学術振興会 特別研究員,2007年 科学技術振興機構CREST博士研究員を経て,2010年より金沢大学理工研究域 助教.
研究テーマ:高速原子間力顕微鏡の開発と生体分子のナノ動態の観察.
抱負:液中ナノメートルの世界を動画で撮影できる高速原子間力顕微鏡を用いて,生体分子が機能するメカニズムをどんどん解明していきたい.
安藤 敏夫(Ando Toshio)
略歴:1980年 早稲田大学大学院理工学研究科博士課程 修了,同年 米国California大学San Francisco校 博士研究員,1983年 同 助手,1986年 金沢大学理学部 講師を経て,1996年より金沢大学理工研究域 教授.
研究テーマ:モータータンパク質,高速原子間力顕微鏡の開発とバイオ応用の研究.
抱負:生命科学研究を革新する装置を開発し,それを自らの研究に活かすとともに世界に普及させたい.
研究室URL:http://www.s.kanazawa-u.ac.jp/phys/biophys/index.htm
© 2010 古寺哲幸・安藤敏夫 Licensed under CC 表示 2.1 日本