胸腺での正の選択におけるCD8陽性T細胞の分化の制御機構
木村 元子
(米国NIH National Cancer Institute,Experimental Immunology Branch)
email:木村元子
DOI: 10.7875/first.author.2016.104
Timing and duration of MHC I positive selection signals are adjusted in the thymus to prevent lineage errors.
Motoko Y. Kimura, Julien Thomas, Xuguang Tai, Terry I. Guinter, Miho Shinzawa, Ruth Etzensperger, Zhenhu Li, Paul Love, Toshinori Nakayama, Alfred Singer
Nature Immunology, 17, 1415-1423 (2016)
MHCクラスI拘束性の正の選択によるCD8陽性T細胞への分化は2つのフェーズからなる.フェーズ1はT細胞受容体シグナルによる正の選択の開始に始まる過程であり,フェーズ2はサイトカインシグナルに依存的なRunx3dの発現の誘導によるCD8陽性T細胞への分化の決定の過程である.この2つのフェーズに必要な時間を調べたところ,自己抗原+MHC-I複合体にアフィニティの強いT細胞受容体をもつ細胞は長いフェーズ1と短いフェーズ2により分化をとげたのに対し,自己抗原+MHC-I複合体にアフィニティの弱いT細胞受容体をもつ細胞は短いフェーズ1と長いフェーズ2をへて分化をとげた.つまり,フェーズ1とフェーズ2の進行に必要なシグナルは逆相関しており,その結果,MHCクラスI拘束性の正の選択はほぼ一定の時間で完了した.フェーズ1とフェーズ2は互いに制御しあうことにより,CD8陽性T細胞への運命決定および分化を効率的かつエラーが生じないよう制御することが明らかにされた.
CD4陽性T細胞およびCD8陽性T細胞は,胸腺において共通の未成熟なCD4陽性CD8陽性のDP細胞から分化する.すなわち,MHCクラスI拘束性のT細胞受容体をもつDP細胞はCD8陽性T細胞へ,MHCクラスII拘束性のT細胞受容体をもつDP細胞はCD4陽性T細胞へと分化する.CD8陽性T細胞への分化の過程においては,正の選択によりもたらされる“T細胞受容体シグナル”と,CD8陽性T細胞への運命決定に重要なRunx3dの発現に重要なインターロイキン7などによる“サイトカインシグナル”が必要である1).しかし,T細胞受容体シグナルおよびサイトカインシグナルはそれぞれどのように制御されるのか,T細胞受容体シグナルおよびサイトカインシグナルの実際のシグナルの長さ,CD8陽性T細胞への分化をとげるのに必要な時間,MHCクラスI拘束性の正の選択において運命決定のエラーがかぎりなく少ない理由,はわかっていなかった.
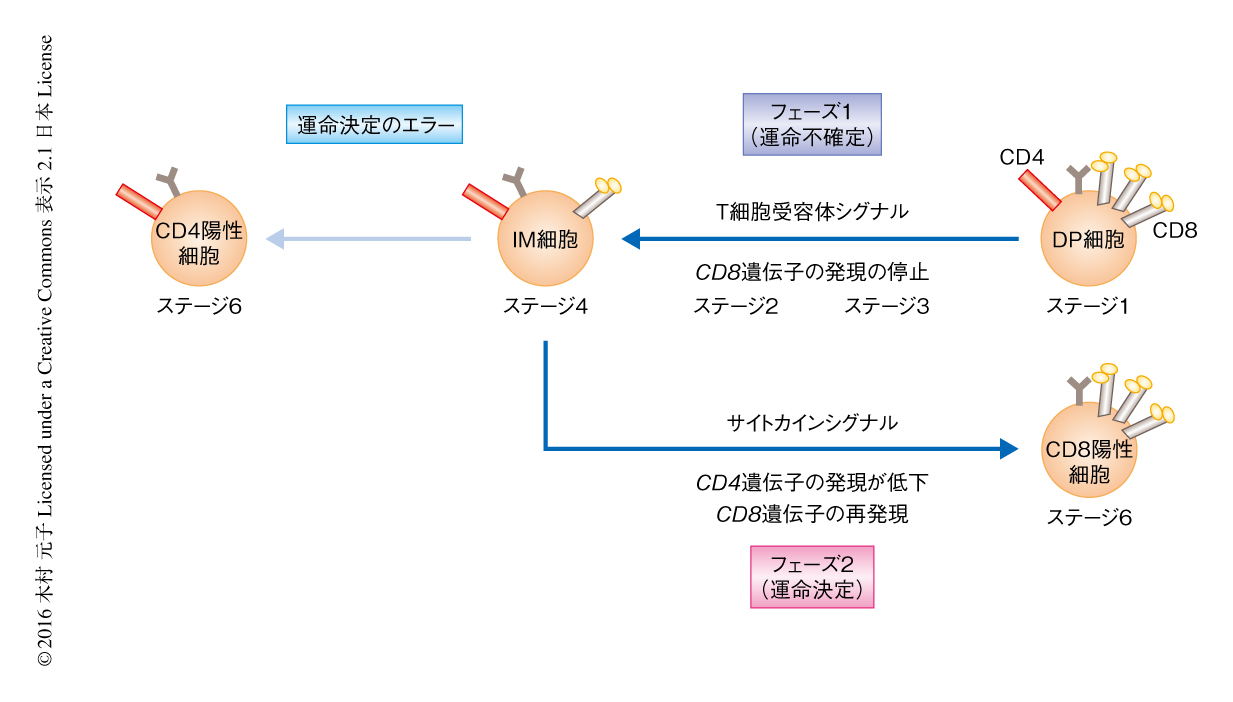
MHC-I拘束性のT細胞の分化は,胸腺においてDP細胞の発現するT細胞受容体が自己抗原+MHC-I複合体と結合することにより開始する.T細胞受容体シグナルはCD8遺伝子の発現を停止させ,DP細胞はCD4陽性CD8低発現のIM細胞になる.つづいて,インターロイキン7などのサイトカインシグナルに依存してRunx3dの発現が誘導されると,IM細胞はCD4の発現が低下しCD8が再発現することによりCD8陽性T細胞へと分化をとげる1)(図1).このように,CD8陽性T細胞への分化の過程においてはCD4およびCD8の細胞表面における発現が複雑に変化することから,CD8陽性T細胞への分化の過程をCD4およびCD8の発現により追跡することは困難であった.そこで,CD8陽性T細胞への分化の過程を詳細に追跡するため,CD69およびCCR7を用いた.胸腺において正の選択のまえのDP細胞はCD69陰性CCR7陰性(ステージ1)であるが,正の選択をうけるとCD69陽性CCR7陰性(ステージ2)となり,そののち,分化が進むにつれてCCR7の発現が徐々に上昇し,CD69陽性CCR7低発現(ステージ3),CD69陽性CCR7中発現(ステージ4),CD69陽性CCR7高発現(ステージ5)をへて,CD69陰性/低発現CCR7高発現(ステージ6)へと分化することがわかった(図1).それぞれのステージにおいてCD4およびCD8の発現を解析したところ,ステージ1からステージ4まではCD8の発現が低下し,ステージ4からステージ6にかけてはCD8の発現が上昇したことから,CD8陽性T細胞への分化の過程には2つのフェーズが存在することがわかった.そこで,ステージ1からステージ4までをフェーズ1,ステージ4からステージ6までをフェーズ2と定義した.
CD8陽性T細胞への運命決定はフェーズ1およびフェーズ2のどの段階でなされるのかを検討した.Runx3dのレポーターマウスを利用してRunx3dの発現のはじまるステージを検討したところ,フェーズ1においてRunx3dの発現はみられず,フェーズ2になってはじめてRunx3dの発現が誘導されることがわかった.この結果から,フェーズ1の細胞はまだ運命決定がなされていない“運命不確定細胞”であり,フェーズ2の細胞はCD8陽性T細胞への分化の決定した“運命決定細胞”と定義された.
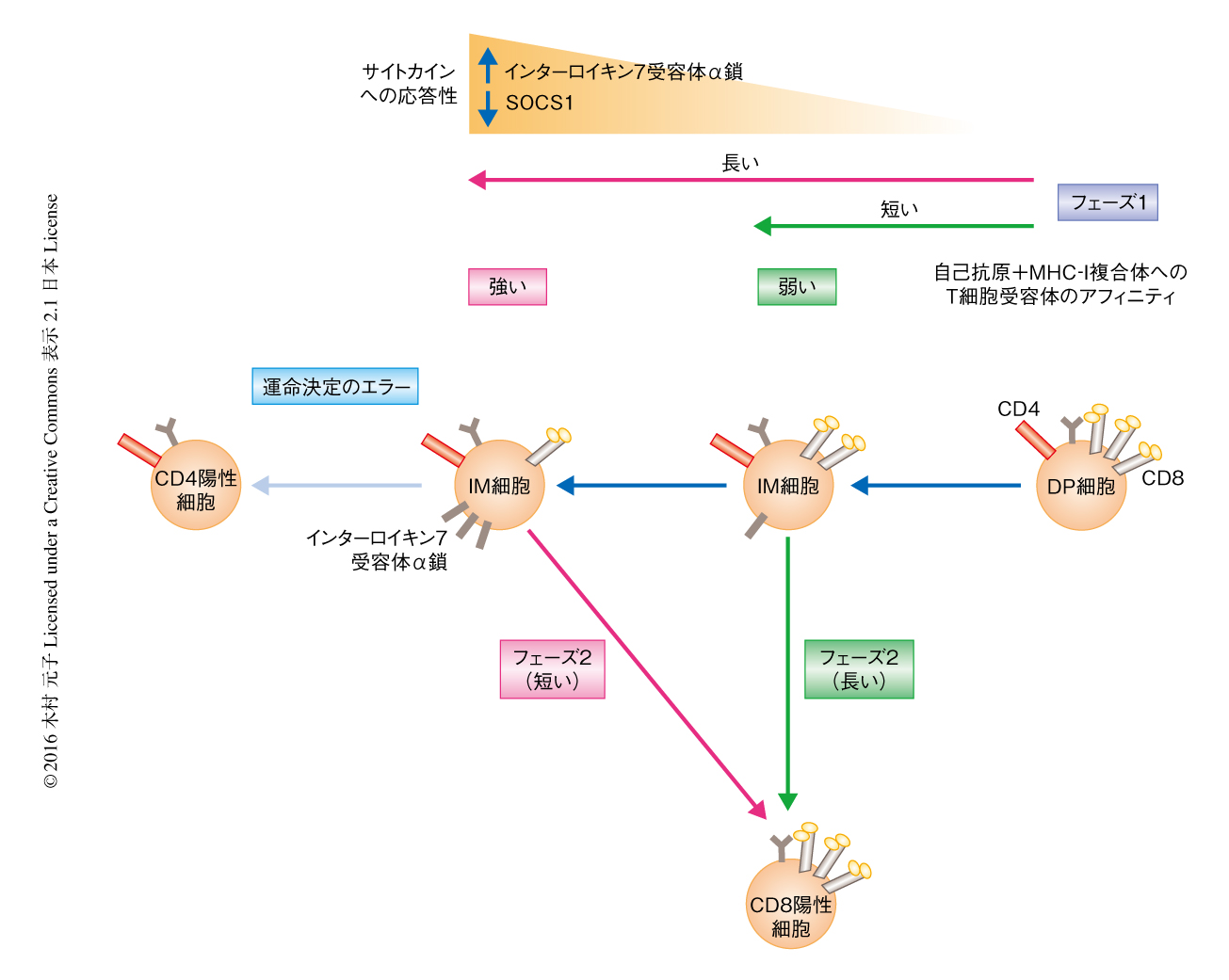
フェーズ1およびフェーズ2の進行を決定する因子について検討した.フェーズ1の開始はT細胞受容体シグナルによりもたらされることから,フェーズ1の進行はT細胞受容体シグナルの強さに影響されるのではないかと仮説をたてた.この仮説を検証するため,正の選択の際の自己抗原+MHC-I複合体へのアフィニティの異なるT細胞受容体をもつトランスジェニックマウスを用いて解析したところ,自己抗原+MHC-I複合体にアフィニティの強いT細胞受容体をもつ細胞はIM細胞においてCD8の発現が低く,アフィニティの弱いT細胞受容体をもつ細胞はIM細胞においてCD8の発現がDP細胞に比べ少し低下するにすぎないことが判明した(図2).この現象は以下のように解釈された.自己抗原+MHC-I複合体とT細胞受容体との結合はCD8に依存することから,T細胞受容体シグナルによるCD8の発現の低下は自己抗原+MHC-I複合体とT細胞受容体との結合の不安定化をもたらす.しかし,自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつ細胞はその結合におけるCD8への依存度が低いため,CD8の発現がかなり低くなるまでT細胞受容体シグナルが持続する.一方,アフィニティの弱いT細胞受容体をもつ細胞は自己抗原+MHC-I複合体との結合においてCD8への依存度が高く,CD8の発現が少し低下するだけでT細胞受容体のシグナルが停止する.
フェーズ2シグナルを決める因子は何であろうか? これまでの研究により,CD8陽性T細胞への運命決定因子であるRunx3dの発現の誘導はインターロイキン7などによるサイトカインシグナルに依存的であることがわかっていた2,3).実際に,サイトカインシグナルを阻害するSocs1のトランスジェニックマウスにおけるフェーズ1およびフェーズ2への影響を調べたところ,フェーズ1の進行はまったく阻害されなかったが,フェーズ2の進行は停止しフェーズ2の細胞は消失した.以上のことから,フェーズ1はT細胞受容体シグナルにより進行し,フェーズ2はサイトカインシグナルにより進行することが明らかにされた.
RAG2遺伝子の発現制御のもとGFP遺伝子を発現するRAG2-GFPトランスジェニックマウスを利用してフェーズ1およびフェーズ2の実際の時間の長さを測定した.RAG2遺伝子の発現はDP細胞において高く,正の選択によるT細胞受容体シグナルにより停止する.したがって,RAG2-GFPトランスジェニックマウスにおけるGFPの発現はDP細胞において高い.一方,正の選択によるT細胞受容体シグナルによりRAG2-GFPトランスジェニックマウスにおけるGFP遺伝子の発現は停止するが,GFPタンパク質の半減期は約50時間と長く直線的に減少することから,GFPタンパク質の低下率を測定することにより,分化の過程にある個々の細胞について正の選択をうけてから経過した時間を測定することが可能になる4).このRAG2-GFPトランスジェニックマウスを自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつマウスおよびアフィニティの弱いT細胞受容体をもつマウスに導入し,それぞれにおいてフェーズ1およびフェーズ2の時間を測定した.その結果,予想どおり,フェーズ1の進行時間は自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつ細胞において長く,アフィニティの弱いT細胞受容体をもつ細胞において短かった.一方で,フェーズ2の進行にかかる時間については,自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつ細胞において短く,アフィニティの弱いT細胞受容体をもつ細胞において非常に長い,という予想外の結果が得られた.胸腺においてDP細胞が正の選択をうけてからCD8陽性T細胞への分化に必要な総時間は,おのおのの細胞のもつT細胞受容体の自己抗原+MHC-I複合体へのアフィニティの違いによる影響はみられず,ほぼ一定の85~95時間であった(図2).
なぜフェーズ1とフェーズ2の長さは逆相関の関係にあるのだろうか? 胸腺における正の選択のまえのDP細胞はサイトカインシグナルを抑制するSocs1の発現が高く,インターロイキン7受容体α鎖の発現のない“サイトカイン不応答性細胞”である.正の選択によりT細胞受容体シグナルを受け取るとIM細胞はSocs1の発現を低下させインターロイキン7受容体α鎖の発現を誘導して“サイトカイン応答性細胞”になる3,5).そこで,フェーズ1の長さの違いがIM細胞のサイトカイン応答性の獲得に違いをもたらし,サイトカインシグナルによるフェーズ2の進行に影響をおよぼすのではないかと仮説をたて検証した.その結果,サイトカイン応答性はフェーズ1の長さに依存することが判明した.すなわち,フェーズ1の長い自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつ細胞においては,フェーズ1の進行にともないSocs1遺伝子の発現が低下し,インターロイキン7受容体α鎖の発現は上昇した(図2).一方,フェーズ1の短いアフィニティの低いT細胞受容体をもつ細胞においては,Socs1遺伝子の発現はIM細胞においても依然として高く,インターロイキン7受容体α鎖の発現の上昇もほとんどみられなかった.結果として,高いサイトカイン応答性を獲得した自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつ細胞はフェーズ2におけるRunx3dの発現が高いためフェーズ2の進行が速く,サイトカイン応答性の弱いアフィニティの低いT細胞受容体をもつ細胞はRunx3dの発現が低くフェーズ2の完了に時間がかかると考えられた(図2).
MHC-I拘束性の正の選択において,フェーズ1を実験的により長くつづかせた場合にCD8陽性T細胞への分化にどのような影響があるのか検証した.CD8の細胞内領域はCD4の細胞内領域よりもT細胞受容体シグナルの伝達に必須であるLckとの結合能が低いため,CD8に依存的なシグナルはCD4に依存的なシグナルよりも弱くなる.そこで,CD8の細胞外領域+CD4の細胞内領域をもつキメラ分子をコードする遺伝子をCD8遺伝子の発現制御のもと発現するマウスを利用した6).これを導入した自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつ細胞は,T細胞受容体の自己抗原+MHC-I複合体へのアフィニティに変化はないものの,結合によりもたらされるT細胞受容体シグナルは本来の細胞よりも強くなると考えられる.実際に,この細胞のフェーズ1の長さを測定したところ,フェーズ1は本来の細胞よりも長くなり,やがて,一部のIM細胞はエラーを起こし,MHC-I分子により正の選択をうけたにもかかわらずCD4陽性T細胞へと分化した.この結果から,MHC-I拘束性の正の選択において,フェーズ1はある一定の時間内に終了しフェーズ2を開始することがCD8陽性T細胞へと分化するのに必須であることが示された.さらなる解析により,MHC-I拘束性のT細胞がCD8陽性T細胞へとまちがいなく分化するためには,フェーズ1は約53時間以内に終了する必要のあることが判明した.MHC-I拘束性の正の選択においては,フェーズ1およびフェーズ2を制御するT細胞受容体シグナルおよびサイトカインシグナルが互いのシグナルを制御しあうことにより,効率よく一定の時間にCD8陽性T細胞へと分化することを可能にしていた.
MHC-I拘束性のT細胞受容体をもつ細胞はCD8陽性T細胞へ,MHC-II拘束性のT細胞受容体をもつ細胞はCD4陽性T細胞へと分化することは,末梢において正しく免疫応答が起こるのに必須である.なぜ多様性に富みランダムに形成されるT細胞受容体をもつおのおのの未熟な胸腺細胞は,正しい運命を享受し分化をとげることができるのかは不明であった.この研究により,その背後には正の選択の際にT細胞受容体シグナルおよびサイトカインシグナルという2つのシグナルが互いを制御しあう巧妙な機構の存在することが明らかにされた.胸腺におけるT細胞の自己認識能の獲得および運命決定の過程は,免疫応答すべての根幹となる生命現象であり,その詳細な機構の解明の重要性は昔もいまも変わることなく,今後も地道な研究の継続が必要と考える.
略歴:2002年 千葉大学大学院医学研究院 修了,同年 同 助手,2006年 米国NIH National Cancer Instituteポストドクトラルフェロー,2011年 同 リサーチフェローを経て,2014年より千葉大学大学院医学研究院 特任准教授(現 准教授).
研究テーマ:胸腺における細胞の分化の機構,CD69バイオロジー.
抱負:生命の根幹にかかわる重要なルールをみつけたい.
© 2016 木村 元子 Licensed under CC 表示 2.1 日本
(米国NIH National Cancer Institute,Experimental Immunology Branch)
email:木村元子
DOI: 10.7875/first.author.2016.104
Timing and duration of MHC I positive selection signals are adjusted in the thymus to prevent lineage errors.
Motoko Y. Kimura, Julien Thomas, Xuguang Tai, Terry I. Guinter, Miho Shinzawa, Ruth Etzensperger, Zhenhu Li, Paul Love, Toshinori Nakayama, Alfred Singer
Nature Immunology, 17, 1415-1423 (2016)
要 約
MHCクラスI拘束性の正の選択によるCD8陽性T細胞への分化は2つのフェーズからなる.フェーズ1はT細胞受容体シグナルによる正の選択の開始に始まる過程であり,フェーズ2はサイトカインシグナルに依存的なRunx3dの発現の誘導によるCD8陽性T細胞への分化の決定の過程である.この2つのフェーズに必要な時間を調べたところ,自己抗原+MHC-I複合体にアフィニティの強いT細胞受容体をもつ細胞は長いフェーズ1と短いフェーズ2により分化をとげたのに対し,自己抗原+MHC-I複合体にアフィニティの弱いT細胞受容体をもつ細胞は短いフェーズ1と長いフェーズ2をへて分化をとげた.つまり,フェーズ1とフェーズ2の進行に必要なシグナルは逆相関しており,その結果,MHCクラスI拘束性の正の選択はほぼ一定の時間で完了した.フェーズ1とフェーズ2は互いに制御しあうことにより,CD8陽性T細胞への運命決定および分化を効率的かつエラーが生じないよう制御することが明らかにされた.
はじめに
CD4陽性T細胞およびCD8陽性T細胞は,胸腺において共通の未成熟なCD4陽性CD8陽性のDP細胞から分化する.すなわち,MHCクラスI拘束性のT細胞受容体をもつDP細胞はCD8陽性T細胞へ,MHCクラスII拘束性のT細胞受容体をもつDP細胞はCD4陽性T細胞へと分化する.CD8陽性T細胞への分化の過程においては,正の選択によりもたらされる“T細胞受容体シグナル”と,CD8陽性T細胞への運命決定に重要なRunx3dの発現に重要なインターロイキン7などによる“サイトカインシグナル”が必要である1).しかし,T細胞受容体シグナルおよびサイトカインシグナルはそれぞれどのように制御されるのか,T細胞受容体シグナルおよびサイトカインシグナルの実際のシグナルの長さ,CD8陽性T細胞への分化をとげるのに必要な時間,MHCクラスI拘束性の正の選択において運命決定のエラーがかぎりなく少ない理由,はわかっていなかった.
1.CD8陽性T細胞への分化は2つのフェーズをへる
MHC-I拘束性のT細胞の分化は,胸腺においてDP細胞の発現するT細胞受容体が自己抗原+MHC-I複合体と結合することにより開始する.T細胞受容体シグナルはCD8遺伝子の発現を停止させ,DP細胞はCD4陽性CD8低発現のIM細胞になる.つづいて,インターロイキン7などのサイトカインシグナルに依存してRunx3dの発現が誘導されると,IM細胞はCD4の発現が低下しCD8が再発現することによりCD8陽性T細胞へと分化をとげる1)(図1).このように,CD8陽性T細胞への分化の過程においてはCD4およびCD8の細胞表面における発現が複雑に変化することから,CD8陽性T細胞への分化の過程をCD4およびCD8の発現により追跡することは困難であった.そこで,CD8陽性T細胞への分化の過程を詳細に追跡するため,CD69およびCCR7を用いた.胸腺において正の選択のまえのDP細胞はCD69陰性CCR7陰性(ステージ1)であるが,正の選択をうけるとCD69陽性CCR7陰性(ステージ2)となり,そののち,分化が進むにつれてCCR7の発現が徐々に上昇し,CD69陽性CCR7低発現(ステージ3),CD69陽性CCR7中発現(ステージ4),CD69陽性CCR7高発現(ステージ5)をへて,CD69陰性/低発現CCR7高発現(ステージ6)へと分化することがわかった(図1).それぞれのステージにおいてCD4およびCD8の発現を解析したところ,ステージ1からステージ4まではCD8の発現が低下し,ステージ4からステージ6にかけてはCD8の発現が上昇したことから,CD8陽性T細胞への分化の過程には2つのフェーズが存在することがわかった.そこで,ステージ1からステージ4までをフェーズ1,ステージ4からステージ6までをフェーズ2と定義した.
CD8陽性T細胞への運命決定はフェーズ1およびフェーズ2のどの段階でなされるのかを検討した.Runx3dのレポーターマウスを利用してRunx3dの発現のはじまるステージを検討したところ,フェーズ1においてRunx3dの発現はみられず,フェーズ2になってはじめてRunx3dの発現が誘導されることがわかった.この結果から,フェーズ1の細胞はまだ運命決定がなされていない“運命不確定細胞”であり,フェーズ2の細胞はCD8陽性T細胞への分化の決定した“運命決定細胞”と定義された.
2.フェーズ1はT細胞受容体シグナル,フェーズ2はサイトカインシグナルにより進行する
フェーズ1およびフェーズ2の進行を決定する因子について検討した.フェーズ1の開始はT細胞受容体シグナルによりもたらされることから,フェーズ1の進行はT細胞受容体シグナルの強さに影響されるのではないかと仮説をたてた.この仮説を検証するため,正の選択の際の自己抗原+MHC-I複合体へのアフィニティの異なるT細胞受容体をもつトランスジェニックマウスを用いて解析したところ,自己抗原+MHC-I複合体にアフィニティの強いT細胞受容体をもつ細胞はIM細胞においてCD8の発現が低く,アフィニティの弱いT細胞受容体をもつ細胞はIM細胞においてCD8の発現がDP細胞に比べ少し低下するにすぎないことが判明した(図2).この現象は以下のように解釈された.自己抗原+MHC-I複合体とT細胞受容体との結合はCD8に依存することから,T細胞受容体シグナルによるCD8の発現の低下は自己抗原+MHC-I複合体とT細胞受容体との結合の不安定化をもたらす.しかし,自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつ細胞はその結合におけるCD8への依存度が低いため,CD8の発現がかなり低くなるまでT細胞受容体シグナルが持続する.一方,アフィニティの弱いT細胞受容体をもつ細胞は自己抗原+MHC-I複合体との結合においてCD8への依存度が高く,CD8の発現が少し低下するだけでT細胞受容体のシグナルが停止する.
フェーズ2シグナルを決める因子は何であろうか? これまでの研究により,CD8陽性T細胞への運命決定因子であるRunx3dの発現の誘導はインターロイキン7などによるサイトカインシグナルに依存的であることがわかっていた2,3).実際に,サイトカインシグナルを阻害するSocs1のトランスジェニックマウスにおけるフェーズ1およびフェーズ2への影響を調べたところ,フェーズ1の進行はまったく阻害されなかったが,フェーズ2の進行は停止しフェーズ2の細胞は消失した.以上のことから,フェーズ1はT細胞受容体シグナルにより進行し,フェーズ2はサイトカインシグナルにより進行することが明らかにされた.
3.フェーズ1とフェーズ2の進行時間は逆相関の関係にありCD8陽性T細胞の分化にかかる時間は一定である
RAG2遺伝子の発現制御のもとGFP遺伝子を発現するRAG2-GFPトランスジェニックマウスを利用してフェーズ1およびフェーズ2の実際の時間の長さを測定した.RAG2遺伝子の発現はDP細胞において高く,正の選択によるT細胞受容体シグナルにより停止する.したがって,RAG2-GFPトランスジェニックマウスにおけるGFPの発現はDP細胞において高い.一方,正の選択によるT細胞受容体シグナルによりRAG2-GFPトランスジェニックマウスにおけるGFP遺伝子の発現は停止するが,GFPタンパク質の半減期は約50時間と長く直線的に減少することから,GFPタンパク質の低下率を測定することにより,分化の過程にある個々の細胞について正の選択をうけてから経過した時間を測定することが可能になる4).このRAG2-GFPトランスジェニックマウスを自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつマウスおよびアフィニティの弱いT細胞受容体をもつマウスに導入し,それぞれにおいてフェーズ1およびフェーズ2の時間を測定した.その結果,予想どおり,フェーズ1の進行時間は自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつ細胞において長く,アフィニティの弱いT細胞受容体をもつ細胞において短かった.一方で,フェーズ2の進行にかかる時間については,自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつ細胞において短く,アフィニティの弱いT細胞受容体をもつ細胞において非常に長い,という予想外の結果が得られた.胸腺においてDP細胞が正の選択をうけてからCD8陽性T細胞への分化に必要な総時間は,おのおのの細胞のもつT細胞受容体の自己抗原+MHC-I複合体へのアフィニティの違いによる影響はみられず,ほぼ一定の85~95時間であった(図2).
なぜフェーズ1とフェーズ2の長さは逆相関の関係にあるのだろうか? 胸腺における正の選択のまえのDP細胞はサイトカインシグナルを抑制するSocs1の発現が高く,インターロイキン7受容体α鎖の発現のない“サイトカイン不応答性細胞”である.正の選択によりT細胞受容体シグナルを受け取るとIM細胞はSocs1の発現を低下させインターロイキン7受容体α鎖の発現を誘導して“サイトカイン応答性細胞”になる3,5).そこで,フェーズ1の長さの違いがIM細胞のサイトカイン応答性の獲得に違いをもたらし,サイトカインシグナルによるフェーズ2の進行に影響をおよぼすのではないかと仮説をたて検証した.その結果,サイトカイン応答性はフェーズ1の長さに依存することが判明した.すなわち,フェーズ1の長い自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつ細胞においては,フェーズ1の進行にともないSocs1遺伝子の発現が低下し,インターロイキン7受容体α鎖の発現は上昇した(図2).一方,フェーズ1の短いアフィニティの低いT細胞受容体をもつ細胞においては,Socs1遺伝子の発現はIM細胞においても依然として高く,インターロイキン7受容体α鎖の発現の上昇もほとんどみられなかった.結果として,高いサイトカイン応答性を獲得した自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつ細胞はフェーズ2におけるRunx3dの発現が高いためフェーズ2の進行が速く,サイトカイン応答性の弱いアフィニティの低いT細胞受容体をもつ細胞はRunx3dの発現が低くフェーズ2の完了に時間がかかると考えられた(図2).
4.エラーのないCD8陽性T細胞への正の選択の機構
MHC-I拘束性の正の選択において,フェーズ1を実験的により長くつづかせた場合にCD8陽性T細胞への分化にどのような影響があるのか検証した.CD8の細胞内領域はCD4の細胞内領域よりもT細胞受容体シグナルの伝達に必須であるLckとの結合能が低いため,CD8に依存的なシグナルはCD4に依存的なシグナルよりも弱くなる.そこで,CD8の細胞外領域+CD4の細胞内領域をもつキメラ分子をコードする遺伝子をCD8遺伝子の発現制御のもと発現するマウスを利用した6).これを導入した自己抗原+MHC-I複合体へのアフィニティの強いT細胞受容体をもつ細胞は,T細胞受容体の自己抗原+MHC-I複合体へのアフィニティに変化はないものの,結合によりもたらされるT細胞受容体シグナルは本来の細胞よりも強くなると考えられる.実際に,この細胞のフェーズ1の長さを測定したところ,フェーズ1は本来の細胞よりも長くなり,やがて,一部のIM細胞はエラーを起こし,MHC-I分子により正の選択をうけたにもかかわらずCD4陽性T細胞へと分化した.この結果から,MHC-I拘束性の正の選択において,フェーズ1はある一定の時間内に終了しフェーズ2を開始することがCD8陽性T細胞へと分化するのに必須であることが示された.さらなる解析により,MHC-I拘束性のT細胞がCD8陽性T細胞へとまちがいなく分化するためには,フェーズ1は約53時間以内に終了する必要のあることが判明した.MHC-I拘束性の正の選択においては,フェーズ1およびフェーズ2を制御するT細胞受容体シグナルおよびサイトカインシグナルが互いのシグナルを制御しあうことにより,効率よく一定の時間にCD8陽性T細胞へと分化することを可能にしていた.
おわりに
MHC-I拘束性のT細胞受容体をもつ細胞はCD8陽性T細胞へ,MHC-II拘束性のT細胞受容体をもつ細胞はCD4陽性T細胞へと分化することは,末梢において正しく免疫応答が起こるのに必須である.なぜ多様性に富みランダムに形成されるT細胞受容体をもつおのおのの未熟な胸腺細胞は,正しい運命を享受し分化をとげることができるのかは不明であった.この研究により,その背後には正の選択の際にT細胞受容体シグナルおよびサイトカインシグナルという2つのシグナルが互いを制御しあう巧妙な機構の存在することが明らかにされた.胸腺におけるT細胞の自己認識能の獲得および運命決定の過程は,免疫応答すべての根幹となる生命現象であり,その詳細な機構の解明の重要性は昔もいまも変わることなく,今後も地道な研究の継続が必要と考える.
文 献
- Singer, A., Adoro, S. & Park, J. H.: Lineage fate and intense debate: myths, models and mechanisms of CD4- versus CD8-lineage choice. Nat. Rev. Immunol., 8, 788-801 (2008)[PubMed]
- Yu, Q., Erman, B., Bhandoola, A. et al.: In vitro evidence that cytokine receptor signals are required for differentiation of double positive thymocytes into functionally mature CD8+ T cells. J. Exp. Med., 197, 475-487 (2003)[PubMed]
- Park, J. H., Adoro, S., Guinter, T. et al.: Signaling by intrathymic cytokines, not T cell antigen receptors, specifies CD8 lineage choice and promotes the differentiation of cytotoxic-lineage T cells. Nat. Immunol., 11, 257-264 (2010)[PubMed]
- McCaughtry, T. M., Wilken, M. S. & Hogquist, K. A.: Thymic emigration revisited. J. Exp. Med., 204, 2513-2520 (2007)[PubMed]
- Yu, Q., Park, J. H., Doan, L. L. et al.: Cytokine signal transduction is suppressed in preselection double positive thymocytes and restored by positive selection. J. Exp. Med., 203, 165-175 (2006)[PubMed]
- Erman, B., Alag, A. S., Dahle, O. et al.: Coreceptor signal strength regulates positive selection but does not determine CD4/CD8 lineage choice in a physiologic in vivo model. J. Immunol., 177, 6613-6625 (2006)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2002年 千葉大学大学院医学研究院 修了,同年 同 助手,2006年 米国NIH National Cancer Instituteポストドクトラルフェロー,2011年 同 リサーチフェローを経て,2014年より千葉大学大学院医学研究院 特任准教授(現 准教授).
研究テーマ:胸腺における細胞の分化の機構,CD69バイオロジー.
抱負:生命の根幹にかかわる重要なルールをみつけたい.
© 2016 木村 元子 Licensed under CC 表示 2.1 日本