リガンド指向性化学によるGABAA受容体に対する新規のアロステリック作用薬の発見
山浦 圭・清中茂樹・浜地 格
(京都大学大学院工学研究科 合成・生物化学専攻生物有機化学分野)
email:山浦 圭,清中茂樹,浜地 格
DOI: 10.7875/first.author.2016.090
Discovery of allosteric modulators for GABAA receptors by ligand-directed chemistry.
Kei Yamaura, Shigeki Kiyonaka, Tomohiro Numata, Ryuji Inoue, Itaru Hamachi
Nature Chemical Biology, 12, 822-830 (2016)
GABAA受容体は向精神薬の標的として注目されている.これまで,GABAA受容体に対し選択的に作用する薬剤の多くは偶発的に発見されたものであった.その要因として,GABAA受容体の構造の情報が不十分であったため,薬剤の理論的な設計やハイスループットなスクリーニング系の構築が困難だったことがあげられる.筆者らは,独自に開発した特定のタンパク質に目印をつけられる手法であるリガンド指向性化学を用いて,構造の情報にたよることのないGABAA受容体に対する新たな創薬スクリーニング法を開発した.具体的には,GABAA受容体の薬剤結合部位の近傍に蛍光色素を化学修飾することにより生細胞においてGABAA受容体をバイオセンサー化した.このバイオセンサーを活用した薬剤のスクリーニングにより,GABAA受容体に対する新しいアロステリック作用薬が見い出された.
γ-アミノ酪酸(γ-aminobutyric acid:GABA)は中枢神経系において主要な抑制性の神経伝達物質である.その受容体であるGABAA受容体は神経伝達の制御において必要不可欠であり,その異常は不安障害や睡眠障害,うつ病や統合失調症など多くの精神疾患に深く関係することがわかっている1).また,GABAA受容体はα,β,γのサブユニットからなるヘテロ五量体であり,サブユニットの境界にγ-アミノ酪酸,ベンゾジアゼピン,バルビツール酸,エトミデートなど多くの薬剤との結合部位が形成される2).実際に,バルビツール酸およびエトミデートは麻酔薬として,また,ベンゾジアゼピンは抗不安薬や睡眠薬として広く利用されている.このように,GABAA受容体は向精神薬の標的として注目されつづけてきた.しかしながら,その複雑さゆえに詳細な立体構造の情報が不十分であり,創薬スクリーニング法の構築がむずかしく,GABAA受容体に対する効率的な創薬の開発は困難な状況にあった.このことから,GABAA受容体に対して適用の可能なハイスループットな創薬スクリーニング法がもとめられていた.
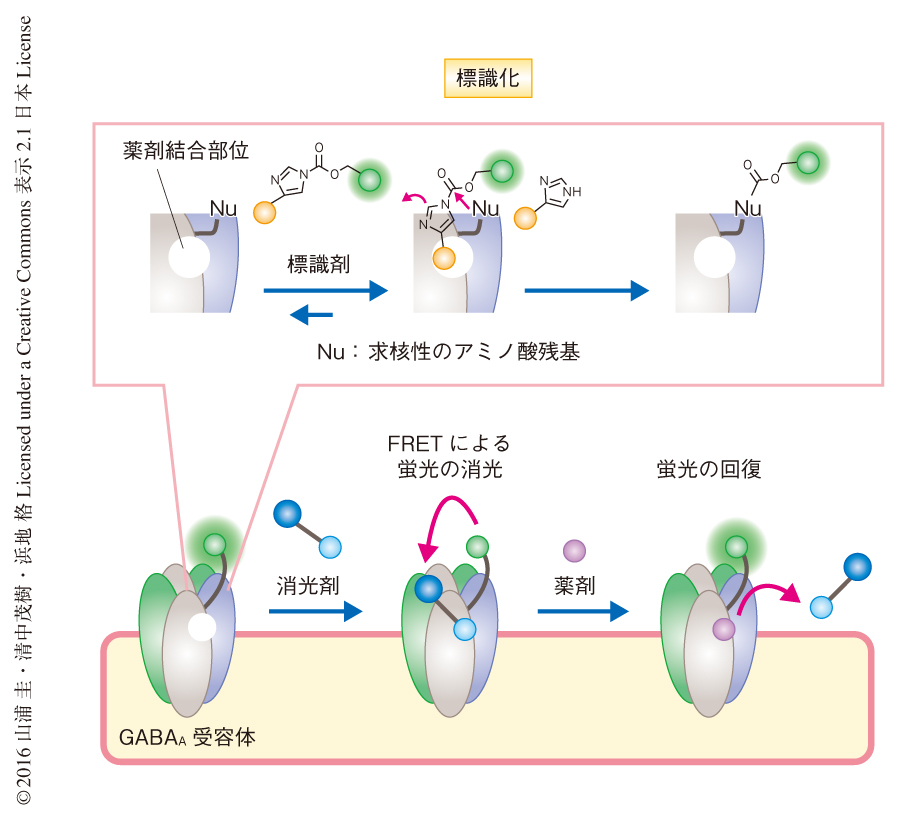
GABAA受容体に対する選択的な化学標識を基軸とした新たな創薬スクリーニング法を開発した.すなわち,GABAA受容体の薬剤結合部位を蛍光バイオセンサー化することにより,イメージングを活用した創薬スクリーニング法を構築できると考えた(図1).具体的には,筆者らの研究グループが独自に開発したリガンド指向性化学3,4) を用いることにより,薬剤結合部位の近傍に蛍光色素を化学修飾した.リガンド指向性化学においては,リガンド,反応基,蛍光色素からなる標識剤を設計し化学合成する.標識剤を細胞に作用させることによりリガンドの結合による近接効果がはたらき,反応基が標的となるタンパク質の薬剤結合部位の近傍の求核性のアミノ酸残基と反応する.これにより標的となるタンパク質を選択的に蛍光色素などにより標識することが可能である.また,リガンドは洗浄により除去されるだけでなく,リガンドの種類を変更することによりさまざまな薬剤結合部位を蛍光色素により化学修飾することができる.この標識法を薬剤結合部位に結合する消光剤を利用するBFQR(bimolecular fluorescence quenching and recovery,2分子蛍光消光回復)法5) と組み合わせることによりGABAA受容体をバイオセンサー化した.GABAA受容体を蛍光色素により修飾したのち,その消光剤を細胞に作用させると薬剤結合部位と結合し近接した蛍光色素とのあいだでFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)が起こり,蛍光は消光される.この状態でGABAA受容体と結合する化合物を添加すると消光剤は追い出され,それにより蛍光は回復する.すなわち,GABAA受容体を基体とした蛍光オン型のバイオセンサーが構築される.
GABAA受容体のγ-アミノ酪酸との結合部位およびベンゾジアゼピンとの結合部位に対し,それぞれの薬剤結合部位に対応する標識剤および消光剤を用いることによりバイオセンサー化に成功した.構築されたバイオセンサーに対し,GABAA受容体に結合するさまざまなリガンドを添加してリガンドに対する選択性を評価した結果,標識された薬剤結合部位に対応するリガンドが選択的に検出されることがわかった.さらに,Hillプロットによりリガンドの親和性を算出した結果,過去に報告されているリガンドの親和性とほとんど変わらない値が得られた.また,サブタイプの異なるGABAA受容体をHEK293T細胞に発現させ,同じ手法によりベンゾジアゼピン結合部位をバイオセンサー化したところ,特定のサブタイプに対し選択的なリガンドがイメージングにより区別された.
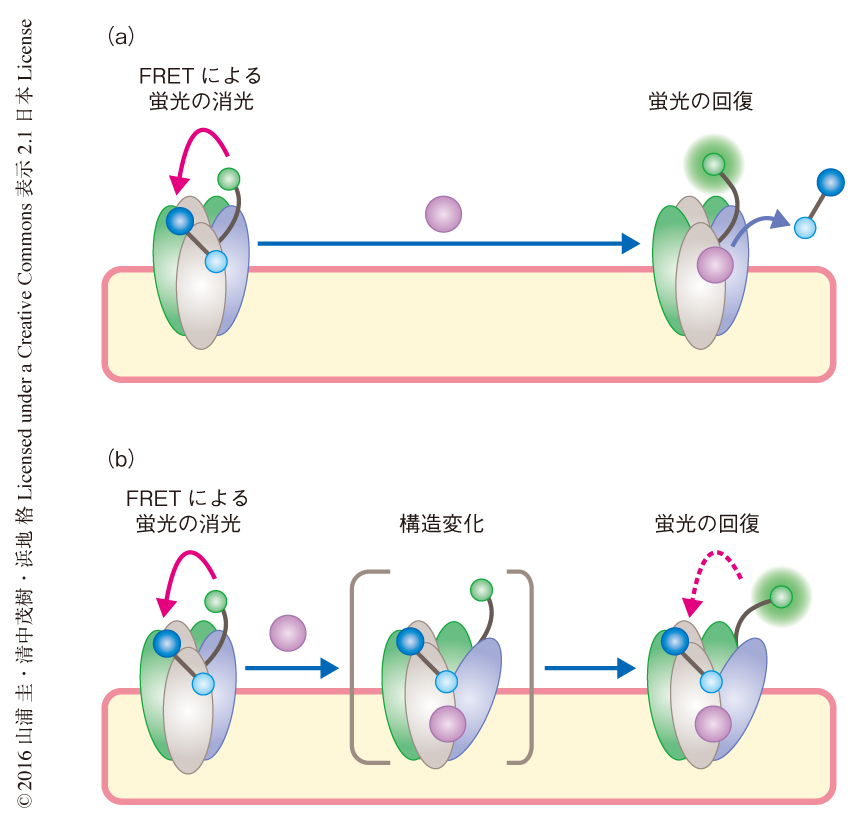
ベンゾジアゼピン結合部位をバイオセンサー化したGABAA受容体を用いて薬剤のスクリーニングを行った.1280個の薬理活性化合物ライブラリーを用いたイメージングにもとづくスクリーニングにより,flumazenil,ILTG,PPT,TBBの4つの化合物がヒットした.flumazenilおよびILTGはGABAA受容体に対する作用が既知であったが6,7),PPTおよびTBBに関してはこれまでGABAA受容体に作用するという報告はなかった.放射性同位体により標識したベンゾジアゼピン結合部位に対するリガンドを用いた競合的結合アッセイにより,flumazenilおよびILTGはベンゾジアゼピン結合部位と結合することが確認されたが,PPTおよびTBBに関してはベンゾジアゼピン結合部位とは結合しなかった.一方,構築したバイオセンサーを用いた蛍光滴定および電気生理学的な解析により,PPTおよびTBBは確かにGABAA受容体と結合しベンゾジゼピン結合部位における構造変化をひき起こすことが示唆された.これらの結果から,ベンゾジアゼピン結合部位に対するバイオセンサーは競合的に結合するリガンドのみならず,別の部位と結合し構造変化をひき起こすリガンドも検出できることが示された(図2).
スクリーニングにおいてヒットしたPPTおよびTBBの作用を電気生理学的に評価したところ,ともにγ-アミノ酪酸により誘起される電流応答を阻害することがわかった.PPTあるいはTBBの存在下においてγ-アミノ酪酸の濃度に対する依存性について調べた結果,γ-アミノ酪酸の親和性は変わっていなかった.これらのことから,PPTおよびTBBは負のアロステリック作用薬として機能することが示された.さらに,詳細な電流応答に着目したところ,PPTの添加はγ-アミノ酪酸の単独の添加と比較して脱感作を早める一方,そのような効果はTBBの添加においてはみられなかった.今回,新しいスクリーニング法により,GABAA受容体に対する2種類の作用の異なる負のアロステリック作用薬が見い出されたといえる.
脳においてはサブタイプの異なる複数のGABAA受容体がそれぞれ異なる機能に関与することにより高次な機能を制御する8).したがって,今回,開発されたGABAA受容体に対する創薬スクリーニング法を特定のGABAA受容体に対し選択的に作用する薬剤のスクリーニングへと展開できれば,副作用のない薬剤の開発につながると期待される.また,この研究において得られた新たなGABAA受容体の作用薬は新たな向精神薬のリード化合物になると期待される.
この研究において用いたスクリーニング法は標的となるタンパク質に対し幅広いリガンドを検出することが可能であり,ハイスループットであることから,従来の放射性同位体を用いた結合評価法やFLIPRアッセイと比較してすぐれた点が多い.また,構造の情報に過度に依存しないので,複雑で構造の情報の乏しいタンパク質を標的とした創薬にも応用が可能であると期待される.
略歴:2016年 京都大学大学院工学研究科にて博士号取得,同年より京都大学大学院工学研究科 博士研究員.
研究テーマ:リガンド指向性化学を用いた創薬への応用および展開.
清中 茂樹(Shigeki Kiyonaka)
京都大学大学院工学研究科 准教授.
浜地 格(Itaru Hamachi)
京都大学大学院工学研究科 教授.
研究室URL:http://www.sbchem.kyoto-u.ac.jp/hamachi-lab/
© 2016 山浦 圭・清中茂樹・浜地 格 Licensed under CC 表示 2.1 日本
(京都大学大学院工学研究科 合成・生物化学専攻生物有機化学分野)
email:山浦 圭,清中茂樹,浜地 格
DOI: 10.7875/first.author.2016.090
Discovery of allosteric modulators for GABAA receptors by ligand-directed chemistry.
Kei Yamaura, Shigeki Kiyonaka, Tomohiro Numata, Ryuji Inoue, Itaru Hamachi
Nature Chemical Biology, 12, 822-830 (2016)
要 約
GABAA受容体は向精神薬の標的として注目されている.これまで,GABAA受容体に対し選択的に作用する薬剤の多くは偶発的に発見されたものであった.その要因として,GABAA受容体の構造の情報が不十分であったため,薬剤の理論的な設計やハイスループットなスクリーニング系の構築が困難だったことがあげられる.筆者らは,独自に開発した特定のタンパク質に目印をつけられる手法であるリガンド指向性化学を用いて,構造の情報にたよることのないGABAA受容体に対する新たな創薬スクリーニング法を開発した.具体的には,GABAA受容体の薬剤結合部位の近傍に蛍光色素を化学修飾することにより生細胞においてGABAA受容体をバイオセンサー化した.このバイオセンサーを活用した薬剤のスクリーニングにより,GABAA受容体に対する新しいアロステリック作用薬が見い出された.
はじめに
γ-アミノ酪酸(γ-aminobutyric acid:GABA)は中枢神経系において主要な抑制性の神経伝達物質である.その受容体であるGABAA受容体は神経伝達の制御において必要不可欠であり,その異常は不安障害や睡眠障害,うつ病や統合失調症など多くの精神疾患に深く関係することがわかっている1).また,GABAA受容体はα,β,γのサブユニットからなるヘテロ五量体であり,サブユニットの境界にγ-アミノ酪酸,ベンゾジアゼピン,バルビツール酸,エトミデートなど多くの薬剤との結合部位が形成される2).実際に,バルビツール酸およびエトミデートは麻酔薬として,また,ベンゾジアゼピンは抗不安薬や睡眠薬として広く利用されている.このように,GABAA受容体は向精神薬の標的として注目されつづけてきた.しかしながら,その複雑さゆえに詳細な立体構造の情報が不十分であり,創薬スクリーニング法の構築がむずかしく,GABAA受容体に対する効率的な創薬の開発は困難な状況にあった.このことから,GABAA受容体に対して適用の可能なハイスループットな創薬スクリーニング法がもとめられていた.
1.GABAA受容体のバイオセンサー化
GABAA受容体に対する選択的な化学標識を基軸とした新たな創薬スクリーニング法を開発した.すなわち,GABAA受容体の薬剤結合部位を蛍光バイオセンサー化することにより,イメージングを活用した創薬スクリーニング法を構築できると考えた(図1).具体的には,筆者らの研究グループが独自に開発したリガンド指向性化学3,4) を用いることにより,薬剤結合部位の近傍に蛍光色素を化学修飾した.リガンド指向性化学においては,リガンド,反応基,蛍光色素からなる標識剤を設計し化学合成する.標識剤を細胞に作用させることによりリガンドの結合による近接効果がはたらき,反応基が標的となるタンパク質の薬剤結合部位の近傍の求核性のアミノ酸残基と反応する.これにより標的となるタンパク質を選択的に蛍光色素などにより標識することが可能である.また,リガンドは洗浄により除去されるだけでなく,リガンドの種類を変更することによりさまざまな薬剤結合部位を蛍光色素により化学修飾することができる.この標識法を薬剤結合部位に結合する消光剤を利用するBFQR(bimolecular fluorescence quenching and recovery,2分子蛍光消光回復)法5) と組み合わせることによりGABAA受容体をバイオセンサー化した.GABAA受容体を蛍光色素により修飾したのち,その消光剤を細胞に作用させると薬剤結合部位と結合し近接した蛍光色素とのあいだでFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)が起こり,蛍光は消光される.この状態でGABAA受容体と結合する化合物を添加すると消光剤は追い出され,それにより蛍光は回復する.すなわち,GABAA受容体を基体とした蛍光オン型のバイオセンサーが構築される.
GABAA受容体のγ-アミノ酪酸との結合部位およびベンゾジアゼピンとの結合部位に対し,それぞれの薬剤結合部位に対応する標識剤および消光剤を用いることによりバイオセンサー化に成功した.構築されたバイオセンサーに対し,GABAA受容体に結合するさまざまなリガンドを添加してリガンドに対する選択性を評価した結果,標識された薬剤結合部位に対応するリガンドが選択的に検出されることがわかった.さらに,Hillプロットによりリガンドの親和性を算出した結果,過去に報告されているリガンドの親和性とほとんど変わらない値が得られた.また,サブタイプの異なるGABAA受容体をHEK293T細胞に発現させ,同じ手法によりベンゾジアゼピン結合部位をバイオセンサー化したところ,特定のサブタイプに対し選択的なリガンドがイメージングにより区別された.
2.薬剤のスクリーニングおよびヒット化合物
ベンゾジアゼピン結合部位をバイオセンサー化したGABAA受容体を用いて薬剤のスクリーニングを行った.1280個の薬理活性化合物ライブラリーを用いたイメージングにもとづくスクリーニングにより,flumazenil,ILTG,PPT,TBBの4つの化合物がヒットした.flumazenilおよびILTGはGABAA受容体に対する作用が既知であったが6,7),PPTおよびTBBに関してはこれまでGABAA受容体に作用するという報告はなかった.放射性同位体により標識したベンゾジアゼピン結合部位に対するリガンドを用いた競合的結合アッセイにより,flumazenilおよびILTGはベンゾジアゼピン結合部位と結合することが確認されたが,PPTおよびTBBに関してはベンゾジアゼピン結合部位とは結合しなかった.一方,構築したバイオセンサーを用いた蛍光滴定および電気生理学的な解析により,PPTおよびTBBは確かにGABAA受容体と結合しベンゾジゼピン結合部位における構造変化をひき起こすことが示唆された.これらの結果から,ベンゾジアゼピン結合部位に対するバイオセンサーは競合的に結合するリガンドのみならず,別の部位と結合し構造変化をひき起こすリガンドも検出できることが示された(図2).
3.ヒット化合物の作用機構
スクリーニングにおいてヒットしたPPTおよびTBBの作用を電気生理学的に評価したところ,ともにγ-アミノ酪酸により誘起される電流応答を阻害することがわかった.PPTあるいはTBBの存在下においてγ-アミノ酪酸の濃度に対する依存性について調べた結果,γ-アミノ酪酸の親和性は変わっていなかった.これらのことから,PPTおよびTBBは負のアロステリック作用薬として機能することが示された.さらに,詳細な電流応答に着目したところ,PPTの添加はγ-アミノ酪酸の単独の添加と比較して脱感作を早める一方,そのような効果はTBBの添加においてはみられなかった.今回,新しいスクリーニング法により,GABAA受容体に対する2種類の作用の異なる負のアロステリック作用薬が見い出されたといえる.
おわりに
脳においてはサブタイプの異なる複数のGABAA受容体がそれぞれ異なる機能に関与することにより高次な機能を制御する8).したがって,今回,開発されたGABAA受容体に対する創薬スクリーニング法を特定のGABAA受容体に対し選択的に作用する薬剤のスクリーニングへと展開できれば,副作用のない薬剤の開発につながると期待される.また,この研究において得られた新たなGABAA受容体の作用薬は新たな向精神薬のリード化合物になると期待される.
この研究において用いたスクリーニング法は標的となるタンパク質に対し幅広いリガンドを検出することが可能であり,ハイスループットであることから,従来の放射性同位体を用いた結合評価法やFLIPRアッセイと比較してすぐれた点が多い.また,構造の情報に過度に依存しないので,複雑で構造の情報の乏しいタンパク質を標的とした創薬にも応用が可能であると期待される.
文 献
- Chebib, M. & Johnston, G. A.: GABA-activated ligand gated ion channels: medicinal chemistry and molecular biology. J. Med. Chem., 43, 1427-1447 (2000)[PubMed]
- Sieghart, W.: Allosteric modulation of GABAA receptors via multiple drug-binding sites. Adv. Pharmacol., 72, 53-96 (2015)[PubMed]
- Tsukiji, S., Miyagawa, M., Takaoka, Y. et al.: Ligand-directed tosyl chemistry for protein labeling in vivo. Nat. Chem. Biol., 5, 341-343 (2009)[PubMed]
- Fujishima, S. H., Yasui, R., Miki, T. et al.: Ligand-directed acyl imidazole chemistry for labeling of membrane-bound proteins on live cells. J. Am. Chem. Soc., 134, 3961-3964 (2012)[PubMed]
- Wang, H., Koshi, Y., Minato, D. et al.: Chemical cell-surface receptor engineering using affinity-guided, multivalent organocatalysts. J. Am. Chem. Soc., 133, 12220-12228 (2011)[PubMed]
- Hanson, S. M. & Czajkowski, C.: Structural mechanisms underlying benzodiazepine modulation of the GABAA receptor. J. Neurosci., 28, 3490-3499 (2008)[PubMed]
- Cho, S., Kim, S., Jin, Z. et al.: Isoliquiritigenin, a chalcone compound, is a positive allosteric modulator of GABAA receptors and shows hypnotic effects. Biochem. Biophys. Res. Commun. 413, 637-642 (2011)[PubMed]
- Rudolph, U. & Knoflach, F.: Beyond classical benzodiazepines: novel therapeutic potential of GABAA receptor subtypes. Nat. Rev. Drug Discov., 10, 685-697 (2011)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2016年 京都大学大学院工学研究科にて博士号取得,同年より京都大学大学院工学研究科 博士研究員.
研究テーマ:リガンド指向性化学を用いた創薬への応用および展開.
清中 茂樹(Shigeki Kiyonaka)
京都大学大学院工学研究科 准教授.
浜地 格(Itaru Hamachi)
京都大学大学院工学研究科 教授.
研究室URL:http://www.sbchem.kyoto-u.ac.jp/hamachi-lab/
© 2016 山浦 圭・清中茂樹・浜地 格 Licensed under CC 表示 2.1 日本