PiwiはヒストンH1を介したクロマチンの構造の制御により標的となるトランスポゾンを抑制する
岩崎由香・塩見春彦・齋藤都暁
(慶應義塾大学医学部 分子生物学教室)
email:岩崎由香,塩見春彦,齋藤都暁
DOI: 10.7875/first.author.2016.081
Piwi modulates chromatin accessibility by regulating multiple factors including histone H1 to repress transposons.
Yuka W. Iwasaki, Kensaku Murano, Hirotsugu Ishizu, Aoi Shibuya, Yumiko Iyoda, Mikiko C. Siomi, Haruhiko Siomi, Kuniaki Saito
Molecular Cell, 63, 408-419 (2016)
トランスポゾンの転移は生命の次世代への継承にとり脅威になるため,とくに生殖組織においてはトランスポゾンを選択的に抑制するしくみが必須である.Piwiおよび非コード小分子RNAであるpiRNAがトランスポゾンの抑制を担うことが見い出されており,PiwiとpiRNAとの複合体はトランスポゾン領域をヘテロクロマチン化することが示唆されているが,その分子機構はいまだ不明である.この研究においては,ショウジョウバエにおいてPiwiの新たな相互作用タンパク質としてヒストンH1が同定された.さらに,ヒストンH1のトランスポゾン領域への結合はPiwiに依存することが見い出された.また,PiwiはヒストンH1やHP1aなどを介してクロマチンの構造を制御することが示された.HP1aがヒストンH3のLys9のトリメチル化修飾などにより制御される一方,ヒストンH1はこれとは並行して機能していた.これらの結果から,PiwiとpiRNAとの複合体はヒストンH1やHP1aなど複数のタンパク質を介してクロマチンの構造を制御することにより標的となるトランスポゾンを抑制するというモデルが提唱された.
真核生物のゲノムはトランスポゾンの無秩序な転移の脅威から自己を防衛しつつ,生存に必須な遺伝子の発現を確保している1).近年,この自己防衛にpiRNA(PIWI-interacting RNA)とよばれる20~30塩基長の非コード小分子RNAを中心とした遺伝子発現の抑制が主要な役割をはたすことが示唆された2).piRNAはおもにトランスポゾンに由来し,PIWIタンパク質ファミリーと複合体を形成する.PIWI遺伝子ファミリーやpiRNAの生合成に関連する遺伝子に変異をもつショウジョウバエにおいてはトランスポゾン領域の発現が上昇し,生殖幹細胞に発生の異常が生じ不稔になる.以上のことから,PIWIタンパク質ファミリーとpiRNAとの複合体はトランスポゾン領域を認識しその発現を選択的に抑制することにより生殖組織の正常な発生に寄与すると考えられる.
ヘテロクロマチン領域はヒストンH3のLys9のトリメチル化修飾などの抑制性のヒストンマークおよびHP1などのクロマチンタンパク質により規定される3).ショウジョウバエのPIWIタンパク質ファミリーのひとつであるPiwiはpiRNAと複合体を形成し,クロマチンにおけるヒストンH3のLys9のトリメチル化修飾を介したHP1aのリクルートにより標的となるトランスポゾン領域の転写を抑制することが示唆されているが4-7),その分子機構はいまだ不明である.Mael,DmGTSF1/Asterix,Panxなどさまざまなタンパク質がPiwi-piRNA複合体とさらに複合体を形成し,トランスポゾン領域の転写の抑制に寄与することが知られている2,6,8,9).これらのうち,MaelのノックダウンはヒストンH3のLys9のトリメチル化修飾にはほとんど影響しないことが示されている6).このことから,ヒストンH3のLys9のトリメチル化修飾のみならず,別の機構によりトランスポゾン領域の発現が抑制される可能性が考えられる.
ヒストンH1はヌクレオソームコアの外側からクロマチンと結合し,クロマチンの高次構造の形成を促進するリンカーヒストンであることが知られている10).また,ヒストンH1はおもにトランスポゾン領域を標的とし,その転写の制御を担うという報告もある11).近年の研究においては,ヒストンH1は特定のクロマチン領域につねに安定的に結合しているのではなく,結合と解離をくり返すとされている12,13).したがって,ヒストンH1を特定のクロマチン領域に安定的に結合させるためには,特定の修飾やタンパク質が必要なのではないかと考えられる.しかしながら,ヒストンH1の位置情報を規定するタンパク質の知見はいまだ乏しい.
ショウジョウバエの卵巣に由来する培養細胞である卵巣性体細胞OSCは,piRNAによるトランスポゾン領域の発現の抑制を観察し操作することのできる培養細胞株である14).RNAi法によるノックダウンや過剰発現系が開発されており,生化学的な解析も容易であることから,このOSCを用いて解析を進めた.OSCの核の画分を用いて抗Piwi抗体による免疫沈降を行い,銀染色および質量分析によりPiwiと結合するタンパク質を同定した.その結果,Piwiの核における相互作用タンパク質としてヒストンH1が同定された.PiwiとヒストンH1との相互作用はウェスタンブロッティング法およびin vitro合成されたヒストンH1を用いたGSTプルダウン法により確認された.
PiwiあるいはヒストンH1のノックダウンにより発現の変動する遺伝子を網羅的に同定することを目的として,RNA-seq解析を行った.その結果,RNAポリメラーゼIIにより転写される遺伝子の多くについては影響がみられなかった一方,多くのトランスポゾン領域の発現量が上昇していた.ヒストンH1をノックダウンした際には6割以上のトランスポゾン領域の発現が,Piwiをノックダウンした際には2割以上のトランスポゾン領域の発現が2倍以上に上昇した.さらに,発現の変動したトランスポゾン領域の種類を詳細に解析した結果,Piwiにより制御されるトランスポゾン領域のほとんどはヒストンH1により制御されていることが明らかにされた.これをうけて,トランスポゾン領域を3つのグループに分けた.PiwiおよびヒストンH1により制御されるトランスポゾン領域(グループI),ヒストンH1のみにより制御されるトランスポゾン領域(グループII),PiwiあるいはヒストンH1により制御されないトランスポゾン領域(グループIII)である.特徴として,PiwiおよびヒストンH1により制御されるトランスポゾン領域はユークロマチン領域に存在するトランスポゾン領域である割合が比較的高かった.このことから,転移活性の高いトランスポゾン領域が選択的にPiwiおよびヒストンH1により制御されている可能性が考えられた.さらに,Piwi-piRNA複合体による制御はトランスポゾン領域にとどまらずその周辺の領域にも波及することが知られている6).周辺の領域にコードされる遺伝子についても解析したところ,PiwiおよびヒストンH1のノックダウンにより,PiwiおよびヒストンH1により制御されるトランスポゾン領域の周辺にコードされる遺伝子の発現量が上昇した.これらのことから,PiwiおよびヒストンH1は共通のトランスポゾン領域の発現を抑制すると考えられた.
PiwiおよびヒストンH1により制御されるトランスポゾン領域のPiwiおよびヒストンH1による発現の抑制について,PiwiとヒストンH1との関係性を明らかにするためヒストンH1についてChIP-seq解析を行った.その結果,Piwiをノックダウンしたときには対照と比較してヒストンH1のChIPシグナルは減少した.さらに,このChIPシグナルの減少はPiwiおよびヒストンH1により制御されるトランスポゾン領域に特異的に検出され,ヒストンH1のみにより制御されるトランスポゾン領域についてはPiwiのノックダウンによるヒストンH1のChIPシグナルの減少は確認されなかった.さらに,トランスポゾン領域の周辺の領域について解析した結果,同様に,PiwiおよびヒストンH1により制御されるトランスポゾン領域の周辺の領域において特異的に,PiwiのノックダウンによりヒストンH1のChIPシグナルが減少した.これらのことから,PiwiのノックダウンによりPiwiの標的となるトランスポゾン領域へのヒストンH1の安定的な結合が阻害されることが示唆された.
ここまでの結果から,PiwiがヒストンH1の制御を介してトランスポゾン領域の発現を抑制することが想定されたため,ヒストンH1によるクロマチンの構造の凝集がPiwi-piRNA複合体によるトランスポゾン領域の発現の抑制に関連する可能性について検討した.解析にはATAC-seq法とよばれるトランスポザーゼを用いてクロマチンの状態を解析する方法を用いた.アクセスしやすいオープンなクロマチン領域はトランスポザーゼが作用しやすい.トランスポザーゼの作用によりシークエンス解析を可能にするタグ配列が挿入されることにより,アクセスしやすいクロマチン領域をシグナルとして検出することができる.解析の結果,PiwiあるいはヒストンH1をノックダウンすることによりPiwiおよびヒストンH1により制御されるトランスポゾン領域のアクセスのしやすさが増加することが明らかにされた.つまり,PiwiおよびヒストンH1はともに標的となるトランスポゾン領域におけるクロマチンの構造の凝集を制御することが示された.
先行研究より,Piwi-piRNA複合体はヒストンH3のLys9のトリメチル化修飾をともなう制御によりトランスポゾン領域の発現を抑制することが知られていた4-7).これをうけて,ヒストンH3のLys9のトリメチル化修飾とヒストンH1との関係性について解析した.PiwiあるいはヒストンH1をノックダウンしたときのヒストンH3のLys9のトリメチル化修飾を解析した結果,先行研究と同様に,PiwiノックダウンによりPiwiおよびヒストンH1により発現の制御されるグループIのトランスポゾン領域におけるヒストンH3のLys9のトリメチル化修飾が大きく減少した.一方で,ヒストンH1のノックダウンはヒストンH3のLys9のトリメチル化修飾に影響しなかった.これらのことから,ヒストンH1は既知のPiwi-piRNA複合体によるヒストンH3のLys9のトリメチル化修飾をともなう制御と並行して,標的となるトランスポゾン領域の発現を抑制すると考えられた.
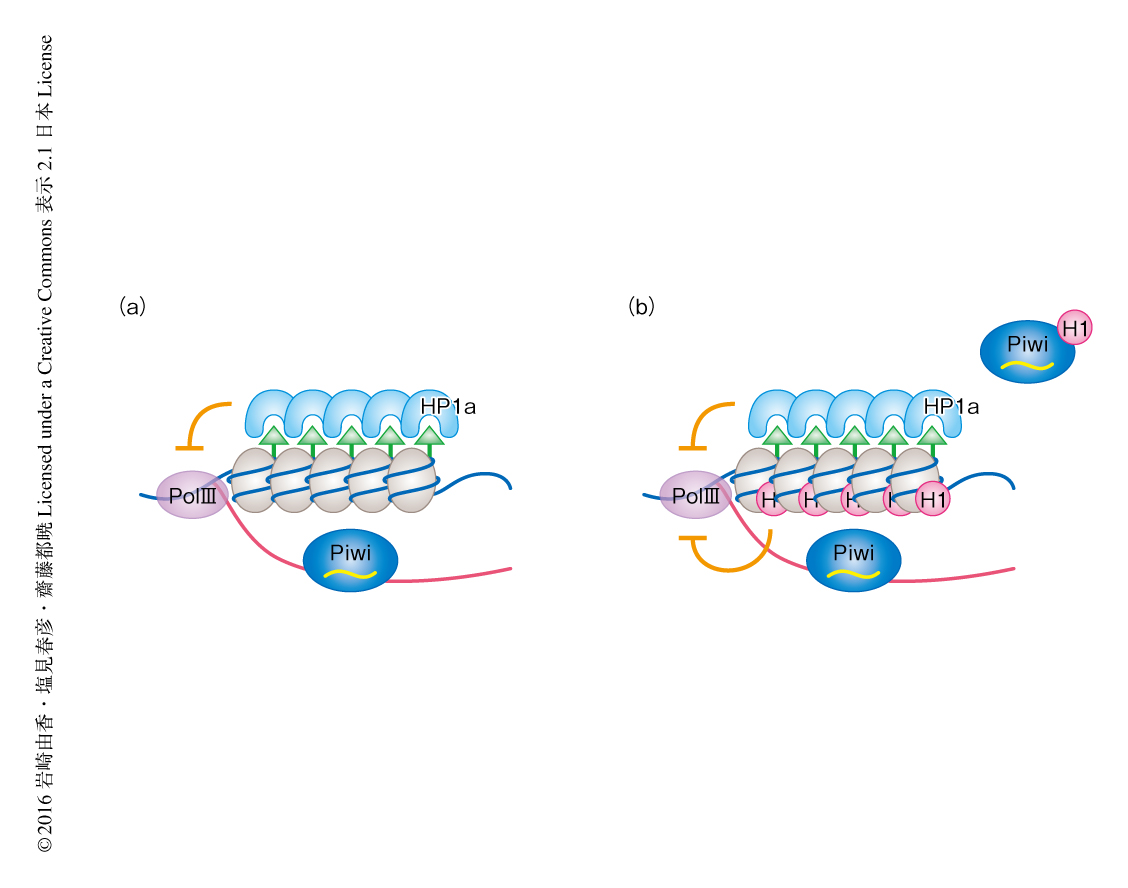
さらに,Piwi-piRNA複合体によるトランスポゾン領域の発現の抑制において,ヒストンH3のLys9のトリメチル化修飾によりリクルートされるHP1a 4-7) とヒストンH1との関係性について解析した.ChIP-seq解析により,ヒストンH1のノックダウンはHP1aのトランスポゾン領域への結合に影響しないこと,および,HP1aのノックダウンはヒストンH1のトランスポゾン領域への結合にほぼ影響しないことが示された.さらに,HP1aのChIPシグナルとヒストンH3のLys9のトリメチル化のChIPシグナルに重なりが確認された一方,ヒストンH1のChIPシグナルとヒストンH3のLys9のトリメチル化のChIPシグナルには有意な重なりはみられなかった.また,ヒストンH1およびHP1aをともにノックダウンしたところ,それぞれを個別にノックダウンした場合と比較して,標的となるトランスポゾン領域の発現の相乗的な脱抑制が観察された.これらの結果から,ヒストンH1はHP1aと並行して機能することにより,Piwiによるトランスポゾン領域の発現の抑制に機能すると考えられた(図1).
この研究により,Piwi-piRNA複合体によるトランスポゾンの抑制の実態が複数の経路の制御をともなうクロマチンの構造の制御であることが明らかにされた(図1).このことから,Piwiは複雑な制御機構によりクロマチンの構造を制御していると考えられた.先行研究により,複数のタンパク質がPiwi-piRNA複合体によるトランスポゾン領域の発現の抑制に関与することが示唆されている2).例として,MaelはヒストンH1と同様にノックダウンによりトランスポゾンの脱抑制が起こる一方で,ヒストンH3のLys9のトリメチル化修飾には影響しないことが知られている6).また,PanxはヒストンH3のLys9のトリメチル化に必須であることが報告されている8,9).これらのタンパク質とPiwiやヒストンH1との関係性も興味深い.また,この研究から得られた知見と先行研究15) とをあわせて考えると,ヒストンH1およびヒストンH3のLys9のトリメチル化はPiwiの下流においてヌクレオソームのターンオーバーを制御している可能性が考えられる.Piwiによるクロマチンの構造のダイナミックな制御がほかのクロマチンタンパク質およびクロマチンの修飾にどのように影響するかを検討することにより,Piwi-piRNA複合体によるトランスポゾンの抑制の機構の理解が進展することが期待される.
略歴:2011年 慶應義塾大学大学院政策・メディア研究科後期博士課程 修了,同年より慶應義塾大学医学部 特任助教(現 助教).
研究テーマ:小分子RNAの関与する生命現象の分子機構の解明および俯瞰的な理解.
塩見 春彦(Haruhiko Siomi)
慶應義塾大学医学部 教授.
研究室URL:http://www.siomilab.med.keio.ac.jp/
齋藤 都暁(Kuniaki Saito)
慶應義塾大学医学部 准教授.
© 2016 岩崎由香・塩見春彦・齋藤都暁 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 分子生物学教室)
email:岩崎由香,塩見春彦,齋藤都暁
DOI: 10.7875/first.author.2016.081
Piwi modulates chromatin accessibility by regulating multiple factors including histone H1 to repress transposons.
Yuka W. Iwasaki, Kensaku Murano, Hirotsugu Ishizu, Aoi Shibuya, Yumiko Iyoda, Mikiko C. Siomi, Haruhiko Siomi, Kuniaki Saito
Molecular Cell, 63, 408-419 (2016)
要 約
トランスポゾンの転移は生命の次世代への継承にとり脅威になるため,とくに生殖組織においてはトランスポゾンを選択的に抑制するしくみが必須である.Piwiおよび非コード小分子RNAであるpiRNAがトランスポゾンの抑制を担うことが見い出されており,PiwiとpiRNAとの複合体はトランスポゾン領域をヘテロクロマチン化することが示唆されているが,その分子機構はいまだ不明である.この研究においては,ショウジョウバエにおいてPiwiの新たな相互作用タンパク質としてヒストンH1が同定された.さらに,ヒストンH1のトランスポゾン領域への結合はPiwiに依存することが見い出された.また,PiwiはヒストンH1やHP1aなどを介してクロマチンの構造を制御することが示された.HP1aがヒストンH3のLys9のトリメチル化修飾などにより制御される一方,ヒストンH1はこれとは並行して機能していた.これらの結果から,PiwiとpiRNAとの複合体はヒストンH1やHP1aなど複数のタンパク質を介してクロマチンの構造を制御することにより標的となるトランスポゾンを抑制するというモデルが提唱された.
はじめに
真核生物のゲノムはトランスポゾンの無秩序な転移の脅威から自己を防衛しつつ,生存に必須な遺伝子の発現を確保している1).近年,この自己防衛にpiRNA(PIWI-interacting RNA)とよばれる20~30塩基長の非コード小分子RNAを中心とした遺伝子発現の抑制が主要な役割をはたすことが示唆された2).piRNAはおもにトランスポゾンに由来し,PIWIタンパク質ファミリーと複合体を形成する.PIWI遺伝子ファミリーやpiRNAの生合成に関連する遺伝子に変異をもつショウジョウバエにおいてはトランスポゾン領域の発現が上昇し,生殖幹細胞に発生の異常が生じ不稔になる.以上のことから,PIWIタンパク質ファミリーとpiRNAとの複合体はトランスポゾン領域を認識しその発現を選択的に抑制することにより生殖組織の正常な発生に寄与すると考えられる.
ヘテロクロマチン領域はヒストンH3のLys9のトリメチル化修飾などの抑制性のヒストンマークおよびHP1などのクロマチンタンパク質により規定される3).ショウジョウバエのPIWIタンパク質ファミリーのひとつであるPiwiはpiRNAと複合体を形成し,クロマチンにおけるヒストンH3のLys9のトリメチル化修飾を介したHP1aのリクルートにより標的となるトランスポゾン領域の転写を抑制することが示唆されているが4-7),その分子機構はいまだ不明である.Mael,DmGTSF1/Asterix,Panxなどさまざまなタンパク質がPiwi-piRNA複合体とさらに複合体を形成し,トランスポゾン領域の転写の抑制に寄与することが知られている2,6,8,9).これらのうち,MaelのノックダウンはヒストンH3のLys9のトリメチル化修飾にはほとんど影響しないことが示されている6).このことから,ヒストンH3のLys9のトリメチル化修飾のみならず,別の機構によりトランスポゾン領域の発現が抑制される可能性が考えられる.
ヒストンH1はヌクレオソームコアの外側からクロマチンと結合し,クロマチンの高次構造の形成を促進するリンカーヒストンであることが知られている10).また,ヒストンH1はおもにトランスポゾン領域を標的とし,その転写の制御を担うという報告もある11).近年の研究においては,ヒストンH1は特定のクロマチン領域につねに安定的に結合しているのではなく,結合と解離をくり返すとされている12,13).したがって,ヒストンH1を特定のクロマチン領域に安定的に結合させるためには,特定の修飾やタンパク質が必要なのではないかと考えられる.しかしながら,ヒストンH1の位置情報を規定するタンパク質の知見はいまだ乏しい.
1.PiwiはヒストンH1と複合体を形成する
ショウジョウバエの卵巣に由来する培養細胞である卵巣性体細胞OSCは,piRNAによるトランスポゾン領域の発現の抑制を観察し操作することのできる培養細胞株である14).RNAi法によるノックダウンや過剰発現系が開発されており,生化学的な解析も容易であることから,このOSCを用いて解析を進めた.OSCの核の画分を用いて抗Piwi抗体による免疫沈降を行い,銀染色および質量分析によりPiwiと結合するタンパク質を同定した.その結果,Piwiの核における相互作用タンパク質としてヒストンH1が同定された.PiwiとヒストンH1との相互作用はウェスタンブロッティング法およびin vitro合成されたヒストンH1を用いたGSTプルダウン法により確認された.
2.ヒストンH1はPiwiの標的となるトランスポゾン領域の発現を抑制する
PiwiあるいはヒストンH1のノックダウンにより発現の変動する遺伝子を網羅的に同定することを目的として,RNA-seq解析を行った.その結果,RNAポリメラーゼIIにより転写される遺伝子の多くについては影響がみられなかった一方,多くのトランスポゾン領域の発現量が上昇していた.ヒストンH1をノックダウンした際には6割以上のトランスポゾン領域の発現が,Piwiをノックダウンした際には2割以上のトランスポゾン領域の発現が2倍以上に上昇した.さらに,発現の変動したトランスポゾン領域の種類を詳細に解析した結果,Piwiにより制御されるトランスポゾン領域のほとんどはヒストンH1により制御されていることが明らかにされた.これをうけて,トランスポゾン領域を3つのグループに分けた.PiwiおよびヒストンH1により制御されるトランスポゾン領域(グループI),ヒストンH1のみにより制御されるトランスポゾン領域(グループII),PiwiあるいはヒストンH1により制御されないトランスポゾン領域(グループIII)である.特徴として,PiwiおよびヒストンH1により制御されるトランスポゾン領域はユークロマチン領域に存在するトランスポゾン領域である割合が比較的高かった.このことから,転移活性の高いトランスポゾン領域が選択的にPiwiおよびヒストンH1により制御されている可能性が考えられた.さらに,Piwi-piRNA複合体による制御はトランスポゾン領域にとどまらずその周辺の領域にも波及することが知られている6).周辺の領域にコードされる遺伝子についても解析したところ,PiwiおよびヒストンH1のノックダウンにより,PiwiおよびヒストンH1により制御されるトランスポゾン領域の周辺にコードされる遺伝子の発現量が上昇した.これらのことから,PiwiおよびヒストンH1は共通のトランスポゾン領域の発現を抑制すると考えられた.
3.PiwiはヒストンH1のトランスポゾン領域への結合の安定性を制御する
PiwiおよびヒストンH1により制御されるトランスポゾン領域のPiwiおよびヒストンH1による発現の抑制について,PiwiとヒストンH1との関係性を明らかにするためヒストンH1についてChIP-seq解析を行った.その結果,Piwiをノックダウンしたときには対照と比較してヒストンH1のChIPシグナルは減少した.さらに,このChIPシグナルの減少はPiwiおよびヒストンH1により制御されるトランスポゾン領域に特異的に検出され,ヒストンH1のみにより制御されるトランスポゾン領域についてはPiwiのノックダウンによるヒストンH1のChIPシグナルの減少は確認されなかった.さらに,トランスポゾン領域の周辺の領域について解析した結果,同様に,PiwiおよびヒストンH1により制御されるトランスポゾン領域の周辺の領域において特異的に,PiwiのノックダウンによりヒストンH1のChIPシグナルが減少した.これらのことから,PiwiのノックダウンによりPiwiの標的となるトランスポゾン領域へのヒストンH1の安定的な結合が阻害されることが示唆された.
4.PiwiおよびヒストンH1はクロマチンの構造を制御することによりトランスポゾン領域の発現を抑制する
ここまでの結果から,PiwiがヒストンH1の制御を介してトランスポゾン領域の発現を抑制することが想定されたため,ヒストンH1によるクロマチンの構造の凝集がPiwi-piRNA複合体によるトランスポゾン領域の発現の抑制に関連する可能性について検討した.解析にはATAC-seq法とよばれるトランスポザーゼを用いてクロマチンの状態を解析する方法を用いた.アクセスしやすいオープンなクロマチン領域はトランスポザーゼが作用しやすい.トランスポザーゼの作用によりシークエンス解析を可能にするタグ配列が挿入されることにより,アクセスしやすいクロマチン領域をシグナルとして検出することができる.解析の結果,PiwiあるいはヒストンH1をノックダウンすることによりPiwiおよびヒストンH1により制御されるトランスポゾン領域のアクセスのしやすさが増加することが明らかにされた.つまり,PiwiおよびヒストンH1はともに標的となるトランスポゾン領域におけるクロマチンの構造の凝集を制御することが示された.
5.Piwi-piRNA複合体はヒストンH1をヒストンH3のLys9のトリメチル化修飾と並行して制御することによりトランスポゾン領域の発現を抑制する
先行研究より,Piwi-piRNA複合体はヒストンH3のLys9のトリメチル化修飾をともなう制御によりトランスポゾン領域の発現を抑制することが知られていた4-7).これをうけて,ヒストンH3のLys9のトリメチル化修飾とヒストンH1との関係性について解析した.PiwiあるいはヒストンH1をノックダウンしたときのヒストンH3のLys9のトリメチル化修飾を解析した結果,先行研究と同様に,PiwiノックダウンによりPiwiおよびヒストンH1により発現の制御されるグループIのトランスポゾン領域におけるヒストンH3のLys9のトリメチル化修飾が大きく減少した.一方で,ヒストンH1のノックダウンはヒストンH3のLys9のトリメチル化修飾に影響しなかった.これらのことから,ヒストンH1は既知のPiwi-piRNA複合体によるヒストンH3のLys9のトリメチル化修飾をともなう制御と並行して,標的となるトランスポゾン領域の発現を抑制すると考えられた.
さらに,Piwi-piRNA複合体によるトランスポゾン領域の発現の抑制において,ヒストンH3のLys9のトリメチル化修飾によりリクルートされるHP1a 4-7) とヒストンH1との関係性について解析した.ChIP-seq解析により,ヒストンH1のノックダウンはHP1aのトランスポゾン領域への結合に影響しないこと,および,HP1aのノックダウンはヒストンH1のトランスポゾン領域への結合にほぼ影響しないことが示された.さらに,HP1aのChIPシグナルとヒストンH3のLys9のトリメチル化のChIPシグナルに重なりが確認された一方,ヒストンH1のChIPシグナルとヒストンH3のLys9のトリメチル化のChIPシグナルには有意な重なりはみられなかった.また,ヒストンH1およびHP1aをともにノックダウンしたところ,それぞれを個別にノックダウンした場合と比較して,標的となるトランスポゾン領域の発現の相乗的な脱抑制が観察された.これらの結果から,ヒストンH1はHP1aと並行して機能することにより,Piwiによるトランスポゾン領域の発現の抑制に機能すると考えられた(図1).
おわりに
この研究により,Piwi-piRNA複合体によるトランスポゾンの抑制の実態が複数の経路の制御をともなうクロマチンの構造の制御であることが明らかにされた(図1).このことから,Piwiは複雑な制御機構によりクロマチンの構造を制御していると考えられた.先行研究により,複数のタンパク質がPiwi-piRNA複合体によるトランスポゾン領域の発現の抑制に関与することが示唆されている2).例として,MaelはヒストンH1と同様にノックダウンによりトランスポゾンの脱抑制が起こる一方で,ヒストンH3のLys9のトリメチル化修飾には影響しないことが知られている6).また,PanxはヒストンH3のLys9のトリメチル化に必須であることが報告されている8,9).これらのタンパク質とPiwiやヒストンH1との関係性も興味深い.また,この研究から得られた知見と先行研究15) とをあわせて考えると,ヒストンH1およびヒストンH3のLys9のトリメチル化はPiwiの下流においてヌクレオソームのターンオーバーを制御している可能性が考えられる.Piwiによるクロマチンの構造のダイナミックな制御がほかのクロマチンタンパク質およびクロマチンの修飾にどのように影響するかを検討することにより,Piwi-piRNA複合体によるトランスポゾンの抑制の機構の理解が進展することが期待される.
文 献
- Goodier, J. L. & Kazazian, H. H. Jr.: Retrotransposons revisited: the restraint and rehabilitation of parasites. Cell, 135, 23-35 (2008)[PubMed]
- Iwasaki, Y. W., Siomi, M. C. & Siomi, H.: PIWI-interacting RNA: its biogenesis and functions. Annu. Rev. Biochem., 84, 405-433 (2015)[PubMed]
- Soshnev, A. A., Josefowicz, S. Z. & Allis, C. D.: Greater than the sum of parts: complexity of the dynamic epigenome. Mol. Cell, 62, 681-694 (2016)[PubMed]
- Le Thomas, A., Rogers, A. K., Webster, A. et al.: Piwi induces piRNA-guided transcriptional silencing and establishment of a repressive chromatin state. Genes Dev., 27, 390-399 (2013)[PubMed]
- Rozhkov, N. V., Hammell, M. & Hannon, G. J.: Multiple roles for Piwi in silencing Drosophila transposons. Genes Dev. 27, 400-412 (2013)[PubMed]
- Sienski, G., Donertas, D. & Brennecke, J.: Transcriptional silencing of transposons by Piwi and maelstrom and its impact on chromatin state and gene expression. Cell, 151, 964-980 (2012)[PubMed]
- Wang, S. H. & Elgin, S. C.: Drosophila Piwi functions downstream of piRNA production mediating a chromatin-based transposon silencing mechanism in female germ line. Proc. Natl. Acad. Sci. USA, 108, 21164-21169 (2011)[PubMed]
- Sienski, G., Batki, J., Senti, K. A. et al.: Silencio/CG9754 connects the Piwi-piRNA complex to the cellular heterochromatin machinery. Genes Dev., 29, 2258-2271 (2015)[PubMed]
- Yu, Y., Gu, J., Jin, Y. et al.: Panoramix enforces piRNA-dependent cotranscriptional silencing. Science, 350, 339-342 (2015)[PubMed]
- Catez, F., Ueda, T. & Bustin, M.: Determinants of histone H1 mobility and chromatin binding in living cells. Nat. Struct. Mol. Biol., 13, 305-310 (2006)[PubMed]
- Lu, X., Wontakal, S. N., Kavi, H. et al.: Drosophila H1 regulates the genetic activity of heterochromatin by recruitment of Su(var)3-9. Science, 340, 78-81 (2013)[PubMed]
- Bustin, M., Catez, F. & Lim, J. H.: The dynamics of histone H1 function in chromatin. Mol. Cell, 17, 617-620 (2005)[PubMed]
- Misteli, T., Gunjan, A., Hock, R. et al.: Dynamic binding of histone H1 to chromatin in living cells. Nature, 408, 877-881 (2000)[PubMed]
- Saito, K., Inagaki, S., Mituyama, T. et al.: A regulatory circuit for piwi by the large Maf gene traffic jam in Drosophila. Nature 461, 1296-1299 (2009)[PubMed]
- Grewal, S. I. & Jia, S.: Heterochromatin revisited. Nat. Rev. Genet., 8, 35-46 (2007)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2011年 慶應義塾大学大学院政策・メディア研究科後期博士課程 修了,同年より慶應義塾大学医学部 特任助教(現 助教).
研究テーマ:小分子RNAの関与する生命現象の分子機構の解明および俯瞰的な理解.
塩見 春彦(Haruhiko Siomi)
慶應義塾大学医学部 教授.
研究室URL:http://www.siomilab.med.keio.ac.jp/
齋藤 都暁(Kuniaki Saito)
慶應義塾大学医学部 准教授.
© 2016 岩崎由香・塩見春彦・齋藤都暁 Licensed under CC 表示 2.1 日本