アレスチンの移行は光情報変換系によって促進されその量は異性化したロドプシンの量に対し化学量論的である
佐藤 明子
(名古屋大学大学院理学研究科 生命理学専攻細胞形態形成グループ)
email:佐藤明子
DOI: 10.7875/first.author.2010.044
Arrestin translocation is stoichiometric to rhodopsin isomerization and accelerated by phototransduction in Drosophila photoreceptors.
Akiko K. Satoh, Hongai Xia, Limin Yan, Che-Hsiung Liu, Roger C. Hardie, Donald F. Ready
Neuron, 67, 997-1008 (2010)
視覚アレスチンは,光を受け取ると視細胞の細胞体から光受容膜である脊椎動物の桿体外節あるいは無脊椎動物の感桿分体へと移行し,活性化ロドプシンを不活性化する.しかしながら,このアレスチン移行の分子機構は解明されておらず,一致した見解は得られていなかった.暗順応状態のショウジョウバエの視細胞の間接蛍光抗体法による観察から,アレスチンが細胞質内の細胞内膜系に結合していることがわかった.移行したアレスチンの量は間接蛍光抗体法およびアレスチン-GFP融合タンパク質を用いた観察から,ロドプシンの異性化量に対して化学量論的であることがわかった.アレスチン移行の速度は野生型ショウジョウバエではきわめて速く,かつ,電気生理学的に計測された経時変化と一致した.その速度は,光情報変換系の3つの因子,ホスホリパーゼC,Gタンパク質Gq,TRPチャンネルのうちのひとつを遺伝的に除くと野生型の10倍から100倍も遅くなった.これらの結果は,ショウジョウバエの視細胞においてアレスチンの移行は拡散により起こっていて,光情報変換とそれにともなうCa2+の細胞内への流入によりいちじるしく加速されることを示していた.
近年,光条件の違いにより蛋白質の局在がダイナミックに変化する現象(蛋白質の移行,translocation)が発見され,光順応のひとつの機構として視覚の研究者のあいだで注目をあつめている1,2).しかし,その分子機構はまだほとんどわかっていない.このような蛋白質の移行は,視細胞以外の細胞でも外部からの刺激に対して順応するため広く一般に使用されている原理であろう.この10年ほど,アレスチン移行の分子機構について多くの研究が行われてきた.2つの相反する仮説,すなわち,拡散モデルとモータータンパク質による輸送モデルが提唱され,また,この過程への光情報変換系の関与の有無についても一致した見解が得られないまま議論は続いている1,2).
ショウジョウバエの視細胞の光情報変換系はホスホリパーゼCに依存するCa2+流入カスケードである.この過程は光受容タンパク質ロドプシンが光を吸収して活性型のメタロドプシンに変換することによって開始する3,4).ショウジョウバエ視細胞には2種類の視覚アレスチン,Arr1とArr2が発現しており,これらが結合することで活性型であるメタロドプシンは不活性化される.量的に優勢のArr2は暗順応条件下ではその約25%が光受容膜に,残り75%が細胞質に存在しているが,光を照射するとすべてが光受容膜に局在する5-7).ショウジョウバエ視細胞でのアレスチン移行の分子機構に関して現時点でもっとも影響力のある仮説はミオシンIIIモーター(NinaC)による輸送モデルである6,8,9).この仮説では,暗所でアレスチンはホスファチジルイノシトール1,4,5-トリスリン酸に富む小胞に結合しており,光を受け取るとこの小胞をミオシンIIIが感桿分体を構成する微絨毛の内部へと輸送するためアレスチンが移行するとされている.しかし,アレスチン移行のNinaC依存性は以前の筆者らの観察では再現できず7),また,微絨毛はきわめて微小な管状の膜(膜外部まで含めた直径が50 nm)であるため小胞が内部に入り込む余地は存在せず,これまでも疑問が呈されてきた4).
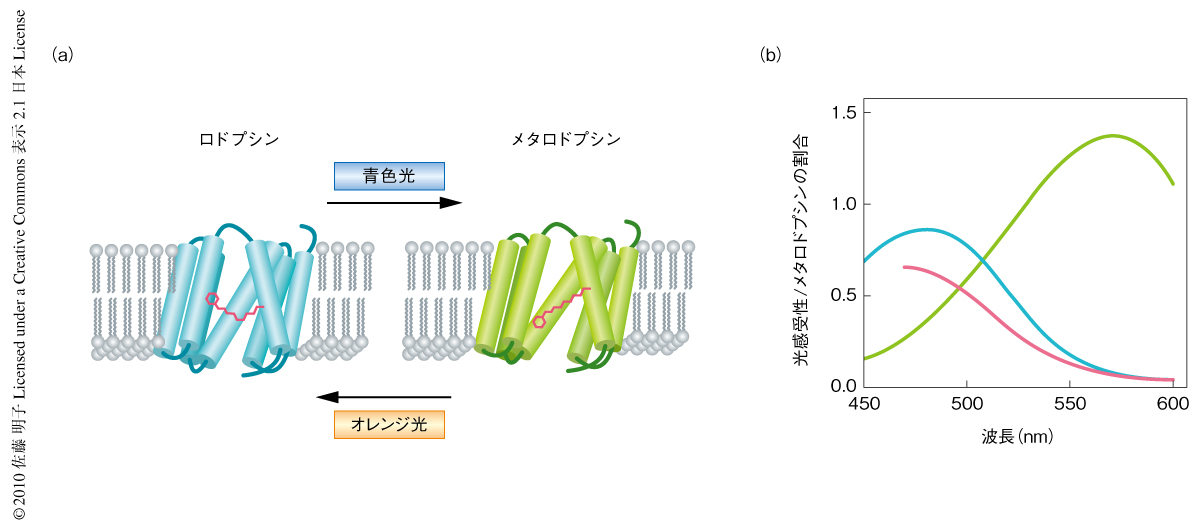
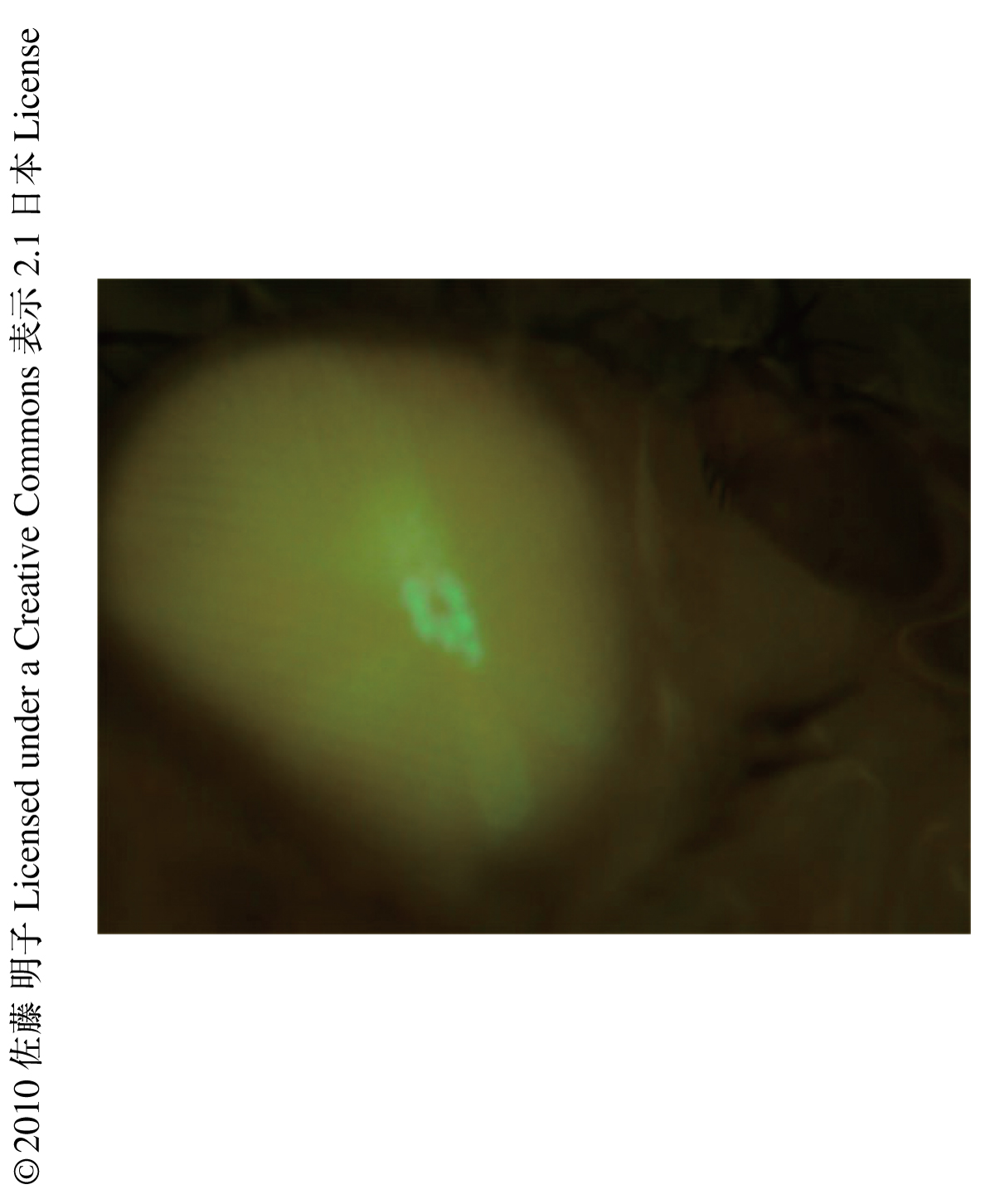
ショウジョウバエのロドプシンは2安定型色素(bistable pigment)であり,光を吸収して生成したメタロドプシンはもういちど光を吸収すると不活性型であるロドプシンにもどる.ロドプシンの吸収極大波長が480 nmなのに対してメタロドプシンの吸収極大波長は580 nm付近にあるため,青色光によりメタロドプシンを,オレンジ光によりロドプシンを生成することが可能である(図1).ショウジョウバエではこのロドプシンの2安定性という性質を用いてArr2-GFP融合タンパク質の移行を同一のショウジョウバエで何度も観察することが可能である.また,光受容膜に存在するArr2-GFP融合タンパク質の量は深部偽瞳孔(deep pseudopupil)とよばれる複眼中央部に形成される個眼用の虚像を用いることで,生きたショウジョウバエにおいて定量的に観察することが可能である(図2).この方法を用いてArr2-GFP融合タンパク質の移行を観察し,深部偽瞳孔の蛍光強度を時間に対してグラフ化したところ,時定数6.8秒の単一の指数関数で近似することができた.このことから,アレスチンは非常に速い経時変化で光受容膜へと移行することが明らかとなった.
つぎに,メタロドプシンの生成量とアレスチンの移行量との関係を検討した.さきに述べたように,2安定性であるロドプシンでは照射する光の波長により生成するメタロドプシンの量を調節できる.そこで,さまざまな波長の光を照射して一定時間おいたのち,光受容膜に存在するArr2-GFP融合タンパク質の蛍光強度を測定した.青色光を照射したときの蛍光強度はすべてのArr2-GFP融合タンパク質(100%)が光受容膜へ局在した場合の強度,オレンジ光を照射したときの蛍光強度は暗所と同様の25%のアレスチンが光受容膜に存在した場合の強度とみなすことが可能である.そこで,さまざまな波長の光を照射したとき,その蛍光強度から光受容膜に存在するArr2-GFP融合タンパク質の割合,さらに,波長依存的に移行したアレスチンの割合を容易に算出できる.
こうして求めた波長依存的なArr2-GFP融合タンパク質の移行の割合は,野生型ショウジョウバエにおいて内在性のアレスチンにつき間接蛍光抗体法により測定した波長依存的なアレスチン移行の割合と一致した.なお,Arr2-GFP融合タンパク質の発現量は内在性アレスチンと比較して少なくその量的な影響は無視できた.さらに,生成したメタロドプシンの割合はロドプシンとメタロドプシンの吸収曲線から導き出せるだけでなく,メタロドプシンの発する蛍光を用いても測定が可能であった.
こうして計算された,さまざまな波長の光を照射したときのアレスチンの移行量とメタロドプシンの生成量との割合を,これまでの研究からよく知られているロドプシンとアレスチンとの分子存在比2.7を用い,また,暗所で光受容膜に存在するアレスチンを全体の25%としてメタロドプシンとアレスチンの数に変換してグラフ化したところ,アレスチンが1本の微絨毛あたり約150分子~325分子のあいだではきれいな一対一の関係が観察された.すなわち,アレスチンはメタロドプシンの量に対して化学量論的に移行していることが明らかとなった.そしてこのことは,アレスチンの移行が拡散によって起こっていることを示していた.
アレスチンの移行における光情報変換系の影響については脊椎動物において相反する結果が報告されており議論が分かれている1,2).ショウジョウバエにおいては,最近,光情報変換系の影響を否定する報告がなされた10).筆者らは,Arr2-GFP融合タンパク質によるin vivo観察と間接蛍光抗体法による内在性アレスチンの局在観察により独自に解析を行なった.
Arr2-GFP融合タンパク質を用いて光情報変換系に必須のnorpA遺伝子のヌル変異体norpAP24におけるアレスチンの移行を観察したところ,この変異体では移行がいちじるしく遅くなっていることがわかった.時間を横軸,蛍光強度を縦軸にとったグラフは野生型とは異なり,2つの指数関数の和にフィットした.その時定数は91秒と1007秒であり,野生型ショウジョウバエでの時定数6.8秒と比較して,おのおの10倍以上あるいは100倍以上も遅くなっていることがわかった.
また,間接蛍光抗体法を用いてnorpAP24変異体について観察を行ったところ,青色光を照射したのちただちに完全暗所に固定した場合,すべてのアレスチンが光受容膜に移行している野生型とは異なって,この変異体では細胞質中に多数のシグナルが観察された.一方,青色光を照射したのち暗所に1時間おいたときには,この変異体でもすべてのアレスチンが光受容膜に移行していた.光情報変換系に必須の因子であるGタンパク質GqおよびTRPチャンネルの変異体についても同様の解析を行った結果,やはり,アレスチン移行の遅延が観察された.これらの結果から,光情報変換系がアレスチンの移行を加速していることがわかった.
光情報変換系は最終的に細胞内Ca2+濃度の上昇をひき起こす.アレスチン移行の光情報変換系による加速は細胞内Ca2+濃度の上昇が直接的な原因である可能性が考えられた.ショウジョウバエを嫌気条件下におくとミトコンドリアにおけるATP合成反応が低下し,細胞内Ca2+濃度を低レベルに抑えるためのポンプが正常に機能せず,結果として細胞内Ca2+濃度が上昇する.そこで,野生型ショウジョウバエとnorpA遺伝子の変異体を嫌気条件下におき,細胞内Ca2+濃度を上昇させた状態で青色光を照射してメタロドプシンを生成させアレスチンの移行を観察した.その結果,嫌気条件下では野生型と変異体でのアレスチンの移行はそれぞれ時定数30.8秒と31.2秒の1次指数関数で近似でき,両者のあいだに差はみられなかった.norpA遺伝子の変異体においては嫌気条件下では好気条件下と比較してアレスチンの移行がいちじるしく加速していることがわかった.この変異体での嫌気条件における加速と,さらに,その時定数の値が野生型とほぼ同一であったことから,アレスチン移行の加速が細胞内へのCa2+の流入によってひき起こされたと結論できた.しかし,野生型ショウジョウバエの嫌気条件下でのアレスチン移行の時定数が好気条件下と比較して4.5倍ほど遅延したことは,嫌気条件では細胞内Ca2+濃度以外にアレスチンの移行を制御するなんらかの因子が欠損している可能性がある.
暗順応条件下でのアレスチンの局在を詳細に観察した結果,細胞内アレスチンと小胞体マーカーであるHDELとが部分的な共局在を示すことがわかり,暗所ではアレスチンは小胞体などの細胞内膜系と結合していることがわかった.アレスチンの結合する相手として細胞内膜系とメタロドプシンの2つが存在することが明らかになったので,筆者らは,アレスチン移行の分子機構として“two-sinkモデル”を提唱した.
まず,暗順応状態では細胞内Ca2+濃度は低く,約75%のアレスチンは細胞内膜系に弱い親和性をもって結合している.光を照射すると光情報変換系により細胞内にCa2+が流入しアレスチンは細胞内膜系から遊離する.自由拡散することが可能になったアレスチンは,光照射によって生成したより親和性の高いメタロドプシンに選択的に結合する.光情報変換系が欠損した細胞では光を照射しても細胞内Ca2+濃度が上昇しないため,アレスチンは細胞内膜系から遊離できず短時間ではメタロドプシンと結合できない.しかし,アレスチンのメタロドプシンに対する親和性は細胞内膜系への親和性と比べてはるかに高いため,アレスチンは低い細胞内Ca2+濃度で起こる遅い拡散反応により最終的には光によって生成したメタロドプシンと化学量論的に結合する.
この研究により,ショウジョウバエにおけるアレスチン移行の分子機構について2つの結論が得られた.
ひとつは,アレスチンは異性化したロドプシンの量に対して化学量論的に移行することである.この知見はこれまで議論されてきた2つの相反する仮説,すなわち,拡散モデルとモータータンパク質による輸送モデルのうち前者を強力に支持する.また,今回,Arr2-GFP融合タンパク質を用いてin vivoでのアレスチンの移行を観察したことにより,この過程が時定数6.8秒の指数関数で近似できるきわめて速い反応であることが明らかになった.この速度はモータータンパク質では達成不可能だと考えられ,拡散による移行を支持している
もうひとつは,光情報変換系による細胞内Ca2+濃度の上昇によりアレスチンの移行が10倍から100倍にも加速されることである.この加速の分子機構は細胞内Ca2+によるアレスチンの細胞内膜系からの遊離により説明が可能であるが,その証明にはアレスチンの細胞内膜系への結合の分子機構を明らかにする必要がある.今後の研究により,結合のターゲットとなりうる分子(脂質,あるいは,細胞内膜系に結合している蛋白質)を同定しCa2+の作用を検討していくことが必要である.
略歴:1998年 大阪大学大学院理学研究科 修了,2000年 米国Purdue大学 ポスドクを経て,2008年より名古屋大学大学院理学研究科 グローバルCOE特任准教授.
研究テーマ:ショウジョウバエ視細胞をモデルとした細胞生物学.
抱負:日々,自分自身が楽しんで研究に取り組めることを大事にしつつ,まわりからも評価していただけるようなよい成果をだしていけるよう,がんばっていきたいと思います.
研究室URL:http://www.bio.nagoya-u.ac.jp/gcoe/member/sato.html
© 2010 佐藤 明子 Licensed under CC 表示 2.1 日本
(名古屋大学大学院理学研究科 生命理学専攻細胞形態形成グループ)
email:佐藤明子
DOI: 10.7875/first.author.2010.044
Arrestin translocation is stoichiometric to rhodopsin isomerization and accelerated by phototransduction in Drosophila photoreceptors.
Akiko K. Satoh, Hongai Xia, Limin Yan, Che-Hsiung Liu, Roger C. Hardie, Donald F. Ready
Neuron, 67, 997-1008 (2010)
要 約
視覚アレスチンは,光を受け取ると視細胞の細胞体から光受容膜である脊椎動物の桿体外節あるいは無脊椎動物の感桿分体へと移行し,活性化ロドプシンを不活性化する.しかしながら,このアレスチン移行の分子機構は解明されておらず,一致した見解は得られていなかった.暗順応状態のショウジョウバエの視細胞の間接蛍光抗体法による観察から,アレスチンが細胞質内の細胞内膜系に結合していることがわかった.移行したアレスチンの量は間接蛍光抗体法およびアレスチン-GFP融合タンパク質を用いた観察から,ロドプシンの異性化量に対して化学量論的であることがわかった.アレスチン移行の速度は野生型ショウジョウバエではきわめて速く,かつ,電気生理学的に計測された経時変化と一致した.その速度は,光情報変換系の3つの因子,ホスホリパーゼC,Gタンパク質Gq,TRPチャンネルのうちのひとつを遺伝的に除くと野生型の10倍から100倍も遅くなった.これらの結果は,ショウジョウバエの視細胞においてアレスチンの移行は拡散により起こっていて,光情報変換とそれにともなうCa2+の細胞内への流入によりいちじるしく加速されることを示していた.
はじめに
近年,光条件の違いにより蛋白質の局在がダイナミックに変化する現象(蛋白質の移行,translocation)が発見され,光順応のひとつの機構として視覚の研究者のあいだで注目をあつめている1,2).しかし,その分子機構はまだほとんどわかっていない.このような蛋白質の移行は,視細胞以外の細胞でも外部からの刺激に対して順応するため広く一般に使用されている原理であろう.この10年ほど,アレスチン移行の分子機構について多くの研究が行われてきた.2つの相反する仮説,すなわち,拡散モデルとモータータンパク質による輸送モデルが提唱され,また,この過程への光情報変換系の関与の有無についても一致した見解が得られないまま議論は続いている1,2).
ショウジョウバエの視細胞の光情報変換系はホスホリパーゼCに依存するCa2+流入カスケードである.この過程は光受容タンパク質ロドプシンが光を吸収して活性型のメタロドプシンに変換することによって開始する3,4).ショウジョウバエ視細胞には2種類の視覚アレスチン,Arr1とArr2が発現しており,これらが結合することで活性型であるメタロドプシンは不活性化される.量的に優勢のArr2は暗順応条件下ではその約25%が光受容膜に,残り75%が細胞質に存在しているが,光を照射するとすべてが光受容膜に局在する5-7).ショウジョウバエ視細胞でのアレスチン移行の分子機構に関して現時点でもっとも影響力のある仮説はミオシンIIIモーター(NinaC)による輸送モデルである6,8,9).この仮説では,暗所でアレスチンはホスファチジルイノシトール1,4,5-トリスリン酸に富む小胞に結合しており,光を受け取るとこの小胞をミオシンIIIが感桿分体を構成する微絨毛の内部へと輸送するためアレスチンが移行するとされている.しかし,アレスチン移行のNinaC依存性は以前の筆者らの観察では再現できず7),また,微絨毛はきわめて微小な管状の膜(膜外部まで含めた直径が50 nm)であるため小胞が内部に入り込む余地は存在せず,これまでも疑問が呈されてきた4).
1.Arr2-GFP融合タンパク質の移行のin vivoイメージング
ショウジョウバエのロドプシンは2安定型色素(bistable pigment)であり,光を吸収して生成したメタロドプシンはもういちど光を吸収すると不活性型であるロドプシンにもどる.ロドプシンの吸収極大波長が480 nmなのに対してメタロドプシンの吸収極大波長は580 nm付近にあるため,青色光によりメタロドプシンを,オレンジ光によりロドプシンを生成することが可能である(図1).ショウジョウバエではこのロドプシンの2安定性という性質を用いてArr2-GFP融合タンパク質の移行を同一のショウジョウバエで何度も観察することが可能である.また,光受容膜に存在するArr2-GFP融合タンパク質の量は深部偽瞳孔(deep pseudopupil)とよばれる複眼中央部に形成される個眼用の虚像を用いることで,生きたショウジョウバエにおいて定量的に観察することが可能である(図2).この方法を用いてArr2-GFP融合タンパク質の移行を観察し,深部偽瞳孔の蛍光強度を時間に対してグラフ化したところ,時定数6.8秒の単一の指数関数で近似することができた.このことから,アレスチンは非常に速い経時変化で光受容膜へと移行することが明らかとなった.
2.移行するアレスチンの量は異性化したロドプシンの量に対し化学量論的でその移行は拡散による
つぎに,メタロドプシンの生成量とアレスチンの移行量との関係を検討した.さきに述べたように,2安定性であるロドプシンでは照射する光の波長により生成するメタロドプシンの量を調節できる.そこで,さまざまな波長の光を照射して一定時間おいたのち,光受容膜に存在するArr2-GFP融合タンパク質の蛍光強度を測定した.青色光を照射したときの蛍光強度はすべてのArr2-GFP融合タンパク質(100%)が光受容膜へ局在した場合の強度,オレンジ光を照射したときの蛍光強度は暗所と同様の25%のアレスチンが光受容膜に存在した場合の強度とみなすことが可能である.そこで,さまざまな波長の光を照射したとき,その蛍光強度から光受容膜に存在するArr2-GFP融合タンパク質の割合,さらに,波長依存的に移行したアレスチンの割合を容易に算出できる.
こうして求めた波長依存的なArr2-GFP融合タンパク質の移行の割合は,野生型ショウジョウバエにおいて内在性のアレスチンにつき間接蛍光抗体法により測定した波長依存的なアレスチン移行の割合と一致した.なお,Arr2-GFP融合タンパク質の発現量は内在性アレスチンと比較して少なくその量的な影響は無視できた.さらに,生成したメタロドプシンの割合はロドプシンとメタロドプシンの吸収曲線から導き出せるだけでなく,メタロドプシンの発する蛍光を用いても測定が可能であった.
こうして計算された,さまざまな波長の光を照射したときのアレスチンの移行量とメタロドプシンの生成量との割合を,これまでの研究からよく知られているロドプシンとアレスチンとの分子存在比2.7を用い,また,暗所で光受容膜に存在するアレスチンを全体の25%としてメタロドプシンとアレスチンの数に変換してグラフ化したところ,アレスチンが1本の微絨毛あたり約150分子~325分子のあいだではきれいな一対一の関係が観察された.すなわち,アレスチンはメタロドプシンの量に対して化学量論的に移行していることが明らかとなった.そしてこのことは,アレスチンの移行が拡散によって起こっていることを示していた.
3.アレスチンの移行は光情報変換カスケードによって促進される
アレスチンの移行における光情報変換系の影響については脊椎動物において相反する結果が報告されており議論が分かれている1,2).ショウジョウバエにおいては,最近,光情報変換系の影響を否定する報告がなされた10).筆者らは,Arr2-GFP融合タンパク質によるin vivo観察と間接蛍光抗体法による内在性アレスチンの局在観察により独自に解析を行なった.
Arr2-GFP融合タンパク質を用いて光情報変換系に必須のnorpA遺伝子のヌル変異体norpAP24におけるアレスチンの移行を観察したところ,この変異体では移行がいちじるしく遅くなっていることがわかった.時間を横軸,蛍光強度を縦軸にとったグラフは野生型とは異なり,2つの指数関数の和にフィットした.その時定数は91秒と1007秒であり,野生型ショウジョウバエでの時定数6.8秒と比較して,おのおの10倍以上あるいは100倍以上も遅くなっていることがわかった.
また,間接蛍光抗体法を用いてnorpAP24変異体について観察を行ったところ,青色光を照射したのちただちに完全暗所に固定した場合,すべてのアレスチンが光受容膜に移行している野生型とは異なって,この変異体では細胞質中に多数のシグナルが観察された.一方,青色光を照射したのち暗所に1時間おいたときには,この変異体でもすべてのアレスチンが光受容膜に移行していた.光情報変換系に必須の因子であるGタンパク質GqおよびTRPチャンネルの変異体についても同様の解析を行った結果,やはり,アレスチン移行の遅延が観察された.これらの結果から,光情報変換系がアレスチンの移行を加速していることがわかった.
4.アレスチン移行の加速は細胞内へのCa2+の流入によってひき起こされる
光情報変換系は最終的に細胞内Ca2+濃度の上昇をひき起こす.アレスチン移行の光情報変換系による加速は細胞内Ca2+濃度の上昇が直接的な原因である可能性が考えられた.ショウジョウバエを嫌気条件下におくとミトコンドリアにおけるATP合成反応が低下し,細胞内Ca2+濃度を低レベルに抑えるためのポンプが正常に機能せず,結果として細胞内Ca2+濃度が上昇する.そこで,野生型ショウジョウバエとnorpA遺伝子の変異体を嫌気条件下におき,細胞内Ca2+濃度を上昇させた状態で青色光を照射してメタロドプシンを生成させアレスチンの移行を観察した.その結果,嫌気条件下では野生型と変異体でのアレスチンの移行はそれぞれ時定数30.8秒と31.2秒の1次指数関数で近似でき,両者のあいだに差はみられなかった.norpA遺伝子の変異体においては嫌気条件下では好気条件下と比較してアレスチンの移行がいちじるしく加速していることがわかった.この変異体での嫌気条件における加速と,さらに,その時定数の値が野生型とほぼ同一であったことから,アレスチン移行の加速が細胞内へのCa2+の流入によってひき起こされたと結論できた.しかし,野生型ショウジョウバエの嫌気条件下でのアレスチン移行の時定数が好気条件下と比較して4.5倍ほど遅延したことは,嫌気条件では細胞内Ca2+濃度以外にアレスチンの移行を制御するなんらかの因子が欠損している可能性がある.
5.アレスチンの細胞内膜系への結合とアレスチン移行のモデル
暗順応条件下でのアレスチンの局在を詳細に観察した結果,細胞内アレスチンと小胞体マーカーであるHDELとが部分的な共局在を示すことがわかり,暗所ではアレスチンは小胞体などの細胞内膜系と結合していることがわかった.アレスチンの結合する相手として細胞内膜系とメタロドプシンの2つが存在することが明らかになったので,筆者らは,アレスチン移行の分子機構として“two-sinkモデル”を提唱した.
まず,暗順応状態では細胞内Ca2+濃度は低く,約75%のアレスチンは細胞内膜系に弱い親和性をもって結合している.光を照射すると光情報変換系により細胞内にCa2+が流入しアレスチンは細胞内膜系から遊離する.自由拡散することが可能になったアレスチンは,光照射によって生成したより親和性の高いメタロドプシンに選択的に結合する.光情報変換系が欠損した細胞では光を照射しても細胞内Ca2+濃度が上昇しないため,アレスチンは細胞内膜系から遊離できず短時間ではメタロドプシンと結合できない.しかし,アレスチンのメタロドプシンに対する親和性は細胞内膜系への親和性と比べてはるかに高いため,アレスチンは低い細胞内Ca2+濃度で起こる遅い拡散反応により最終的には光によって生成したメタロドプシンと化学量論的に結合する.
おわりに
この研究により,ショウジョウバエにおけるアレスチン移行の分子機構について2つの結論が得られた.
ひとつは,アレスチンは異性化したロドプシンの量に対して化学量論的に移行することである.この知見はこれまで議論されてきた2つの相反する仮説,すなわち,拡散モデルとモータータンパク質による輸送モデルのうち前者を強力に支持する.また,今回,Arr2-GFP融合タンパク質を用いてin vivoでのアレスチンの移行を観察したことにより,この過程が時定数6.8秒の指数関数で近似できるきわめて速い反応であることが明らかになった.この速度はモータータンパク質では達成不可能だと考えられ,拡散による移行を支持している
もうひとつは,光情報変換系による細胞内Ca2+濃度の上昇によりアレスチンの移行が10倍から100倍にも加速されることである.この加速の分子機構は細胞内Ca2+によるアレスチンの細胞内膜系からの遊離により説明が可能であるが,その証明にはアレスチンの細胞内膜系への結合の分子機構を明らかにする必要がある.今後の研究により,結合のターゲットとなりうる分子(脂質,あるいは,細胞内膜系に結合している蛋白質)を同定しCa2+の作用を検討していくことが必要である.
文 献
- Slepak, V. Z. & Hurley, J. B.: Mechanism of light-induced translocation of arrestin and transducin in photoreceptors: interaction-restricted diffusion. IUBMB Life, 60, 2-9 (2008)[PubMed]
- Calvert, P. D., Strissel, K. J., Schiesser, W. E. et al.: Light-driven translocation of signaling proteins in vertebrate photoreceptors. Trends Cell Biol., 16, 560-568 (2006)[PubMed]
- Yau, K. W. & Hardie, R. C.: Phototransduction motifs and variations. Cell, 139, 246-264 (2009)[PubMed]
- Hardie, R. C. & Postma, M.: Phototransduction in microvillar photoreceptors of Drosophila and other invertebrates. in The Senses: A Comprehensive Reference, vol.1 (eds. by Masland, R. H. & Albright, T. D.), pp.77-130, Academic Press, San Diego (2008)
- Alloway, P. G., Howard, L. & Dolph, P. J.: The formation of stable rhodopsin-arrestin complexes induces apoptosis and photoreceptor cell degeneration. Neuron, 28, 129-138 (2000)[PubMed]
- Lee, S. J., Xu, H., Kang, L. W. et al.: Light adaptation through phosphoinositide-regulated translocation of Drosophila visual arrestin. Neuron, 39, 121-132 (2003)[PubMed]
- Satoh, A. K. & Ready, D. F.: Arrestin1 mediates light-dependent rhodopsin endocytosis and cell survival. Curr. Biol., 15, 1722-1733 (2005)[PubMed]
- Lee, S. J. & Montell, C.: Light-dependent translocation of visual arrestin regulated by the NINAC myosin III. Neuron, 43, 95-103 (2004)[PubMed]
- Strissel, K. J. & Arshavsky, V. Y.: Myosin III illuminates the mechanism of arrestin translocation. Neuron, 43, 2-4 (2004)[PubMed]
- Elsaesser, R., Kalra, D., Li, R. et al.: Light-induced translocation of Drosophila visual Arrestin2 depends on Rac2. Proc. Natl. Acad. Sci. USA, 107, 4740-4745 (2005)[PubMed]
著者プロフィール
略歴:1998年 大阪大学大学院理学研究科 修了,2000年 米国Purdue大学 ポスドクを経て,2008年より名古屋大学大学院理学研究科 グローバルCOE特任准教授.
研究テーマ:ショウジョウバエ視細胞をモデルとした細胞生物学.
抱負:日々,自分自身が楽しんで研究に取り組めることを大事にしつつ,まわりからも評価していただけるようなよい成果をだしていけるよう,がんばっていきたいと思います.
研究室URL:http://www.bio.nagoya-u.ac.jp/gcoe/member/sato.html
© 2010 佐藤 明子 Licensed under CC 表示 2.1 日本