急性骨髄性白血病に対し効果のある新たなセレブロンモジュレーターの開発
伊藤拓水・半田 宏
(東京医科大学 ナノ粒子先端医学応用講座)
email:伊藤拓水
DOI: 10.7875/first.author.2016.076
A novel cereblon modulator recruits GSPT1 to the CRL4CRBN ubiquitin ligase.
Mary E. Matyskiela, Gang Lu, Takumi Ito, Barbra Pagarigan, Chin-Chun Lu, Karen Miller, Wei Fang, Nai-Yu Wang, Derek Nguyen, Jack Houston, Gilles Carmel, Tam Tran, Mariko Riley, Lyn’Al Nosaka, Gabriel C. Lander, Svetlana Gaidarova, Shuichan Xu, Alexander L. Ruchelman, Hiroshi Handa, James Carmichael, Thomas O. Daniel, Brian E. Cathers, Antonia Lopez-Girona, Philip P. Chamberlain
Nature, 535, 252-257 (2016)
サリドマイドや免疫調節薬の主要な標的タンパク質として同定されたセレブロンは,リガンドの種類に応じて基質の認識が変わるユビキチンリガーゼ複合体の構成タンパク質である.今回,表現型スクリーニングにより得られた新規のリガンドCC-885は急性骨髄性白血病の細胞に対し強く増殖を抑制した.CC-885と結合したセレブロンは新規の基質タンパク質GSPT1と結合し,これをユビキチン化しその分解をひき起こすことにより抗がん作用を示した.セレブロン,CC-885,GSPT1からなる複合体のX線結晶構造を決定したところ,CC-885はセレブロンとGSPT1の両者と結合することにより相互作用の場を提供し,GSPT1は特定のGlyを介しセレブロンおよびCC-885と結合していた.GSPT1にはIkarosなどセレブロンの既知の基質タンパク質との明確な相同性はなかったが,Ikarosも特定のGlyを介してリガンドとセレブロンとの複合体と結合することが示唆された.この研究において,急性骨髄性白血病に効果のあるセレブロンの新規のモジュレーターが発見され,さらには,セレブロン,モジュレーター,基質タンパク質からなる複合体の構造基盤が明らかされた
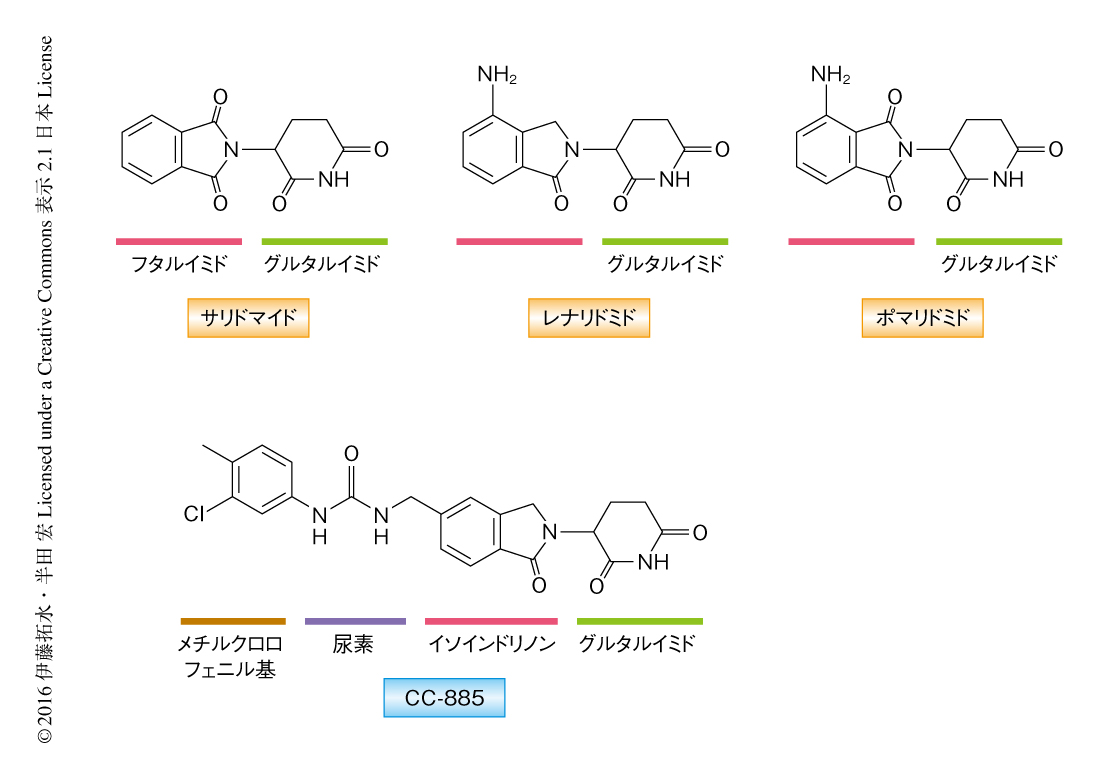
免疫調節薬はサリドマイドをリード化合物として開発された新しいタイプの抗がん剤である1).なかでも,レナリドミドおよびポマリドミドは血液がんの一種である多発性骨髄腫に対しすぐれた治療効果を示し,すでにわが国や欧米において認可されている.レナリドミドは骨髄異形成症候群に対してもすぐれた治療効果を示す.長年にわたり,サリドマイドや免疫調節薬の作用機構は不明であったが,2010年,筆者らは,磁性ナノ微粒子を用いたアフィニティ精製により共通の主要な標的タンパク質としてセレブロンを発見した2).セレブロンは442アミノ酸残基からなり,植物から哺乳類まで進化的に保存されている.DDB1,Cul4A,Rbx1とユビキチンリガーゼ複合体を構成し,基質タンパク質の受容体として機能する.構造生物学的な研究により,サリドマイドや免疫調節薬は共通の構造であるグルタルイミドがセレブロンのもつ3つのTrpからなるポケットに入り込むかたちで結合することが明らかされた3,4).この結果から,グルタルイミドを含む化合物はセレブロンと結合することが示唆された.現在では,セレブロンはグルタルイミドを含むリガンドの種類に応じて認識する基質の変わるユニークなユビキチンリガーゼ複合体の構成タンパク質であることがわかっている.免疫調節薬であるレナリドミドあるいはポマリドミドがセレブロンと結合すると,転写因子であるIkaros(IKZF1)あるいはAiolos(IKZF3)を認識するようになりその分解をひき起こす5,6).このIkarosあるいはAiolosの分解が多発性骨髄腫の細胞の増殖を抑制する.レナリドミドは骨髄異形成症候群においても治療効果を示すが,それはCk1αの分解を特異的にひき起こすことが理由である7).
以上から,さまざまなグルタルイミドをもつセレブロンのリガンドを開発することにより,治療の標的となりうるタンパク質の分解を新たに制御することが期待された.ただし,セレブロン,リガンド,基質タンパク質の結合の詳細については不明な点が多いことから,その結晶構造を解析し構造の分子基盤を明らかにする必要があった.
米国Celgene社のもつ化合物に対し表現型スクリーニングを実施し,132種類のさまざまな組織に由来するがん細胞株において増殖の抑制を示すCC-885の単離に成功した(図1).CC-885は既知の免疫調節薬のなかではレナリドミドに近いが,レナリドミドはイソインドリノンにアミノ基が付加しているのに対し,CC-885は尿素が付加しクロロメチルフェニル基と連結していた.CC-885は急性骨髄性白血病の細胞株においてサブナノモルオーダーで作用を示し,また,患者から単離した急性骨髄性白血病の細胞に対し,健常な細胞と比べ低い濃度で増殖を抑制したことから,急性骨髄性白血病の治療への臨床応用が期待された.CC-885はグルタルイミドをもつことからセレブロンと結合して作用すると想定された.CRISPR-Cas9系を用いたゲノム編集技術によりセレブロンを欠損した急性骨髄性白血病株を作製したところ,CC-885の作用はほとんどみられなくなったことから,CC-885の主要な標的タンパク質はセレブロンであることが確認された.
CC-885により分解がひき起こされるセレブロンの基質タンパク質を探索した.CC-885は急性骨髄性白血病細胞株よりは高濃度になったが,HEK293細胞に由来する293T細胞や293FT細胞においても増殖を抑制した.そこで,FLAG-HAエピトープタグを付加したセレブロンを安定的に発現する293T細胞株を樹立し,その細胞抽出液とCC-885とを混合してFLAGタグにより免疫沈降した.その結果,CC-885に依存的にセレブロンと結合する新たなタンパク質としてGSPT1が同定された.GSPT1は637アミノ酸残基からなり,eRF3αともよばれeRF1と複合体を形成する8).GSPT1とeRF1との複合体は翻訳において終止コドンを認識し,リボソームからの新生タンパク質の放出を担うことが知られている.
さまざまな細胞株にCC-885を処理したのちGSPT1の発現を解析したところ,どの細胞株においてもGSPT1の減少がみられた.また,その減少はユビキチン-プロテアソーム系に依存的であり,さらには,GSPT1はCC-885に依存してユビキチン化された.セレブロンが欠損した細胞株においてはCC-885の処理によりGSPT1は分解されなかった.GSPT1はセレブロンの既知の基質タンパク質であるIkaros,Aiolos,Ck1αとアミノ酸配列における相同性はほとんどなかった.また,これまで報告されたサリドマイド,レナリドミド,ポマリドミドといったどのリガンドによってもGSPT1とセレブロンは結合しなかった.
CC-885の抗がん作用はセレブロンによるGSPT1の分解によるのかどうか検証した.リガンドの効果がGSPT1に依存することを検証するためには,セレブロンとは結合しないが機能を保持するGSPT1の変異体を細胞株に発現させ,CC-885の活性を検証する必要があった.GSPT1は出芽酵母において保存されていたが,出芽酵母におけるホモログSUP35を293T細胞に発現させたところCC-885により分解されなかった.そこで,GSPT1とSUP35をハイブリッドしたキメラタンパク質を作製するなどしてその差異を検証し,最終的に,ヒトのGSPT1のGly575にあたる部分はSUP35においてAsnであり,Gly575をAsnに置換したGSPT1変異体はセレブロンと結合しないことが判明した.そして,急性骨髄性白血病細胞株にこのGSPT1変異体を発現させたところ,CC-885による増殖の抑制はほとんどみられなくなった.また,GSPT1をRNAi法によりノックダウンしても細胞の増殖は抑制された.以上より,CC-885の急性骨髄性白血病に対する作用はGSPT1の分解が主要な原因であると結論づけられた.
すでに,セレブロンおよびGSPT1はX線結晶構造解析により構造が決定されていたが,リガンドに依存的なセレブロンと基質タンパク質との結合の分子基盤を明らかにするため,セレブロン,CC-885,GSPT1からなる複合体の結晶構造を3.6Åの分解能で決定した(PDB ID:5HXB).GSPT1のドメイン3がセレブロンおよびCC-885と直接に結合していた.CC-885のグルタルイミドはセレブロンの3つのTrpからなるポケットと結合し,水素結合を形成していた.CC-885のイソインドリノンはセレブロンおよびGSPT1の両方と結合していた.GSPT1はセレブロンと水素結合を形成し,また,ファンデルワールス力により相互作用していた.セレブロンのN末端側はGSPT1のドメイン3と結合しており,CC-885の近傍に位置していた.GSPT1はセレブロンの3つのTrpからなるポケットのあるC末端側だけでなく,N末端側にもまたがって結合していた.
複合体を形成するために必須と考えられたセレブロンのアミノ酸残基をAlaに置換して相互作用を検証したところ,どの相互作用も失われるか減少するかした.また,表面プラズモン共鳴法によりCC-885の存在下においてGSPT1とセレブロンとのあいだの解離定数はおよそ350 nMと決定された一方,CC-885の非存在下では相互作用は検出されなかった.さらに,ネガティブ染色電子顕微鏡法により,CC-885の非存在下においてセレブロンとGSPT1の結合した粒子は検出されなかった.GSPT1は568~578残基の部分でセレブロンとCC-885との複合体と相互作用していた.ここで,GSPT1におけるとりわけ重要なアミノ酸残基はGly575であった.さきに述べたとおり,ヒトと出芽酵母のホモログとの比較から,Gly575がAsnに置換したGSPT1変異体はセレブロンと結合しないことが明らかにされたが,このGly575はCC-885のイソインドリノンと結合していた.そして,Gly575の位置は,RamachandranプロットにおいてGlyのみが許容された.
GSPT1は既知の基質タンパク質であるIkaros,Aiolos,Ck1αとアミノ酸配列においてほとんど相同性がなかった.しかしながら,GSPT1との結合に必要なアミノ酸残基のいくつかをAlaに置換したセレブロン変異体において,ポマリドミドの処理によりひき起こされるIkarosとの結合が消失したことから,GSPT1とIkarosには共通のタンパク質分解シグナル部位の存在が示唆された.Ikarosのホモロジーモデルを構築したところ,GSPT1と同様に,特定のGlyがセレブロンあるいはリガンドとの結合に重要であると予測された.Ikarosは140~168残基だけでポマリドミドの存在のもとセレブロンと結合するが,そのアミノ酸配列にはGly151が存在した.Gly151をAlaに置換したIkaros変異体は,Gly575をAlaに置換したGSPT1変異体と同様にセレブロンとの結合能が消失した.また最近,セレブロン,レナリドミド,Ck1αからなる複合体のX線結晶構造が報告され,Ck1αにおいても特定のGlyがセレブロンとの結合に必須であることが明らかにされた9).以上から,リガンドに依存的な基質タンパク質にはGlyを含む共通のセレブロン認識モチーフの存在する可能性があるという結論にいたった.
この研究により,セレブロンを制御する新しいリガンドとしてCC-885が発見された.CC-885がセレブロンと結合するとGSPT1の分解がひき起こされ,がん細胞の増殖が抑制される.がん細胞のうち,急性骨髄性白血病細胞はCC-885に対する感受性が高いことから,臨床応用への展開が期待される(図2).
新薬において標的となりうる因子はdruggableであるといわれる.たとえ,ある疾患に関連する因子について直接的な阻害化合物を設計するという点ではundruggableであっても,セレブロンの機能を変換することにより分解をひき起こし,結果としてそのはたらきが抑制されるなら標的として設定することが可能になる.CC-885は翻訳終結因子であるGSPT1をセレブロンにおける新たな基質にすることのできるセレブロンモジュレーターである.
現在,セレブロンと結合するリガンドとほかの疾患タンパク質を認識するリガンドとを融合させたPROTAC(proteolysis targeting chimera)という技術の開発が進んでいる10).セレブロンと結合するリガンドとBCR-ABL融合タンパク質と結合するリガンドとを融合することにより,すでに,セレブロンによるBCR-ABL融合タンパク質の分解が実現している.しかし,リガンドの大きさが大きくなることから細胞に移行しない,半減期が短いなど,薬理動態において問題が生じやすい.CC-885の分子量は500以下であり,低分子化合物として薬理動態における強みを保持しつつ,新たな基質タンパク質の分解をひき起こすことが可能である.
構造生物学的な解析により,セレブロンに共通する基質認識モチーフとして,少なくともGlyを含む構造が示唆された.現時点では,Gly以外の規則はわかっておらず,ほかの箇所についてはアミノ酸残基やアミノ酸配列よりジオメトリーや立体性に依存するのだろうという予測にとどまっている.しかし今後,次世代のセレブロンモジュレーターを合理的にデザインしていくうえで,この研究において得られた構造生物学的な知見は大きな手がかりになるだろう.
略歴:2010年 東京工業大学大学院生命理工学研究科にて博士号取得,2016年より東京医科大学 准教授.
研究テーマ:セレブロンの解析,および,新たなセレブロンモジュレーターの開発.
関心事:そもそも,セレブロンは薬剤と結合していない状態ではいかなる生理的な役割をもつのかに興味があります.また,CC-885のような人工物ではなく,天然のセレブロンモジュレーターが存在するのかどうか気になっています.
半田 宏(Hiroshi Handa)
東京医科大学 特任教授.
研究室URL:http://www.tokyo-med.ac.jp/nanoparticle/index.html
© 2016 伊藤拓水・半田 宏 Licensed under CC 表示 2.1 日本
(東京医科大学 ナノ粒子先端医学応用講座)
email:伊藤拓水
DOI: 10.7875/first.author.2016.076
A novel cereblon modulator recruits GSPT1 to the CRL4CRBN ubiquitin ligase.
Mary E. Matyskiela, Gang Lu, Takumi Ito, Barbra Pagarigan, Chin-Chun Lu, Karen Miller, Wei Fang, Nai-Yu Wang, Derek Nguyen, Jack Houston, Gilles Carmel, Tam Tran, Mariko Riley, Lyn’Al Nosaka, Gabriel C. Lander, Svetlana Gaidarova, Shuichan Xu, Alexander L. Ruchelman, Hiroshi Handa, James Carmichael, Thomas O. Daniel, Brian E. Cathers, Antonia Lopez-Girona, Philip P. Chamberlain
Nature, 535, 252-257 (2016)
要 約
サリドマイドや免疫調節薬の主要な標的タンパク質として同定されたセレブロンは,リガンドの種類に応じて基質の認識が変わるユビキチンリガーゼ複合体の構成タンパク質である.今回,表現型スクリーニングにより得られた新規のリガンドCC-885は急性骨髄性白血病の細胞に対し強く増殖を抑制した.CC-885と結合したセレブロンは新規の基質タンパク質GSPT1と結合し,これをユビキチン化しその分解をひき起こすことにより抗がん作用を示した.セレブロン,CC-885,GSPT1からなる複合体のX線結晶構造を決定したところ,CC-885はセレブロンとGSPT1の両者と結合することにより相互作用の場を提供し,GSPT1は特定のGlyを介しセレブロンおよびCC-885と結合していた.GSPT1にはIkarosなどセレブロンの既知の基質タンパク質との明確な相同性はなかったが,Ikarosも特定のGlyを介してリガンドとセレブロンとの複合体と結合することが示唆された.この研究において,急性骨髄性白血病に効果のあるセレブロンの新規のモジュレーターが発見され,さらには,セレブロン,モジュレーター,基質タンパク質からなる複合体の構造基盤が明らかされた
はじめに
免疫調節薬はサリドマイドをリード化合物として開発された新しいタイプの抗がん剤である1).なかでも,レナリドミドおよびポマリドミドは血液がんの一種である多発性骨髄腫に対しすぐれた治療効果を示し,すでにわが国や欧米において認可されている.レナリドミドは骨髄異形成症候群に対してもすぐれた治療効果を示す.長年にわたり,サリドマイドや免疫調節薬の作用機構は不明であったが,2010年,筆者らは,磁性ナノ微粒子を用いたアフィニティ精製により共通の主要な標的タンパク質としてセレブロンを発見した2).セレブロンは442アミノ酸残基からなり,植物から哺乳類まで進化的に保存されている.DDB1,Cul4A,Rbx1とユビキチンリガーゼ複合体を構成し,基質タンパク質の受容体として機能する.構造生物学的な研究により,サリドマイドや免疫調節薬は共通の構造であるグルタルイミドがセレブロンのもつ3つのTrpからなるポケットに入り込むかたちで結合することが明らかされた3,4).この結果から,グルタルイミドを含む化合物はセレブロンと結合することが示唆された.現在では,セレブロンはグルタルイミドを含むリガンドの種類に応じて認識する基質の変わるユニークなユビキチンリガーゼ複合体の構成タンパク質であることがわかっている.免疫調節薬であるレナリドミドあるいはポマリドミドがセレブロンと結合すると,転写因子であるIkaros(IKZF1)あるいはAiolos(IKZF3)を認識するようになりその分解をひき起こす5,6).このIkarosあるいはAiolosの分解が多発性骨髄腫の細胞の増殖を抑制する.レナリドミドは骨髄異形成症候群においても治療効果を示すが,それはCk1αの分解を特異的にひき起こすことが理由である7).
以上から,さまざまなグルタルイミドをもつセレブロンのリガンドを開発することにより,治療の標的となりうるタンパク質の分解を新たに制御することが期待された.ただし,セレブロン,リガンド,基質タンパク質の結合の詳細については不明な点が多いことから,その結晶構造を解析し構造の分子基盤を明らかにする必要があった.
1.表現型スクリーニングによるCC-885の単離
米国Celgene社のもつ化合物に対し表現型スクリーニングを実施し,132種類のさまざまな組織に由来するがん細胞株において増殖の抑制を示すCC-885の単離に成功した(図1).CC-885は既知の免疫調節薬のなかではレナリドミドに近いが,レナリドミドはイソインドリノンにアミノ基が付加しているのに対し,CC-885は尿素が付加しクロロメチルフェニル基と連結していた.CC-885は急性骨髄性白血病の細胞株においてサブナノモルオーダーで作用を示し,また,患者から単離した急性骨髄性白血病の細胞に対し,健常な細胞と比べ低い濃度で増殖を抑制したことから,急性骨髄性白血病の治療への臨床応用が期待された.CC-885はグルタルイミドをもつことからセレブロンと結合して作用すると想定された.CRISPR-Cas9系を用いたゲノム編集技術によりセレブロンを欠損した急性骨髄性白血病株を作製したところ,CC-885の作用はほとんどみられなくなったことから,CC-885の主要な標的タンパク質はセレブロンであることが確認された.
2.CC-885に依存的なセレブロンの基質タンパク質GSPT1の発見
CC-885により分解がひき起こされるセレブロンの基質タンパク質を探索した.CC-885は急性骨髄性白血病細胞株よりは高濃度になったが,HEK293細胞に由来する293T細胞や293FT細胞においても増殖を抑制した.そこで,FLAG-HAエピトープタグを付加したセレブロンを安定的に発現する293T細胞株を樹立し,その細胞抽出液とCC-885とを混合してFLAGタグにより免疫沈降した.その結果,CC-885に依存的にセレブロンと結合する新たなタンパク質としてGSPT1が同定された.GSPT1は637アミノ酸残基からなり,eRF3αともよばれeRF1と複合体を形成する8).GSPT1とeRF1との複合体は翻訳において終止コドンを認識し,リボソームからの新生タンパク質の放出を担うことが知られている.
さまざまな細胞株にCC-885を処理したのちGSPT1の発現を解析したところ,どの細胞株においてもGSPT1の減少がみられた.また,その減少はユビキチン-プロテアソーム系に依存的であり,さらには,GSPT1はCC-885に依存してユビキチン化された.セレブロンが欠損した細胞株においてはCC-885の処理によりGSPT1は分解されなかった.GSPT1はセレブロンの既知の基質タンパク質であるIkaros,Aiolos,Ck1αとアミノ酸配列における相同性はほとんどなかった.また,これまで報告されたサリドマイド,レナリドミド,ポマリドミドといったどのリガンドによってもGSPT1とセレブロンは結合しなかった.
3.CC-885の急性骨髄性白血病に対する作用はGSPT1の分解に依存する
CC-885の抗がん作用はセレブロンによるGSPT1の分解によるのかどうか検証した.リガンドの効果がGSPT1に依存することを検証するためには,セレブロンとは結合しないが機能を保持するGSPT1の変異体を細胞株に発現させ,CC-885の活性を検証する必要があった.GSPT1は出芽酵母において保存されていたが,出芽酵母におけるホモログSUP35を293T細胞に発現させたところCC-885により分解されなかった.そこで,GSPT1とSUP35をハイブリッドしたキメラタンパク質を作製するなどしてその差異を検証し,最終的に,ヒトのGSPT1のGly575にあたる部分はSUP35においてAsnであり,Gly575をAsnに置換したGSPT1変異体はセレブロンと結合しないことが判明した.そして,急性骨髄性白血病細胞株にこのGSPT1変異体を発現させたところ,CC-885による増殖の抑制はほとんどみられなくなった.また,GSPT1をRNAi法によりノックダウンしても細胞の増殖は抑制された.以上より,CC-885の急性骨髄性白血病に対する作用はGSPT1の分解が主要な原因であると結論づけられた.
4.X線結晶構造の決定によるセレブロン,CC-885,GSPT1の相互作用の解明
すでに,セレブロンおよびGSPT1はX線結晶構造解析により構造が決定されていたが,リガンドに依存的なセレブロンと基質タンパク質との結合の分子基盤を明らかにするため,セレブロン,CC-885,GSPT1からなる複合体の結晶構造を3.6Åの分解能で決定した(PDB ID:5HXB).GSPT1のドメイン3がセレブロンおよびCC-885と直接に結合していた.CC-885のグルタルイミドはセレブロンの3つのTrpからなるポケットと結合し,水素結合を形成していた.CC-885のイソインドリノンはセレブロンおよびGSPT1の両方と結合していた.GSPT1はセレブロンと水素結合を形成し,また,ファンデルワールス力により相互作用していた.セレブロンのN末端側はGSPT1のドメイン3と結合しており,CC-885の近傍に位置していた.GSPT1はセレブロンの3つのTrpからなるポケットのあるC末端側だけでなく,N末端側にもまたがって結合していた.
複合体を形成するために必須と考えられたセレブロンのアミノ酸残基をAlaに置換して相互作用を検証したところ,どの相互作用も失われるか減少するかした.また,表面プラズモン共鳴法によりCC-885の存在下においてGSPT1とセレブロンとのあいだの解離定数はおよそ350 nMと決定された一方,CC-885の非存在下では相互作用は検出されなかった.さらに,ネガティブ染色電子顕微鏡法により,CC-885の非存在下においてセレブロンとGSPT1の結合した粒子は検出されなかった.GSPT1は568~578残基の部分でセレブロンとCC-885との複合体と相互作用していた.ここで,GSPT1におけるとりわけ重要なアミノ酸残基はGly575であった.さきに述べたとおり,ヒトと出芽酵母のホモログとの比較から,Gly575がAsnに置換したGSPT1変異体はセレブロンと結合しないことが明らかにされたが,このGly575はCC-885のイソインドリノンと結合していた.そして,Gly575の位置は,RamachandranプロットにおいてGlyのみが許容された.
5.既知の基質タンパク質IkarosとGSPT1のセレブロン認識モチーフの比較
GSPT1は既知の基質タンパク質であるIkaros,Aiolos,Ck1αとアミノ酸配列においてほとんど相同性がなかった.しかしながら,GSPT1との結合に必要なアミノ酸残基のいくつかをAlaに置換したセレブロン変異体において,ポマリドミドの処理によりひき起こされるIkarosとの結合が消失したことから,GSPT1とIkarosには共通のタンパク質分解シグナル部位の存在が示唆された.Ikarosのホモロジーモデルを構築したところ,GSPT1と同様に,特定のGlyがセレブロンあるいはリガンドとの結合に重要であると予測された.Ikarosは140~168残基だけでポマリドミドの存在のもとセレブロンと結合するが,そのアミノ酸配列にはGly151が存在した.Gly151をAlaに置換したIkaros変異体は,Gly575をAlaに置換したGSPT1変異体と同様にセレブロンとの結合能が消失した.また最近,セレブロン,レナリドミド,Ck1αからなる複合体のX線結晶構造が報告され,Ck1αにおいても特定のGlyがセレブロンとの結合に必須であることが明らかにされた9).以上から,リガンドに依存的な基質タンパク質にはGlyを含む共通のセレブロン認識モチーフの存在する可能性があるという結論にいたった.
おわりに
この研究により,セレブロンを制御する新しいリガンドとしてCC-885が発見された.CC-885がセレブロンと結合するとGSPT1の分解がひき起こされ,がん細胞の増殖が抑制される.がん細胞のうち,急性骨髄性白血病細胞はCC-885に対する感受性が高いことから,臨床応用への展開が期待される(図2).
新薬において標的となりうる因子はdruggableであるといわれる.たとえ,ある疾患に関連する因子について直接的な阻害化合物を設計するという点ではundruggableであっても,セレブロンの機能を変換することにより分解をひき起こし,結果としてそのはたらきが抑制されるなら標的として設定することが可能になる.CC-885は翻訳終結因子であるGSPT1をセレブロンにおける新たな基質にすることのできるセレブロンモジュレーターである.
現在,セレブロンと結合するリガンドとほかの疾患タンパク質を認識するリガンドとを融合させたPROTAC(proteolysis targeting chimera)という技術の開発が進んでいる10).セレブロンと結合するリガンドとBCR-ABL融合タンパク質と結合するリガンドとを融合することにより,すでに,セレブロンによるBCR-ABL融合タンパク質の分解が実現している.しかし,リガンドの大きさが大きくなることから細胞に移行しない,半減期が短いなど,薬理動態において問題が生じやすい.CC-885の分子量は500以下であり,低分子化合物として薬理動態における強みを保持しつつ,新たな基質タンパク質の分解をひき起こすことが可能である.
構造生物学的な解析により,セレブロンに共通する基質認識モチーフとして,少なくともGlyを含む構造が示唆された.現時点では,Gly以外の規則はわかっておらず,ほかの箇所についてはアミノ酸残基やアミノ酸配列よりジオメトリーや立体性に依存するのだろうという予測にとどまっている.しかし今後,次世代のセレブロンモジュレーターを合理的にデザインしていくうえで,この研究において得られた構造生物学的な知見は大きな手がかりになるだろう.
文 献
- Bartlett, J. B., Dredge, K. & Dalgleish, A. G.: The evolution of thalidomide and its IMiD derivatives as anticancer agents. Nat. Rev. Cancer, 4, 314-322 (2004)[PubMed]
- Ito, T., Ando, H., Suzuki, T. et al.: Identification of a primary target of thalidomide teratogenicity. Science, 327, 1345-1350 (2010)[PubMed]
- Fischer, E. S., Bohm, K., Lydeard, J. R. et al.: Structure of the DDB1-CRBN E3 ubiquitin ligase in complex with thalidomide. Nature, 512, 49-53 (2014)[PubMed]
- Chamberlain, P. P., Lopez-Girona, A., Miller, K. et al.: Structure of the human Cereblon-DDB1-Lenalidomide complex reveals basis for responsiveness to thalidomide analogs. Nat. Struct. Mol. Biol., 21, 803-809 (2014)[PubMed]
- Kronke, J., Udeshi, N. D., Narla, A. et al.: Lenalidomide causes selective degradation of IKZF1 and IKZF3 in multiple myeloma cells. Science, 343, 301-305 (2014)[PubMed]
- Lu, G., Middleton, R. E., Sun, H. et al.: The myeloma drug lenalidomide promotes the cereblon-dependent destruction of Ikaros proteins. Science, 343, 305-309 (2014)[PubMed]
- Kronke, J., Fink, E. C., Hollenbach, P. W. et al.: Lenalidomide induces ubiquitination and degradation of Ck1α in del(5q) MDS. Nature, 523, 183-188 (2015)[PubMed]
- Cheng, Z., Saito, K., Pisarev, A. V. et al.: Structural insights into eRF3 and stop codon recognition by eRF1. Genes Dev., 23, 1106-1118 (2009)[PubMed]
- Petzold, G., Fischer, E. S. & Thoma, N. H.: Structural basis of lenalidomide-induced Ck1α degradation by the CRL4CRBN ubiquitin ligase. Nature, 532, 127-130 (2016)[PubMed]
- Deshaies, R. J.: Protein degradation: prime time for PROTACs. Nat. Chem. Biol., 11, 634-635 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2010年 東京工業大学大学院生命理工学研究科にて博士号取得,2016年より東京医科大学 准教授.
研究テーマ:セレブロンの解析,および,新たなセレブロンモジュレーターの開発.
関心事:そもそも,セレブロンは薬剤と結合していない状態ではいかなる生理的な役割をもつのかに興味があります.また,CC-885のような人工物ではなく,天然のセレブロンモジュレーターが存在するのかどうか気になっています.
半田 宏(Hiroshi Handa)
東京医科大学 特任教授.
研究室URL:http://www.tokyo-med.ac.jp/nanoparticle/index.html
© 2016 伊藤拓水・半田 宏 Licensed under CC 表示 2.1 日本