細胞質のミトコンドリア膜タンパク質はUBQLNにより品質管理される
板倉 英祐
(英国MRC Laboratory of Molecular Biology)
email:板倉英祐
DOI: 10.7875/first.author.2016.075
Ubiquilins chaperone and triage mitochondrial membrane proteins for degradation.
Eisuke Itakura, Eszter Zavodszky, Sichen Shao, Matthew L. Wohlever, Robert J. Keenan, Ramanujan S. Hegde
Molecular Cell, 63, 21-33 (2016)
膜タンパク質のもつ高疎水性の膜貫通ドメインが細胞質に露出すると,すぐさま凝集体が形成される.ミトコンドリア膜タンパク質のほとんどは細胞質において合成されたのちミトコンドリアへと輸送されるが,輸送に失敗したミトコンドリア膜タンパク質の膜貫通ドメインがどのように保護され,また,分解されるのかは不明であった.今回,筆者らは,UBQLNが細胞質に存在するミトコンドリア膜タンパク質と直接に結合し凝集体の形成をふせいでいることを見い出した.さらに,UBQLNはそのコンフォメーションを変化させることにより,ユビキチンリガーゼのリクルート,および,それにひきつづくプロテアソームのリクルートまで,一連の反応を仲介していた.つまり,UBQLNはミトコンドリア膜タンパク質のもつ膜貫通ドメインの露出をふせぎながら保護から分解までを実行する膜タンパク質の品質管理機構を担うことがわかった.
真核生物のもつ全遺伝子の約25%は膜タンパク質をコードする.膜タンパク質は膜に挿入されたのちはたらくが,細胞質において合成される.そのため,膜タンパク質のもつ膜貫通ドメインは一過的に水溶性の細胞質に露出する.膜貫通ドメインは疎水性であるため細胞質においては不溶性であり,膜に挿入されるまで分子シャペロンとの結合により凝集体の形成をふせがねばならない.膜貫通ドメインを保護する分子シャペロンは,小胞体の膜タンパク質についてよく研究されてきた1).しかし,細胞質からミトコンドリアへと輸送されるミトコンドリア膜タンパク質と相互作用し可溶性を維持するタンパク質については明らかにされていなかった.
ミトコンドリアは約1000~1500種類のタンパク質をもつ.そのほぼすべては細胞質において合成され,大部分は膜貫通ドメインを含む.ミトコンドリアの外膜および内膜のタンパク質透過装置にかかわる機構についてはかなり理解されてきた2).また,一般的な分子シャペロンであるHsp70およびHsp90はさまざまなミトコンドリア外膜タンパク質の前駆体と結合し,折りたたみの状態を制御しながらその輸送にかかわることが示唆されている.しかし,これらの分子シャペロンのもつ基質結合部位はミトコンドリア膜タンパク質のもつ典型的な膜貫通ドメインと効率的に結合するためには小さすぎる.細胞質に存在するミトコンドリア膜タンパク質の前駆体の保護,および,ミトコンドリアへの輸送が失敗した場合に分解へと導く機構についてはまったくわかっていない.また,さまざまなストレスがミトコンドリア膜タンパク質の輸送に影響をおよぼすことが知られている.さらに,慢性的な輸送の阻害は細胞質におけるタンパク質の恒常性に大きく影響する3,4).したがって,ミトコンドリアへの輸送に失敗したミトコンドリア膜タンパク質の前駆体を分解する経路の存在が示唆されるが,そのような機能を担うタンパク質は明らかにされていない.
ミトコンドリア外膜タンパク質Omp25の膜貫通ドメインをモデルとして使用した.トランスフェクションなどによりOmp25を培養細胞へ導入しただけでは,Omp25はすぐさまミトコンドリアへと移行するため,細胞質に存在するOmp25の膜貫通ドメインと結合するタンパク質を同定することはきわめてむずかしいと考えられた.そこで,翻訳因子だけでなく細胞質の一般的なタンパク質も含むウサギ網状赤血球抽出液を用いたin vitro翻訳系によりOmp25を合成した.ウサギ網状赤血球抽出液は生体膜の成分をまったく含まないため,合成されたOmp25は細胞質のタンパク質と結合するか,あるいは,凝集体を形成する.実際に,合成したOmp25をスクロース密度勾配法によって大きさにより分離すると,凝集体の画分とは別に,約80~100 kDaの複合体が形成されていた(Omp25は約20 kDaである).このOmp25の複合体とセミインタクト細胞を用いてin vitroにおいてミトコンドリアへの移行を測定したところ,ミトコンドリアへの効率的な移行が観察されたことから,この複合体においてOmp25の膜貫通ドメインは未知の分子シャペロンにより保護され,可溶性を維持していると考えられた.
Omp25と結合するタンパク質を質量分析法により決定したところ,UBQLN1が同定された.Omp25の膜貫通ドメインの疎水性を低下させるとUBQLN1との結合が減少したことや,小胞体膜タンパク質のもつ膜貫通ドメインと比べ,ミトコンドリア膜タンパク質のもつ膜貫通ドメインに対しUBQLN1の親和性が高かったことから,UBQLN1はおもにミトコンドリア膜タンパク質の分子シャペロンであることが示唆された.UBQLN1はN末端側にユビキチン様ドメイン,C末端側にユビキチン結合ドメインをもつ.Omp25の膜貫通ドメインがUBQLN1のどの領域に結合するのか調べたところ,ユビキチン様ドメインあるいはユビキチン結合ドメインの欠失はOmp25の膜貫通ドメインとの結合に影響しなかったが,中央に存在するMドメインを欠失したUBQLN1変異体はOmp25の膜貫通ドメインと結合しなくなった.in vitro翻訳系により合成したOmp25はUBQLN1の非存在下あるいはMドメインを欠損したUBQLN1変異体の存在下においては凝集体を形成したが,野生型のUBQLN1やユビキチン様ドメインあるいはユビキチン結合ドメインを欠失したUBQLN1変異体の存在下において凝集体の形成は抑制された.これらのことから,in vitroにおいて,UBQLN1のMドメインはミトコンドリア膜タンパク質の膜貫通ドメインを直接に認識し凝集体の形成をふせぐ分子シャペロン活性をもつことが示唆された.
in vivoにおけるUBQLN1の役割について調べた.哺乳類にはUBQLNファミリーとしてUBQLN1~UBQLN4まで4つのホモログが存在するが,UBQLN3は精巣に特異的に発現し,HEK293細胞にはUBQLN1,UBQLN2,UBQLN4が発現している.CRISPR-Cas9系を用いたゲノム編集によりUBQLN1,UBQLN2,UBQLN4をノックアウトしたUBQLNトリプルノックアウト細胞を作製した.Omp25を野生型の細胞に発現させると界面活性剤に可溶性の画分にのみOmp25が検出されるが,UBQLNトリプルノックアウト細胞にOmp25を発現させると界面活性剤に不溶性の画分にもOmp25が検出され,これはUBQLN1を発現させることにより消失した.さらに,ミトコンドリア移行シグナルをもつミトコンドリア内膜タンパク質ATP5G1を用いると,野生型の細胞あるいはUBQLNトリプルノックアウト細胞にUBQLN1を発現させた細胞においては可溶性の画分に成熟したATP5G1が検出された一方,UBQLNトリプルノックアウト細胞においてはATP5G1の前駆体が不溶性の画分に多く検出された.ミトコンドリア脱分極剤によりミトコンドリアにストレスをあたえると,野生型の細胞においてもATP5G1の前駆体が増加した.さらに,蓄積したATP5G1の前駆体にはUBQLN1が結合していることもわかった.これらのことから,ストレスをうけたミトコンドリアにおいてはミトコンドリアタンパク質の移行が低下し,その結果,ミトコンドリアへの移行に失敗したミトコンドリア膜タンパク質はUBQLN1の分子シャペロン活性により凝集体の形成から保護され分解へと導かれていることが明らかにされた.
UBQLN1がどのようにしてミトコンドリア膜タンパク質を分解へと導くのかについて調べるため,FLAGタグを付加した組換えUBQLN1をくわえたウサギ網状赤血球抽出液を用いたin vitro翻訳系によりOmp25を合成し,UBQLN1との複合体を形成させこれを精製し,ユビキチン,ユビキチン活性化酵素,ユビキチン結合酵素をくわえてユビキチン化を測定した.その結果,野生型のUBQLN1とOmp25との複合体においてOmp25はユビキチン化したが,ユビキチン結合ドメインを欠失したUBQLN1変異体とOmp25との複合体においてOmp25はユビキチン化しなかった.さらに,野生型のUBQLN1とOmp25との複合体を用いてin vitroにおいてミトコンドリアへの移行を測定したところ,ユビキチン化されたOmp25はミトコンドリアへと移行しないが,ユビキチン結合ドメインを欠失したUBQLN1変異体とOmp25との複合体においてはユビキチン化させたOmp25もミトコンドリアへと移行した.これらのことから,UBQLN1はユビキチン結合ドメインに直接にユビキチンリガーゼをリクルートしミトコンドリア膜タンパク質をユビキチン化していること,そののち,ユビキチン化されたミトコンドリア膜タンパク質をユビキチン結合ドメインと強く結合させることによりミトコンドリアへの移行を抑制することがわかった.
ユビキチン様ドメインはプロテアソームと相互作用することが知られていることから5),UBQLN1とミトコンドリア膜タンパク質との結合状態によるプロテアソームとの相互作用の変化について調べた.その結果,ユビキチン結合ドメインを欠失したUBQLN1,および,ユビキチン化したOmp25が結合したUBQLN1はプロテアソームとの結合が増加した.
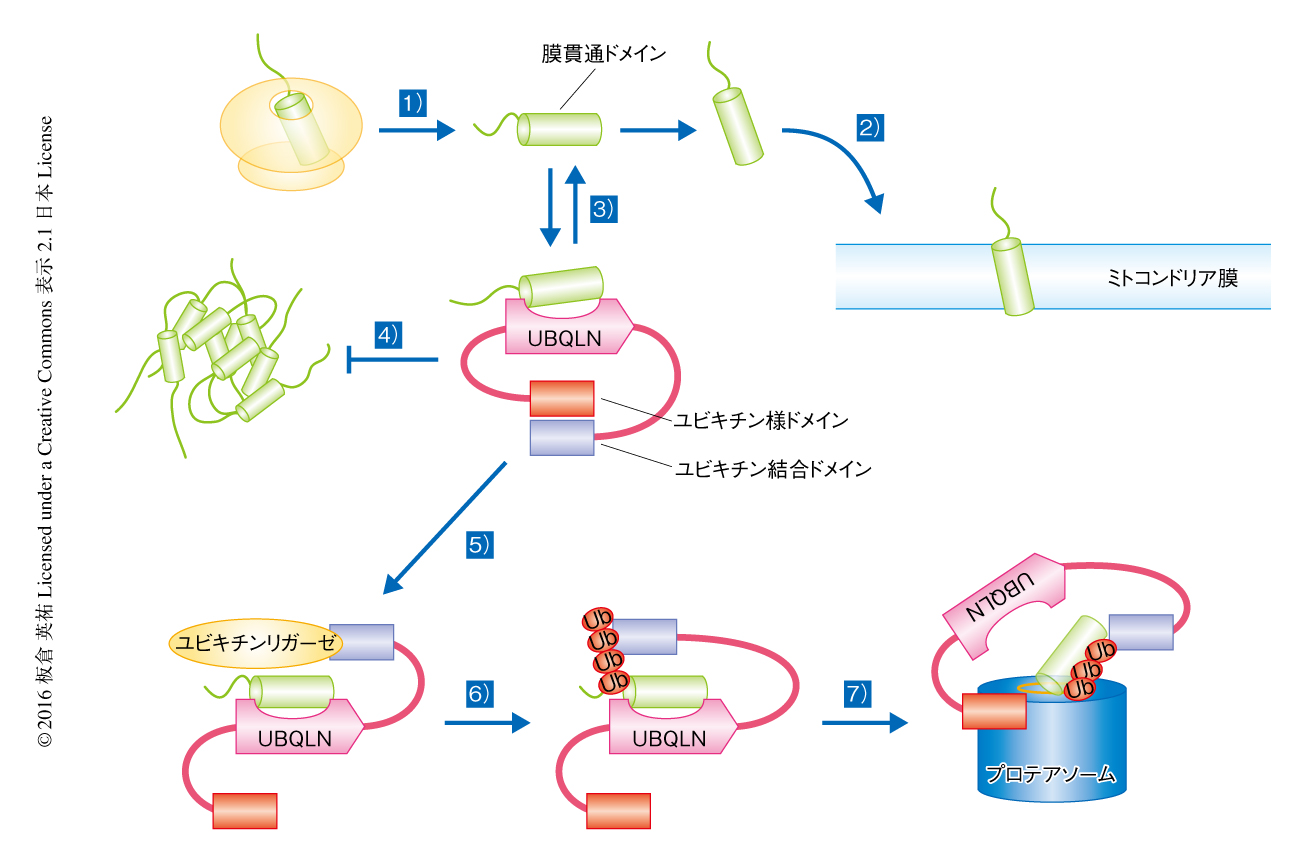
以上のことから,つぎのようなUBQLNによるミトコンドリア膜タンパク質の品質管理機構について明らかにされた(図1).1)合成されたミトコンドリア膜タンパク質はリボソームから細胞質へと放出される.2)ミトコンドリア膜タンパク質はミトコンドリアへと移行する.3)通常,UBQLNはユビキチン様ドメインとユビキチン結合ドメインとが分子内結合した閉じた構造をとる.ミトコンドリアにストレスがくわわることなどにより細胞質においてミトコンドリア膜タンパク質が増加すると,その膜貫通ドメインにUBQLNが結合する.この過程は可逆的であるため,UBQLNから解離しミトコンドリアへの移行の過程にもどることも可能である.4)UBQLNとの結合によりミトコンドリア膜タンパク質は膜貫通ドメインの露出による凝集体の形成が抑制される.5)ミトコンドリア膜タンパク質がミトコンドリアへと移行できない場合には,ユビキリンリガーゼが時間に依存的にUBQLNのユビキチン結合ドメインにリクルートされ,ミトコンドリア膜タンパク質がユビキチン化される.6)ユビキチン化されたミトコンドリア膜タンパク質はUBQLNのユビキチン結合ドメインと強く結合するため,結果として,この時点からミトコンドリアへの移行が抑制される.7)ユビキチン結合ドメインから解離したユビキチン様ドメインはプロテアソームと結合し,ユビキチン化したミトコンドリア膜タンパク質をすみやかに分解へと導く.
膜貫通ドメインの細胞質への露出は不適切な疎水性相互作用をひき起こす危険をともなう.ミトコンドリアへの移行に失敗したミトコンドリア膜タンパク質に対し,UBQLNはその保護,ユビキチン化,分解にいたるすべての過程を凝集体の形成をふせぎながら進めることができ,新しいタイプの細胞質における膜タンパク質の品質管理機構であることが明らかにされた.
UBQLNトリプルノックアウト細胞を用いた研究から,ポリグルタミンタンパク質の形成する凝集体の分解にもUBQLNファミリーがかかわることが判明した.UBQLN2をコードする遺伝子は筋萎縮性側索硬化症の原因遺伝子として報告されていることから6),膜タンパク質の品質管理機構の低下が筋萎縮性側索硬化症など神経疾患の発症に関与する可能性がある.今後のさらなる研究から,膜タンパク質の品質管理機構の破綻と神経疾患の発症との関連性の解明が期待される.
略歴:2009年 埼玉大学大学院理工学研究科博士課程 修了,同年 東京医科歯科大学医歯学総合研究科 研究員,2012年 英国MRC Laboratory of Molecular Biology研究員を経て,2015年より千葉大学大学院融合科学研究科 助教.
研究テーマ:タンパク質の品質管理機構.
抱負:知りたいことを知るための努力を怠らないこと.
© 2016 板倉 英祐 Licensed under CC 表示 2.1 日本
(英国MRC Laboratory of Molecular Biology)
email:板倉英祐
DOI: 10.7875/first.author.2016.075
Ubiquilins chaperone and triage mitochondrial membrane proteins for degradation.
Eisuke Itakura, Eszter Zavodszky, Sichen Shao, Matthew L. Wohlever, Robert J. Keenan, Ramanujan S. Hegde
Molecular Cell, 63, 21-33 (2016)
要 約
膜タンパク質のもつ高疎水性の膜貫通ドメインが細胞質に露出すると,すぐさま凝集体が形成される.ミトコンドリア膜タンパク質のほとんどは細胞質において合成されたのちミトコンドリアへと輸送されるが,輸送に失敗したミトコンドリア膜タンパク質の膜貫通ドメインがどのように保護され,また,分解されるのかは不明であった.今回,筆者らは,UBQLNが細胞質に存在するミトコンドリア膜タンパク質と直接に結合し凝集体の形成をふせいでいることを見い出した.さらに,UBQLNはそのコンフォメーションを変化させることにより,ユビキチンリガーゼのリクルート,および,それにひきつづくプロテアソームのリクルートまで,一連の反応を仲介していた.つまり,UBQLNはミトコンドリア膜タンパク質のもつ膜貫通ドメインの露出をふせぎながら保護から分解までを実行する膜タンパク質の品質管理機構を担うことがわかった.
はじめに
真核生物のもつ全遺伝子の約25%は膜タンパク質をコードする.膜タンパク質は膜に挿入されたのちはたらくが,細胞質において合成される.そのため,膜タンパク質のもつ膜貫通ドメインは一過的に水溶性の細胞質に露出する.膜貫通ドメインは疎水性であるため細胞質においては不溶性であり,膜に挿入されるまで分子シャペロンとの結合により凝集体の形成をふせがねばならない.膜貫通ドメインを保護する分子シャペロンは,小胞体の膜タンパク質についてよく研究されてきた1).しかし,細胞質からミトコンドリアへと輸送されるミトコンドリア膜タンパク質と相互作用し可溶性を維持するタンパク質については明らかにされていなかった.
ミトコンドリアは約1000~1500種類のタンパク質をもつ.そのほぼすべては細胞質において合成され,大部分は膜貫通ドメインを含む.ミトコンドリアの外膜および内膜のタンパク質透過装置にかかわる機構についてはかなり理解されてきた2).また,一般的な分子シャペロンであるHsp70およびHsp90はさまざまなミトコンドリア外膜タンパク質の前駆体と結合し,折りたたみの状態を制御しながらその輸送にかかわることが示唆されている.しかし,これらの分子シャペロンのもつ基質結合部位はミトコンドリア膜タンパク質のもつ典型的な膜貫通ドメインと効率的に結合するためには小さすぎる.細胞質に存在するミトコンドリア膜タンパク質の前駆体の保護,および,ミトコンドリアへの輸送が失敗した場合に分解へと導く機構についてはまったくわかっていない.また,さまざまなストレスがミトコンドリア膜タンパク質の輸送に影響をおよぼすことが知られている.さらに,慢性的な輸送の阻害は細胞質におけるタンパク質の恒常性に大きく影響する3,4).したがって,ミトコンドリアへの輸送に失敗したミトコンドリア膜タンパク質の前駆体を分解する経路の存在が示唆されるが,そのような機能を担うタンパク質は明らかにされていない.
1.UBQLN1はミトコンドリア膜タンパク質の膜貫通ドメインと結合する
ミトコンドリア外膜タンパク質Omp25の膜貫通ドメインをモデルとして使用した.トランスフェクションなどによりOmp25を培養細胞へ導入しただけでは,Omp25はすぐさまミトコンドリアへと移行するため,細胞質に存在するOmp25の膜貫通ドメインと結合するタンパク質を同定することはきわめてむずかしいと考えられた.そこで,翻訳因子だけでなく細胞質の一般的なタンパク質も含むウサギ網状赤血球抽出液を用いたin vitro翻訳系によりOmp25を合成した.ウサギ網状赤血球抽出液は生体膜の成分をまったく含まないため,合成されたOmp25は細胞質のタンパク質と結合するか,あるいは,凝集体を形成する.実際に,合成したOmp25をスクロース密度勾配法によって大きさにより分離すると,凝集体の画分とは別に,約80~100 kDaの複合体が形成されていた(Omp25は約20 kDaである).このOmp25の複合体とセミインタクト細胞を用いてin vitroにおいてミトコンドリアへの移行を測定したところ,ミトコンドリアへの効率的な移行が観察されたことから,この複合体においてOmp25の膜貫通ドメインは未知の分子シャペロンにより保護され,可溶性を維持していると考えられた.
Omp25と結合するタンパク質を質量分析法により決定したところ,UBQLN1が同定された.Omp25の膜貫通ドメインの疎水性を低下させるとUBQLN1との結合が減少したことや,小胞体膜タンパク質のもつ膜貫通ドメインと比べ,ミトコンドリア膜タンパク質のもつ膜貫通ドメインに対しUBQLN1の親和性が高かったことから,UBQLN1はおもにミトコンドリア膜タンパク質の分子シャペロンであることが示唆された.UBQLN1はN末端側にユビキチン様ドメイン,C末端側にユビキチン結合ドメインをもつ.Omp25の膜貫通ドメインがUBQLN1のどの領域に結合するのか調べたところ,ユビキチン様ドメインあるいはユビキチン結合ドメインの欠失はOmp25の膜貫通ドメインとの結合に影響しなかったが,中央に存在するMドメインを欠失したUBQLN1変異体はOmp25の膜貫通ドメインと結合しなくなった.in vitro翻訳系により合成したOmp25はUBQLN1の非存在下あるいはMドメインを欠損したUBQLN1変異体の存在下においては凝集体を形成したが,野生型のUBQLN1やユビキチン様ドメインあるいはユビキチン結合ドメインを欠失したUBQLN1変異体の存在下において凝集体の形成は抑制された.これらのことから,in vitroにおいて,UBQLN1のMドメインはミトコンドリア膜タンパク質の膜貫通ドメインを直接に認識し凝集体の形成をふせぐ分子シャペロン活性をもつことが示唆された.
2.UBQLNの欠損によりミトコンドリア膜タンパク質の凝集体が形成される
in vivoにおけるUBQLN1の役割について調べた.哺乳類にはUBQLNファミリーとしてUBQLN1~UBQLN4まで4つのホモログが存在するが,UBQLN3は精巣に特異的に発現し,HEK293細胞にはUBQLN1,UBQLN2,UBQLN4が発現している.CRISPR-Cas9系を用いたゲノム編集によりUBQLN1,UBQLN2,UBQLN4をノックアウトしたUBQLNトリプルノックアウト細胞を作製した.Omp25を野生型の細胞に発現させると界面活性剤に可溶性の画分にのみOmp25が検出されるが,UBQLNトリプルノックアウト細胞にOmp25を発現させると界面活性剤に不溶性の画分にもOmp25が検出され,これはUBQLN1を発現させることにより消失した.さらに,ミトコンドリア移行シグナルをもつミトコンドリア内膜タンパク質ATP5G1を用いると,野生型の細胞あるいはUBQLNトリプルノックアウト細胞にUBQLN1を発現させた細胞においては可溶性の画分に成熟したATP5G1が検出された一方,UBQLNトリプルノックアウト細胞においてはATP5G1の前駆体が不溶性の画分に多く検出された.ミトコンドリア脱分極剤によりミトコンドリアにストレスをあたえると,野生型の細胞においてもATP5G1の前駆体が増加した.さらに,蓄積したATP5G1の前駆体にはUBQLN1が結合していることもわかった.これらのことから,ストレスをうけたミトコンドリアにおいてはミトコンドリアタンパク質の移行が低下し,その結果,ミトコンドリアへの移行に失敗したミトコンドリア膜タンパク質はUBQLN1の分子シャペロン活性により凝集体の形成から保護され分解へと導かれていることが明らかにされた.
3.UBQLN1はユビキチンリガーゼをリクルートしミトコンドリア膜タンパク質をユビキチン化する
UBQLN1がどのようにしてミトコンドリア膜タンパク質を分解へと導くのかについて調べるため,FLAGタグを付加した組換えUBQLN1をくわえたウサギ網状赤血球抽出液を用いたin vitro翻訳系によりOmp25を合成し,UBQLN1との複合体を形成させこれを精製し,ユビキチン,ユビキチン活性化酵素,ユビキチン結合酵素をくわえてユビキチン化を測定した.その結果,野生型のUBQLN1とOmp25との複合体においてOmp25はユビキチン化したが,ユビキチン結合ドメインを欠失したUBQLN1変異体とOmp25との複合体においてOmp25はユビキチン化しなかった.さらに,野生型のUBQLN1とOmp25との複合体を用いてin vitroにおいてミトコンドリアへの移行を測定したところ,ユビキチン化されたOmp25はミトコンドリアへと移行しないが,ユビキチン結合ドメインを欠失したUBQLN1変異体とOmp25との複合体においてはユビキチン化させたOmp25もミトコンドリアへと移行した.これらのことから,UBQLN1はユビキチン結合ドメインに直接にユビキチンリガーゼをリクルートしミトコンドリア膜タンパク質をユビキチン化していること,そののち,ユビキチン化されたミトコンドリア膜タンパク質をユビキチン結合ドメインと強く結合させることによりミトコンドリアへの移行を抑制することがわかった.
4.UBQLN1はコンフォメーションの変化によりミトコンドリア膜タンパク質の保護,ユビキチン化,分解に導く
ユビキチン様ドメインはプロテアソームと相互作用することが知られていることから5),UBQLN1とミトコンドリア膜タンパク質との結合状態によるプロテアソームとの相互作用の変化について調べた.その結果,ユビキチン結合ドメインを欠失したUBQLN1,および,ユビキチン化したOmp25が結合したUBQLN1はプロテアソームとの結合が増加した.
以上のことから,つぎのようなUBQLNによるミトコンドリア膜タンパク質の品質管理機構について明らかにされた(図1).1)合成されたミトコンドリア膜タンパク質はリボソームから細胞質へと放出される.2)ミトコンドリア膜タンパク質はミトコンドリアへと移行する.3)通常,UBQLNはユビキチン様ドメインとユビキチン結合ドメインとが分子内結合した閉じた構造をとる.ミトコンドリアにストレスがくわわることなどにより細胞質においてミトコンドリア膜タンパク質が増加すると,その膜貫通ドメインにUBQLNが結合する.この過程は可逆的であるため,UBQLNから解離しミトコンドリアへの移行の過程にもどることも可能である.4)UBQLNとの結合によりミトコンドリア膜タンパク質は膜貫通ドメインの露出による凝集体の形成が抑制される.5)ミトコンドリア膜タンパク質がミトコンドリアへと移行できない場合には,ユビキリンリガーゼが時間に依存的にUBQLNのユビキチン結合ドメインにリクルートされ,ミトコンドリア膜タンパク質がユビキチン化される.6)ユビキチン化されたミトコンドリア膜タンパク質はUBQLNのユビキチン結合ドメインと強く結合するため,結果として,この時点からミトコンドリアへの移行が抑制される.7)ユビキチン結合ドメインから解離したユビキチン様ドメインはプロテアソームと結合し,ユビキチン化したミトコンドリア膜タンパク質をすみやかに分解へと導く.
膜貫通ドメインの細胞質への露出は不適切な疎水性相互作用をひき起こす危険をともなう.ミトコンドリアへの移行に失敗したミトコンドリア膜タンパク質に対し,UBQLNはその保護,ユビキチン化,分解にいたるすべての過程を凝集体の形成をふせぎながら進めることができ,新しいタイプの細胞質における膜タンパク質の品質管理機構であることが明らかにされた.
おわりに
UBQLNトリプルノックアウト細胞を用いた研究から,ポリグルタミンタンパク質の形成する凝集体の分解にもUBQLNファミリーがかかわることが判明した.UBQLN2をコードする遺伝子は筋萎縮性側索硬化症の原因遺伝子として報告されていることから6),膜タンパク質の品質管理機構の低下が筋萎縮性側索硬化症など神経疾患の発症に関与する可能性がある.今後のさらなる研究から,膜タンパク質の品質管理機構の破綻と神経疾患の発症との関連性の解明が期待される.
文 献
- Hegde, R. S. & Keenan, R. J.: Tail-anchored membrane protein insertion into the endoplasmic reticulum. Nat. Rev. Mol. Cell Biol., 12, 787-798 (2011)[PubMed]
- Chacinska, A., Koehler, C. M., Milenkovic, D. et al.: Importing mitochondrial proteins: machineries and mechanisms. Cell, 138, 628-644 (2009)[PubMed]
- Wolff, S., Weissman, J. S. & Dillin, A.: Differential scales of protein quality control. Cell, 157, 52-64 (2014)[PubMed]
- Wrobel, L., Topf, U., Bragoszewski, P. et al.: Mistargeted mitochondrial proteins activate a proteostatic response in the cytosol. Nature, 524, 485-488 (2015)[PubMed]
- Finley, D.: Recognition and processing of ubiquitin-protein conjugates by the proteasome. Annu. Rev. Biochem., 78, 477-513 (2009)[PubMed]
- Deng, H. -X., Chen, W., Hong, S. -T. et al.: Mutations in UBQLN2 cause dominant X-linked juvenile and adult-onset ALS and ALS/dementia. Nature, 477, 211-215 (2011)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2009年 埼玉大学大学院理工学研究科博士課程 修了,同年 東京医科歯科大学医歯学総合研究科 研究員,2012年 英国MRC Laboratory of Molecular Biology研究員を経て,2015年より千葉大学大学院融合科学研究科 助教.
研究テーマ:タンパク質の品質管理機構.
抱負:知りたいことを知るための努力を怠らないこと.
© 2016 板倉 英祐 Licensed under CC 表示 2.1 日本