エンハンサーによる転写バーストの制御
深谷 雄志
(米国Princeton大学Lewis-Sigler Institute for Integrative Genomics)
email:深谷雄志
DOI: 10.7875/first.author.2016.068
Enhancer control of transcriptional bursting.
Takashi Fukaya, Bomyi Lim, Michael Levine
Cell, 166, 358-368 (2016)
近年の研究により,転写は連続的ではなくオンとオフをくり返す不連続な反応であることが明らかにされた.この現象は転写バーストとよばれ,細菌から酵母,ショウジョウバエ,哺乳類にまで保存された普遍的な現象であると考えられる.しかしその一方で,転写バーストの起こるしくみや生物学的な意義について理解は進んでいない.とくに,エンハンサーと転写バーストとの関係性については未解明であった.この研究において,ショウジョウバエの初期胚を用いた転写活性のライブイメージング技術を駆使することにより,エンハンサーが転写バーストにおよぼす影響について定量的に解析した.その結果,エンハンサーは転写バーストの頻度を制御することにより遺伝子の発現量を規定することがわかった.つまり,転写活性能の強いエンハンサーは弱いエンハンサーに比べ転写バーストを高頻度でひき起こしており,その結果として,遺伝子の発現量が上昇した.また,単一のエンハンサーの制御下にある2つの異なる遺伝子の転写活性を同時に可視化する新たなライブイメージング技術を用いた解析により,エンハンサーとプロモーターとの相互作用は,これまでに考えられてきたよりも,はるかにダイナミックで動的な過程であることが示唆された.
いまから35年以上まえ,電子顕微鏡を用いた解析により転写バーストの存在がはじめて示された1).ショウジョウバエの初期胚において,新生されたRNAの集団が鋳型DNAのうえに不連続に分布するようすが観察されたのである.このことは,転写は連続的ではなくオンとオフをくり返す不連続な反応であることを示唆した.さらに,近年の定量的なイメージング解析により,転写バーストはショウジョウバエだけではなく,生物種のあいだで広く保存された普遍的な現象であることが明らかにされた2).しかしその一方で,転写バーストの起こるしくみや生物学的な意義について理解は進んでいない.この研究においては,ショウジョウバエの初期胚を用いた転写活性のライブイメージング技術を駆使することにより,転写の時空間的な特異性を制御するエンハンサーとよばれる非コード領域と転写バーストとの関連性について定量的に解析した.さらに,2つの異なる遺伝子の転写活性をリアルタイムで可視化する新たなライブイメージング技術を構築し,エンハンサーとプロモーターとの相互作用の動的な性質について検証した.
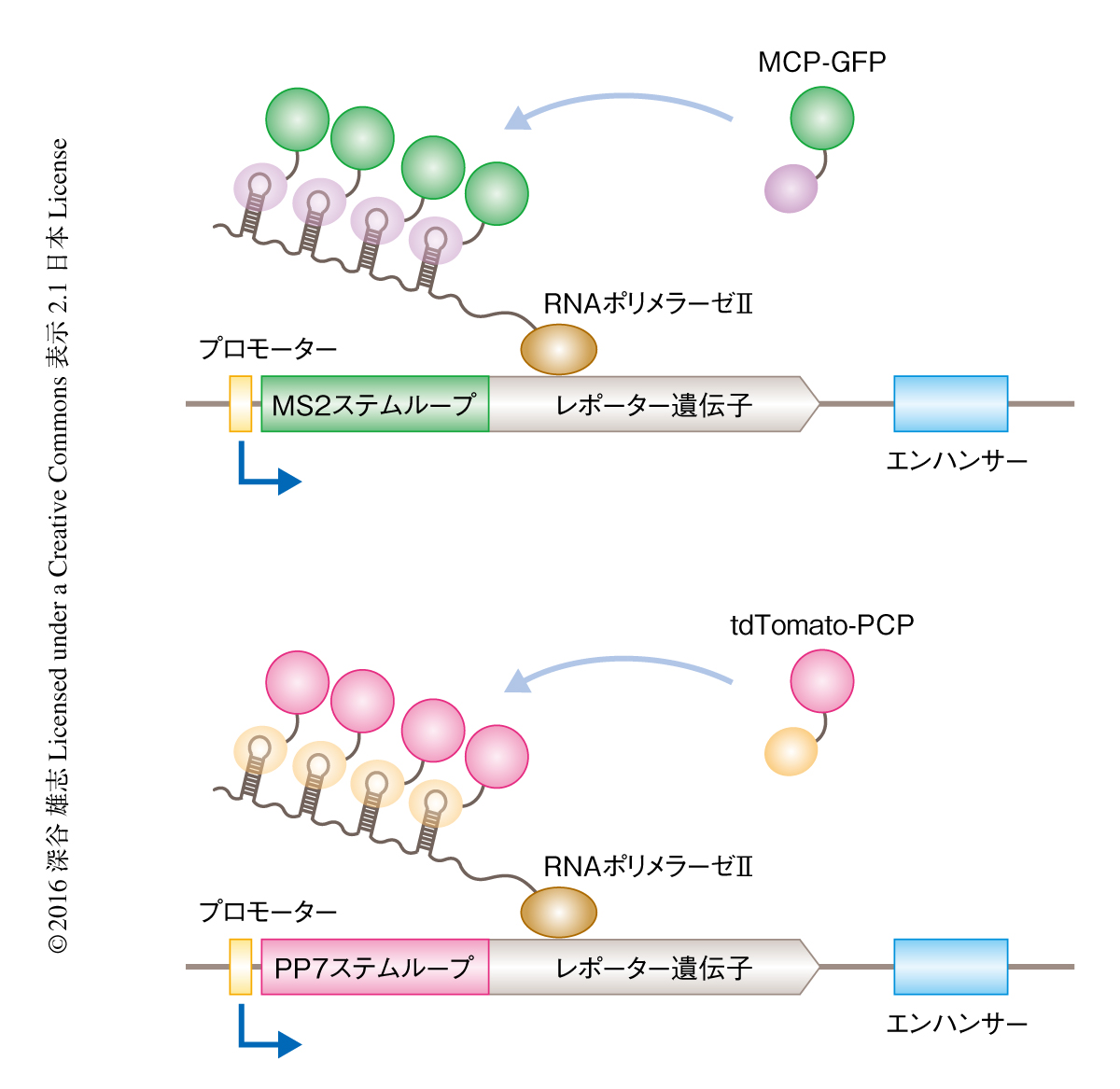
MS2ファージに由来するコートタンパク質MCPとRNAステムループとのあいだの特異的なRNA-タンパク質相互作用を利用することにより,転写活性を生きた細胞においてリアルタイムで可視化することが可能である.5’側非翻訳領域にMS2ファージに由来するRNAステムループをコードするレポーター遺伝子が転写されると,MCPと蛍光タンパク質との融合タンパク質が新生されたRNAへの結合を介して局所的に凝集し,結果として,核において転写活性に応じた明るさの輝点が生じる(図1).このMS2-MCP系を応用したショウジョウバエの初期胚における転写のライブイメージングは,2013年に報告された3,4).この実験系を用いることにより,個体の発生の過程において転写がどのように制御されるのかをリアルタイムかつ1細胞レベルで解析することが可能になった.さらに,ショウジョウバエの初期胚においては核が同調的な分裂をくり返しながら胚の表面において一層に整列しており,1回のライブイメージング解析により数百もの核において転写活性を同時に可視化できるという培養細胞にはない独自の利点があった.
ここでは,中胚葉の陥入に必須の転写因子をコードするsnail遺伝子を制御するプロモーターおよびエンハンサーをモデルとした.snail遺伝子の中胚葉領域における発現を担うシャドウエンハンサーをレポーター遺伝子のもつプロモーターの1 kb上流あるいは7.5 kb下流に挿入し,その転写活性をライブイメージングにより比較した.その結果,エンハンサーがプロモーターの近傍に位置する場合には転写活性は連続的であったのに対し,遠くに位置する場合には転写活性はオン-オフをくり返しながらゆらいでいた.このことから,エンハンサーの位置が転写活性のダイナミクスに大きな影響をおよぼすことが示された.エンハンサーとプロモーターが近くに位置する場合には転写バーストが高頻度に起こるため,みかけ上,転写活性が連続的にオンになると考えられた.一方で,エンハンサーが遠くに位置する場合にはエンハンサーが近傍に位置する場合と比べ遺伝子の発現が低下し,結果として,個別の転写バーストが解像度よく検出されたと考えられた.そこで,7.5 kb下流にエンハンサーを挿入したレポーター遺伝子に着目し,より詳細な解析を進めた.なお,近年のゲノムワイドな解析において,ショウジョウバエの初期胚においてはたらくエンハンサーとその標的となるプロモーターは平均して10 kbほど離れて存在すると見積もられている5).
snail遺伝子の中胚葉領域における発現は,シャドウエンハンサーだけでなく,遺伝子の近傍に位置するプライマリーエンハンサーによっても制御される.これまでの研究により,シャドウエンハンサーとプライマリーエンハンサーは同じ発現パターンを生じるものの,シャドウエンハンサーはプライマリーエンハンサーに比べ転写活性能の高いことが報告されている6,7).この違いがどのような差により生じているのかを調べるため,シャドウエンハンサーに代えプライマリーエンハンサーをもつレポーター遺伝子を用いて解析した.その結果,プライマリーエンハンサーをもつ場合はシャドウエンハンサーをもつ場合に比べ転写バーストは低頻度にしか起こらないことが明らかにされた.一方で,いちどの転写バーストごとに産生されるRNAの量は同等であった.初期胚の発生の過程においてはたらくほかのエンハンサーを用いた解析からも,遺伝子の発現量と転写バーストの頻度との強い相関がみられた.このことから,エンハンサーは転写バーストの頻度を制御することにより発生における遺伝子の発現量を規定することが示唆された.
複数の遺伝子が単一のエンハンサーの制御下にある場合,より近傍に位置するプロモーターがエンハンサーと優位に相互作用することにより遠位にあるプロモーターからの転写を抑制する,プロモーター競合とよばれる現象が知られている8).プロモーター競合が転写バーストにおよぼす影響について解析するため,単一のエンハンサーにより制御される2つのレポーター遺伝子の転写活性を同時に可視化する新たなライブイメージング技術を構築した.ショウジョウバエの初期胚において,PP7ファージに由来するコートタンパク質PCPとRNAステムループとの相互作用を利用することにより,2色目の蛍光タンパク質を介してレポーター遺伝子の転写活性を可視化する新たな技術を開発した(図1).つまり,MS2-MCP系とPP7-PCP系とを組み合わせることにより,2つの異なる遺伝子の転写活性を単一のショウジョウバエの初期胚において可視化することが可能になった.
単一のシャドウエンハンサーを2つのレポーター遺伝子が対称的あるいは非対称的にはさみ込むように配置し,ライブイメージングにより転写活性を解析した.2つのレポーター遺伝子を対称的に配置し,おのおののプロモーターがエンハンサーから7.5 kbほど離れているようにした場合,レポーター遺伝子は同等の頻度で転写バーストをくり返した.一方のレポーター遺伝子を反転して非対称に配置し,プロモーターがエンハンサーとは1 kbしか離れていないようにした場合,さきの結果と同様に,このレポーター遺伝子からは連続的な転写活性が観察された.このとき,もう一方のレポーター遺伝子とエンハンサーとの距離はまったく変わっていないにもかかわらず,転写バーストの頻度は顕著に低下した.つまり,エンハンサーの近傍に位置するプロモーターの存在により遠位にあるプロモーターとエンハンサーとのあいだの相互作用が阻害され,結果として,遠位にあるレポーター遺伝子からの転写バーストの頻度が低下したと考えられた.このことから,エンハンサーとプロモーターとの相互作用の頻度が転写バーストの頻度と相関することが示唆された.
そこで,対称的に配置された2つのレポーター遺伝子のうち,一方のレポーター遺伝子とエンハンサーとのあいだにgypsyレトロトランスポゾンに由来するインスレーターとよばれる配列を挿入した.インスレーターはエンハンサーとプロモーターとの相互作用を阻害することにより転写活性を負に制御する9).ライブイメージングにより解析したところ,エンハンサーとのあいだにインスレーターの存在するレポーター遺伝子の転写バーストの頻度がいちじるしく低下した.この結果は,転写バーストの頻度がエンハンサーとプロモーターとの相互作用の頻度を反映するという考えを支持した.低頻度ではあったもののインスレーターを挿入したレポーター遺伝子が転写バーストをひき起こしたときには,いちどの転写バーストにより転写されるRNAの量はインスレーターの存在しないときと同等であった.このことから,インスレーターの有無にかかわらず,エンハンサーはプロモーターと相互作用すると同じレベルに転写を活性化することが示された.
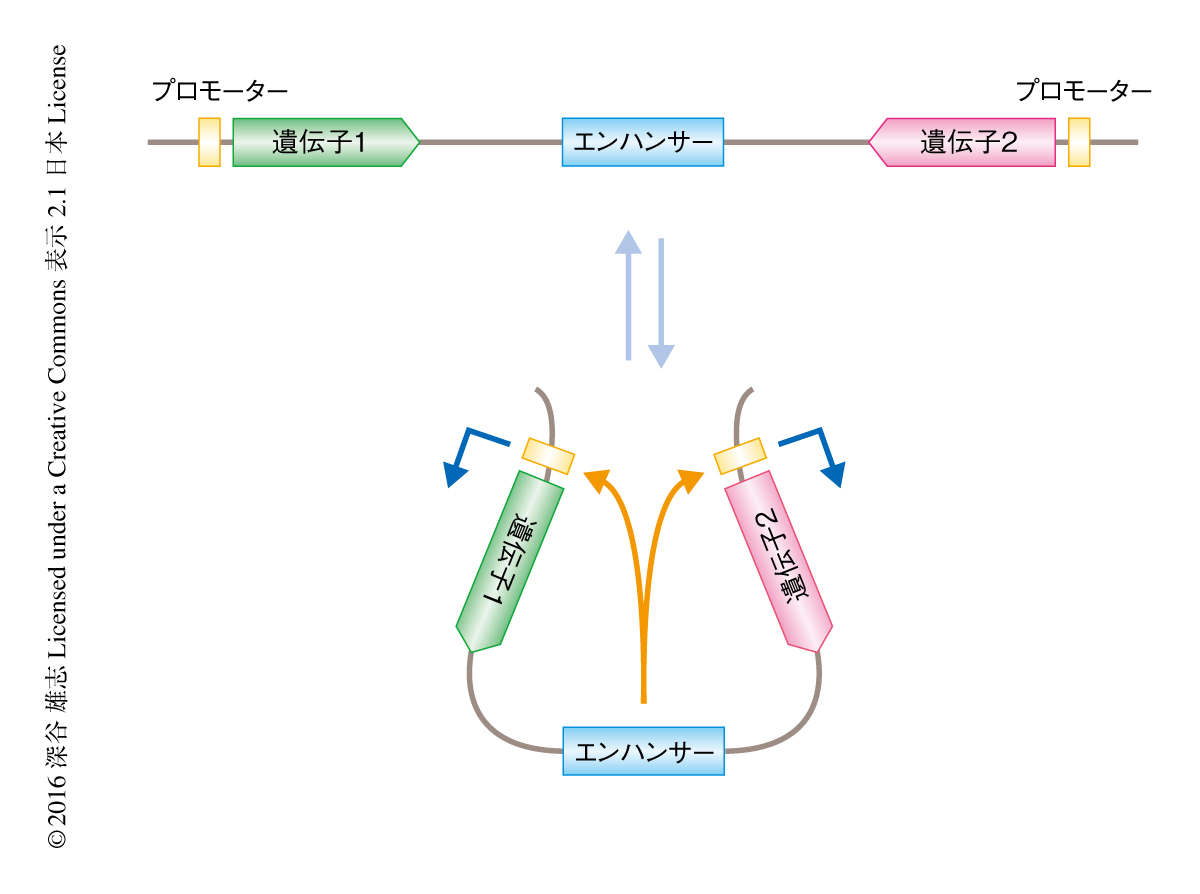
単一のエンハンサーが2つの遺伝子からの転写を活性化する際の動的な性質について検証した.従来のDNAループモデルにもとづくと,エンハンサーはどちらか一方のプロモーターのみと安定的に相互作用し,転写バーストをひき起こしたのちに解離して,ふたたびエンハンサーがどちらか一方のプロモーターを活性化する,という過程をくり返すことが予測された.この場合,2つのレポーター遺伝子の転写バーストが相互排他的に起こるはずである.この仮説を検証するため,対称的に配置した2つのレポーター遺伝子のあいだにエンハンサーを配置しライブイメージングにより解析した.その結果,2つのプロモーターは15 kb以上も離れているにもかかわらず,同調的な転写バーストをひき起こした.このことから,エンハンサーとプロモーターとの相互作用は局所的なDNA構造の変動をともなう,これまで考えられてきたよりもはるかに動的な過程であることが示された(図2).
転写活性のライブイメージング解析により,発生の過程における転写制御を1細胞レベルで定量的に理解することが可能になった.この研究においては,この技術を応用することによりエンハンサーを介した転写バーストの制御機構の存在を明らかにした.同じ時期に,ヒトやマウスの培養細胞においてもエンハンサーとプロモーターとの相互作用と転写バーストの頻度は相関することが見い出されている10).このことから,エンハンサーによる動的な転写バーストの制御は真核生物に広く保存された共通の機構であると考えられる.
略歴:2014年 東京大学大学院新領域創成科学研究科博士課程 修了,同年 米国California大学Berkeley校 博士研究員を経て,2015年より米国Princeton大学 博士研究員.
研究テーマ:遺伝子の発現制御における基礎的なしくみの理解.
© 2016 深谷 雄志 Licensed under CC 表示 2.1 日本
(米国Princeton大学Lewis-Sigler Institute for Integrative Genomics)
email:深谷雄志
DOI: 10.7875/first.author.2016.068
Enhancer control of transcriptional bursting.
Takashi Fukaya, Bomyi Lim, Michael Levine
Cell, 166, 358-368 (2016)
この論文に出現する遺伝子・タンパク質のUniprot ID
snail(P08044)
要 約
近年の研究により,転写は連続的ではなくオンとオフをくり返す不連続な反応であることが明らかにされた.この現象は転写バーストとよばれ,細菌から酵母,ショウジョウバエ,哺乳類にまで保存された普遍的な現象であると考えられる.しかしその一方で,転写バーストの起こるしくみや生物学的な意義について理解は進んでいない.とくに,エンハンサーと転写バーストとの関係性については未解明であった.この研究において,ショウジョウバエの初期胚を用いた転写活性のライブイメージング技術を駆使することにより,エンハンサーが転写バーストにおよぼす影響について定量的に解析した.その結果,エンハンサーは転写バーストの頻度を制御することにより遺伝子の発現量を規定することがわかった.つまり,転写活性能の強いエンハンサーは弱いエンハンサーに比べ転写バーストを高頻度でひき起こしており,その結果として,遺伝子の発現量が上昇した.また,単一のエンハンサーの制御下にある2つの異なる遺伝子の転写活性を同時に可視化する新たなライブイメージング技術を用いた解析により,エンハンサーとプロモーターとの相互作用は,これまでに考えられてきたよりも,はるかにダイナミックで動的な過程であることが示唆された.
はじめに
いまから35年以上まえ,電子顕微鏡を用いた解析により転写バーストの存在がはじめて示された1).ショウジョウバエの初期胚において,新生されたRNAの集団が鋳型DNAのうえに不連続に分布するようすが観察されたのである.このことは,転写は連続的ではなくオンとオフをくり返す不連続な反応であることを示唆した.さらに,近年の定量的なイメージング解析により,転写バーストはショウジョウバエだけではなく,生物種のあいだで広く保存された普遍的な現象であることが明らかにされた2).しかしその一方で,転写バーストの起こるしくみや生物学的な意義について理解は進んでいない.この研究においては,ショウジョウバエの初期胚を用いた転写活性のライブイメージング技術を駆使することにより,転写の時空間的な特異性を制御するエンハンサーとよばれる非コード領域と転写バーストとの関連性について定量的に解析した.さらに,2つの異なる遺伝子の転写活性をリアルタイムで可視化する新たなライブイメージング技術を構築し,エンハンサーとプロモーターとの相互作用の動的な性質について検証した.
1.転写バーストの可視化
MS2ファージに由来するコートタンパク質MCPとRNAステムループとのあいだの特異的なRNA-タンパク質相互作用を利用することにより,転写活性を生きた細胞においてリアルタイムで可視化することが可能である.5’側非翻訳領域にMS2ファージに由来するRNAステムループをコードするレポーター遺伝子が転写されると,MCPと蛍光タンパク質との融合タンパク質が新生されたRNAへの結合を介して局所的に凝集し,結果として,核において転写活性に応じた明るさの輝点が生じる(図1).このMS2-MCP系を応用したショウジョウバエの初期胚における転写のライブイメージングは,2013年に報告された3,4).この実験系を用いることにより,個体の発生の過程において転写がどのように制御されるのかをリアルタイムかつ1細胞レベルで解析することが可能になった.さらに,ショウジョウバエの初期胚においては核が同調的な分裂をくり返しながら胚の表面において一層に整列しており,1回のライブイメージング解析により数百もの核において転写活性を同時に可視化できるという培養細胞にはない独自の利点があった.
ここでは,中胚葉の陥入に必須の転写因子をコードするsnail遺伝子を制御するプロモーターおよびエンハンサーをモデルとした.snail遺伝子の中胚葉領域における発現を担うシャドウエンハンサーをレポーター遺伝子のもつプロモーターの1 kb上流あるいは7.5 kb下流に挿入し,その転写活性をライブイメージングにより比較した.その結果,エンハンサーがプロモーターの近傍に位置する場合には転写活性は連続的であったのに対し,遠くに位置する場合には転写活性はオン-オフをくり返しながらゆらいでいた.このことから,エンハンサーの位置が転写活性のダイナミクスに大きな影響をおよぼすことが示された.エンハンサーとプロモーターが近くに位置する場合には転写バーストが高頻度に起こるため,みかけ上,転写活性が連続的にオンになると考えられた.一方で,エンハンサーが遠くに位置する場合にはエンハンサーが近傍に位置する場合と比べ遺伝子の発現が低下し,結果として,個別の転写バーストが解像度よく検出されたと考えられた.そこで,7.5 kb下流にエンハンサーを挿入したレポーター遺伝子に着目し,より詳細な解析を進めた.なお,近年のゲノムワイドな解析において,ショウジョウバエの初期胚においてはたらくエンハンサーとその標的となるプロモーターは平均して10 kbほど離れて存在すると見積もられている5).
2.エンハンサーによる転写バーストの制御
snail遺伝子の中胚葉領域における発現は,シャドウエンハンサーだけでなく,遺伝子の近傍に位置するプライマリーエンハンサーによっても制御される.これまでの研究により,シャドウエンハンサーとプライマリーエンハンサーは同じ発現パターンを生じるものの,シャドウエンハンサーはプライマリーエンハンサーに比べ転写活性能の高いことが報告されている6,7).この違いがどのような差により生じているのかを調べるため,シャドウエンハンサーに代えプライマリーエンハンサーをもつレポーター遺伝子を用いて解析した.その結果,プライマリーエンハンサーをもつ場合はシャドウエンハンサーをもつ場合に比べ転写バーストは低頻度にしか起こらないことが明らかにされた.一方で,いちどの転写バーストごとに産生されるRNAの量は同等であった.初期胚の発生の過程においてはたらくほかのエンハンサーを用いた解析からも,遺伝子の発現量と転写バーストの頻度との強い相関がみられた.このことから,エンハンサーは転写バーストの頻度を制御することにより発生における遺伝子の発現量を規定することが示唆された.
3.エンハンサーとプロモーターとの相互作用と転写バースト
複数の遺伝子が単一のエンハンサーの制御下にある場合,より近傍に位置するプロモーターがエンハンサーと優位に相互作用することにより遠位にあるプロモーターからの転写を抑制する,プロモーター競合とよばれる現象が知られている8).プロモーター競合が転写バーストにおよぼす影響について解析するため,単一のエンハンサーにより制御される2つのレポーター遺伝子の転写活性を同時に可視化する新たなライブイメージング技術を構築した.ショウジョウバエの初期胚において,PP7ファージに由来するコートタンパク質PCPとRNAステムループとの相互作用を利用することにより,2色目の蛍光タンパク質を介してレポーター遺伝子の転写活性を可視化する新たな技術を開発した(図1).つまり,MS2-MCP系とPP7-PCP系とを組み合わせることにより,2つの異なる遺伝子の転写活性を単一のショウジョウバエの初期胚において可視化することが可能になった.
単一のシャドウエンハンサーを2つのレポーター遺伝子が対称的あるいは非対称的にはさみ込むように配置し,ライブイメージングにより転写活性を解析した.2つのレポーター遺伝子を対称的に配置し,おのおののプロモーターがエンハンサーから7.5 kbほど離れているようにした場合,レポーター遺伝子は同等の頻度で転写バーストをくり返した.一方のレポーター遺伝子を反転して非対称に配置し,プロモーターがエンハンサーとは1 kbしか離れていないようにした場合,さきの結果と同様に,このレポーター遺伝子からは連続的な転写活性が観察された.このとき,もう一方のレポーター遺伝子とエンハンサーとの距離はまったく変わっていないにもかかわらず,転写バーストの頻度は顕著に低下した.つまり,エンハンサーの近傍に位置するプロモーターの存在により遠位にあるプロモーターとエンハンサーとのあいだの相互作用が阻害され,結果として,遠位にあるレポーター遺伝子からの転写バーストの頻度が低下したと考えられた.このことから,エンハンサーとプロモーターとの相互作用の頻度が転写バーストの頻度と相関することが示唆された.
そこで,対称的に配置された2つのレポーター遺伝子のうち,一方のレポーター遺伝子とエンハンサーとのあいだにgypsyレトロトランスポゾンに由来するインスレーターとよばれる配列を挿入した.インスレーターはエンハンサーとプロモーターとの相互作用を阻害することにより転写活性を負に制御する9).ライブイメージングにより解析したところ,エンハンサーとのあいだにインスレーターの存在するレポーター遺伝子の転写バーストの頻度がいちじるしく低下した.この結果は,転写バーストの頻度がエンハンサーとプロモーターとの相互作用の頻度を反映するという考えを支持した.低頻度ではあったもののインスレーターを挿入したレポーター遺伝子が転写バーストをひき起こしたときには,いちどの転写バーストにより転写されるRNAの量はインスレーターの存在しないときと同等であった.このことから,インスレーターの有無にかかわらず,エンハンサーはプロモーターと相互作用すると同じレベルに転写を活性化することが示された.
4.単一のエンハンサーによる同調的な転写バースト
単一のエンハンサーが2つの遺伝子からの転写を活性化する際の動的な性質について検証した.従来のDNAループモデルにもとづくと,エンハンサーはどちらか一方のプロモーターのみと安定的に相互作用し,転写バーストをひき起こしたのちに解離して,ふたたびエンハンサーがどちらか一方のプロモーターを活性化する,という過程をくり返すことが予測された.この場合,2つのレポーター遺伝子の転写バーストが相互排他的に起こるはずである.この仮説を検証するため,対称的に配置した2つのレポーター遺伝子のあいだにエンハンサーを配置しライブイメージングにより解析した.その結果,2つのプロモーターは15 kb以上も離れているにもかかわらず,同調的な転写バーストをひき起こした.このことから,エンハンサーとプロモーターとの相互作用は局所的なDNA構造の変動をともなう,これまで考えられてきたよりもはるかに動的な過程であることが示された(図2).
おわりに
転写活性のライブイメージング解析により,発生の過程における転写制御を1細胞レベルで定量的に理解することが可能になった.この研究においては,この技術を応用することによりエンハンサーを介した転写バーストの制御機構の存在を明らかにした.同じ時期に,ヒトやマウスの培養細胞においてもエンハンサーとプロモーターとの相互作用と転写バーストの頻度は相関することが見い出されている10).このことから,エンハンサーによる動的な転写バーストの制御は真核生物に広く保存された共通の機構であると考えられる.
文 献
- McKnight, S. L. & Miller, O. L. J.: Post-replicative nonribosomal transcription units in D. melanogaster embryos. Cell, 17, 551-563 (1979)[PubMed]
- Coulon, A., Chow, C. C., Singer, R. H. et al.: Eukaryotic transcriptional dynamics: from single molecules to cell populations. Nat. Rev. Genet., 14, 572-584 (2013)[PubMed]
- Garcia, H. G., Tikhonov, M., Lin, A. et al.: Quantitative imaging of transcription in living Drosophila embryos links polymerase activity to patterning. Curr. Biol., 23, 2140-2145 (2013)[PubMed]
- Lucas, T., Ferraro, T., Roelens, B. et al.: Live imaging of Bicoid-dependent transcription in Drosophila embryos. Curr. Biol., 23, 2135-2139 (2013)[PubMed]
- Kvon, E. Z., Kazmar, T., Stampfel, G. et al.: Genome-scale functional characterization of Drosophila developmental enhancers in vivo. Nature, 512, 91-95 (2014)[PubMed]
- Dunipace, L., Ozdemir, A. & Stathopoulos, A.: Complex interactions between cis-regulatory modules in native conformation are critical for Drosophila snail expression. Development, 138, 4075-4084 (2011)[PubMed]
- Bothma, J. P., Garcia, H. G., Ng, S. et al.: Enhancer additivity and non-additivity are determined by enhancer strength in the Drosophila embryo. Elife 4, e07956 (2015)[PubMed]
- Choi, O. R. & Engel, J. D.: Developmental regulation of β-globin gene switching. Cell, 55, 17-26 (1988)[PubMed]
- Cai, H. & Levine, M.: Modulation of enhancer-promoter interactions by insulators in the Drosophila embryo. Nature, 376, 533-536 (1995)[PubMed]
- Bartman, C. R., Hsu, S. C., Hsiung, C. C. -S. et al.: Enhancer regulation of transcriptional bursting parameters revealed by forced chromatin looping. Mol. Cell, 62, 237-247 (2016)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2014年 東京大学大学院新領域創成科学研究科博士課程 修了,同年 米国California大学Berkeley校 博士研究員を経て,2015年より米国Princeton大学 博士研究員.
研究テーマ:遺伝子の発現制御における基礎的なしくみの理解.
© 2016 深谷 雄志 Licensed under CC 表示 2.1 日本