インターロイキン1はヒトの2型自然リンパ球の活性化および可塑性を制御する
大根 陽一郎
(米国MedImmune,R&D Research)
email:大根陽一郎
DOI: 10.7875/first.author.2016.052
IL-1 is a critical regulator of group 2 innate lymphoid cell function and plasticity.
Yoichiro Ohne, Jonathan S. Silver, LuAnn Thompson-Snipes, Magalie A. Collet, Jean Philippe Blanck, Brandi L. Cantarel, Alan M. Copenhaver, Alison A. Humbles, Yong-Jun Liu
Nature Immunology, 17, 646-655 (2016)
2型自然リンパ球は上皮細胞に由来するサイトカインであるインターロイキン33,インターロイキン25,TSLPに応答し,寄生虫に対する防御やアレルギー性疾患の発症にかかわると考えられている.今回,筆者らは,インターロイキン1がヒトの2型自然リンパ球の重要な活性化タンパク質であることを見い出した.インターロイキン1は2型自然リンパ球の増殖およびサイトカインの産生を促進するとともに,上皮細胞に由来するサイトカインに対する受容体の発現を誘導した.さらに,インターロイキン1は2型自然リンパ球の可塑性も制御することが明らかにされた.インターロイキン1により刺激された2型自然リンパ球はインターロイキン12受容体を発現し,インターロイキン12のシグナルによりクロマチンの構造の変化をともなう1型自然リンパ球様の形質を獲得した.このようなインターロイキン1の作用はマウスの個体においても機能することが示され,炎症における中心的なメディエーターであるインターロイキン1の2型自然リンパ球を介した新たな役割が明らかにされた.
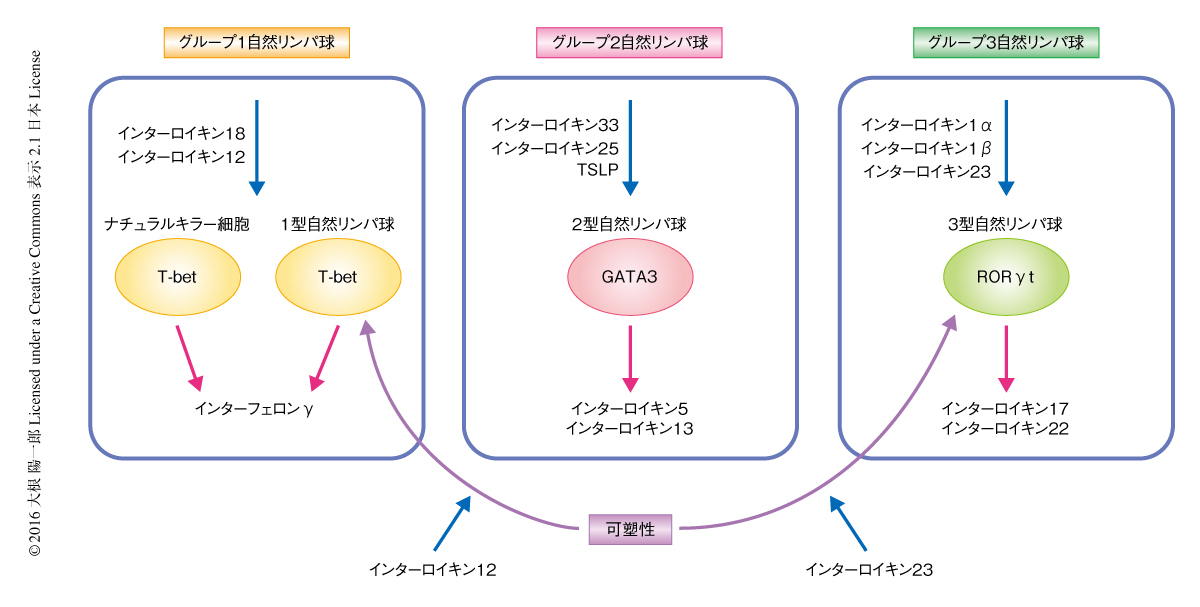
近年,同定された自然リンパ球(innate lymphoid cell:ILC)は自然免疫系におけるヘルパーT細胞に対応する細胞の集団として感染に対する防御や組織の修復に役割を担う.自然リンパ球は不均一な細胞の集団であり,産生するサイトカインの種類およびこれらをつかさどるマスター転写因子の発現から1型,2型,3型の3つのグループに分けられる1)(図1).このうち,2型自然リンパ球はインターロイキン5およびインターロイキン13を産生し,転写因子GATA3を高レベルで発現する.2型自然リンパ球は寄生虫の防御に重要な寄与をもつ一方,喘息やアトピー性皮膚炎の発症に関与することが示されており,その活性の制御機構の解明は重要な課題のひとつである.
自然リンパ球は抗原受容体をもたず,サイトカインおよび増殖因子が活性の制御に重要と考えられている.とくに,インターロイキン1ファミリーサイトカインによるNF-κBシグナル伝達経路がその活性化に重要な役割を担う.おのおののグループの自然リンパ球は異なるインターロイキン1ファミリーサイトカインに対し優先的あるいは選択的に応答すると考えられている(図1).2型自然リンパ球については,上皮細胞により放出されるサイトカインであるインターロイキン33が強力な活性化タンパク質として知られており,2型自然リンパ球は上皮細胞と協調的にはたらくことが示唆されている.
自然リンパ球は異なる機能をもつ細胞の集団であり,おのおののグループが特定のタイプの免疫応答をつかさどると考えられている.しかし一方で,自然リンパ球は可塑性をもち異なるグループへと分化することも明らかにされてきた.とくに,1型自然リンパ球と3型自然リンパ球とのあいだの可塑性はよく研究されている2,3)(図1).一方,2型自然リンパ球は比較的安定と考えられており,2型自然リンパ球が分化し新たな形質を獲得するかどうかについては知られていなかった.
健常人の末梢血に由来する2型自然リンパ球を用いて,2型自然リンパ球の活性化を促進するサイトカインあるいは増殖因子をスクリーニングした.多数のサイトカインのなかから,これまで知られていたインターロイキン33やインターロイキン25にくわえ,インターロイキン1αおよびインターロイキン1βが2型自然リンパ球のex vivoにおける増殖,インターロイキン5およびインターロイキン13の産生を強く促進することが見い出された.この培養において,2型自然リンパ球は10日間のうちにもとの細胞数の50倍以上に増加した.インターロイキン1αあるいはインターロイキン1βによる2型自然リンパ球の活性化の程度はインターロイキン33とほぼ同じであり,インターロイキン25に比べはるかに高かった.また,インターロイキン1βは扁桃から単離した2型自然リンパ球に対しても同様に作用した.さらに,2型自然リンパ球がインターロイキン1受容体を発現すること,インターロイキン1受容体の内因性の阻害タンパク質であるインターロイキン1受容体アンタゴニストはインターロイキン1βの作用を阻害することが示され,インターロイキン1βの作用がその選択的な受容体を介したものであることが明らかにされた.以上のことから,インターロイキン1による2型自然リンパ球の活性化が生理的に重要であることが示唆された.
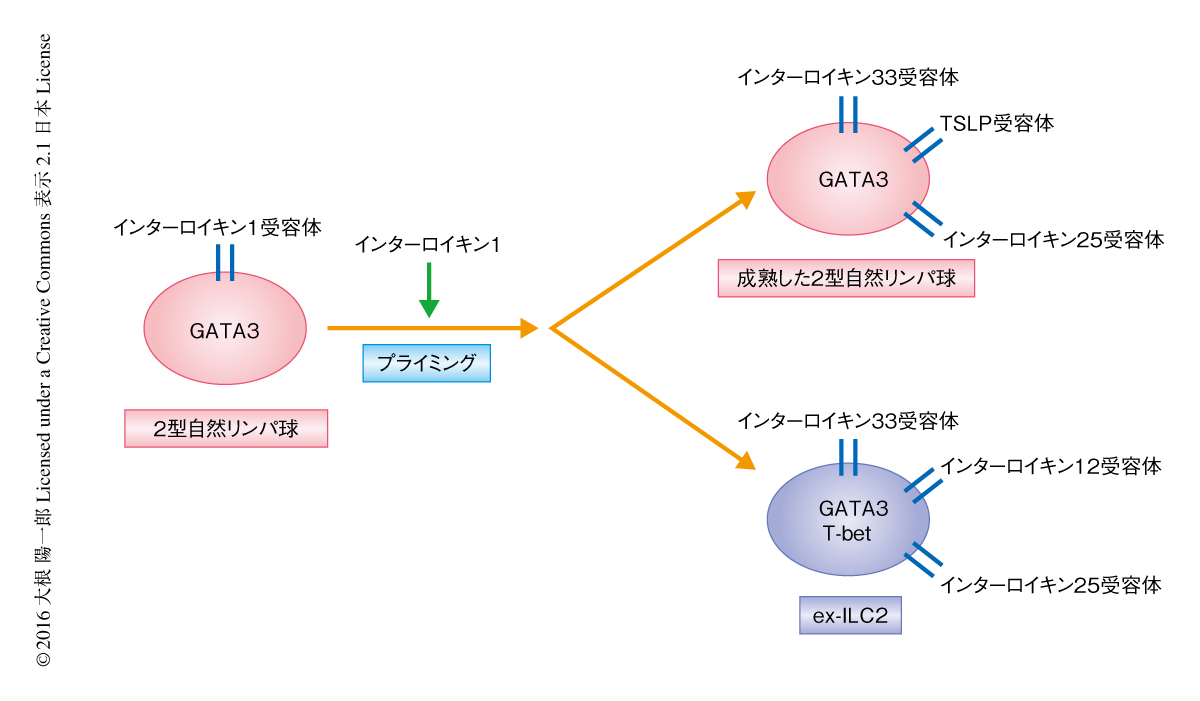
インターロイキン1は2型自然リンパ球の活性化だけでなく,インターロイキン33をはじめとする上皮細胞に由来するサイトカインに対する応答を増強した.インターロイキン1βは2型自然リンパ球においてインターロイキン33受容体,インターロイキン25受容体,TSLP受容体をコードする遺伝子のmRNAレベルの発現を顕著に誘導した.さらに,単離した直後の2型自然リンパ球のこれらの刺激に対する応答はきわめて微弱であった一方,インターロイキン1βの存在のもとで培養された2型自然リンパ球はインターロイキン33およびTSLPに強く応答し,それぞれNF-κBおよびSTAT5のリン酸化をひき起こした.また,単離の直後の2型自然リンパ球において,インターロイキン1βはインターロイキン33に比べNF-κBのリン酸化をつねにより強力にひき起こした.さらに,2型自然リンパ球におけるインターロイキン33受容体の発現量は,インターロイキン33に応答する細胞として知られる好塩基球に比べ顕著に低かった.このことから,ヒトの末梢血に存在する2型自然リンパ球にとりインターロイキン1が主要なインターロイキン1ファミリーサイトカインであることが示唆された.以上の結果から,インターロイキン1が比較的未成熟な状態で存在するヒトの2型自然リンパ球を“プライミング”し,上皮細胞と協調的にはたらくために必要な受容体の発現を促進すると結論された.
インターロイキン1のシグナルの2型自然リンパ球への影響を詳細に解析するため,単離の直後の2型自然リンパ球およびインターロイキン1βにより刺激された2型自然リンパ球のトランスクリプトームをRNA-seq法により取得した.約4700の遺伝子の発現の上昇がインターロイキン1βにより刺激された2型自然リンパ球において観察され,このうち,抗原の提示や脂質の代謝など,2型自然リンパ球の関与する細胞の機能4,5) にかかわる遺伝子の発現が上昇していた.この結果から,インターロイキン1が2型自然リンパ球の成熟を促進することが示唆された.
インターロイキン1βにより刺激された2型自然リンパ球において,Th1細胞に特異的な遺伝子パターンが見い出された.とりわけ,1型自然リンパ球のマスター転写因子であるT-betをコードする遺伝子,および,インターロイキン12受容体の特異的なサブユニットをコードする遺伝子の発現が弱いながらも有意に上昇した.成熟したTh2細胞様の形質を示す2型自然リンパ球がTh1細胞様の遺伝子を発現するという,いっけん矛盾するようにみえるこの現象は,活性化された2型自然リンパ球が1型自然リンパ球へ分化しうるという可能性を示唆すると考えられた.
主として抗原提示細胞により産生されるインターロイキン12は,3型自然リンパ球から1型自然リンパ球への分化を促進する3).活性化した2型自然リンパ球においてインターロイキン12受容体が発現していたことをうけ,2型自然リンパ球の分化におけるインターロイキン12の影響について検討した.仮説と一致して,インターロイキン1βの存在のもと培養された2型自然リンパ球はインターロイキン12の刺激によりインターフェロンγの産生能を獲得した.この細胞はインターロイキン13の産生能を保持しており,さらに,転写因子T-betおよび転写因子GATA3を共発現した.よって,この“ex-ILC2”(ILC2,2型自然リンパ球)は,2型自然リンパ球および1型自然リンパ球の両者の特徴を備えていた.また,インターロイキン12の刺激による1型自然リンパ球様の機能の獲得はインターロイキン1βの存在のもとでのみ観察されたことから,インターロイキン1βによるプライミングが2型自然リンパ球の可塑性に必須であることが示された.
この新奇な表現型を示すex-ILC2の分化の状態をエピジェネティックのレベルで検討した.インターフェロンγをコードする遺伝子座,および,インターロイキン4,インターロイキン5,インターロイキン13をコードする遺伝子座は,それぞれ,Th1細胞およびTh2細胞において転写活性化を示すヒストン修飾が濃縮されている.そこで,2型自然リンパ球と,1型自然リンパ球のサブタイプとしてナチュラルキラー細胞において,転写の活性化の指標であるヒストンH3のLys9のアセチル化,および,転写の抑制の指標であるヒストンH3のLys27のトリメチル化の動態をクロマチン免疫沈降法により調べた.予想されたとおり,通常の2型自然リンパ球においてはインターロイキン4,インターロイキン5,インターロイキン13をコードする遺伝子座の転写の活性化およびインターフェロンγをコードする遺伝子座の転写の抑制が観察され,ナチュラルキラー細胞はこの逆のパターンを示した.しかし,インターロイキン12により刺激されたex-ILC2においてはインターフェロンγをコードする遺伝子座およびインターロイキン4,インターロイキン5,インターロイキン13をコードする遺伝子座がともに活性化していることを示すヒストン修飾のパターンが観察され,ex-ILC2がエピジェネティックのレベルにおいても2型自然リンパ球および1型自然リンパ球の両方の性質をあわせもつことが明らかにされた.
2型自然リンパ球の可塑性におけるインターロイキン1βのin vivoでの作用について,マウスの個体を用いて検討した.免疫不全マウスにインターロイキン1βおよびインターロイキン12を経鼻的に投与し,肺に局在する2型自然リンパ球の表現型について検討した.インターロイキン1βあるいはインターロイキン12を投与したマウスにおいて,GATA3およびT-betを共発現する細胞が出現し,その頻度はインターロイキン1βおよびインターロイキン12を同時に添加した個体において最大になった.この細胞はインターロイキン5およびインターフェロンγを同時に産生し,さらに,インターロイキン18受容体を発現したことから,マウスの個体においてもインターロイキン1βおよびインターロイキン12のシグナルがex-ILC2の分化を誘導することが示された.
マウスの個体ではインターロイキン1β単独でex-ILC2への分化が観察されたことから,インターロイキン1βの経鼻的な投与は肺におけるインターロイキン12の産生を誘導していると考えられた.実際に,インターロイキン1βと同時に抗インターロイキン12中和抗体を投与することによりex-ILC2の分化の誘導は抑制された.さらに,このマウスから単離された2型自然リンパ球はex vivoにおけるインターロイキン33応答性が増強されており,対照となる2型自然リンパ球に比べ多量のインターロイキン5およびインターロイキン13を産生した.以上から,インターロイキン1βはマウスの個体においても2型自然リンパ球の活性化および可塑性の両方を制御することが示された.
この研究における観察から,インターロイキン1がヒトの2型自然リンパ球をプライミングし,2型自然リンパ球が成熟あるいはex-ILC2へと分化する際の起点になることが提唱された(図2).インターロイキン33とは異なり,インターロイキン1βは免疫系,とくに,ミエロイド系の細胞によりインフラマソームの活性化を介して産生される.よって,炎症のもとでの免疫細胞との相互作用が2型自然リンパ球の運命の決定に寄与するのであろう.このような相互作用が起こる臓器あるいは領域について,個体のレベルにて明らかにすることは今後の課題である.
ヒトの末梢血の2型自然リンパ球においてインターロイキン33受容体やTSLP受容体の発現は低いレベルであり,これらのサイトカインに対する応答は微弱であった.扁桃あるいは肺から単離された2型自然リンパ球も同様の傾向を示しており6),健康なヒトの個体において2型自然リンパ球は未成熟な状態で存在することが示唆された.マウスにおいては骨髄に存在する前駆細胞を含め,2型自然リンパ球は高いレベルでインターロイキン33受容体を発現しており,ヒトとマウスのあいだで基底レベルにおける2型自然リンパ球の状態に大きな違いがあることが明らかにされた.よって,ヒトを対象にした2型自然リンパ球に関する基礎的な知見の蓄積は,2型自然リンパ球を疾患の治療の標的にするうえで重要であると考えられた.
また,今回の研究から,2型自然リンパ球を含むすべてのグループの自然リンパ球は可塑性をもつことが示された.ごく最近の研究から,自然リンパ球はきわめて長い寿命をもって末梢組織に存在することが示されており7,8),可塑性は自然リンパ球がさまざまな病原体に対し効率よく免疫応答を誘導するための合理的な機構と考えられる.このような可塑性が疾患に関与するかどうかについては今後の課題であるが,Nature Immunology誌にこの論文と同時に掲載されたほかの研究グループの報告において,マウスのex-ILC2はより病原的であることが示され,さらに,慢性閉塞性肺疾患の患者において2型自然リンパ球の1型自然リンパ球への分化が促進されていることも示唆された9).喘息をはじめとするアレルギー性疾患は古典的にはTh2細胞にかかわる疾患ととらえられてきたが,重度の患者においてTh1細胞やTh17細胞との混合型を示すサブタイプの存在が明らかにされてきており10),2型自然リンパ球の可塑性がこのような混合型のサブタイプの要因のひとつとなることも考えられる.このような点から,2型自然リンパ球の詳細な分子機構にもとづく可塑性の抑制あるいは形質のリプログラミングは,このような重症なアレルギー疾患の治療の標的となる可能性を秘めると考えられる.
略歴:2007年 東京大学大学院農学生命科学研究科 修了,神戸大学大学院医学研究科 博士研究員,米国Baylor Scott and White Health博士研究員を経て,2014年より米国Medimmune研究員.
研究テーマ:自然リンパ球の機能および疾患への関与.
関心事:ヒトの免疫系を本質的に理解するためのアプローチおよび創薬への応用.
© 2016 大根 陽一郎 Licensed under CC 表示 2.1 日本
(米国MedImmune,R&D Research)
email:大根陽一郎
DOI: 10.7875/first.author.2016.052
IL-1 is a critical regulator of group 2 innate lymphoid cell function and plasticity.
Yoichiro Ohne, Jonathan S. Silver, LuAnn Thompson-Snipes, Magalie A. Collet, Jean Philippe Blanck, Brandi L. Cantarel, Alan M. Copenhaver, Alison A. Humbles, Yong-Jun Liu
Nature Immunology, 17, 646-655 (2016)
要 約
2型自然リンパ球は上皮細胞に由来するサイトカインであるインターロイキン33,インターロイキン25,TSLPに応答し,寄生虫に対する防御やアレルギー性疾患の発症にかかわると考えられている.今回,筆者らは,インターロイキン1がヒトの2型自然リンパ球の重要な活性化タンパク質であることを見い出した.インターロイキン1は2型自然リンパ球の増殖およびサイトカインの産生を促進するとともに,上皮細胞に由来するサイトカインに対する受容体の発現を誘導した.さらに,インターロイキン1は2型自然リンパ球の可塑性も制御することが明らかにされた.インターロイキン1により刺激された2型自然リンパ球はインターロイキン12受容体を発現し,インターロイキン12のシグナルによりクロマチンの構造の変化をともなう1型自然リンパ球様の形質を獲得した.このようなインターロイキン1の作用はマウスの個体においても機能することが示され,炎症における中心的なメディエーターであるインターロイキン1の2型自然リンパ球を介した新たな役割が明らかにされた.
はじめに
近年,同定された自然リンパ球(innate lymphoid cell:ILC)は自然免疫系におけるヘルパーT細胞に対応する細胞の集団として感染に対する防御や組織の修復に役割を担う.自然リンパ球は不均一な細胞の集団であり,産生するサイトカインの種類およびこれらをつかさどるマスター転写因子の発現から1型,2型,3型の3つのグループに分けられる1)(図1).このうち,2型自然リンパ球はインターロイキン5およびインターロイキン13を産生し,転写因子GATA3を高レベルで発現する.2型自然リンパ球は寄生虫の防御に重要な寄与をもつ一方,喘息やアトピー性皮膚炎の発症に関与することが示されており,その活性の制御機構の解明は重要な課題のひとつである.
自然リンパ球は抗原受容体をもたず,サイトカインおよび増殖因子が活性の制御に重要と考えられている.とくに,インターロイキン1ファミリーサイトカインによるNF-κBシグナル伝達経路がその活性化に重要な役割を担う.おのおののグループの自然リンパ球は異なるインターロイキン1ファミリーサイトカインに対し優先的あるいは選択的に応答すると考えられている(図1).2型自然リンパ球については,上皮細胞により放出されるサイトカインであるインターロイキン33が強力な活性化タンパク質として知られており,2型自然リンパ球は上皮細胞と協調的にはたらくことが示唆されている.
自然リンパ球は異なる機能をもつ細胞の集団であり,おのおののグループが特定のタイプの免疫応答をつかさどると考えられている.しかし一方で,自然リンパ球は可塑性をもち異なるグループへと分化することも明らかにされてきた.とくに,1型自然リンパ球と3型自然リンパ球とのあいだの可塑性はよく研究されている2,3)(図1).一方,2型自然リンパ球は比較的安定と考えられており,2型自然リンパ球が分化し新たな形質を獲得するかどうかについては知られていなかった.
1.インターロイキン1は2型自然リンパ球の強力な活性化タンパク質である
健常人の末梢血に由来する2型自然リンパ球を用いて,2型自然リンパ球の活性化を促進するサイトカインあるいは増殖因子をスクリーニングした.多数のサイトカインのなかから,これまで知られていたインターロイキン33やインターロイキン25にくわえ,インターロイキン1αおよびインターロイキン1βが2型自然リンパ球のex vivoにおける増殖,インターロイキン5およびインターロイキン13の産生を強く促進することが見い出された.この培養において,2型自然リンパ球は10日間のうちにもとの細胞数の50倍以上に増加した.インターロイキン1αあるいはインターロイキン1βによる2型自然リンパ球の活性化の程度はインターロイキン33とほぼ同じであり,インターロイキン25に比べはるかに高かった.また,インターロイキン1βは扁桃から単離した2型自然リンパ球に対しても同様に作用した.さらに,2型自然リンパ球がインターロイキン1受容体を発現すること,インターロイキン1受容体の内因性の阻害タンパク質であるインターロイキン1受容体アンタゴニストはインターロイキン1βの作用を阻害することが示され,インターロイキン1βの作用がその選択的な受容体を介したものであることが明らかにされた.以上のことから,インターロイキン1による2型自然リンパ球の活性化が生理的に重要であることが示唆された.
2.インターロイキン1は2型自然リンパ球の上皮細胞に由来するサイトカインに対する受容体の発現を誘導し応答を増強させる
インターロイキン1は2型自然リンパ球の活性化だけでなく,インターロイキン33をはじめとする上皮細胞に由来するサイトカインに対する応答を増強した.インターロイキン1βは2型自然リンパ球においてインターロイキン33受容体,インターロイキン25受容体,TSLP受容体をコードする遺伝子のmRNAレベルの発現を顕著に誘導した.さらに,単離した直後の2型自然リンパ球のこれらの刺激に対する応答はきわめて微弱であった一方,インターロイキン1βの存在のもとで培養された2型自然リンパ球はインターロイキン33およびTSLPに強く応答し,それぞれNF-κBおよびSTAT5のリン酸化をひき起こした.また,単離の直後の2型自然リンパ球において,インターロイキン1βはインターロイキン33に比べNF-κBのリン酸化をつねにより強力にひき起こした.さらに,2型自然リンパ球におけるインターロイキン33受容体の発現量は,インターロイキン33に応答する細胞として知られる好塩基球に比べ顕著に低かった.このことから,ヒトの末梢血に存在する2型自然リンパ球にとりインターロイキン1が主要なインターロイキン1ファミリーサイトカインであることが示唆された.以上の結果から,インターロイキン1が比較的未成熟な状態で存在するヒトの2型自然リンパ球を“プライミング”し,上皮細胞と協調的にはたらくために必要な受容体の発現を促進すると結論された.
3.インターロイキン1は2型自然リンパ球に対しトランスクリプトームの大規模な変動をもたらす
インターロイキン1のシグナルの2型自然リンパ球への影響を詳細に解析するため,単離の直後の2型自然リンパ球およびインターロイキン1βにより刺激された2型自然リンパ球のトランスクリプトームをRNA-seq法により取得した.約4700の遺伝子の発現の上昇がインターロイキン1βにより刺激された2型自然リンパ球において観察され,このうち,抗原の提示や脂質の代謝など,2型自然リンパ球の関与する細胞の機能4,5) にかかわる遺伝子の発現が上昇していた.この結果から,インターロイキン1が2型自然リンパ球の成熟を促進することが示唆された.
インターロイキン1βにより刺激された2型自然リンパ球において,Th1細胞に特異的な遺伝子パターンが見い出された.とりわけ,1型自然リンパ球のマスター転写因子であるT-betをコードする遺伝子,および,インターロイキン12受容体の特異的なサブユニットをコードする遺伝子の発現が弱いながらも有意に上昇した.成熟したTh2細胞様の形質を示す2型自然リンパ球がTh1細胞様の遺伝子を発現するという,いっけん矛盾するようにみえるこの現象は,活性化された2型自然リンパ球が1型自然リンパ球へ分化しうるという可能性を示唆すると考えられた.
4.インターロイキン1βにより刺激された2型自然リンパ球はインターロイキン12のシグナルの存在のもと2型自然リンパ球と1型自然リンパ球の特徴をもつ細胞に分化する
主として抗原提示細胞により産生されるインターロイキン12は,3型自然リンパ球から1型自然リンパ球への分化を促進する3).活性化した2型自然リンパ球においてインターロイキン12受容体が発現していたことをうけ,2型自然リンパ球の分化におけるインターロイキン12の影響について検討した.仮説と一致して,インターロイキン1βの存在のもと培養された2型自然リンパ球はインターロイキン12の刺激によりインターフェロンγの産生能を獲得した.この細胞はインターロイキン13の産生能を保持しており,さらに,転写因子T-betおよび転写因子GATA3を共発現した.よって,この“ex-ILC2”(ILC2,2型自然リンパ球)は,2型自然リンパ球および1型自然リンパ球の両者の特徴を備えていた.また,インターロイキン12の刺激による1型自然リンパ球様の機能の獲得はインターロイキン1βの存在のもとでのみ観察されたことから,インターロイキン1βによるプライミングが2型自然リンパ球の可塑性に必須であることが示された.
この新奇な表現型を示すex-ILC2の分化の状態をエピジェネティックのレベルで検討した.インターフェロンγをコードする遺伝子座,および,インターロイキン4,インターロイキン5,インターロイキン13をコードする遺伝子座は,それぞれ,Th1細胞およびTh2細胞において転写活性化を示すヒストン修飾が濃縮されている.そこで,2型自然リンパ球と,1型自然リンパ球のサブタイプとしてナチュラルキラー細胞において,転写の活性化の指標であるヒストンH3のLys9のアセチル化,および,転写の抑制の指標であるヒストンH3のLys27のトリメチル化の動態をクロマチン免疫沈降法により調べた.予想されたとおり,通常の2型自然リンパ球においてはインターロイキン4,インターロイキン5,インターロイキン13をコードする遺伝子座の転写の活性化およびインターフェロンγをコードする遺伝子座の転写の抑制が観察され,ナチュラルキラー細胞はこの逆のパターンを示した.しかし,インターロイキン12により刺激されたex-ILC2においてはインターフェロンγをコードする遺伝子座およびインターロイキン4,インターロイキン5,インターロイキン13をコードする遺伝子座がともに活性化していることを示すヒストン修飾のパターンが観察され,ex-ILC2がエピジェネティックのレベルにおいても2型自然リンパ球および1型自然リンパ球の両方の性質をあわせもつことが明らかにされた.
5.インターロイキン1βはマウスの個体において2型自然リンパ球の活性化および可塑性を制御する
2型自然リンパ球の可塑性におけるインターロイキン1βのin vivoでの作用について,マウスの個体を用いて検討した.免疫不全マウスにインターロイキン1βおよびインターロイキン12を経鼻的に投与し,肺に局在する2型自然リンパ球の表現型について検討した.インターロイキン1βあるいはインターロイキン12を投与したマウスにおいて,GATA3およびT-betを共発現する細胞が出現し,その頻度はインターロイキン1βおよびインターロイキン12を同時に添加した個体において最大になった.この細胞はインターロイキン5およびインターフェロンγを同時に産生し,さらに,インターロイキン18受容体を発現したことから,マウスの個体においてもインターロイキン1βおよびインターロイキン12のシグナルがex-ILC2の分化を誘導することが示された.
マウスの個体ではインターロイキン1β単独でex-ILC2への分化が観察されたことから,インターロイキン1βの経鼻的な投与は肺におけるインターロイキン12の産生を誘導していると考えられた.実際に,インターロイキン1βと同時に抗インターロイキン12中和抗体を投与することによりex-ILC2の分化の誘導は抑制された.さらに,このマウスから単離された2型自然リンパ球はex vivoにおけるインターロイキン33応答性が増強されており,対照となる2型自然リンパ球に比べ多量のインターロイキン5およびインターロイキン13を産生した.以上から,インターロイキン1βはマウスの個体においても2型自然リンパ球の活性化および可塑性の両方を制御することが示された.
おわりに
この研究における観察から,インターロイキン1がヒトの2型自然リンパ球をプライミングし,2型自然リンパ球が成熟あるいはex-ILC2へと分化する際の起点になることが提唱された(図2).インターロイキン33とは異なり,インターロイキン1βは免疫系,とくに,ミエロイド系の細胞によりインフラマソームの活性化を介して産生される.よって,炎症のもとでの免疫細胞との相互作用が2型自然リンパ球の運命の決定に寄与するのであろう.このような相互作用が起こる臓器あるいは領域について,個体のレベルにて明らかにすることは今後の課題である.
ヒトの末梢血の2型自然リンパ球においてインターロイキン33受容体やTSLP受容体の発現は低いレベルであり,これらのサイトカインに対する応答は微弱であった.扁桃あるいは肺から単離された2型自然リンパ球も同様の傾向を示しており6),健康なヒトの個体において2型自然リンパ球は未成熟な状態で存在することが示唆された.マウスにおいては骨髄に存在する前駆細胞を含め,2型自然リンパ球は高いレベルでインターロイキン33受容体を発現しており,ヒトとマウスのあいだで基底レベルにおける2型自然リンパ球の状態に大きな違いがあることが明らかにされた.よって,ヒトを対象にした2型自然リンパ球に関する基礎的な知見の蓄積は,2型自然リンパ球を疾患の治療の標的にするうえで重要であると考えられた.
また,今回の研究から,2型自然リンパ球を含むすべてのグループの自然リンパ球は可塑性をもつことが示された.ごく最近の研究から,自然リンパ球はきわめて長い寿命をもって末梢組織に存在することが示されており7,8),可塑性は自然リンパ球がさまざまな病原体に対し効率よく免疫応答を誘導するための合理的な機構と考えられる.このような可塑性が疾患に関与するかどうかについては今後の課題であるが,Nature Immunology誌にこの論文と同時に掲載されたほかの研究グループの報告において,マウスのex-ILC2はより病原的であることが示され,さらに,慢性閉塞性肺疾患の患者において2型自然リンパ球の1型自然リンパ球への分化が促進されていることも示唆された9).喘息をはじめとするアレルギー性疾患は古典的にはTh2細胞にかかわる疾患ととらえられてきたが,重度の患者においてTh1細胞やTh17細胞との混合型を示すサブタイプの存在が明らかにされてきており10),2型自然リンパ球の可塑性がこのような混合型のサブタイプの要因のひとつとなることも考えられる.このような点から,2型自然リンパ球の詳細な分子機構にもとづく可塑性の抑制あるいは形質のリプログラミングは,このような重症なアレルギー疾患の治療の標的となる可能性を秘めると考えられる.
文 献
- Artis, D. & Spits, H.: The biology of innate lymphoid cells. Nature, 517, 293-301 (2015)[PubMed]
- Klose, C. S. N., Kiss, E. A., Schwierzeck, V. et al.: A T-bet gradient controls the fate and function of CCR6-RORγt+ innate lymphoid cells. Nature, 494, 261-265 (2013)[PubMed]
- Bernink, J. H., Krabbendam, L., Germar, K. et al.: Interleukin-12 and -23 control plasticity of CD127+ group 1 and group 3 innate lymphoid cells in the intestinal lamina propria. Immunity, 43, 146-160 (2015)[PubMed]
- Robinette, M. L., Fuchs, A., Cortez, V. S. et al.: Transcriptional programs define molecular characteristics of innate lymphoid cell classes and subsets. Nat. Immunol., 16, 306-317 (2015)[PubMed]
- Oliphant, C. J., Hwang, Y. Y., Walker, J. A. et al.: MHCII-mediated dialog between group 2 innate lymphoid cells and CD4+ T cells potentiates type 2 immunity and promotes parasitic helminth expulsion. Immunity, 41, 283-295 (2014)[PubMed]
- Bal, S. M., Bernink, J. H., Nagasawa, M. et al.: IL-1β, IL-4 and IL-12 control the fate of group 2 innate lymphoid cells in human airway inflammation in the lungs. Nat. Immunol., 17, 636-645 (2016)[PubMed]
- Moro, K., Kabata, H., Tanabe, M. et al.: Interferon and IL-27 antagonize the function of group 2 innate lymphoid cells and type 2 innate immune responses. Nat. Immunol., 17, 76-86 (2016)[PubMed] [新着論文レビュー]
- Gasteiger, G., Fan, X., Dikiy, S. et al.: Tissue residency of innate lymphoid cells in lymphoid and nonlymphoid organs. Science, 350, 981-985 (2015)[PubMed]
- Silver, J. S., Kearley, J., Sanden, C. et al.: Inflammatory triggers associated with COPD exacerbations orchestrate ILC2 plasticity in the lung. Nat. Immunol., 17, 626-635 (2016)[PubMed]
- Lambrecht, B. N. & Hammad, H.: The immunology of asthma. Nat. Immunol., 16, 45-56 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2007年 東京大学大学院農学生命科学研究科 修了,神戸大学大学院医学研究科 博士研究員,米国Baylor Scott and White Health博士研究員を経て,2014年より米国Medimmune研究員.
研究テーマ:自然リンパ球の機能および疾患への関与.
関心事:ヒトの免疫系を本質的に理解するためのアプローチおよび創薬への応用.
© 2016 大根 陽一郎 Licensed under CC 表示 2.1 日本