内在性のリガンドによるAh受容体の恒常的な活性化はウイルスの感染によるI型インターフェロンの産生の誘導を抑制する
山田大翔・高岡晃教
(北海道大学遺伝子病制御研究所 分子生体防御分野)
email:高岡晃教
DOI: 10.7875/first.author.2016.051
Constitutive aryl hydrocarbon receptor signaling constrains type I interferon-mediated antiviral innate defense.
Taisho Yamada, Hiromasa Horimoto, Takeshi Kameyama, Sumio Hayakawa, Hiroaki Yamato, Masayoshi Dazai, Ayato Takada, Hiroshi Kida, Debbie Bott, Angela C. Zhou, David Hutin, Tania H. Watts, Masahiro Asaka, Jason Matthews, Akinori Takaoka
Nature Immunology, 17, 687-694 (2016)
Ah受容体はリガンドに依存して活性化する転写因子として機能し,ダイオキシンなどの毒性に関与する.しかしながら,ウイルスに感染したときの自然免疫応答におけるAh受容体の役割については不明な点が多い.この研究において,筆者らは,内在性のリガンドによるAh受容体の活性化はウイルスの感染によるI型インターフェロンの産生の誘導に対し抑制的に作用することを見い出した.ウイルスの感染によるインターフェロンβの産生の誘導はAh受容体を欠損させた細胞やマウスにおいて増強し,ウイルスの複製は抑制された.さらに,Ah受容体の活性化により発現の誘導されるTIPARPが,TBK1をADPリボシル化することによりそのキナーゼ活性を阻害して,I型インターフェロンの産生を抑制することが明らかにされた.以上の結果より,内在性のリガンドにより活性化されたAh受容体はI型インターフェロンの産生を抑制するという生理的な意義が示され,Ah受容体-TIPARPシグナル伝達系は抗ウイルス応答を増強するための治療の標的となりうる可能性が示唆された.
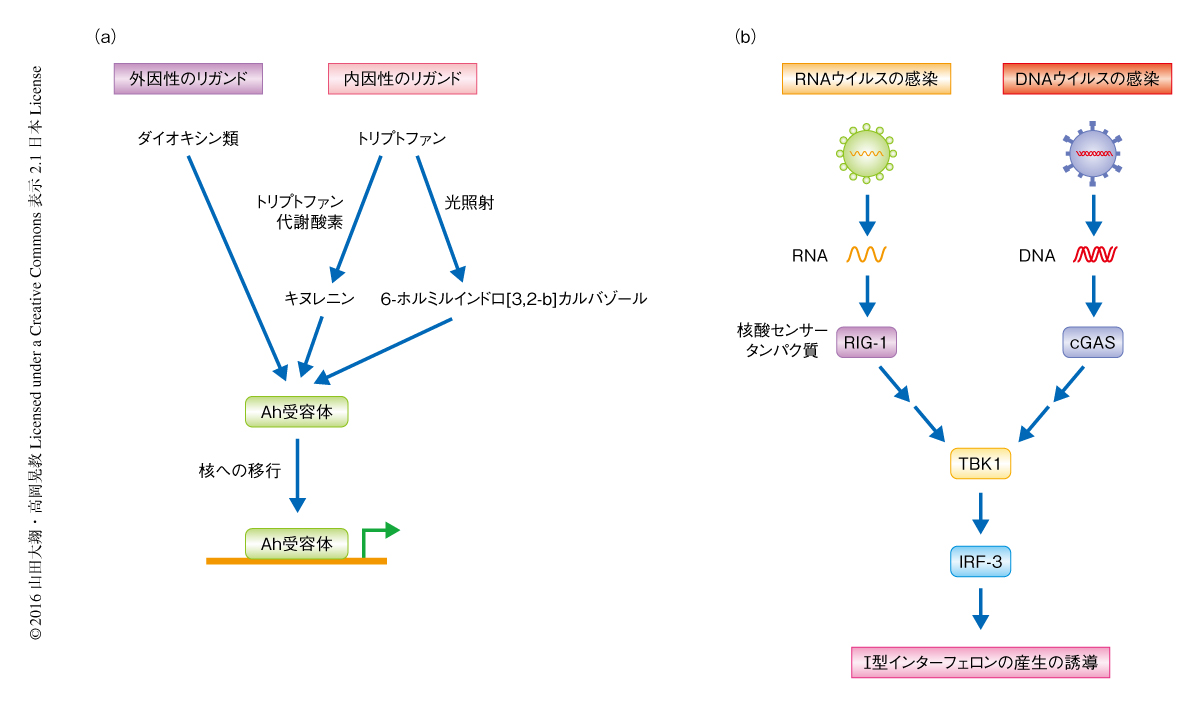
Ah受容体(aryl hydrocarbon receptor,芳香族炭化水素受容体)はダイオキシン類を認識し,発生,生殖機能,免疫機能の障害や,がん化などの毒性の発現に関与することが知られている1,2).一方で,Ah受容体の内在性のリガンドについても研究されており,細胞周期,細胞分化,免疫応答などの生理的な役割を担うことが示されている3).たとえば,トリプトファンからトリプトファン代謝酵素の作用により産生されるキヌレニンや,トリプトファンの光照射により生成する6-ホルミルインドロ[3,2-b]カルバゾールは,Ah受容体の内在性のリガンドとして知られている1)(図1a).
これまで,Ah受容体の免疫系における機能については,Ah受容体を外来性のリガンドに曝露する方法により多く研究されてきた4-6).一方で,炎症やがんにおいては,免疫担当細胞やがん細胞においてトリプトファンの代謝が亢進することによりその代謝産物が増加することが知られており4),実際に,キヌレニンの増加により制御性T細胞が増加することが示されている7).しかしながら,ウイルスに感染したときの自然免疫応答におけるAh受容体の役割についてはほとんど検討されていない.
ウイルスの感染により活性化される代表的な自然免疫応答として,ウイルスに由来する核酸を宿主のパターン認識受容体(pattern recognition receptor:PRR)が認識することにより誘導されるI型インターフェロンの産生があげられる8).たとえば,RNAセンサータンパク質であるRIG-Iや,DNAセンサータンパク質であるcGASなどのパターン認識受容体の活性化は,キナーゼであるTBK1および転写因子であるIRF-3を介してI型インターフェロンの産生を誘導することが知られている8,9)(図1b).
Ah受容体ノックアウトマウスに由来する胎仔線維芽細胞を用いた解析により,5種類のRNAウイルスおよび1種類のDNAウイルスのいずれの感染に対しても,Ah受容体はI型インターフェロンの産生を負に制御することが明らかにされた.Ah受容体を欠損した胎仔線維芽細胞においては,野生型マウスの胎仔線維芽細胞と比較して,インターフェロンβおよびインターフェロンαの産生が顕著に増加し,水疱性口内炎ウイルスあるいはインフルエンザウイルスの感染ののち24時間におけるウイルスの量は減少した.また,RNAあるいはDNAに由来する微生物関連分子パターン(microbial-associated molecular pattern:MAMP)による刺激においても同様の結果が得られた.Ah受容体ノックアウトマウスにおいては,インフルエンザウイルスの感染により気管支肺洗浄液におけるインターフェロンβが増加しウイルスの量が減少した.さらに,定常の状態のAh受容体ノックアウトマウスに由来する胎仔線維芽細胞の解析,および,Ah受容体のアンタゴニストであるCH-223191を処理したマウス胎仔線維芽細胞の解析により,内在性のリガンドによるAh受容体の活性化がI型インターフェロンの産生の抑制に関与することが示唆された.これに関連して,水疱性口内炎ウイルスの感染ののち6時間においてAh受容体の標的となる遺伝子の発現の上昇は認められなかったことから,少なくとも,ウイルスの感染の初期においては,内在性リガンドにより恒常的に活性化されるAh受容体がI型インターフェロンの産生を負の制御することが示唆された.
Ah受容体の内在性のリガンドとして知られるキヌレニンあるいは6-ホルミルインドロ[3,2-b]カルバゾールの処理により,ウイルスの感染によるI型インターフェロンの産生は有意に減少した.さらに,トリプトファン代謝酵素の阻害剤を用いた解析により,トリプトファンの代謝産物がAh受容体のリガンドとしてはたらき,ウイルスの感染によるI型インターフェロンの産生の誘導の抑制に関与することが示唆された.さらに,6-ホルミルインドロ[3,2-b]カルバゾールを腹腔内に投与したマウスに水疱性口内炎ウイルスを感染させたところ,Ah受容体に依存的した血清におけるインターフェロンβの減少およびウイルスの量の増加が認められた.これらの結果から,内在性のトリプトファンの代謝産物がリガンドとしてはたらくことによるAh受容体の恒常的な活性化が,ウイルスの感染によるI型インターフェロンの産生の誘導を介する抗ウイルス応答を抑制的に制御することが示された.
キヌレニンの処理によるAh受容体の活性化がI型インターフェロンの産生をどのように抑制するかについて検討したところ,Ah受容体の標的となる遺伝子にコードされるタンパク質のなかで,ADPリボシル化酵素であるTIPARPがもっとも主要な責任タンパク質であった.TIPARPノックアウトマウスに由来する胎仔線維芽細胞を用いて解析した結果,RNAあるいはDNAに由来する微生物関連分子パターンによる刺激によりI型インターフェロンの産生が有意に増加した.さらに,RNAウイルスあるいはDNAウイルスを感染させたときにも同様の結果が得られ,ウイルスの量の有意な減少が認められた.これらの結果から,TIPARPはウイルスの感染によるI型インターフェロンの産生の誘導を負に制御し,抗ウイルス応答を抑制する役割のあることが示唆された.
RNAセンサータンパク質であるRIG-IからI型インターフェロンの産生の誘導へのシグナル経路において,TIPARPはどの段階において関与するか検討したところ,少なくとも,TBK1の近傍においてRIG-Iからのシグナルを抑制することが示唆された.また,RNAに由来する微生物関連分子パターンによる刺激ののち4時間において,内在性のTIPARPとTBK1との会合が認められた.さらに,組換えタンパク質を用いてTIPARPとTBK1との会合について検討したところ,直接的に会合することが明らかにされた.また,共焦点レーザー顕微鏡による解析やFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)解析により,TIPARPとTBK1は核の周囲において共局在することが明らかにされた.
TIPARPはTBK1の活性化を制御するのかどうか検討したところ,TIPARPノックアウトマウスに由来する胎仔線維芽細胞においてTBK1のリン酸化が増強していることが示された.TIPARPがTBK1をどのように制御しているかについて検討するため,TIPARPのADPリボース転移活性に着目した10).TIPARPのHis532をAlaに置換した変異体はADP転移活性のないことが知られている10).組換えタンパク質を用いた系において,TIPARPはTBK1のキナーゼドメインを直接的にADPリボシル化し,このADPリボシル化はTBK1のキナーゼ活性を抑制することが明らかにされた.さらに,TIPARPノックアウトマウスに由来する胎仔線維芽細胞に野生型のTIPARPを発現させることにより表現型は回復したが,His532をAlaに置換した変異体を過剰に発現させても表現型は回復しなかった.以上の結果より,TIPARPはTBK1をADPリボシル化することによりそのキナーゼ活性を阻害し,I型インターフェロンの産生を抑制していることが示された.
Ah受容体の活性化によるI型インターフェロンの産生の抑制において,TIPARPが実際に関与しているかどうかTIPARPノックアウトマウスに由来する胎仔線維芽細胞を用いて解析したところ,Ah受容体のアンタゴニストやトリプトファン代謝酵素の阻害剤を用いてもI型インターフェロンの産生に対する抑制の阻害効果は得られなかった.したがって,内在性のリガンドにより活性化されたAh受容体を介したI型インターフェロンの産生の制御にはTIPARPが必須であることが示された.この内在性のリガンドにより恒常的に活性化したAh受容体が,マウスの個体レベルにおいて抗ウイルス応答に影響をあたえているかどうか検討した.Ah受容体のアンタゴニストを腹腔内に投与したマウスにおいて,インフルエンザウイルスに感染ののち36時間において気管支肺洗浄液におけるインターフェロンβの増加およびウイルスの量の減少がみられ,インフルエンザウイルスの感染に対し抵抗が高まる結果となった.さらに,TIPARPノックアウトマウスへのインフルエンザウイルスの感染により,in vivoにおいてもAh受容体による作用はTIPARPに依存することが証明された.したがって,Ah受容体-TIPARPシグナル伝達系はウイルスの感染によるI型インターフェロンの産生の誘導を負に制御する機構であることが明らかにされた.
この研究において,内在性のリガンドを介するAh受容体の恒常的な活性化は,ウイルスの感染による核酸センサータンパク質を介するI型インターフェロンの産生の誘導を抑制するという,Ah受容体の生理的な役割が明らかにされた.また,その分子機構として,Ah受容体の活性化により発現の誘導されるTIPARPがTBK1をADPリボシル化するという,これまでに報告のない翻訳後修飾を介することが示された(図2).
内在性のリガンドによるAh受容体の恒常的な活性化を介してTIPARPの発現を制御することは,ウイルスの感染においてI型インターフェロンの産生を微調整するという自然免疫応答の制御機構と考えられる.つまり,I型インターフェロンの過剰な産生によりひき起こされる有害な影響から宿主を守るため,ウイルスの感染において核酸センサータンパク質の下流におけるTBK1の活性を抑制するという重要な役割を,Ah受容体の恒常的な活性化が担うことを示唆している.別の観点からみると,宿主のストレスや栄養状態などの要因によるAh受容体の活性化が,ウイルスの感染に対する自然免疫応答を抑制している可能性も示唆される.
この研究の結果は,Ah受容体およびTIPARPが病態の制御にむけた新たな治療の標的となる可能性を示した点で重要な意義をもつと考えられる一方,Ah受容体を介したダイオキシン類などの免疫毒性に対する一局面を説明することにもつながると考えている.また,I型インターフェロンは抗腫瘍作用や発がんの過程にもかかわることが知られており,Ah受容体-TIPARPシグナル伝達系に依存的なI型インターフェロンの産生の制御とがんの進行,発生,免疫監視などとの関連性は今後の興味深い課題であると考えている.
略歴:2016年 北海道大学大学院医学研究科博士課程 修了,同年より北海道大学遺伝子病制御研究所 助教.
研究テーマ:ウイルス感染およびがんにおける自然免疫応答の分子機構.
高岡 晃教(Akinori Takaoka)
北海道大学遺伝子病制御研究所 教授.
研究室URL:http://www.igm.hokudai.ac.jp/sci/
© 2016 山田大翔・高岡晃教 Licensed under CC 表示 2.1 日本
(北海道大学遺伝子病制御研究所 分子生体防御分野)
email:高岡晃教
DOI: 10.7875/first.author.2016.051
Constitutive aryl hydrocarbon receptor signaling constrains type I interferon-mediated antiviral innate defense.
Taisho Yamada, Hiromasa Horimoto, Takeshi Kameyama, Sumio Hayakawa, Hiroaki Yamato, Masayoshi Dazai, Ayato Takada, Hiroshi Kida, Debbie Bott, Angela C. Zhou, David Hutin, Tania H. Watts, Masahiro Asaka, Jason Matthews, Akinori Takaoka
Nature Immunology, 17, 687-694 (2016)
要 約
Ah受容体はリガンドに依存して活性化する転写因子として機能し,ダイオキシンなどの毒性に関与する.しかしながら,ウイルスに感染したときの自然免疫応答におけるAh受容体の役割については不明な点が多い.この研究において,筆者らは,内在性のリガンドによるAh受容体の活性化はウイルスの感染によるI型インターフェロンの産生の誘導に対し抑制的に作用することを見い出した.ウイルスの感染によるインターフェロンβの産生の誘導はAh受容体を欠損させた細胞やマウスにおいて増強し,ウイルスの複製は抑制された.さらに,Ah受容体の活性化により発現の誘導されるTIPARPが,TBK1をADPリボシル化することによりそのキナーゼ活性を阻害して,I型インターフェロンの産生を抑制することが明らかにされた.以上の結果より,内在性のリガンドにより活性化されたAh受容体はI型インターフェロンの産生を抑制するという生理的な意義が示され,Ah受容体-TIPARPシグナル伝達系は抗ウイルス応答を増強するための治療の標的となりうる可能性が示唆された.
はじめに
Ah受容体(aryl hydrocarbon receptor,芳香族炭化水素受容体)はダイオキシン類を認識し,発生,生殖機能,免疫機能の障害や,がん化などの毒性の発現に関与することが知られている1,2).一方で,Ah受容体の内在性のリガンドについても研究されており,細胞周期,細胞分化,免疫応答などの生理的な役割を担うことが示されている3).たとえば,トリプトファンからトリプトファン代謝酵素の作用により産生されるキヌレニンや,トリプトファンの光照射により生成する6-ホルミルインドロ[3,2-b]カルバゾールは,Ah受容体の内在性のリガンドとして知られている1)(図1a).
これまで,Ah受容体の免疫系における機能については,Ah受容体を外来性のリガンドに曝露する方法により多く研究されてきた4-6).一方で,炎症やがんにおいては,免疫担当細胞やがん細胞においてトリプトファンの代謝が亢進することによりその代謝産物が増加することが知られており4),実際に,キヌレニンの増加により制御性T細胞が増加することが示されている7).しかしながら,ウイルスに感染したときの自然免疫応答におけるAh受容体の役割についてはほとんど検討されていない.
ウイルスの感染により活性化される代表的な自然免疫応答として,ウイルスに由来する核酸を宿主のパターン認識受容体(pattern recognition receptor:PRR)が認識することにより誘導されるI型インターフェロンの産生があげられる8).たとえば,RNAセンサータンパク質であるRIG-Iや,DNAセンサータンパク質であるcGASなどのパターン認識受容体の活性化は,キナーゼであるTBK1および転写因子であるIRF-3を介してI型インターフェロンの産生を誘導することが知られている8,9)(図1b).
1.内因性のリガンドにより活性化されたAh受容体はI型インターフェロンの産生を負に制御する
Ah受容体ノックアウトマウスに由来する胎仔線維芽細胞を用いた解析により,5種類のRNAウイルスおよび1種類のDNAウイルスのいずれの感染に対しても,Ah受容体はI型インターフェロンの産生を負に制御することが明らかにされた.Ah受容体を欠損した胎仔線維芽細胞においては,野生型マウスの胎仔線維芽細胞と比較して,インターフェロンβおよびインターフェロンαの産生が顕著に増加し,水疱性口内炎ウイルスあるいはインフルエンザウイルスの感染ののち24時間におけるウイルスの量は減少した.また,RNAあるいはDNAに由来する微生物関連分子パターン(microbial-associated molecular pattern:MAMP)による刺激においても同様の結果が得られた.Ah受容体ノックアウトマウスにおいては,インフルエンザウイルスの感染により気管支肺洗浄液におけるインターフェロンβが増加しウイルスの量が減少した.さらに,定常の状態のAh受容体ノックアウトマウスに由来する胎仔線維芽細胞の解析,および,Ah受容体のアンタゴニストであるCH-223191を処理したマウス胎仔線維芽細胞の解析により,内在性のリガンドによるAh受容体の活性化がI型インターフェロンの産生の抑制に関与することが示唆された.これに関連して,水疱性口内炎ウイルスの感染ののち6時間においてAh受容体の標的となる遺伝子の発現の上昇は認められなかったことから,少なくとも,ウイルスの感染の初期においては,内在性リガンドにより恒常的に活性化されるAh受容体がI型インターフェロンの産生を負の制御することが示唆された.
Ah受容体の内在性のリガンドとして知られるキヌレニンあるいは6-ホルミルインドロ[3,2-b]カルバゾールの処理により,ウイルスの感染によるI型インターフェロンの産生は有意に減少した.さらに,トリプトファン代謝酵素の阻害剤を用いた解析により,トリプトファンの代謝産物がAh受容体のリガンドとしてはたらき,ウイルスの感染によるI型インターフェロンの産生の誘導の抑制に関与することが示唆された.さらに,6-ホルミルインドロ[3,2-b]カルバゾールを腹腔内に投与したマウスに水疱性口内炎ウイルスを感染させたところ,Ah受容体に依存的した血清におけるインターフェロンβの減少およびウイルスの量の増加が認められた.これらの結果から,内在性のトリプトファンの代謝産物がリガンドとしてはたらくことによるAh受容体の恒常的な活性化が,ウイルスの感染によるI型インターフェロンの産生の誘導を介する抗ウイルス応答を抑制的に制御することが示された.
2.キヌレニンの処理によるAh受容体の活性化により発現の誘導されるTIPARPはI型インターフェロンの産生を抑制する
キヌレニンの処理によるAh受容体の活性化がI型インターフェロンの産生をどのように抑制するかについて検討したところ,Ah受容体の標的となる遺伝子にコードされるタンパク質のなかで,ADPリボシル化酵素であるTIPARPがもっとも主要な責任タンパク質であった.TIPARPノックアウトマウスに由来する胎仔線維芽細胞を用いて解析した結果,RNAあるいはDNAに由来する微生物関連分子パターンによる刺激によりI型インターフェロンの産生が有意に増加した.さらに,RNAウイルスあるいはDNAウイルスを感染させたときにも同様の結果が得られ,ウイルスの量の有意な減少が認められた.これらの結果から,TIPARPはウイルスの感染によるI型インターフェロンの産生の誘導を負に制御し,抗ウイルス応答を抑制する役割のあることが示唆された.
3.TIPARPはTBK1をADPリボシル化してそのキナーゼ活性を阻害する
RNAセンサータンパク質であるRIG-IからI型インターフェロンの産生の誘導へのシグナル経路において,TIPARPはどの段階において関与するか検討したところ,少なくとも,TBK1の近傍においてRIG-Iからのシグナルを抑制することが示唆された.また,RNAに由来する微生物関連分子パターンによる刺激ののち4時間において,内在性のTIPARPとTBK1との会合が認められた.さらに,組換えタンパク質を用いてTIPARPとTBK1との会合について検討したところ,直接的に会合することが明らかにされた.また,共焦点レーザー顕微鏡による解析やFRET(fluorescence resonance energy transfer,蛍光共鳴エネルギー移動)解析により,TIPARPとTBK1は核の周囲において共局在することが明らかにされた.
TIPARPはTBK1の活性化を制御するのかどうか検討したところ,TIPARPノックアウトマウスに由来する胎仔線維芽細胞においてTBK1のリン酸化が増強していることが示された.TIPARPがTBK1をどのように制御しているかについて検討するため,TIPARPのADPリボース転移活性に着目した10).TIPARPのHis532をAlaに置換した変異体はADP転移活性のないことが知られている10).組換えタンパク質を用いた系において,TIPARPはTBK1のキナーゼドメインを直接的にADPリボシル化し,このADPリボシル化はTBK1のキナーゼ活性を抑制することが明らかにされた.さらに,TIPARPノックアウトマウスに由来する胎仔線維芽細胞に野生型のTIPARPを発現させることにより表現型は回復したが,His532をAlaに置換した変異体を過剰に発現させても表現型は回復しなかった.以上の結果より,TIPARPはTBK1をADPリボシル化することによりそのキナーゼ活性を阻害し,I型インターフェロンの産生を抑制していることが示された.
4.Ah受容体-TIPARPシグナル伝達系はウイルスの感染によるI型インターフェロンの産生の誘導を抑制する
Ah受容体の活性化によるI型インターフェロンの産生の抑制において,TIPARPが実際に関与しているかどうかTIPARPノックアウトマウスに由来する胎仔線維芽細胞を用いて解析したところ,Ah受容体のアンタゴニストやトリプトファン代謝酵素の阻害剤を用いてもI型インターフェロンの産生に対する抑制の阻害効果は得られなかった.したがって,内在性のリガンドにより活性化されたAh受容体を介したI型インターフェロンの産生の制御にはTIPARPが必須であることが示された.この内在性のリガンドにより恒常的に活性化したAh受容体が,マウスの個体レベルにおいて抗ウイルス応答に影響をあたえているかどうか検討した.Ah受容体のアンタゴニストを腹腔内に投与したマウスにおいて,インフルエンザウイルスに感染ののち36時間において気管支肺洗浄液におけるインターフェロンβの増加およびウイルスの量の減少がみられ,インフルエンザウイルスの感染に対し抵抗が高まる結果となった.さらに,TIPARPノックアウトマウスへのインフルエンザウイルスの感染により,in vivoにおいてもAh受容体による作用はTIPARPに依存することが証明された.したがって,Ah受容体-TIPARPシグナル伝達系はウイルスの感染によるI型インターフェロンの産生の誘導を負に制御する機構であることが明らかにされた.
おわりに
この研究において,内在性のリガンドを介するAh受容体の恒常的な活性化は,ウイルスの感染による核酸センサータンパク質を介するI型インターフェロンの産生の誘導を抑制するという,Ah受容体の生理的な役割が明らかにされた.また,その分子機構として,Ah受容体の活性化により発現の誘導されるTIPARPがTBK1をADPリボシル化するという,これまでに報告のない翻訳後修飾を介することが示された(図2).
内在性のリガンドによるAh受容体の恒常的な活性化を介してTIPARPの発現を制御することは,ウイルスの感染においてI型インターフェロンの産生を微調整するという自然免疫応答の制御機構と考えられる.つまり,I型インターフェロンの過剰な産生によりひき起こされる有害な影響から宿主を守るため,ウイルスの感染において核酸センサータンパク質の下流におけるTBK1の活性を抑制するという重要な役割を,Ah受容体の恒常的な活性化が担うことを示唆している.別の観点からみると,宿主のストレスや栄養状態などの要因によるAh受容体の活性化が,ウイルスの感染に対する自然免疫応答を抑制している可能性も示唆される.
この研究の結果は,Ah受容体およびTIPARPが病態の制御にむけた新たな治療の標的となる可能性を示した点で重要な意義をもつと考えられる一方,Ah受容体を介したダイオキシン類などの免疫毒性に対する一局面を説明することにもつながると考えている.また,I型インターフェロンは抗腫瘍作用や発がんの過程にもかかわることが知られており,Ah受容体-TIPARPシグナル伝達系に依存的なI型インターフェロンの産生の制御とがんの進行,発生,免疫監視などとの関連性は今後の興味深い課題であると考えている.
文 献
- Denison, M. S. & Nagy, S. R.: Activation of the aryl hydrocarbon receptor by structurally diverse exogenous and endogenous chemicals. Annu. Rev. Pharmacol. Toxicol., 43, 309-334 (2003)[PubMed]
- Linden, J., Lensu, S., Tuomisto, J. et al.: Dioxins, the aryl hydrocarbon receptor and the central regulation of energy balance. Front. Neuroendocrinol., 31, 452-478 (2010)[PubMed]
- Hao, N. & Whitelaw, M. L.: The emerging roles of AhR in physiology and immunity. Biochem. Pharmacol., 86, 561-570 (2013)[PubMed]
- Stockinger, B., Di Meglio, P., Gialitakis, M. et al.: The aryl hydrocarbon receptor: multitasking in the immune system. Annu. Rev. Immunol., 32, 403-432 (2014)[PubMed]
- Vorderstrasse, B. A., Bohn, A. A. & Lawrence, B. P.: Examining the relationship between impaired host resistance and altered immune function in mice treated with TCDD. Toxicology, 188, 15-28 (2003)[PubMed]
- Lawrence, B. P., Roberts, A. D., Neumiller, J. J. et al.: Aryl hydrocarbon receptor activation impairs the priming but not the recall of influenza virus-specific CD8+ T cells in the lung. J. Immunol., 177, 5819-5828 (2006)[PubMed]
- Mezrich, J. D., Fechner, J. D., Zhang, X. et al.: An interaction between kynurenine and the aryl hydrocarbon receptor can generate regulatory T cells. J. Immunol., 185, 3190-3198 (2010)[PubMed]
- Goubau, D., Deddouche, S. & Reis e Sousa, C.: Cytosolic sensing of viruses. Immunity, 38, 855-869 (2013)[PubMed]
- Honda, K., Takaoka, A. & Taniguchi, T.: Type I interferon gene induction by the interferon regulatory factor family of transcription factors. Immunity, 25, 349-360 (2006)[PubMed]
- MacPherson, L., Tamblyn, L., Rajendra, S. et al.: 2,3,7,8-tetrachlorodibenzo-p-dioxin poly(ADP-ribose) polymerase (TiPARP, ARTD14) is a mono-ADP-ribosyltransferase and repressor of aryl hydrocarbon receptor transactivation. Nucleic Acids Res., 41, 1604-1621 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2016年 北海道大学大学院医学研究科博士課程 修了,同年より北海道大学遺伝子病制御研究所 助教.
研究テーマ:ウイルス感染およびがんにおける自然免疫応答の分子機構.
高岡 晃教(Akinori Takaoka)
北海道大学遺伝子病制御研究所 教授.
研究室URL:http://www.igm.hokudai.ac.jp/sci/
© 2016 山田大翔・高岡晃教 Licensed under CC 表示 2.1 日本