プラナリアの全能性幹細胞におけるPIWIファミリータンパク質による転移因子の抑制の機構
柴田典人・阿形清和
(京都大学大学院理学研究科 生物科学専攻分子発生学分科)
email:柴田典人,阿形清和
DOI: 10.7875/first.author.2016.047
Inheritance of a nuclear PIWI from pluripotent stem cells by somatic descendants ensures differentiation by silencing transposons in planarian.
Norito Shibata, Makoto Kashima, Taisuke Ishiko, Osamu Nishimura, Labib Rouhana, Kazuyo Misaki, Shigenobu Yonemura, Kuniaki Saito, Haruhiko Siomi, Mikiko C. Siomi, Kiyokazu Agata
Developmental Cell, 37, 226-237 (2016)
全能性幹細胞からの分化の過程においては転移因子の抑制が重要になる.多くの動物における生殖細胞の形成の過程においては,PIWIファミリータンパク質が低分子RNAであるpiRNAとともに転移因子の抑制においてその中心を担うことが知られている.これまで,プラナリアの全能性幹細胞である新生細胞においては,3種類のpiwiファミリー遺伝子が発現し体細胞の分化において重要な役割をはたすらしいことが示唆されてきたが,その分子機構については未知であった.筆者らは,核に局在するPIWIファミリータンパク質DjPiwiBが体細胞の分化の過程において遺伝子発現のない子孫細胞に受け継がれることを見い出した.DjPiwiBは新生細胞においてではなく,新生細胞から分化した子孫細胞において転移因子の活性化を抑制することにより細胞の分化を保証していた.この研究において,全能性幹細胞におけるPIWIファミリータンパク質による転移因子の抑制の新しい分子機構が提唱された.
分化全能性とは,生物のからだを構成するすべての種類の細胞へと分化できる能力をいう.全能性幹細胞であるES細胞に分化を誘導すると,劇的なエピジェネティックな変化をともなう大幅な遺伝子発現の変化が起こる.このクロマチンの状態の変化により,ゲノムDNAに存在する転移因子が活性化しないよう,たとえば,ES細胞においてはヒストンの修飾により転移因子が抑制される1).しかしながら,全能性幹細胞の分化の過程における転移因子の抑制については不明な点も多い.
無脊椎動物のなかには,成体において全能性幹細胞を保持しそれを厳格に制御することにより,からだの一部から個体を再生できる能力をもつ種が多く存在する2,3).成体に新生細胞とよばれる全能性幹細胞をもつ淡水性のプラナリアもそのひとつである.プラナリアを小さな断片に切断しても新生細胞からすべての種類の細胞が分化し,約1週間で完全な個体を再生する(図1).この新生細胞においては,ヒト,マウス,ショウジョウバエといった生物の生殖細胞において特異的に発現するRNA結合タンパク質が数多く発現する4).このうち,PIWIファミリータンパク質は,マウスやショウジョウバエにおける生殖細胞の形成の過程において,低分子RNAであるpiRNA(PIWI-interacting RNA)と結合し塩基配列に特異的に多くの転移因子を抑制することが報告されている5).プラナリアの新生細胞においては3種類のpiwiファミリー遺伝子が発現しており6,7),そのうちのひとつの機能を阻害すると再生の不全が生じる6).piRNAと予想される低分子RNAの存在も報告されているが,プラナリアの新生細胞において,実際にPIWIファミリータンパク質が転移因子を抑制するのかどうかなどは未知であった.
日本産の淡水性のプラナリアであるナミウズムシ(Dugesia japonica)においては,3種類のpiwiファミリー遺伝子,DjpiwiA遺伝子,DjpiwiB遺伝子,DjpiwiC遺伝子が新生細胞において発現する7).RNAi法を用いてこれらのコードするPIWIファミリータンパク質をノックダウンしたところ,別種のプラナリアにおいて報告のあったように6),DjPiwiBをノックダウンした個体において再生の不全が観察された.ノックダウンのためRNAを投与してから1日目に切断した個体では不完全な再生がみられ,7日目に切断した個体ではまったく再生が観察されなかった.このプラナリアの新生細胞の挙動を調べてみると,細胞分裂およびその数ともに正常なプラナリアと変化はなかった.これより,DjPiwiBは新生細胞の分化に必要とされるのではないかと考えられた.
多くの生物において,PIWIファミリータンパク質はpiRNAと共役して塩基配列に特異的に標的となる遺伝子の発現を転写レベルあるいは転写後レベルにおいて抑制する.そこで,DjPiwiBの標的となる遺伝子を明らかにするため,DjPiwiBに対する抗体を作製して免疫沈降法によりプラナリアからDjPiwiBを精製した.精製したDjPiwiBからRNAを回収し,その塩基配列を網羅的に解析したところ,3,087,387リードがプラナリアのゲノムの塩基配列と一致した.これらのRNAは長さがおよそ33塩基長で,最初の塩基がウラシルであるなど,piRNAに共通する特徴を備えていた.それらの塩基配列をプラナリアのESTデータベースと比較すると206,992リードが一致し,そのうち34%は転移因子であった.一致した転移因子のうち,gypsy-P1と名づけたレトロトランスポゾンに由来する転移因子は,定量PCR法により,DjPiwiBをノックダウンした個体において発現が上昇していることがわかった.このように,DjPiwiBはほかの生物と同様に転移因子を標的とすることが明らかにされた.
DjPiwiBをノックダウンした個体の新生細胞においてgypsy-P1の発現が活性化しているかどうかを,in situハイブリダイゼーション法により確認した.すると,gypsy-P1を発現した細胞は新生細胞のマーカーの発現が陰性を示し,新生細胞ではないことがわかった.この結果から,これらの細胞は,DjPiwiBのノックダウンのまえから存在した既存の分化した体細胞である,あるいは,DjPiwiBのノックダウンののち新生細胞から新規に分化した体細胞である,という2つの可能性が示唆された.
新生細胞はX線の照射により特異的に除去される.そこで,X線の照射ののちにDjPiwiBをノックダウンした個体においてgypsy-P1の発現を調べることにより,gypsy-P1が発現していれば既存の分化した体細胞において,発現がなければ新規の分化した体細胞において,gypsy-P1が活性化していると判断されると考えた.結果として,gypsy-P1の発現はX線の照射により劇的に低下した.X線の照射と似た事例として,新生細胞の体細胞への分化にはERKシグナル伝達系の活性化が必要であることが報告されている8).ERKシグナルの特異的な抑制剤であるU0126を処理したプラナリアは,新生細胞が存在しても細胞の分化が抑制され再生できない8).これを利用して,DjPiwiBをノックダウンした個体においてU0126を処理したところ,X線の照射と同様にgypsy-P1の発現が低下した.また,DjPiwiBをノックダウンしたのちすぐに切断することにより細胞の分化を促進すると,gypsy-P1を発現する細胞が増加した.さらに,DjPiwiBをノックダウンした個体における大規模な塩基配列の解読により,gypsy-P1を含む多くの転移因子がX線を照射した個体,あるいは,U0126を処理した個体において,同様の挙動を示すことも明らかにされた.これらの結果から,DjPiwiBは新生細胞においてではなく,新生細胞から体細胞へと分化するときに転移因子を抑制すると考えられた.
さきに述べたように,プラナリアのpiwiファミリー遺伝子は新生細胞において発現する.DjpiwiB遺伝子およびDjpiwiC遺伝子は脳においても発現が観察されるが,それ以外の分化した体細胞においてpiwiファミリー遺伝子の発現は観察されない.では,DjPiwiBはどのように遺伝子発現のない子孫細胞において転移因子を抑制するのだろうか.
DjPiwiA,DjPiwiB,DjPiwiCに対する抗体を作製し免疫染色を行った.その結果,DjPiwiAおよびDjPiwiCは新生細胞の細胞質において検出された一方,DjPiwiBは新生細胞を含むほぼすべての細胞の核において観察された.このように,DjPiwiAおよびDjPiwiCはそれぞれをコードするmRNAの発現と一致した発現を示したが,DjPiwiBはそのmRNAを発現する新生細胞だけでなく,子孫細胞であるほぼすべての体細胞において確認された.
DjPiwiBをノックダウンしたのち7日目に免疫染色を行ったところ,新生細胞においてはDjPiwiBを発現する細胞が80%ほど減少していた.一方,分化した体細胞の90%はDjPiwiBを保持していた.DjPiwiBをノックダウンした個体において,gypsy-P1を発現する細胞にDjPiwiBは検出されず,ノックダウンののち新規に分化したDjPiwiBをもたない体細胞,あるいは,分化している体細胞においてgypsy-P1は発現していた.このことから,新生細胞において生合成されたDjPiwiBが,DjPiwiBをコードするmRNAの存在しない子孫細胞へと受け継がれることにより,分化の過程における転移因子の活性化を抑制するのではないかと考えた.DjPiwiBのノックダウンののち1日目に切断し不完全な再生を起こした個体において,抗DjPiwiB抗体を用いた免疫染色を行うと,再生を起こした部分においてDjPiwiBをもたない,あるいは,シグナルの弱い分化した体細胞が多く観察された.この結果は,DjPiwiBが子孫細胞に受け継がれるという仮説を強く支持するものであった.
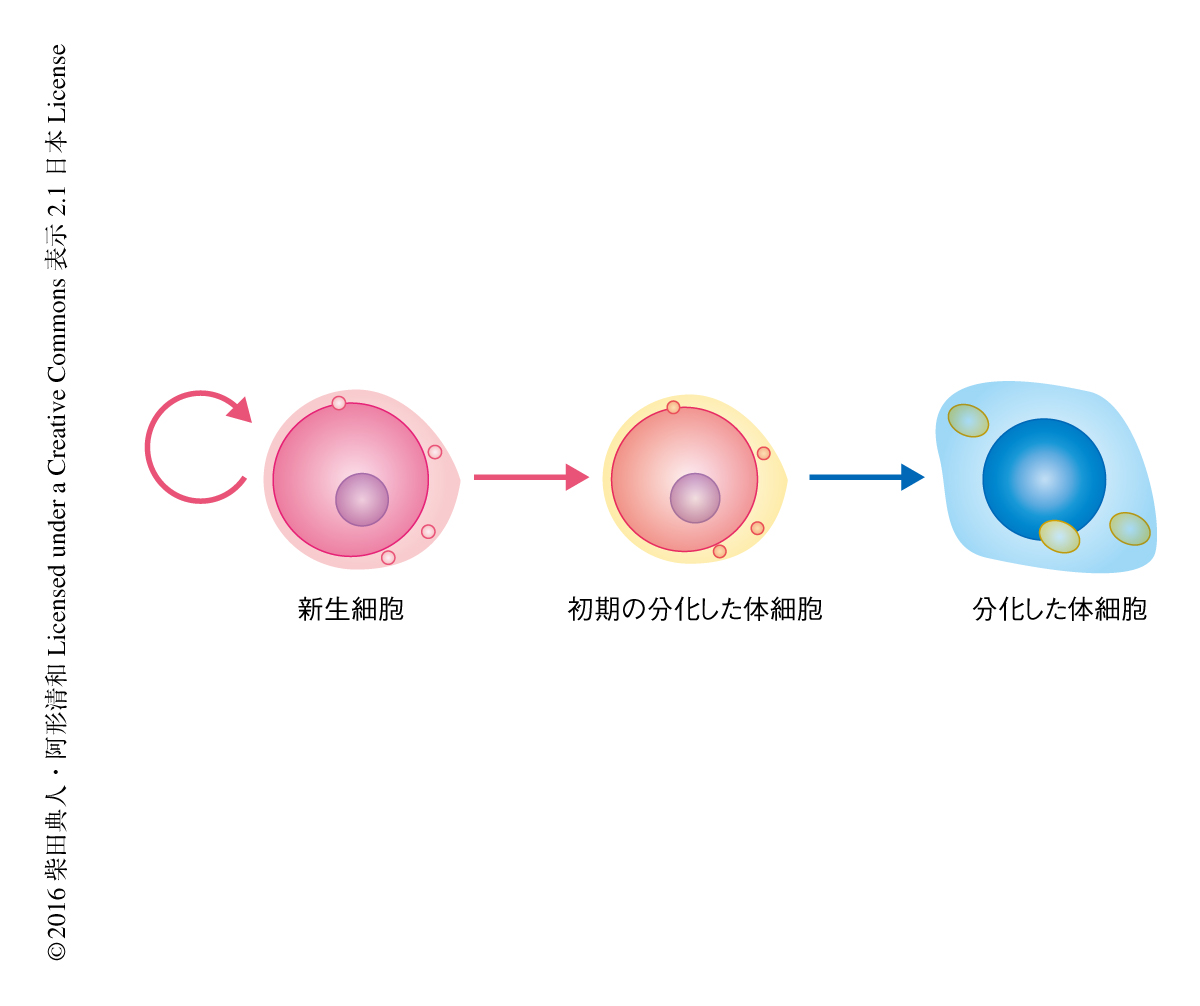
DjPiwiBが受け継がれないため転移因子が活性化した分化した体細胞はどうなるのだろうか.転移因子が活性化されるとDNA損傷の生じることが知られている.そこで,DjPiwiBをノックダウンした個体において,DNA損傷部位に起こるポリADPリボシル化を免疫染色法により観察した.その結果,DjPiwiBをノックダウンした個体においてシグナルが増加しており,多くのDNA損傷の生じていることが示唆された.DjPiwiBをノックダウンした個体においては核の染色が異常になり,また,電子顕微鏡を用いて,少なくともDjPiwiBをノックダウンした個体においてウイルス様の粒子をもつ退化した細胞が観察された.さらに,DjPiwiBをノックダウンした個体においては表皮の初期分化のマーカーの発現が低下した.これらの結果から,DjPiwiBのノックダウンにより観察される再生の不全は,DjPiwiBを失った新生細胞から分化した体細胞において転移因子が活性化し,その結果,細胞死などにより正常な分化した体細胞の供給ができなくなったことが原因であると結論づけられた(図2).
有性生殖により繁殖する生物にとり,生殖細胞におけるゲノム情報の保全は重要であり,転移因子の抑制によるゲノムの保護はPIWIファミリータンパク質によりなされている.一方,成体のからだの一部を用いた再生により繁殖する無性生殖も,多くの無脊椎動物においてみられる生殖の戦略である.プラナリアの再生も無性生殖であり,この現象の基幹をなす新生細胞において,生殖細胞と同様のPIWIファミリータンパク質を用いた転移因子の抑制の機構がはたらいているのは,進化あるいは細胞のもつ生物学的な意味合いの共通性などを考えるうえで興味深い.
マウスやショウジョウバエなどにおいては,細胞質に局在する2種類のPIWIファミリータンパク質が転写後レベルにおいて,核に局在する1種類のPIWIファミリータンパク質が転写レベルにおいて,転移因子を抑制することが報告されている.プラナリアにおいても,細胞質に局在するDjPiwiAおよびDjPiwiCと,核に局在するDjPiwiBが存在した.ショウジョウバエにおいては,生殖細胞において3種類のPIWIファミリータンパク質が,濾胞細胞において核に局在する1種類のPIWIファミリータンパク質が機能する.一方,プラナリアにおいては,新生細胞には3種類のPIWIファミリータンパク質が存在したが,分化した体細胞には核に局在するDjPiwiBのみが存在した.ショウジョウバエの生殖細胞と濾胞細胞はその起源が違い,また,濾胞細胞においてはPIWIファミリータンパク質の遺伝子発現が観察され,PIWIファミリータンパク質の発現はプラナリアとは異なる分子機構により制御される.しかしながら,ショウジョウバエおよびプラナリアにおけるPIWIファミリータンパク質の局在の共通性は,細胞質あるいは核における役割の共通性をうかがわせた.
なぜ,細胞質に局在するPIWIファミリータンパク質ではなく,核に局在するDjPiwiBだけが子孫細胞に受け継がれるのであろうか.マウスやショウジョウバエにおいては,核に局在するPIWIファミリータンパク質はエピジェネティックな機構により転移因子を抑制すると考えられる.プラナリアにおいては,細胞質のPIWIファミリータンパク質は新生細胞に特異的な別の機能をもつことが報告されている9).したがって,新生細胞からの分化の過程において,DjPiwiBをエピジェネティックな記憶として子孫細胞へと受け継がせることにより,転写レベルにおいて転移因子を抑制するのではないかと考えられる.今後,より詳細な研究により,DjPiwiBが受け継がれる分子機構について明らかにしていきたい.
略歴:1999年 姫路工業大学大学院理学研究科 修了,同年 三菱化学生命科学研究所 特別研究員,2001年 基礎生物学研究所 リサーチアソシエイト,2005年 京都大学大学院理学研究科 研究員,同 GCOE助教,同 特定准教授を経て,2016年より津山工業高等専門学校 准教授.
研究テーマ:プラナリアにおける全能性幹細胞の維持,増殖,分化に関する分子機構.
阿形 清和(Kiyokazu Agata)
学習院大学理学部 教授.
© 2016 柴田典人・阿形清和 Licensed under CC 表示 2.1 日本
(京都大学大学院理学研究科 生物科学専攻分子発生学分科)
email:柴田典人,阿形清和
DOI: 10.7875/first.author.2016.047
Inheritance of a nuclear PIWI from pluripotent stem cells by somatic descendants ensures differentiation by silencing transposons in planarian.
Norito Shibata, Makoto Kashima, Taisuke Ishiko, Osamu Nishimura, Labib Rouhana, Kazuyo Misaki, Shigenobu Yonemura, Kuniaki Saito, Haruhiko Siomi, Mikiko C. Siomi, Kiyokazu Agata
Developmental Cell, 37, 226-237 (2016)
要 約
全能性幹細胞からの分化の過程においては転移因子の抑制が重要になる.多くの動物における生殖細胞の形成の過程においては,PIWIファミリータンパク質が低分子RNAであるpiRNAとともに転移因子の抑制においてその中心を担うことが知られている.これまで,プラナリアの全能性幹細胞である新生細胞においては,3種類のpiwiファミリー遺伝子が発現し体細胞の分化において重要な役割をはたすらしいことが示唆されてきたが,その分子機構については未知であった.筆者らは,核に局在するPIWIファミリータンパク質DjPiwiBが体細胞の分化の過程において遺伝子発現のない子孫細胞に受け継がれることを見い出した.DjPiwiBは新生細胞においてではなく,新生細胞から分化した子孫細胞において転移因子の活性化を抑制することにより細胞の分化を保証していた.この研究において,全能性幹細胞におけるPIWIファミリータンパク質による転移因子の抑制の新しい分子機構が提唱された.
はじめに
分化全能性とは,生物のからだを構成するすべての種類の細胞へと分化できる能力をいう.全能性幹細胞であるES細胞に分化を誘導すると,劇的なエピジェネティックな変化をともなう大幅な遺伝子発現の変化が起こる.このクロマチンの状態の変化により,ゲノムDNAに存在する転移因子が活性化しないよう,たとえば,ES細胞においてはヒストンの修飾により転移因子が抑制される1).しかしながら,全能性幹細胞の分化の過程における転移因子の抑制については不明な点も多い.
無脊椎動物のなかには,成体において全能性幹細胞を保持しそれを厳格に制御することにより,からだの一部から個体を再生できる能力をもつ種が多く存在する2,3).成体に新生細胞とよばれる全能性幹細胞をもつ淡水性のプラナリアもそのひとつである.プラナリアを小さな断片に切断しても新生細胞からすべての種類の細胞が分化し,約1週間で完全な個体を再生する(図1).この新生細胞においては,ヒト,マウス,ショウジョウバエといった生物の生殖細胞において特異的に発現するRNA結合タンパク質が数多く発現する4).このうち,PIWIファミリータンパク質は,マウスやショウジョウバエにおける生殖細胞の形成の過程において,低分子RNAであるpiRNA(PIWI-interacting RNA)と結合し塩基配列に特異的に多くの転移因子を抑制することが報告されている5).プラナリアの新生細胞においては3種類のpiwiファミリー遺伝子が発現しており6,7),そのうちのひとつの機能を阻害すると再生の不全が生じる6).piRNAと予想される低分子RNAの存在も報告されているが,プラナリアの新生細胞において,実際にPIWIファミリータンパク質が転移因子を抑制するのかどうかなどは未知であった.
1.PIWIファミリータンパク質DjPiwiBは新生細胞の体細胞への分化に必要である
日本産の淡水性のプラナリアであるナミウズムシ(Dugesia japonica)においては,3種類のpiwiファミリー遺伝子,DjpiwiA遺伝子,DjpiwiB遺伝子,DjpiwiC遺伝子が新生細胞において発現する7).RNAi法を用いてこれらのコードするPIWIファミリータンパク質をノックダウンしたところ,別種のプラナリアにおいて報告のあったように6),DjPiwiBをノックダウンした個体において再生の不全が観察された.ノックダウンのためRNAを投与してから1日目に切断した個体では不完全な再生がみられ,7日目に切断した個体ではまったく再生が観察されなかった.このプラナリアの新生細胞の挙動を調べてみると,細胞分裂およびその数ともに正常なプラナリアと変化はなかった.これより,DjPiwiBは新生細胞の分化に必要とされるのではないかと考えられた.
2.DjPiwiBと結合するpiRNAの網羅的な解析
多くの生物において,PIWIファミリータンパク質はpiRNAと共役して塩基配列に特異的に標的となる遺伝子の発現を転写レベルあるいは転写後レベルにおいて抑制する.そこで,DjPiwiBの標的となる遺伝子を明らかにするため,DjPiwiBに対する抗体を作製して免疫沈降法によりプラナリアからDjPiwiBを精製した.精製したDjPiwiBからRNAを回収し,その塩基配列を網羅的に解析したところ,3,087,387リードがプラナリアのゲノムの塩基配列と一致した.これらのRNAは長さがおよそ33塩基長で,最初の塩基がウラシルであるなど,piRNAに共通する特徴を備えていた.それらの塩基配列をプラナリアのESTデータベースと比較すると206,992リードが一致し,そのうち34%は転移因子であった.一致した転移因子のうち,gypsy-P1と名づけたレトロトランスポゾンに由来する転移因子は,定量PCR法により,DjPiwiBをノックダウンした個体において発現が上昇していることがわかった.このように,DjPiwiBはほかの生物と同様に転移因子を標的とすることが明らかにされた.
3.DjPiwiBは分化した体細胞において消失しgypsy-P1が活性化する
DjPiwiBをノックダウンした個体の新生細胞においてgypsy-P1の発現が活性化しているかどうかを,in situハイブリダイゼーション法により確認した.すると,gypsy-P1を発現した細胞は新生細胞のマーカーの発現が陰性を示し,新生細胞ではないことがわかった.この結果から,これらの細胞は,DjPiwiBのノックダウンのまえから存在した既存の分化した体細胞である,あるいは,DjPiwiBのノックダウンののち新生細胞から新規に分化した体細胞である,という2つの可能性が示唆された.
新生細胞はX線の照射により特異的に除去される.そこで,X線の照射ののちにDjPiwiBをノックダウンした個体においてgypsy-P1の発現を調べることにより,gypsy-P1が発現していれば既存の分化した体細胞において,発現がなければ新規の分化した体細胞において,gypsy-P1が活性化していると判断されると考えた.結果として,gypsy-P1の発現はX線の照射により劇的に低下した.X線の照射と似た事例として,新生細胞の体細胞への分化にはERKシグナル伝達系の活性化が必要であることが報告されている8).ERKシグナルの特異的な抑制剤であるU0126を処理したプラナリアは,新生細胞が存在しても細胞の分化が抑制され再生できない8).これを利用して,DjPiwiBをノックダウンした個体においてU0126を処理したところ,X線の照射と同様にgypsy-P1の発現が低下した.また,DjPiwiBをノックダウンしたのちすぐに切断することにより細胞の分化を促進すると,gypsy-P1を発現する細胞が増加した.さらに,DjPiwiBをノックダウンした個体における大規模な塩基配列の解読により,gypsy-P1を含む多くの転移因子がX線を照射した個体,あるいは,U0126を処理した個体において,同様の挙動を示すことも明らかにされた.これらの結果から,DjPiwiBは新生細胞においてではなく,新生細胞から体細胞へと分化するときに転移因子を抑制すると考えられた.
4.新生細胞において生合成されたDjPiwiBは分化の過程において子孫細胞である分化した体細胞に受け継がれる
さきに述べたように,プラナリアのpiwiファミリー遺伝子は新生細胞において発現する.DjpiwiB遺伝子およびDjpiwiC遺伝子は脳においても発現が観察されるが,それ以外の分化した体細胞においてpiwiファミリー遺伝子の発現は観察されない.では,DjPiwiBはどのように遺伝子発現のない子孫細胞において転移因子を抑制するのだろうか.
DjPiwiA,DjPiwiB,DjPiwiCに対する抗体を作製し免疫染色を行った.その結果,DjPiwiAおよびDjPiwiCは新生細胞の細胞質において検出された一方,DjPiwiBは新生細胞を含むほぼすべての細胞の核において観察された.このように,DjPiwiAおよびDjPiwiCはそれぞれをコードするmRNAの発現と一致した発現を示したが,DjPiwiBはそのmRNAを発現する新生細胞だけでなく,子孫細胞であるほぼすべての体細胞において確認された.
DjPiwiBをノックダウンしたのち7日目に免疫染色を行ったところ,新生細胞においてはDjPiwiBを発現する細胞が80%ほど減少していた.一方,分化した体細胞の90%はDjPiwiBを保持していた.DjPiwiBをノックダウンした個体において,gypsy-P1を発現する細胞にDjPiwiBは検出されず,ノックダウンののち新規に分化したDjPiwiBをもたない体細胞,あるいは,分化している体細胞においてgypsy-P1は発現していた.このことから,新生細胞において生合成されたDjPiwiBが,DjPiwiBをコードするmRNAの存在しない子孫細胞へと受け継がれることにより,分化の過程における転移因子の活性化を抑制するのではないかと考えた.DjPiwiBのノックダウンののち1日目に切断し不完全な再生を起こした個体において,抗DjPiwiB抗体を用いた免疫染色を行うと,再生を起こした部分においてDjPiwiBをもたない,あるいは,シグナルの弱い分化した体細胞が多く観察された.この結果は,DjPiwiBが子孫細胞に受け継がれるという仮説を強く支持するものであった.
DjPiwiBが受け継がれないため転移因子が活性化した分化した体細胞はどうなるのだろうか.転移因子が活性化されるとDNA損傷の生じることが知られている.そこで,DjPiwiBをノックダウンした個体において,DNA損傷部位に起こるポリADPリボシル化を免疫染色法により観察した.その結果,DjPiwiBをノックダウンした個体においてシグナルが増加しており,多くのDNA損傷の生じていることが示唆された.DjPiwiBをノックダウンした個体においては核の染色が異常になり,また,電子顕微鏡を用いて,少なくともDjPiwiBをノックダウンした個体においてウイルス様の粒子をもつ退化した細胞が観察された.さらに,DjPiwiBをノックダウンした個体においては表皮の初期分化のマーカーの発現が低下した.これらの結果から,DjPiwiBのノックダウンにより観察される再生の不全は,DjPiwiBを失った新生細胞から分化した体細胞において転移因子が活性化し,その結果,細胞死などにより正常な分化した体細胞の供給ができなくなったことが原因であると結論づけられた(図2).
おわりに
有性生殖により繁殖する生物にとり,生殖細胞におけるゲノム情報の保全は重要であり,転移因子の抑制によるゲノムの保護はPIWIファミリータンパク質によりなされている.一方,成体のからだの一部を用いた再生により繁殖する無性生殖も,多くの無脊椎動物においてみられる生殖の戦略である.プラナリアの再生も無性生殖であり,この現象の基幹をなす新生細胞において,生殖細胞と同様のPIWIファミリータンパク質を用いた転移因子の抑制の機構がはたらいているのは,進化あるいは細胞のもつ生物学的な意味合いの共通性などを考えるうえで興味深い.
マウスやショウジョウバエなどにおいては,細胞質に局在する2種類のPIWIファミリータンパク質が転写後レベルにおいて,核に局在する1種類のPIWIファミリータンパク質が転写レベルにおいて,転移因子を抑制することが報告されている.プラナリアにおいても,細胞質に局在するDjPiwiAおよびDjPiwiCと,核に局在するDjPiwiBが存在した.ショウジョウバエにおいては,生殖細胞において3種類のPIWIファミリータンパク質が,濾胞細胞において核に局在する1種類のPIWIファミリータンパク質が機能する.一方,プラナリアにおいては,新生細胞には3種類のPIWIファミリータンパク質が存在したが,分化した体細胞には核に局在するDjPiwiBのみが存在した.ショウジョウバエの生殖細胞と濾胞細胞はその起源が違い,また,濾胞細胞においてはPIWIファミリータンパク質の遺伝子発現が観察され,PIWIファミリータンパク質の発現はプラナリアとは異なる分子機構により制御される.しかしながら,ショウジョウバエおよびプラナリアにおけるPIWIファミリータンパク質の局在の共通性は,細胞質あるいは核における役割の共通性をうかがわせた.
なぜ,細胞質に局在するPIWIファミリータンパク質ではなく,核に局在するDjPiwiBだけが子孫細胞に受け継がれるのであろうか.マウスやショウジョウバエにおいては,核に局在するPIWIファミリータンパク質はエピジェネティックな機構により転移因子を抑制すると考えられる.プラナリアにおいては,細胞質のPIWIファミリータンパク質は新生細胞に特異的な別の機能をもつことが報告されている9).したがって,新生細胞からの分化の過程において,DjPiwiBをエピジェネティックな記憶として子孫細胞へと受け継がせることにより,転写レベルにおいて転移因子を抑制するのではないかと考えられる.今後,より詳細な研究により,DjPiwiBが受け継がれる分子機構について明らかにしていきたい.
文 献
- Leung, D. C. & Lorincz, M. C.: Silencing of endogenous retroviruses: when and why do histone marks predominate? Trends Biochem. Sci., 37, 127-133 (2012)[PubMed]
- Agata, K., Saito, Y. & Nakajima, E.: Unifying principles of regeneration I: Epimorphosis versus morphallaxis. Dev. Growth Differ., 49, 73-78 (2007)[PubMed]
- Sanchez Alvarado, A. & Yamanaka, S.: Rethinking differentiation: stem cells, regeneration, and plasticity. Cell, 157, 110-119 (2014)[PubMed]
- Shibata, N., Rouhana, L. & Agata, K.: Cellular and molecular dissection of pluripotent adult somatic stem cells in planarians. Dev. Growth Differ., 52, 27-41 (2010)[PubMed]
- Iwasaki, Y. W., Siomi, M. C. & Siomi, H.: PIWI-interacting RNA: its biogenesis and functions. Annu. Rev. Biochem., 84, 405-433 (2015)[PubMed]
- Reddien, P. W., Oviedo, N. J., Jennings, J. R. et al.: SMEDWI-2 is a PIWI-like protein that regulates planarian stem cells. Science, 310, 1327-1330 (2005)[PubMed]
- Hayashi, T., Shibata, N., Okumura, R. et al.: Single-cell gene profiling of planarian stem cells using fluorescent activated cell sorting and its "index sorting" function for stem cell research. Dev. Growth Differ., 52, 131-144 (2010)[PubMed]
- Tasaki, J., Shibata, N., Nishimura, O. et al.: ERK signaling controls blastema cell differentiation during planarian regeneration. Development, 138, 2417-2427 (2011)[PubMed]
- Rouhana, L., Weiss, J. A., King, R. S. et al.: PIWI homologs mediate histone H4 mRNA localization to planarian chromatoid bodies. Development, 141, 2592-2601 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:1999年 姫路工業大学大学院理学研究科 修了,同年 三菱化学生命科学研究所 特別研究員,2001年 基礎生物学研究所 リサーチアソシエイト,2005年 京都大学大学院理学研究科 研究員,同 GCOE助教,同 特定准教授を経て,2016年より津山工業高等専門学校 准教授.
研究テーマ:プラナリアにおける全能性幹細胞の維持,増殖,分化に関する分子機構.
阿形 清和(Kiyokazu Agata)
学習院大学理学部 教授.
© 2016 柴田典人・阿形清和 Licensed under CC 表示 2.1 日本