繊毛病の原因遺伝子の産物であるJbts17は繊毛におけるタンパク質の輸送を制御することにより繊毛の機能に寄与する
鳥山道則・John B. Wallingford
(米国Texas大学Austin校Department of Molecular Biosciences)
email:鳥山道則
DOI: 10.7875/first.author.2016.046
The ciliopathy-associated CPLANE proteins direct basal body recruitment of intraflagellar transport machinery.
Michinori Toriyama, Chanjae Lee, S. Paige Taylor, Ivan Duran, Daniel H. Cohn, Ange-Line Bruel, Jacqueline M. Tabler, Kevin Drew, Marcus R. Kelly, Sukyoung Kim, Tae Joo Park, Daniella Braun, Ghislaine Pierquin, Armand Biver, Kerstin Wagner, Anne Malfroot, Inusha Panigrahi, Brunella Franco, Hadeel Adel Al-lami, Yvonne Yeung, Yeon Ja Choi, Yannis Duffourd, Laurence Faivre, Jean-Baptiste Rivière, Jiang Chen, Karen J. Liu, Edward M. Marcotte, Friedhelm Hildebrandt, Christel Thauvin-Robinet, Deborah Krakow, Peter K. Jackson, John B. Wallingford
Nature Genetics, 48, 648-656 (2016)
ここ10年のあいだ,細胞のもつ短い突起状の構造体である繊毛の,動物の正常な発生や恒常性の維持における重要性が明らかにされてきた.ヒトの遺伝性疾患である繊毛病においては,繊毛の形成や機能にかかわる遺伝子に変異がみられ,その結果,繊毛の形成の不全がひき起こされ,組織あるいは個体のレベルにおいてさまざまな障害を呈する.ごく最近,新たな繊毛病の原因遺伝子の産物としてJbts17が報告されたが,その遺伝子変異による繊毛病の発症の機序に関する理解は進んでいなかった.筆者らは,アフリカツメガエルの初期胚をモデルとして,繊毛の形成におけるJbts17の機能を解析した.その結果,Jbts17は繊毛の形成にかかわるほかのタンパク質と結合することにより,これらのタンパク質を繊毛の根元に局在する基底小体へとリクルートすること,さらには,繊毛の内部へのタンパク質の輸送をつかさどるタンパク質の機能の制御をつうじ,繊毛の形成を正に制御することがわかった.また,繊毛病の患者に由来するJbts17変異体を用いた解析から,繊毛病の発症の機序の一端が明らかにされた.
多くの動物細胞はその表面に繊毛とよばれる突起状の構造体をもつ.繊毛は機能的に,細胞外からのシグナルの受容および細胞内へのシグナルの伝達を担う1次繊毛と,高速で波打ち運動することにより細胞の外部に流れを生じる運動性繊毛の2つに大きく分類される.繊毛は個体の初期の発生から恒常性の維持など多岐にわたる生命現象に関与しており,正常な生体の機能に必須なオルガネラのひとつである.ヒトの遺伝性疾患である繊毛病においては,この繊毛の形成が不十分になることにより水頭症,多指症,嚢胞腎を代表としたさまざまな症状を示す1,2).これまで,筆者の研究室においては,平面内細胞極性(planar cell polarity:PCP)にかかわるタンパク質であるWDPCP,Inturned,Fuzzyが,細胞の極性の形成のみならず,繊毛の形成および機能に必須であることを見い出してきた3-5).これらのPCPタンパク質は繊毛の根元に存在する基底小体とよばれる構造体に局在することにより,繊毛の形成に対し促進的にはたらくと考えられていたが,その分子機構については謎であった.
PCPタンパク質の繊毛の形成における分子機構の理解をめざし,免疫沈降法によりPCPタンパク質と結合するタンパク質を探索し,質量分析法により同定した.その結果,PCPタンパク質であるWDPCP,Inturned,Fuzzyはそれぞれ相互作用することがわかった.これらのPCPタンパク質は独立して繊毛の形成にかかわると考えられていたが,細胞において複合体として存在し機能する可能性が示唆された.さらに,これらのPCPタンパク質に共通する結合タンパク質として,新規のタンパク質Jbts17(別名:c5orf42)が同定され,精製タンパク質を用いたin vitroにおける結合実験により直接の相互作用が確認された.ごく最近,Jbts17はJoubert症候群,Meckel-Gruber症候群,口-顔-指症候群VI型などの繊毛病の患者において遺伝子変異が発見され,Jbts17は正常な繊毛の形成および機能に必須であることが示唆された6-8).しかし,その機能に関する報告は皆無であったため,Jbts17の遺伝子変異による繊毛病の発症の機序のみならず,繊毛の形成におけるJbts17の分子機構は謎であった.
Jbts17の機能の解明のため,アフリカツメガエルの初期胚においてアンチセンスモルフォリノオリゴヌクレオチドおよびCRISPR/Cas9系を用いて遺伝子の発現を阻害し,繊毛の形成がどのように変化するか解析した.その結果,1次繊毛および運動性繊毛におけるJbts17の機能の阻害は繊毛の形成を有意に阻害した(図1).Jbts17の機能の阻害された個体は,繊毛を介するシグナル伝達により制御される神経管の形成が不完全となり神経管の閉塞の障害を示した.また,1次繊毛はSonic hedgehogシグナル伝達系に必須とされるが,Jbts17の発現を阻害した胚においてはSonic hedgehogシグナル伝達系により発現の誘導されるVax1遺伝子やNkx2.2遺伝子の発現が顕著に低下し,繊毛の形成の不全により,細胞外からのシグナルにより制御される遺伝子の発現が乱されることもわかった.個体における左右差の形成において繊毛の重要性が理解されており,繊毛病の患者においては一定の頻度で内臓逆位となる報告もある.Jbts17をノックダウンした個体においては左右の非対称性の形成に異常が認められた.Pitx2遺伝子は通常は胚の左側のみに特異的に発現するが,Jbts17をノックダウンした胚においては右側のみの発現あるいは両側における発現も認められ,Jbts17は繊毛の幅広い機能に必須であることが見い出された.
イメージング法によりJbts17は繊毛の根元に存在する基底小体とよばれる構造体に特異的に局在することがわかった.基底小体は繊毛の形成に必須であり,繊毛の伸長は基底小体から重合する微小管により開始される.さらに,構造化照明顕微鏡法(structured illumination microscopy)による詳細な解析により,Jbts17は基底小体の繊毛の側にリング状の構造体として局在する像が得られた.同様の手法により,基底小体に局在するほかのタンパク質と局在を比較したところ,Jbts17はCep164と非常に酷似した局在を示すことがわかった.Cep164は基底小体の繊毛の側に存在するdistal appendageとよばれる微小な構造に局在する.このdistal appendageは,繊毛が形成されるまえの基底小体の細胞膜の近傍への移動に必須なだけでなく,IFTタンパク質とよばれる繊毛の内部における物質輸送をつかさどるタンパク質の局在に必須であることが知られている.
Jbts17はPCPタンパク質と結合したことから,Jbts17の基底小体への局在はPCPタンパク質との結合を介し制御される可能性が考えられた.Jbts17をノックダウンした細胞においてPCPタンパク質のいくつかは基底小体において消失あるいは減少した.一方,PCPタンパク質のノックダウンによりJbts17の局在は変化せず基底小体への正常な局在を示した.この結果から,Jbts17はPCPタンパク質の上流において機能しその局在を制御すると考えられた.
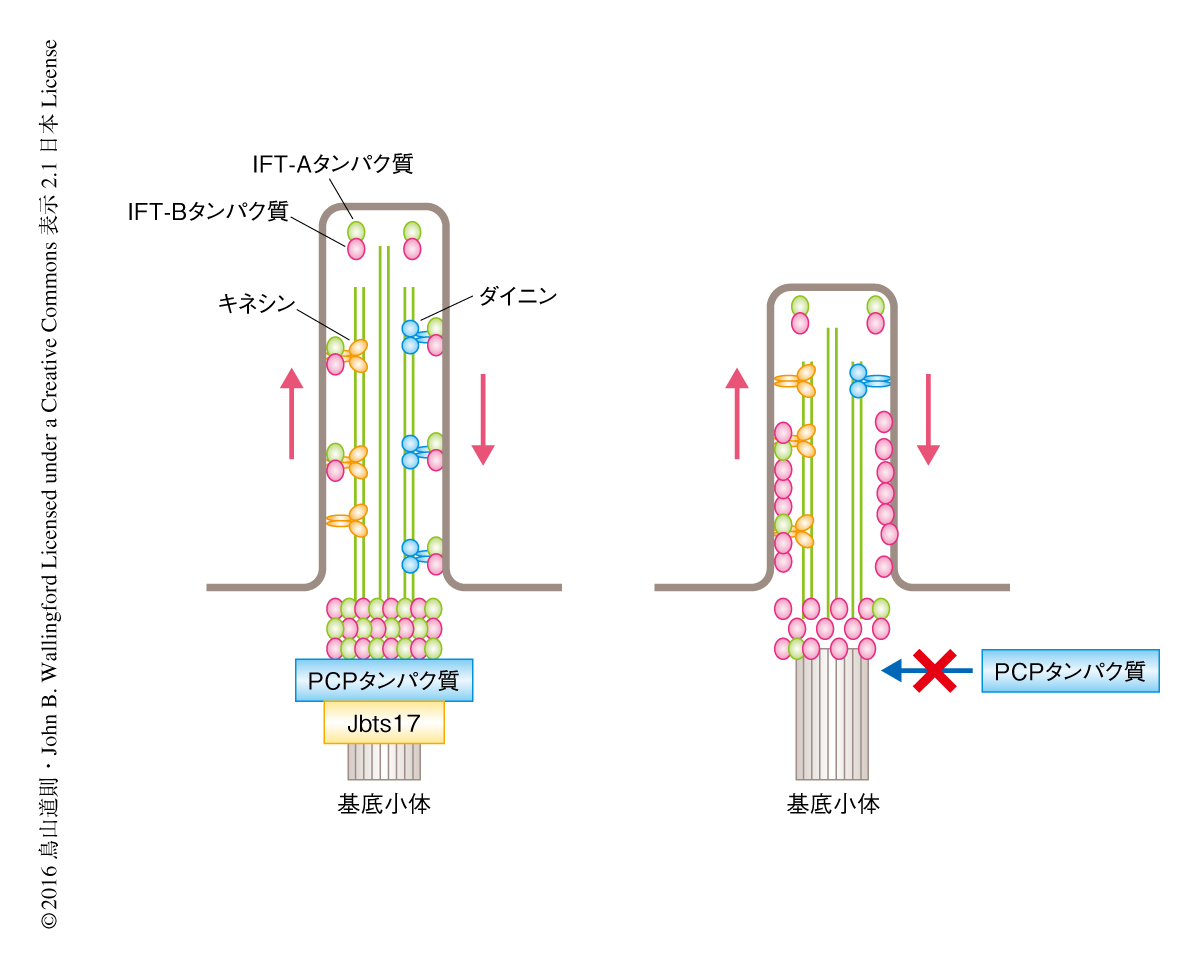
Jbst17およびその結合タンパク質であるPCPタンパク質は繊毛の形成をどのように制御するのだろうか.繊毛の形成にかかわる要因のひとつに繊毛の内部における物質輸送があり,これを制御するのがさきにも述べたIFTタンパク質である.IFTタンパク質は繊毛の伸長に必須とされるタンパク質や膜成分の供給,繊毛の細胞膜に局在する受容体の輸送に必須であり9,10),IFT-Aタンパク質とIFT-Bタンパク質の2つに大別される.IFTタンパク質は生合成ののち,まず,基底小体に局在し,そののち,細胞体の側から繊毛の先端の側へはキネシン,繊毛の先端の側から細胞体の側へはダイニンにより輸送される.IFTタンパク質の機能を阻害した細胞においても,繊毛の形成の異常や繊毛を介するシグナル伝達の減衰の生じることが知られている.そこで,Jbts17がIFTタンパク質の局在および輸送を制御するかどうか解析した.その結果,Jbts17をノックダウンした細胞においては,一部のIFT-Aタンパク質は基底小体に局在しなかった.さらに,高速ライブイメージング法によりIFTタンパク質の繊毛の内部における輸送について解析したところ,Jbts17をノックダウンした細胞において繊毛の内部におけるIFT-Bタンパク質の蓄積が確認され,輸送に異常を示した(図2).
Jbts17の遺伝子変異によりいかに繊毛病が発症するのかを解析するため,内在性のJbts17をノックダウンし,野生型のJbts17あるいは繊毛病の患者において同定された遺伝子変異を導入したJbts17変異体を発現させて,繊毛の形成,IFTタンパク質の局在,神経管の形成について解析した.その結果,野生型のJbts17を発現させた細胞においてはノックダウンによる表現型が回復したが,C末端側を欠損させたJbts17変異体を発現させた細胞において表現型はまったく回復しなかった.このJbts17変異体は基底小体にはまったく局在せず細胞質に局在していた.さらなる解析により,Jbts17の1778~2318アミノ酸残基が基底小体への局在に必須であることが明らかにされた.繊毛病の患者にみつかっているJbts17の遺伝子変異の一部には,ナンセンス変異やフレームシフトによりこの領域の手前で翻訳が停止するものがある.これらのJbts17変異体は基底小体に正常に局在できなくなり,結果として,ほかのタンパク質を基底小体へとリクルートすることができなくなることにより繊毛の形成に異常を示すと考えられた.さらに,繊毛病の患者においてはこれらの領域におけるミスセンス変異もみつかっており,それらのJbts17変異体においてはPCPタンパク質との結合の親和性が低下する可能性も考えられ,そのことが繊毛病の発症にかかわると予想された.
この研究により,繊毛の形成に関与する新規のタンパク質Jbts17がIFTタンパク質の局在および輸送を制御することが,繊毛の形成および機能に必須であることがわかった.IFTタンパク質は繊毛の内部における物質輸送をつかさどる重要なタンパク質であり,繊毛の構造の形成および維持,また,繊毛により受容されるシグナル伝達において必須であるが,いまだ,その機能の全容は把握されていない.Jbts17はIFTタンパク質の局在および繊毛の内部における物質輸送に必須であることがわかったが,その詳細な分子機構については解明すべき点が残されており今後の課題である.
ヒトのJbts17は3197アミノ酸残基から構成される巨大なタンパク質である.この研究において,Jbts17の907~1569アミノ酸残基がPCPタンパク質との結合に,1778~2318アミノ酸残基が基底小体への局在に必須であることが示されたが,これらの領域のほかにも,N末端側にはWD40様ドメイン,C末端側には2つのコイルドコイルドメインがあり,これらのドメインはタンパク質間相互作用にかかわることから,未発見のタンパク質がJbts17と結合することにより繊毛の形成に協調的にかかわると予測される.今後,Jbts17の新たな相互作用タンパク質の同定および機能の解析により,IFTタンパク質の局在および繊毛の内部における物質輸送に新たな知見がもたらされ,繊毛の形成および機能の解明につながることが期待される.
略歴:2007年 奈良先端科学技術大学院大学バイオサイエンス研究科博士課程 修了,同 博士研究員,2013年 米国Texas大学Austin校リサーチフェローを経て,2015年より奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:ニューロンにおける1次繊毛の機能.
John B. Wallingford
米国Texas大学Austin校 教授.
研究室URL:http://www.wallingfordlab.org/
© 2016 鳥山道則・John B. Wallingford Licensed under CC 表示 2.1 日本
(米国Texas大学Austin校Department of Molecular Biosciences)
email:鳥山道則
DOI: 10.7875/first.author.2016.046
The ciliopathy-associated CPLANE proteins direct basal body recruitment of intraflagellar transport machinery.
Michinori Toriyama, Chanjae Lee, S. Paige Taylor, Ivan Duran, Daniel H. Cohn, Ange-Line Bruel, Jacqueline M. Tabler, Kevin Drew, Marcus R. Kelly, Sukyoung Kim, Tae Joo Park, Daniella Braun, Ghislaine Pierquin, Armand Biver, Kerstin Wagner, Anne Malfroot, Inusha Panigrahi, Brunella Franco, Hadeel Adel Al-lami, Yvonne Yeung, Yeon Ja Choi, Yannis Duffourd, Laurence Faivre, Jean-Baptiste Rivière, Jiang Chen, Karen J. Liu, Edward M. Marcotte, Friedhelm Hildebrandt, Christel Thauvin-Robinet, Deborah Krakow, Peter K. Jackson, John B. Wallingford
Nature Genetics, 48, 648-656 (2016)
要 約
ここ10年のあいだ,細胞のもつ短い突起状の構造体である繊毛の,動物の正常な発生や恒常性の維持における重要性が明らかにされてきた.ヒトの遺伝性疾患である繊毛病においては,繊毛の形成や機能にかかわる遺伝子に変異がみられ,その結果,繊毛の形成の不全がひき起こされ,組織あるいは個体のレベルにおいてさまざまな障害を呈する.ごく最近,新たな繊毛病の原因遺伝子の産物としてJbts17が報告されたが,その遺伝子変異による繊毛病の発症の機序に関する理解は進んでいなかった.筆者らは,アフリカツメガエルの初期胚をモデルとして,繊毛の形成におけるJbts17の機能を解析した.その結果,Jbts17は繊毛の形成にかかわるほかのタンパク質と結合することにより,これらのタンパク質を繊毛の根元に局在する基底小体へとリクルートすること,さらには,繊毛の内部へのタンパク質の輸送をつかさどるタンパク質の機能の制御をつうじ,繊毛の形成を正に制御することがわかった.また,繊毛病の患者に由来するJbts17変異体を用いた解析から,繊毛病の発症の機序の一端が明らかにされた.
はじめに
多くの動物細胞はその表面に繊毛とよばれる突起状の構造体をもつ.繊毛は機能的に,細胞外からのシグナルの受容および細胞内へのシグナルの伝達を担う1次繊毛と,高速で波打ち運動することにより細胞の外部に流れを生じる運動性繊毛の2つに大きく分類される.繊毛は個体の初期の発生から恒常性の維持など多岐にわたる生命現象に関与しており,正常な生体の機能に必須なオルガネラのひとつである.ヒトの遺伝性疾患である繊毛病においては,この繊毛の形成が不十分になることにより水頭症,多指症,嚢胞腎を代表としたさまざまな症状を示す1,2).これまで,筆者の研究室においては,平面内細胞極性(planar cell polarity:PCP)にかかわるタンパク質であるWDPCP,Inturned,Fuzzyが,細胞の極性の形成のみならず,繊毛の形成および機能に必須であることを見い出してきた3-5).これらのPCPタンパク質は繊毛の根元に存在する基底小体とよばれる構造体に局在することにより,繊毛の形成に対し促進的にはたらくと考えられていたが,その分子機構については謎であった.
1.Jbts17はPCPタンパク質と結合する
PCPタンパク質の繊毛の形成における分子機構の理解をめざし,免疫沈降法によりPCPタンパク質と結合するタンパク質を探索し,質量分析法により同定した.その結果,PCPタンパク質であるWDPCP,Inturned,Fuzzyはそれぞれ相互作用することがわかった.これらのPCPタンパク質は独立して繊毛の形成にかかわると考えられていたが,細胞において複合体として存在し機能する可能性が示唆された.さらに,これらのPCPタンパク質に共通する結合タンパク質として,新規のタンパク質Jbts17(別名:c5orf42)が同定され,精製タンパク質を用いたin vitroにおける結合実験により直接の相互作用が確認された.ごく最近,Jbts17はJoubert症候群,Meckel-Gruber症候群,口-顔-指症候群VI型などの繊毛病の患者において遺伝子変異が発見され,Jbts17は正常な繊毛の形成および機能に必須であることが示唆された6-8).しかし,その機能に関する報告は皆無であったため,Jbts17の遺伝子変異による繊毛病の発症の機序のみならず,繊毛の形成におけるJbts17の分子機構は謎であった.
2.Jbts17による正常な繊毛の形成は個体の発生に必須である
Jbts17の機能の解明のため,アフリカツメガエルの初期胚においてアンチセンスモルフォリノオリゴヌクレオチドおよびCRISPR/Cas9系を用いて遺伝子の発現を阻害し,繊毛の形成がどのように変化するか解析した.その結果,1次繊毛および運動性繊毛におけるJbts17の機能の阻害は繊毛の形成を有意に阻害した(図1).Jbts17の機能の阻害された個体は,繊毛を介するシグナル伝達により制御される神経管の形成が不完全となり神経管の閉塞の障害を示した.また,1次繊毛はSonic hedgehogシグナル伝達系に必須とされるが,Jbts17の発現を阻害した胚においてはSonic hedgehogシグナル伝達系により発現の誘導されるVax1遺伝子やNkx2.2遺伝子の発現が顕著に低下し,繊毛の形成の不全により,細胞外からのシグナルにより制御される遺伝子の発現が乱されることもわかった.個体における左右差の形成において繊毛の重要性が理解されており,繊毛病の患者においては一定の頻度で内臓逆位となる報告もある.Jbts17をノックダウンした個体においては左右の非対称性の形成に異常が認められた.Pitx2遺伝子は通常は胚の左側のみに特異的に発現するが,Jbts17をノックダウンした胚においては右側のみの発現あるいは両側における発現も認められ,Jbts17は繊毛の幅広い機能に必須であることが見い出された.
3.Jbts17はPCPタンパク質の基底小体へのリクルートに必須である
イメージング法によりJbts17は繊毛の根元に存在する基底小体とよばれる構造体に特異的に局在することがわかった.基底小体は繊毛の形成に必須であり,繊毛の伸長は基底小体から重合する微小管により開始される.さらに,構造化照明顕微鏡法(structured illumination microscopy)による詳細な解析により,Jbts17は基底小体の繊毛の側にリング状の構造体として局在する像が得られた.同様の手法により,基底小体に局在するほかのタンパク質と局在を比較したところ,Jbts17はCep164と非常に酷似した局在を示すことがわかった.Cep164は基底小体の繊毛の側に存在するdistal appendageとよばれる微小な構造に局在する.このdistal appendageは,繊毛が形成されるまえの基底小体の細胞膜の近傍への移動に必須なだけでなく,IFTタンパク質とよばれる繊毛の内部における物質輸送をつかさどるタンパク質の局在に必須であることが知られている.
Jbts17はPCPタンパク質と結合したことから,Jbts17の基底小体への局在はPCPタンパク質との結合を介し制御される可能性が考えられた.Jbts17をノックダウンした細胞においてPCPタンパク質のいくつかは基底小体において消失あるいは減少した.一方,PCPタンパク質のノックダウンによりJbts17の局在は変化せず基底小体への正常な局在を示した.この結果から,Jbts17はPCPタンパク質の上流において機能しその局在を制御すると考えられた.
4.Jbts17はIFTタンパク質の局在および輸送にかかわる
Jbst17およびその結合タンパク質であるPCPタンパク質は繊毛の形成をどのように制御するのだろうか.繊毛の形成にかかわる要因のひとつに繊毛の内部における物質輸送があり,これを制御するのがさきにも述べたIFTタンパク質である.IFTタンパク質は繊毛の伸長に必須とされるタンパク質や膜成分の供給,繊毛の細胞膜に局在する受容体の輸送に必須であり9,10),IFT-Aタンパク質とIFT-Bタンパク質の2つに大別される.IFTタンパク質は生合成ののち,まず,基底小体に局在し,そののち,細胞体の側から繊毛の先端の側へはキネシン,繊毛の先端の側から細胞体の側へはダイニンにより輸送される.IFTタンパク質の機能を阻害した細胞においても,繊毛の形成の異常や繊毛を介するシグナル伝達の減衰の生じることが知られている.そこで,Jbts17がIFTタンパク質の局在および輸送を制御するかどうか解析した.その結果,Jbts17をノックダウンした細胞においては,一部のIFT-Aタンパク質は基底小体に局在しなかった.さらに,高速ライブイメージング法によりIFTタンパク質の繊毛の内部における輸送について解析したところ,Jbts17をノックダウンした細胞において繊毛の内部におけるIFT-Bタンパク質の蓄積が確認され,輸送に異常を示した(図2).
5.Jbts17の遺伝子変異による繊毛病の発症の機構
Jbts17の遺伝子変異によりいかに繊毛病が発症するのかを解析するため,内在性のJbts17をノックダウンし,野生型のJbts17あるいは繊毛病の患者において同定された遺伝子変異を導入したJbts17変異体を発現させて,繊毛の形成,IFTタンパク質の局在,神経管の形成について解析した.その結果,野生型のJbts17を発現させた細胞においてはノックダウンによる表現型が回復したが,C末端側を欠損させたJbts17変異体を発現させた細胞において表現型はまったく回復しなかった.このJbts17変異体は基底小体にはまったく局在せず細胞質に局在していた.さらなる解析により,Jbts17の1778~2318アミノ酸残基が基底小体への局在に必須であることが明らかにされた.繊毛病の患者にみつかっているJbts17の遺伝子変異の一部には,ナンセンス変異やフレームシフトによりこの領域の手前で翻訳が停止するものがある.これらのJbts17変異体は基底小体に正常に局在できなくなり,結果として,ほかのタンパク質を基底小体へとリクルートすることができなくなることにより繊毛の形成に異常を示すと考えられた.さらに,繊毛病の患者においてはこれらの領域におけるミスセンス変異もみつかっており,それらのJbts17変異体においてはPCPタンパク質との結合の親和性が低下する可能性も考えられ,そのことが繊毛病の発症にかかわると予想された.
おわりに
この研究により,繊毛の形成に関与する新規のタンパク質Jbts17がIFTタンパク質の局在および輸送を制御することが,繊毛の形成および機能に必須であることがわかった.IFTタンパク質は繊毛の内部における物質輸送をつかさどる重要なタンパク質であり,繊毛の構造の形成および維持,また,繊毛により受容されるシグナル伝達において必須であるが,いまだ,その機能の全容は把握されていない.Jbts17はIFTタンパク質の局在および繊毛の内部における物質輸送に必須であることがわかったが,その詳細な分子機構については解明すべき点が残されており今後の課題である.
ヒトのJbts17は3197アミノ酸残基から構成される巨大なタンパク質である.この研究において,Jbts17の907~1569アミノ酸残基がPCPタンパク質との結合に,1778~2318アミノ酸残基が基底小体への局在に必須であることが示されたが,これらの領域のほかにも,N末端側にはWD40様ドメイン,C末端側には2つのコイルドコイルドメインがあり,これらのドメインはタンパク質間相互作用にかかわることから,未発見のタンパク質がJbts17と結合することにより繊毛の形成に協調的にかかわると予測される.今後,Jbts17の新たな相互作用タンパク質の同定および機能の解析により,IFTタンパク質の局在および繊毛の内部における物質輸送に新たな知見がもたらされ,繊毛の形成および機能の解明につながることが期待される.
文 献
- Hildebrandt, F., Benzing, T. & Katsanis, N.: Ciliopathies. N. Engl. J. Med., 364 1533-1543 (2011)[PubMed]
- Oh, E. C. & Katasanis, N.: Cilia in vertebrate development and disease. Development, 139, 443-448 (2012)[PubMed]
- Kim, S. K., Shindo, A., Park, T. J. et al.: Planar cell polarity acts through septins to control collective cell movement and ciliogenesis. Science, 329, 1337-1340 (2010)[PubMed] [新着論文レビュー]
- Gray, R. S., Abitua, P. B., Wlodarczyk, B. J. et al.: The planar cell polarity effector Fuz is essential for targeted membrane trafficking, ciliogenesis and mouse embryonic development. Nat. Cell Biol., 11, 1225-1232 (2009)[PubMed]
- Park, T. J., Haigo, S. L. & Wallingford J. B.: Ciliogenesis defects in embryos lacking inturned or fuzzy function are associated with failure of planar cell polarity and Hedgehog signaling. Nat. Genet., 38, 303-311 (2006)[PubMed]
- Alazami, A. M., Alshammari, M. J., Salih, M. A. et al.: Molecular characterization of Joubert syndrome in Saudi Arabia. Hum. Mutat., 33, 1423-1428 (2012)[PubMed]
- Lopez, E., Thauvin-Robinet, C., Reversade, B. et al.: C5orf42 is the major gene responsible for OFD syndrome type VI. Hum. Genet., 133, 367-377 (2014)[PubMed]
- Shaheen, R., Faqeih, E., Alshammari, M. J. et al.: Genomic analysis of Meckel-Gruber syndrome in Arabs reveals marked genetic heterogeneity and novel candidate genes. Eur. J. Hum. Genet., 21, 762-768 (2013)[PubMed]
- Bhogaraju, S., Cajanek, L., Fort, C. et al.: Molecular basis of tubulin transport within the cilium by IFT74 and IFT81. Science, 341, 1009-1012 (2013)[PubMed]
- Lechtreck, K. F.: IFT-cargo interactions and protein transport in cilia. Trends Biochem. Sci., 40, 765-778 (2015)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2007年 奈良先端科学技術大学院大学バイオサイエンス研究科博士課程 修了,同 博士研究員,2013年 米国Texas大学Austin校リサーチフェローを経て,2015年より奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:ニューロンにおける1次繊毛の機能.
John B. Wallingford
米国Texas大学Austin校 教授.
研究室URL:http://www.wallingfordlab.org/
© 2016 鳥山道則・John B. Wallingford Licensed under CC 表示 2.1 日本