自然リンパ球は分化の過程において特徴的な遺伝子制御機構を獲得する
三上 洋平
(米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases,Molecular Immunology and Inflammation Branch,Lymphocyte Cell Biology Section)
email:三上洋平
DOI: 10.7875/first.author.2016.038
Developmental acquisition of regulomes underlies innate lymphoid cell functionality.
Han-Yu Shih, Giuseppe Sciumè, Yohei Mikami, Liying Guo, Hong-Wei Sun, Stephen R. Brooks, Joseph F. Urban, Fred P. Davis, Yuka Kanno, John J. O'Shea
Cell, 165, 1120-1133 (2016)
自然リンパ球は宿主防御,バリアの維持,恒常性の維持において重要な役割をはたす.自然リンパ球は鍵となるサイトカインおよび転写因子をヘルパーT細胞と共有しており,筆者らは,自然リンパ球とヘルパーT細胞との関係を理解するため,クロマチンへのアクセス性について検討した.自然リンパ球において,鍵となるサイトカインをコードする遺伝子の近傍のクロマチンは,自然リンパ球がそれらのサイトカインを産生する以前より転写因子のアクセスが可能になっていた.これらの領域のクロマチンへのアクセス性は,血液幹細胞から分化するにつれ多段階的に獲得されるものであり,in vitroにおけるサイトカインの刺激による自然リンパ球の活性化の前後ではクロマチンへのアクセス性の変化は小さかった.同様に,寄生虫感染モデルを用い生体においてクロマチンへのアクセス性の変化について検討したところ,in vitroと同様に,自然リンパ球におけるアクセス性の変化は感染の前後でわずかであったが,ヘルパーT細胞においては感染の前後でナイーブT細胞がTh2細胞に分化することに起因するであろう劇的な変化が認められた.筆者らは,このように細胞種に特異的なクロマチンへのアクセス性のパターンをレギュロームと定義したが,感染ののちのヘルパーT細胞のレギュロームは2型自然リンパ球のレギュロームと類似していた.この研究により,獲得免疫にかかわるヘルパーT細胞と自然免疫にかかわる自然リンパ球は,その分化の経路が異なるにもかかわらず,遺伝子制御機構を共有していることが示された.
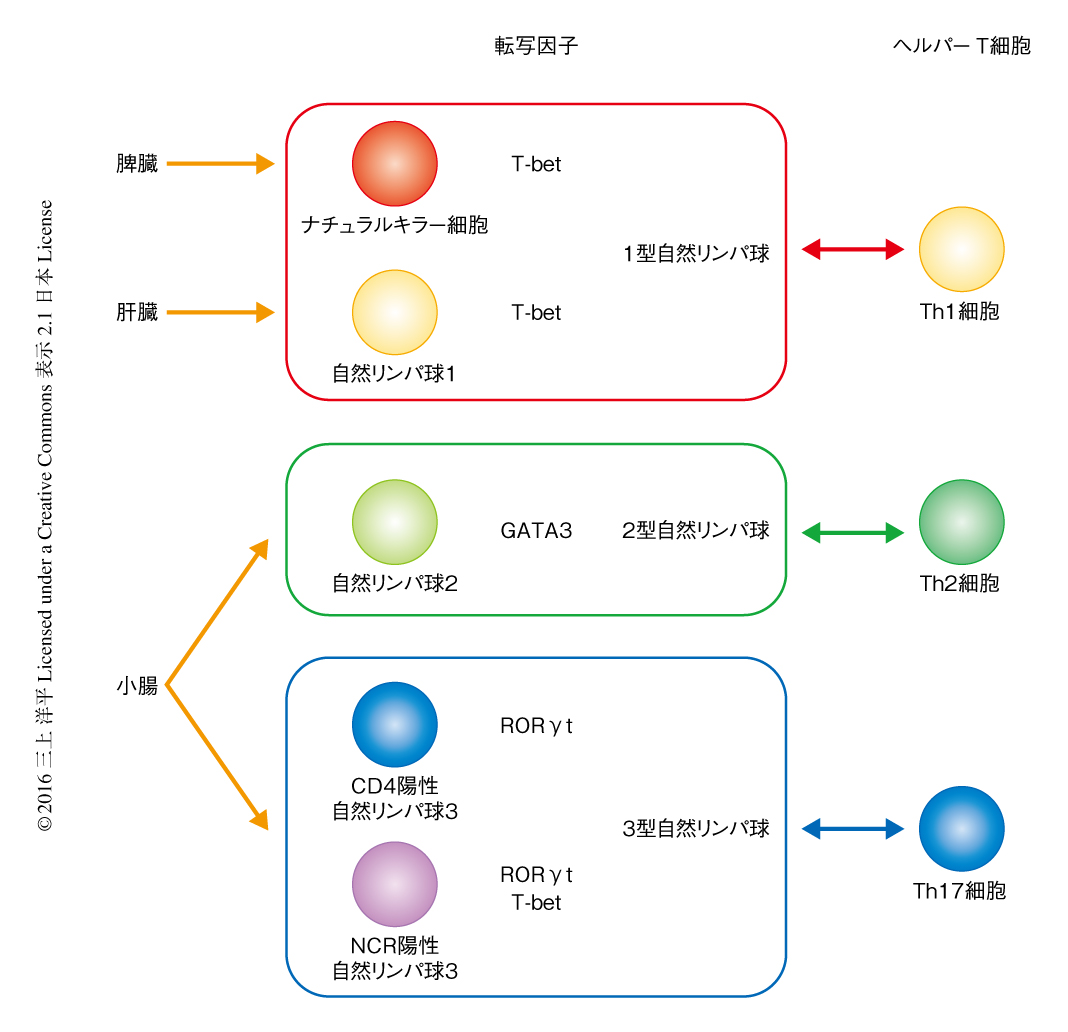
免疫系においては,T細胞,B細胞,ナチュラルキラー細胞にくわえ,近年,新たに分類された自然リンパ球により媒介される複雑なネットワークを介して宿主防御が制御されている1-4).抗原に特異的に獲得免疫を媒介するT細胞およびB細胞とは異なり,自然リンパ球は抗原受容体の非存在下においてすみやかに細菌やウイルスなどの外敵に応答する.自然リンパ球はCD4陽性ヘルパーT細胞サブセットにおいて同定された選択的なサイトカインの産生プロファイルにもとづき3つのクラスに分類されている5-7)(図1).グループ1自然リンパ球はナチュラルキラー細胞と1型自然リンパ球を含み,Th1細胞を定義するインターフェロンγを産生する.ナチュラルヘルパー細胞,nuocyte,Ih2細胞を含むグループ2自然リンパ球は,インターロイキン5,インターロイキン13,インターロイキン9など,従来はTh2細胞を定義するサイトカインを産生する.グループ3自然リンパ球はTh17細胞および/あるいはTh22細胞の産生するインターロイキン17および/あるいはインターロイキン22を産生し,NCR陽性3型自然リンパ球およびCD4陽性3型自然リンパ球を含む.
自然リンパ球はT細胞やB細胞のようにリンパ球系共通前駆細胞から分化するが,その過程にはさまざまな転写因子がかかわる8,9).T-bet,GATA3,RORγtは自然リンパ球の分化に必須な転写因子として知られているが,自然リンパ球の分化に関してはヘルパーT細胞ほど理解されていない.また,さきに述べたとおり,同じグループに属するヘルパーT細胞と自然リンパ球は転写因子やサイトカインを共通して用いているにもかかわらず,どのように共通するあるいは異なる制御をうけているかは明らかにされていない.自然リンパ球の分化において,細胞のアイデンティティはどのように獲得されるのか,また,組織に特異的な環境因子が自然リンパ球における遺伝子発現にどのように影響するのかについても明らかではない.
細胞の特徴を遺伝子の発現パターンにより分類する方法がある.マイクロアレイ法およびRNA-seq法は細胞に特異的なトランスクリプトームを解析する際に有用であるが,トランスクリプトームは局所の環境要因の影響をうける.したがって,細胞のアイデンティティをより詳細に理解するため,細胞の運命と系統との関係を決定する別の戦略として,ヒストン修飾とクロマチンへのアクセス性を含むエピジェネティックマークに注目した10,11).これらは,遺伝子座への転写因子のアクセスを制御することにより,特徴的な遺伝子発現に寄与する制御エレメントを構成する5).筆者らは,これらのツールを駆使して,自然リンパ球およびそれらの前駆細胞のトランスクリプトームを包括的に測定するのと同時に,細胞種に特異的なクロマチンへのアクセス性のパターンをレギュロームと定義し,自然リンパ球に特異的なレギュロームを備えた制御エレメントを同定することを試みた.
自然リンパ球におけるクロマチンへのアクセス性について知るため,ATAC-seq法を用いて自然リンパ球において制御エレメントを同定した.これまで用いられていたDNaseを用いる方法と比べ,ATAC-seq法は必要な細胞の数が少ないという大きなメリットがあり,個体から直接に単離した細胞のレギュロームを特徴づけるのに有用である12).レギュロームが遺伝子の発現に及ぼす影響を検討するため,RNA-seq法によりトランスクリプトームを解析した.肝臓,脾臓,小腸より5種類の自然リンパ球サブセットを単離し解析したところ(図1),遺伝子の発現パターンとは異なり,クロマチンへのアクセス性のパターンは,1型自然リンパ球およびナチュラルキラー細胞,2型自然リンパ球,CD4陽性3型自然リンパ球およびNCR陽性3型自然リンパ球,の3つのグループに分類された.このことより,クロマチンへのアクセス性は自然リンパ球のアイデンティティを反映していることが示唆された(図1).
自然リンパ球においてクロマチンへのアクセス性が遺伝子発現制御におよぼす影響について調べるため,転写因子のアクセスが可能になったクロマチンの領域における転写因子の結合をモチーフ解析およびChIP-seq法により検討した.自然リンパ球においてレギュロームを標的にする可能性のある潜在的な転写因子をモチーフ解析により探索したところ,3つのクラスの自然リンパ球において確認された転写因子のアクセスが可能になったクロマチンの領域に,それぞれ,グループ1自然リンパ球を規定する転写因子であるT-bet,グループ2自然リンパ球を規定する転写因子であるGATA3,グループ3自然リンパ球を規定する転写因子であるRORγtが結合する塩基配列が多く存在した.これらの転写因子が実際にこの領域に結合するかどうかをChIP-seq法により解析した.ナチュラルキラー細胞においてグループ1自然リンパ球の鍵となるサイトカインであるインターフェロンγをコードする遺伝子座の近傍のプロモーター領域およびエンハンサー領域をみたところ,ATAC-seq法により同定されたこれらの転写因子のアクセスが可能になったクロマチンの領域に,ナチュラルキラー細胞における遺伝子発現制御に重要な転写因子であるp300およびT-betが共局在しており,この領域がエンハンサーであることが推定された.2型自然リンパ球において鍵となるサイトカインおよび転写因子の遺伝子座におけるクロマチンへのアクセス性のパターンは2型自然リンパ球に特徴的であり,同様に,3型自然リンパ球において鍵となるサイトカインおよび転写因子の遺伝子座におけるクロマチンへのアクセス性のパターンは3型自然リンパ球に特徴的であった.以上の結果から,クロマチンへのアクセス性が自然リンパ球の機能を反映していることが示唆された.
これら自然リンパ球の3つのクラスごとに特徴的なクロマチンへのアクセス性がいつ獲得されるかを検討するため,骨髄から未熟なナチュラルキラー細胞,ナチュラルキラー細胞前駆細胞,自然リンパ球,2型自然リンパ球前駆細胞を単離し,レギュロームをプロファイリングして,造血幹細胞,多能性前駆細胞,リンパ球系共通前駆細胞と比較した.造血幹細胞に特有の制御エレメントの50%はすでに多能性前駆細胞の段階で失われており,リンパ球系共通前駆細胞ではさらに10%,自然リンパ球の前駆細胞であるナチュラルキラー細胞前駆細胞および2型自然リンパ球前駆細胞では20%が失われていた.一方で,自然リンパ球に特有の制御エレメントの25~30%は初期の前駆細胞である造血幹細胞,多能性前駆細胞,リンパ球系共通前駆細胞にも存在し,リンパ球系共通前駆細胞からナチュラルキラー細胞前駆細胞あるいは2型自然リンパ球前駆細胞に分化する際に自然リンパ球に特有の制御エレメントの30%を獲得していた.
トランスクリプトーム対レギュロームにより定義された自然リンパ球のアイデンティティを比較した.骨髄の2型自然リンパ球前駆細胞およびナチュラルキラー細胞前駆細胞のトランスクリプトームは非常に初期の前駆細胞と互いにクラスターを形成した一方,レギュロームについては,すでに分化している腸の2型自然リンパ球と骨髄の2型自然リンパ球前駆細胞とがクラスターを形成した.同様に,骨髄のナチュラルキラー細胞前駆細胞,未熟なナチュラルキラー細胞,成熟した脾臓のナチュラルキラー細胞,1型自然リンパ球のレギュロームがクラスターを形成した.2型自然リンパ球前駆細胞やナチュラルキラー細胞前駆細胞は成熟した2型自然リンパ球やナチュラルキラー細胞とは異なり,自然リンパ球を特徴づけるような遺伝子を発現していないが,これらの遺伝子座における制御エレメントの大部分はすでに前駆細胞の段階からアクセスできることが明らかにされた.
さらに,モチーフ解析を用いて検討した結果,リンパ球系共通前駆細胞から2型自然リンパ球前駆細胞あるいはナチュラルキラー細胞前駆細胞へと分化した際に獲得された制御エレメントに,分化に必須の転写因子であるGATA3あるいはT-betの結合配列が認められた.このことから,リンパ球系共通前駆細胞から2型自然リンパ球前駆細胞あるいはナチュラルキラー細胞前駆細胞に分化する際に自然リンパ球の分化の決定がなされる,すなわち,自然リンパ球に特異的なクロマチンへのアクセス性は自然リンパ球の分化の初期に決定することが示唆された.
自然リンパ球の重要な特徴は,外部の刺激に応答して迅速に宿主防御を媒介するサイトカインの遺伝子発現およびタンパク質合成をすぐに誘導することである.この過程は,新たなエンハンサーの急速な獲得あるいは既存のエンハンサーの急速な増強によるものなのか,それとも,ほかの機構があるのか明らかではなかった.エンハンサーのダイナミクスと自然リンパ球の活性化への影響を理解するため,ナチュラルキラー細胞,2型自然リンパ球,NCR陽性3型自然リンパ球をサイトカインにより刺激し,刺激の前後におけるトランスクリプトームおよびレギュロームの変化について比較した.ナチュラルキラー細胞,2型自然リンパ球,NCR陽性3型自然リンパ球のすべてにおいて,サイトカインの刺激ののちに発現が亢進した遺伝子よりも発現が抑制された遺伝子のほうが多かった.同様に,クロマチンへのアクセス性についても新たに獲得した数より失われた数のほうが多かったことから,トランスクリプトームとレギュロームのダイナミックな変化がよく相関することが示唆された.しかし,遺伝子発現パターンの相関を分析すると,2型自然リンパ球およびNCR陽性3型自然リンパ球のトランスクリプトームは,刺激をくわえていない場合よりも刺激ののちにおいてより類似していた一方,レギュロームは刺激の前後において同様にクラスターを形成したことから,細胞種に特有の制御エレメントはアイデンティティと一致し,刺激の前後でも比較的安定であることが明らかにされた.
さらに,刺激の前後においてエンハンサー領域の変化を観察するため,ChIP-seq法によりナチュラルキラー細胞において刺激ののちの転写因子p300のクロマチンとの結合およびヒストンH3のLys27のアセチル化のレベルの動態について検討した.その結果,ATAC-seq法により同定されたインターフェロンγをコードする遺伝子座のエンハンサーには,事前にp300が結合していた.刺激の前後においてインターフェロンγをコードする遺伝子座の領域におけるクロマチンへのアクセス性は変化しないままであったのに対し,ヒストンH3のLys27のアセチル化と同様に,p300の結合は刺激をうけると増加した.観察されたエンハンサー活性のダイナミックな変化は,インターフェロンγの産生の活性化と一致した.これらの事実から,細胞が活性化されるまえに,刺激に応答する制御エレメントにおけるクロマチンへの転写因子のアクセスが可能になっているため,外来の刺激に対して即時の応答が可能であることが示唆された.
自然リンパ球の命名法は,T細胞のサブセットを反映した転写因子の発現にもとづいて提案された.しかしながら,骨髄において分化を開始する自然リンパ球とは異なり,T細胞は胸腺において教育され,さらに刺激によりTh1細胞,Th2細胞,Th17細胞などへと分化する.自然リンパ球とT細胞とでレギュロームのあいだの関係を理解するため,自然リンパ球およびその前駆細胞にくわえ,ex vivoにおいてナイーブT細胞,メモリーCD4陽性T細胞,CD8陽性T細胞を単離し,さらに,ほかの研究グループにより報告されたデータセットよりマクロファージ,ミクログリア,樹状細胞,ナチュラルキラー細胞のデータもあわせて用い,レギュロームをクラスタリングした.その結果,さきに述べた成熟した自然リンパ球とその前駆細胞との類似性が再現されたことにくわえ,同一の細胞種が単離された臓器に関係なく同じクラスターに分類された.たとえば,ナチュラルキラー細胞と1型自然リンパ球は異なる組織から単離されたにかかわらずその影響を比較的うけないことが示された.さらに,B細胞および造血前駆細胞に比べ,自然リンパ球はT細胞との密接な関係をもつことが示された.
以上の結果は,健常な状態における免疫細胞のレギュロームの網羅的な検討であったが,感染の際に自然リンパ球およびヘルパーT細胞がどのような遺伝子発現制御をうけているのかは明らかではなかった.そこで,自然リンパ球およびヘルパーT細胞においてトランスクリプトームとレギュロームの類似性について寄生虫感染モデルを用いて評価した.寄生虫の感染に対する免疫応答においては,グループ2自然リンパ球である2型自然リンパ球およびTh2細胞が重要であることが知られている.寄生虫の感染の際に,2型自然リンパ球およびTh2細胞におけるTh2関連遺伝子の制御エレメントのクロマチンへのアクセス性はきわめて類似していた.さらに,寄生虫の感染にともないナイーブT細胞がTh2細胞に分化する際に取得された制御エレメントのうち,2型自然リンパ球は感染の際にレギュロームの70%以上を得ていた.以上より,感染の際には2型自然リンパ球およびTh2細胞における遺伝子制御が類似しており,自然リンパ球とヘルパーT細胞は,T細胞受容体への刺激の有無や分化する場所など明らかに異なる経路を介して確立されていても,活性化した際の遺伝子制御ネットワークは重複することが明らかにされた.
多様かつ機能的に特殊な自然リンパ球サブセットの発見により,免疫系が感染症,炎症,組織修復,代謝の恒常性に対処する機構の複雑性の一端が明らかにされた.自然免疫にかかわる自然リンパ球と獲得免疫にかかわるヘルパーT細胞のみかけのうえでの機能的な相同性から,自然リンパ球とT細胞とのあいだで相関する制御機構の理解は興味深いテーマである.自然リンパ球およびT細胞におけるレギュロームの解明は,自然リンパ球およびT細胞という異なる系統の機能を規定する遺伝子制御機構の理解へとつながる.最大の免疫組織である腸管には多くの自然リンパ球およびT細胞が存在するが,自然リンパ球およびT細胞がレギュロームを構築する機構を追究することは,自然リンパ球およびT細胞の機能を理解するうえで重要であるとともに,クローン病や潰瘍性大腸炎などの腸管における自己免疫疾患や感染症の病態の理解にもつながるものと期待される.
略歴:2012 年慶應義塾大学大学院医学研究科博士課程 修了,2013年より米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases博士研究員.
研究テーマ:腸管粘膜免疫におけるエピゲノム制御機構の解明および新規の治療法の開発.
© 2016 三上 洋平 Licensed under CC 表示 2.1 日本
(米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases,Molecular Immunology and Inflammation Branch,Lymphocyte Cell Biology Section)
email:三上洋平
DOI: 10.7875/first.author.2016.038
Developmental acquisition of regulomes underlies innate lymphoid cell functionality.
Han-Yu Shih, Giuseppe Sciumè, Yohei Mikami, Liying Guo, Hong-Wei Sun, Stephen R. Brooks, Joseph F. Urban, Fred P. Davis, Yuka Kanno, John J. O'Shea
Cell, 165, 1120-1133 (2016)
要 約
自然リンパ球は宿主防御,バリアの維持,恒常性の維持において重要な役割をはたす.自然リンパ球は鍵となるサイトカインおよび転写因子をヘルパーT細胞と共有しており,筆者らは,自然リンパ球とヘルパーT細胞との関係を理解するため,クロマチンへのアクセス性について検討した.自然リンパ球において,鍵となるサイトカインをコードする遺伝子の近傍のクロマチンは,自然リンパ球がそれらのサイトカインを産生する以前より転写因子のアクセスが可能になっていた.これらの領域のクロマチンへのアクセス性は,血液幹細胞から分化するにつれ多段階的に獲得されるものであり,in vitroにおけるサイトカインの刺激による自然リンパ球の活性化の前後ではクロマチンへのアクセス性の変化は小さかった.同様に,寄生虫感染モデルを用い生体においてクロマチンへのアクセス性の変化について検討したところ,in vitroと同様に,自然リンパ球におけるアクセス性の変化は感染の前後でわずかであったが,ヘルパーT細胞においては感染の前後でナイーブT細胞がTh2細胞に分化することに起因するであろう劇的な変化が認められた.筆者らは,このように細胞種に特異的なクロマチンへのアクセス性のパターンをレギュロームと定義したが,感染ののちのヘルパーT細胞のレギュロームは2型自然リンパ球のレギュロームと類似していた.この研究により,獲得免疫にかかわるヘルパーT細胞と自然免疫にかかわる自然リンパ球は,その分化の経路が異なるにもかかわらず,遺伝子制御機構を共有していることが示された.
はじめに
免疫系においては,T細胞,B細胞,ナチュラルキラー細胞にくわえ,近年,新たに分類された自然リンパ球により媒介される複雑なネットワークを介して宿主防御が制御されている1-4).抗原に特異的に獲得免疫を媒介するT細胞およびB細胞とは異なり,自然リンパ球は抗原受容体の非存在下においてすみやかに細菌やウイルスなどの外敵に応答する.自然リンパ球はCD4陽性ヘルパーT細胞サブセットにおいて同定された選択的なサイトカインの産生プロファイルにもとづき3つのクラスに分類されている5-7)(図1).グループ1自然リンパ球はナチュラルキラー細胞と1型自然リンパ球を含み,Th1細胞を定義するインターフェロンγを産生する.ナチュラルヘルパー細胞,nuocyte,Ih2細胞を含むグループ2自然リンパ球は,インターロイキン5,インターロイキン13,インターロイキン9など,従来はTh2細胞を定義するサイトカインを産生する.グループ3自然リンパ球はTh17細胞および/あるいはTh22細胞の産生するインターロイキン17および/あるいはインターロイキン22を産生し,NCR陽性3型自然リンパ球およびCD4陽性3型自然リンパ球を含む.
自然リンパ球はT細胞やB細胞のようにリンパ球系共通前駆細胞から分化するが,その過程にはさまざまな転写因子がかかわる8,9).T-bet,GATA3,RORγtは自然リンパ球の分化に必須な転写因子として知られているが,自然リンパ球の分化に関してはヘルパーT細胞ほど理解されていない.また,さきに述べたとおり,同じグループに属するヘルパーT細胞と自然リンパ球は転写因子やサイトカインを共通して用いているにもかかわらず,どのように共通するあるいは異なる制御をうけているかは明らかにされていない.自然リンパ球の分化において,細胞のアイデンティティはどのように獲得されるのか,また,組織に特異的な環境因子が自然リンパ球における遺伝子発現にどのように影響するのかについても明らかではない.
細胞の特徴を遺伝子の発現パターンにより分類する方法がある.マイクロアレイ法およびRNA-seq法は細胞に特異的なトランスクリプトームを解析する際に有用であるが,トランスクリプトームは局所の環境要因の影響をうける.したがって,細胞のアイデンティティをより詳細に理解するため,細胞の運命と系統との関係を決定する別の戦略として,ヒストン修飾とクロマチンへのアクセス性を含むエピジェネティックマークに注目した10,11).これらは,遺伝子座への転写因子のアクセスを制御することにより,特徴的な遺伝子発現に寄与する制御エレメントを構成する5).筆者らは,これらのツールを駆使して,自然リンパ球およびそれらの前駆細胞のトランスクリプトームを包括的に測定するのと同時に,細胞種に特異的なクロマチンへのアクセス性のパターンをレギュロームと定義し,自然リンパ球に特異的なレギュロームを備えた制御エレメントを同定することを試みた.
1.クロマチンへのアクセス性は自然リンパ球のアイデンティティを反映する
自然リンパ球におけるクロマチンへのアクセス性について知るため,ATAC-seq法を用いて自然リンパ球において制御エレメントを同定した.これまで用いられていたDNaseを用いる方法と比べ,ATAC-seq法は必要な細胞の数が少ないという大きなメリットがあり,個体から直接に単離した細胞のレギュロームを特徴づけるのに有用である12).レギュロームが遺伝子の発現に及ぼす影響を検討するため,RNA-seq法によりトランスクリプトームを解析した.肝臓,脾臓,小腸より5種類の自然リンパ球サブセットを単離し解析したところ(図1),遺伝子の発現パターンとは異なり,クロマチンへのアクセス性のパターンは,1型自然リンパ球およびナチュラルキラー細胞,2型自然リンパ球,CD4陽性3型自然リンパ球およびNCR陽性3型自然リンパ球,の3つのグループに分類された.このことより,クロマチンへのアクセス性は自然リンパ球のアイデンティティを反映していることが示唆された(図1).
2.自然リンパ球におけるクロマチンへのアクセス性は自然リンパ球の機能を反映する
自然リンパ球においてクロマチンへのアクセス性が遺伝子発現制御におよぼす影響について調べるため,転写因子のアクセスが可能になったクロマチンの領域における転写因子の結合をモチーフ解析およびChIP-seq法により検討した.自然リンパ球においてレギュロームを標的にする可能性のある潜在的な転写因子をモチーフ解析により探索したところ,3つのクラスの自然リンパ球において確認された転写因子のアクセスが可能になったクロマチンの領域に,それぞれ,グループ1自然リンパ球を規定する転写因子であるT-bet,グループ2自然リンパ球を規定する転写因子であるGATA3,グループ3自然リンパ球を規定する転写因子であるRORγtが結合する塩基配列が多く存在した.これらの転写因子が実際にこの領域に結合するかどうかをChIP-seq法により解析した.ナチュラルキラー細胞においてグループ1自然リンパ球の鍵となるサイトカインであるインターフェロンγをコードする遺伝子座の近傍のプロモーター領域およびエンハンサー領域をみたところ,ATAC-seq法により同定されたこれらの転写因子のアクセスが可能になったクロマチンの領域に,ナチュラルキラー細胞における遺伝子発現制御に重要な転写因子であるp300およびT-betが共局在しており,この領域がエンハンサーであることが推定された.2型自然リンパ球において鍵となるサイトカインおよび転写因子の遺伝子座におけるクロマチンへのアクセス性のパターンは2型自然リンパ球に特徴的であり,同様に,3型自然リンパ球において鍵となるサイトカインおよび転写因子の遺伝子座におけるクロマチンへのアクセス性のパターンは3型自然リンパ球に特徴的であった.以上の結果から,クロマチンへのアクセス性が自然リンパ球の機能を反映していることが示唆された.
3.自然リンパ球におけるクロマチンへのアクセス性は分化の過程で骨髄において獲得される
これら自然リンパ球の3つのクラスごとに特徴的なクロマチンへのアクセス性がいつ獲得されるかを検討するため,骨髄から未熟なナチュラルキラー細胞,ナチュラルキラー細胞前駆細胞,自然リンパ球,2型自然リンパ球前駆細胞を単離し,レギュロームをプロファイリングして,造血幹細胞,多能性前駆細胞,リンパ球系共通前駆細胞と比較した.造血幹細胞に特有の制御エレメントの50%はすでに多能性前駆細胞の段階で失われており,リンパ球系共通前駆細胞ではさらに10%,自然リンパ球の前駆細胞であるナチュラルキラー細胞前駆細胞および2型自然リンパ球前駆細胞では20%が失われていた.一方で,自然リンパ球に特有の制御エレメントの25~30%は初期の前駆細胞である造血幹細胞,多能性前駆細胞,リンパ球系共通前駆細胞にも存在し,リンパ球系共通前駆細胞からナチュラルキラー細胞前駆細胞あるいは2型自然リンパ球前駆細胞に分化する際に自然リンパ球に特有の制御エレメントの30%を獲得していた.
トランスクリプトーム対レギュロームにより定義された自然リンパ球のアイデンティティを比較した.骨髄の2型自然リンパ球前駆細胞およびナチュラルキラー細胞前駆細胞のトランスクリプトームは非常に初期の前駆細胞と互いにクラスターを形成した一方,レギュロームについては,すでに分化している腸の2型自然リンパ球と骨髄の2型自然リンパ球前駆細胞とがクラスターを形成した.同様に,骨髄のナチュラルキラー細胞前駆細胞,未熟なナチュラルキラー細胞,成熟した脾臓のナチュラルキラー細胞,1型自然リンパ球のレギュロームがクラスターを形成した.2型自然リンパ球前駆細胞やナチュラルキラー細胞前駆細胞は成熟した2型自然リンパ球やナチュラルキラー細胞とは異なり,自然リンパ球を特徴づけるような遺伝子を発現していないが,これらの遺伝子座における制御エレメントの大部分はすでに前駆細胞の段階からアクセスできることが明らかにされた.
さらに,モチーフ解析を用いて検討した結果,リンパ球系共通前駆細胞から2型自然リンパ球前駆細胞あるいはナチュラルキラー細胞前駆細胞へと分化した際に獲得された制御エレメントに,分化に必須の転写因子であるGATA3あるいはT-betの結合配列が認められた.このことから,リンパ球系共通前駆細胞から2型自然リンパ球前駆細胞あるいはナチュラルキラー細胞前駆細胞に分化する際に自然リンパ球の分化の決定がなされる,すなわち,自然リンパ球に特異的なクロマチンへのアクセス性は自然リンパ球の分化の初期に決定することが示唆された.
4.成熟した自然リンパ球では活性化のまえにクロマチンへの転写因子のアクセスが可能になる
自然リンパ球の重要な特徴は,外部の刺激に応答して迅速に宿主防御を媒介するサイトカインの遺伝子発現およびタンパク質合成をすぐに誘導することである.この過程は,新たなエンハンサーの急速な獲得あるいは既存のエンハンサーの急速な増強によるものなのか,それとも,ほかの機構があるのか明らかではなかった.エンハンサーのダイナミクスと自然リンパ球の活性化への影響を理解するため,ナチュラルキラー細胞,2型自然リンパ球,NCR陽性3型自然リンパ球をサイトカインにより刺激し,刺激の前後におけるトランスクリプトームおよびレギュロームの変化について比較した.ナチュラルキラー細胞,2型自然リンパ球,NCR陽性3型自然リンパ球のすべてにおいて,サイトカインの刺激ののちに発現が亢進した遺伝子よりも発現が抑制された遺伝子のほうが多かった.同様に,クロマチンへのアクセス性についても新たに獲得した数より失われた数のほうが多かったことから,トランスクリプトームとレギュロームのダイナミックな変化がよく相関することが示唆された.しかし,遺伝子発現パターンの相関を分析すると,2型自然リンパ球およびNCR陽性3型自然リンパ球のトランスクリプトームは,刺激をくわえていない場合よりも刺激ののちにおいてより類似していた一方,レギュロームは刺激の前後において同様にクラスターを形成したことから,細胞種に特有の制御エレメントはアイデンティティと一致し,刺激の前後でも比較的安定であることが明らかにされた.
さらに,刺激の前後においてエンハンサー領域の変化を観察するため,ChIP-seq法によりナチュラルキラー細胞において刺激ののちの転写因子p300のクロマチンとの結合およびヒストンH3のLys27のアセチル化のレベルの動態について検討した.その結果,ATAC-seq法により同定されたインターフェロンγをコードする遺伝子座のエンハンサーには,事前にp300が結合していた.刺激の前後においてインターフェロンγをコードする遺伝子座の領域におけるクロマチンへのアクセス性は変化しないままであったのに対し,ヒストンH3のLys27のアセチル化と同様に,p300の結合は刺激をうけると増加した.観察されたエンハンサー活性のダイナミックな変化は,インターフェロンγの産生の活性化と一致した.これらの事実から,細胞が活性化されるまえに,刺激に応答する制御エレメントにおけるクロマチンへの転写因子のアクセスが可能になっているため,外来の刺激に対して即時の応答が可能であることが示唆された.
5.自然免疫と獲得免疫との関係
自然リンパ球の命名法は,T細胞のサブセットを反映した転写因子の発現にもとづいて提案された.しかしながら,骨髄において分化を開始する自然リンパ球とは異なり,T細胞は胸腺において教育され,さらに刺激によりTh1細胞,Th2細胞,Th17細胞などへと分化する.自然リンパ球とT細胞とでレギュロームのあいだの関係を理解するため,自然リンパ球およびその前駆細胞にくわえ,ex vivoにおいてナイーブT細胞,メモリーCD4陽性T細胞,CD8陽性T細胞を単離し,さらに,ほかの研究グループにより報告されたデータセットよりマクロファージ,ミクログリア,樹状細胞,ナチュラルキラー細胞のデータもあわせて用い,レギュロームをクラスタリングした.その結果,さきに述べた成熟した自然リンパ球とその前駆細胞との類似性が再現されたことにくわえ,同一の細胞種が単離された臓器に関係なく同じクラスターに分類された.たとえば,ナチュラルキラー細胞と1型自然リンパ球は異なる組織から単離されたにかかわらずその影響を比較的うけないことが示された.さらに,B細胞および造血前駆細胞に比べ,自然リンパ球はT細胞との密接な関係をもつことが示された.
以上の結果は,健常な状態における免疫細胞のレギュロームの網羅的な検討であったが,感染の際に自然リンパ球およびヘルパーT細胞がどのような遺伝子発現制御をうけているのかは明らかではなかった.そこで,自然リンパ球およびヘルパーT細胞においてトランスクリプトームとレギュロームの類似性について寄生虫感染モデルを用いて評価した.寄生虫の感染に対する免疫応答においては,グループ2自然リンパ球である2型自然リンパ球およびTh2細胞が重要であることが知られている.寄生虫の感染の際に,2型自然リンパ球およびTh2細胞におけるTh2関連遺伝子の制御エレメントのクロマチンへのアクセス性はきわめて類似していた.さらに,寄生虫の感染にともないナイーブT細胞がTh2細胞に分化する際に取得された制御エレメントのうち,2型自然リンパ球は感染の際にレギュロームの70%以上を得ていた.以上より,感染の際には2型自然リンパ球およびTh2細胞における遺伝子制御が類似しており,自然リンパ球とヘルパーT細胞は,T細胞受容体への刺激の有無や分化する場所など明らかに異なる経路を介して確立されていても,活性化した際の遺伝子制御ネットワークは重複することが明らかにされた.
おわりに
多様かつ機能的に特殊な自然リンパ球サブセットの発見により,免疫系が感染症,炎症,組織修復,代謝の恒常性に対処する機構の複雑性の一端が明らかにされた.自然免疫にかかわる自然リンパ球と獲得免疫にかかわるヘルパーT細胞のみかけのうえでの機能的な相同性から,自然リンパ球とT細胞とのあいだで相関する制御機構の理解は興味深いテーマである.自然リンパ球およびT細胞におけるレギュロームの解明は,自然リンパ球およびT細胞という異なる系統の機能を規定する遺伝子制御機構の理解へとつながる.最大の免疫組織である腸管には多くの自然リンパ球およびT細胞が存在するが,自然リンパ球およびT細胞がレギュロームを構築する機構を追究することは,自然リンパ球およびT細胞の機能を理解するうえで重要であるとともに,クローン病や潰瘍性大腸炎などの腸管における自己免疫疾患や感染症の病態の理解にもつながるものと期待される.
文 献
- Artis, D. & Spits, H.: The biology of innate lymphoid cells. Nature, 517, 293-301 (2015)[PubMed]
- Diefenbach, A., Colonna, M. & Koyasu, S.: Development, differentiation, and diversity of innate lymphoid cells. Immunity, 41, 354-365 (2014)[PubMed]
- Eberl, G., Colonna, M., Di Santo, J. P. et al.: Innate lymphoid cells: a new paradigm in immunology. Science, 348, aaa6566 (2015)[PubMed]
- Sonnenberg, G. F. & Artis, D.: Innate lymphoid cells in the initiation, regulation and resolution of inflammation. Nat. Med., 21, 698-708 (2015)[PubMed]
- Spits, H., Artis, D., Colonna, M. et al.: Innate lymphoid cells: a proposal for uniform nomenclature. Nat. Rev. Immunol., 13, 145-149 (2013)[PubMed]
- Verykokakis, M., Zook, E. C. & Kee, B. L.: ID'ing innate and innate-like lymphoid cells. Immunol. Rev., 261, 177-197 (2014)[PubMed]
- Sciume, G., Hirahara, K., Takahashi, H. et al.: Distinct requirements for T-bet in gut innate lymphoid cells. J. Exp. Med., 209, 2331-2338 (2012)[PubMed]
- Serafini, N., Vosshenrich, C. A. J. & Di Santo, J. P.: Transcriptional regulation of innatelymphoid cell fate. Nat. Rev. Immunol., 15, 415-428 (2015)[PubMed]
- Ebihara, T., Song, C., Ryu, S. H. et al.: Runx3 specifies lineage commitment of innate lymphoid cells. Nat. Immunol., 16, 1124-1133 (2015)[PubMed] [新着論文レビュー]
- Vahedi, G., Takahashi, H., Nakayamada, S. et al.: STATs shape the active enhancer landscape of T cell populations. Cell, 151, 981-993 (2012)[PubMed]
- Hirahara, K., Onodera, A., Villarino, A. V. et al.: Asymmetric action of STAT transcription factors drives transcriptional outputs and cytokine specificity. Immunity, 42, 877-889 (2015)[PubMed] [新着論文レビュー]
- Buenrostro, J. D., Giresi, P. G., Zaba, L. C. et al.: Transposition of native chromatin for fast and sensitive epigenomic profiling of open chromatin, DNA-binding proteins and nucleosome position. Nat. Methods, 10, 1213-1218 (2013)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012 年慶應義塾大学大学院医学研究科博士課程 修了,2013年より米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases博士研究員.
研究テーマ:腸管粘膜免疫におけるエピゲノム制御機構の解明および新規の治療法の開発.
© 2016 三上 洋平 Licensed under CC 表示 2.1 日本