ヒトの腸において優勢なBacteroidetes門細菌に見い出された線毛の新しい形成機構
庄子幹郎・中山浩次
(長崎大学大学院医歯薬学総合研究科 口腔病原微生物学分野)
email:庄子幹郎,中山浩次
DOI: 10.7875/first.author.2016.032
A distinct type of pilus from the human microbiome.
Qingping Xu, Mikio Shoji, Satoshi Shibata, Mariko Naito, Keiko Sato, Marc-André Elsliger, Joanna C. Grant, Herbert L. Axelrod, Hsiu-Ju Chiu, Carol L. Farr, Lukasz Jaroszewski, Mark W. Knuth, Ashley M. Deacon, Adam Godzik, Scott A. Lesley, Michael A. Curtis, Koji Nakayama, Ian A. Wilson
Cell, 165, 690-703 (2016)
腸管や口腔に定着するBacteroidetes門細菌の線毛タンパク質20個についてのX線結晶構造解析から,多くの線毛タンパク質はC末端側のβストランドが内向きに折れ曲がった構造をとることがわかった.そこで,Bacteroidetes門に属する歯周病細菌Porphyromonas gingivalisを用いて,in vivoにおける線毛の形成機構について詳細に解析した.それらの結果から,菌体の表面のプロテアーゼにより線毛タンパク質のN末端側のβストランドが除去されるとそこに空隙が生じ,C末端側のβストランドが外をむいた状態になり,さらに,N末端側のβストランドが除去された空隙に,つぎの線毛タンパク質のC末端側のβストランドがはまり込む,という線毛タンパク質の重合の機構が示唆された.この機構はこれまでに報告されていた線毛の形成機構とは異なっていたことから,これらの線毛をV型線毛と命名した.
細菌の線毛はタンパク質が数珠状に連なった構造体であり,付着因子としての機能があり病原性に関与する.これまで,細菌の線毛としては形成過程の相違により,I型線毛,IV型線毛,Curli型線毛の3種類が報告されている.歯周病細菌として知られるPorphyromonas gingivalisはFim線毛およびMfa線毛とよばれる2種類の線毛をもつ1,2).また,腸内細菌のBacteroides fragilisも線毛をもつことが報告されている3).P. gingivalisやB. fragilisはBacteroidetes門Bacteroidia綱に属し,I型線毛,IV型線毛,Curli型線毛をもつ細菌とは進化系統において近縁ではないことから,Bacteroidetes門細菌の線毛はユニークな特徴をもつ可能性があった.
P. gingivalisのFim線毛から得られる主要な線毛タンパク質であるFimAのN末端はAlaであるが,FimAをコードするfimA遺伝子を大腸菌において発現させることにより得られたFimA前駆体はこのAlaより46残基ほど上流のMetがN末端でありこのAlaの1残基まえはArgであること,さらに,P. gingivalisのトリプシン様酵素であるRgpプロテアーゼをコードするrgpA遺伝子とrgpB遺伝子の二重変異株は線毛の形成不全を示すことから,P. gingivalisのFim線毛の形成にはRgpプロテアーゼによるFimAのN末端側の領域のプロセシングが必要であることが示唆された4,5).そののち,筆者らは,FimAおよびMfa線毛の主要な線毛タンパク質であるMfa1は,リポタンパク質としてペリプラスムから菌体の表面へと輸送されることを解明した6).Fim線毛およびMfa線毛は,それぞれ,主要な線毛タンパク質であるFimAおよびMfa1,アンカータンパク質であるFimBおよびMfa2,マイナーなタンパク質であるFimC,FimD,FimEおよびMfa3,Mfa4,Mfa5からなり,それらをコードする遺伝子はそれぞれオペロンを形成する7,8).これらのうち,Mfa5のほかはN末端側にリポタンパク質に特有の膜透過シグナル配列をもち,アンカータンパク質を除く線毛タンパク質にはRgpプロテアーゼにより切断されるArgが膜透過シグナル配列につづく配列に存在する.これらの知見から,線毛の形成においては,線毛タンパク質がリポタンパク質として菌体の表面に輸送され,Rgpプロテアーゼなどのプロテアーゼにより切断されたのち,重合が開始されると示唆されていた.しかし,線毛タンパク質の重合の詳細な機構については不明であった.
そこで,筆者らは,Bacteroidetes門細菌に存在する線毛タンパク質の包括的な構造解析を行い,その知見にもとづき線毛の形成機構の解明を試みた.
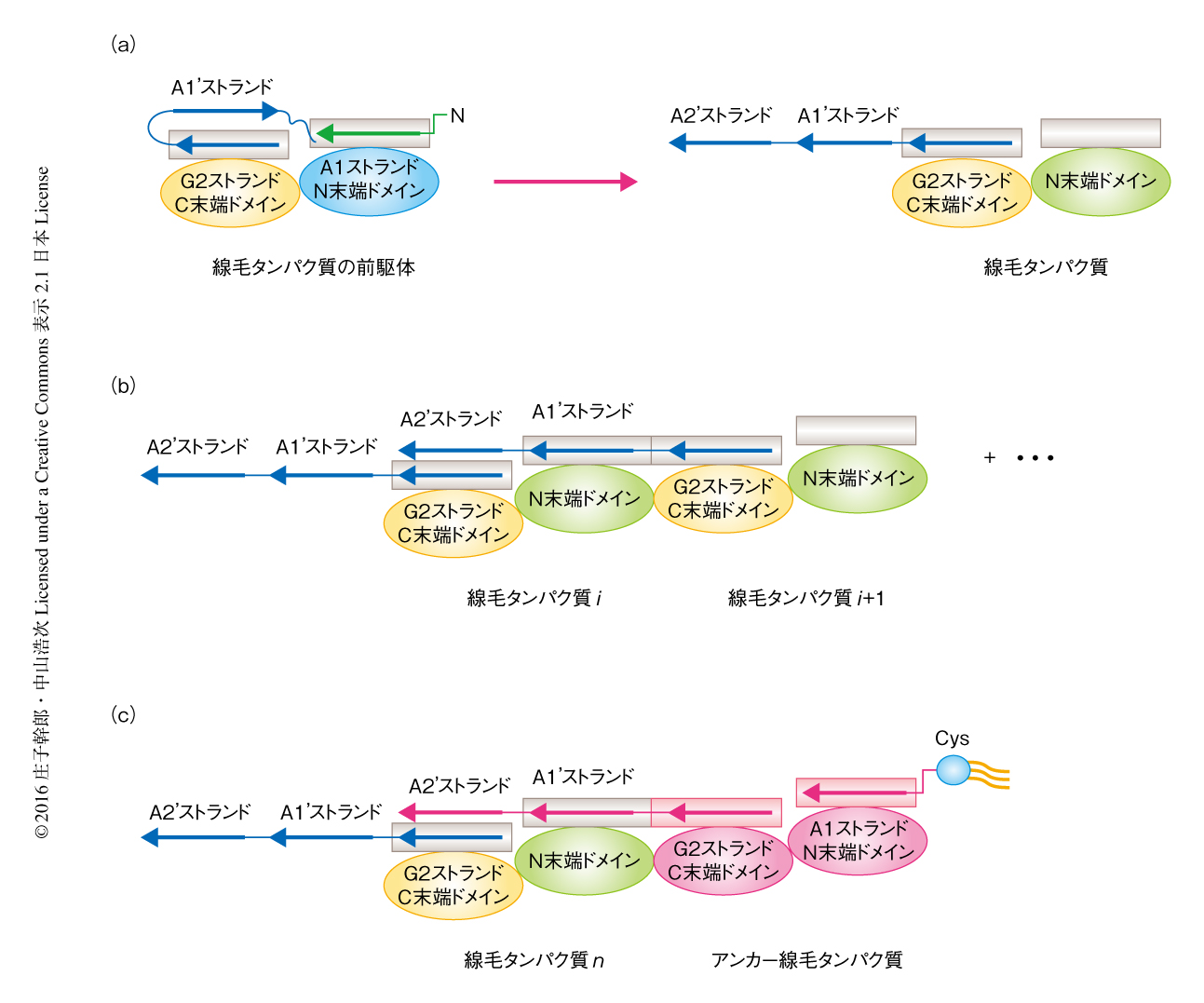
Bacteroides thetaiotaomicronの線毛タンパク質であるBT1062について結晶構造が明らかにされている9).その構造は,N末端ドメインとC末端ドメインがそれぞれ7つのβストランド構造よりなり,C末端側にはさらに2つのβシート構造があるものであった.今回,主要な線毛タンパク質であるFimAファミリーとして8個,アンカータンパク質であるMfa2ファミリーとして3個,構造において類似性の推測されるDUF3988ファミリーとして8個の,計19個の結晶構造が明らかにされた.C末端側のβストランドであるA1’ストランドがタンパク質の内部に折れ曲がったクローズ構造をとるもの14個と,折れ曲がらずに突出したオープン構造をとるもの4個,C末端側の突出末端をもたないもの1個が存在した.さらに,クローズ構造をとるFimAファミリーは,C末端側のA1’ストランドがN末端側のβストランドであるA1ストランドとB1ストランドとのあいだのループ構造により抑え込まれていると推測された.Rgpプロテアーゼによる切断部位はA1ストランドとB1ストランドのあいだにあった.したがって,後述するアンカータンパク質を除き,線毛タンパク質はRgpプロテアーゼに遭遇するまではクローズ構造をとり,RgpプロテアーゼによりA1ストランドが切断されると,C末端側のA1’ストランドは構造変換を起こしてオープン構造をとり,つぎに,A1ストランドが除去されたことにより生じた空隙に,つぎにくる線毛タンパク質のC末端側のA1’ストランドがはまり込むという機構が連続的に起こることにより,線毛が形成されるのではないかと推測された.
P. gingivalis ATCC 33277株は長いFim線毛と短いMfa線毛をもつ.この株のFim線毛が長い理由は,アンカータンパク質であるFimBが遺伝子変異により欠失しているためと考えられている10).FimAのC末端側の突出末端はA1’ストランドおよびA2’ストランドからなり,それらの中央にTrp328が存在する.C末端側の領域が線毛タンパク質の重合にかかわるかどうかを明らかにするため,以下の方法で解析した.Trp328をAlaに置換した変異FimA,および,C末端側のA2’ストランドの3~10残基を欠損させた変異FimAをそれぞれfimA欠損株において発現させ,イムノブロット解析および電子顕微鏡により線毛の有無を調べた.その結果,Trp328をAlaに置換した変異FimAにおいては重合が起こるが,C末端側の少なくとも3残基が欠損すると重合は起こらないことがわかった.同様に,Mfa線毛についても,Mfa1のC末端側の3残基が欠損すると重合が起こらなくなった.また,in vitroにおいて組換えFimAによる多量体の形成について調べたところ,Trp328をAlaに置換した変異FimAにおいては多量体が形成されたが,A2’ストランドを欠損したFimAにおいては形成されなかった.
RgpプロテアーゼによるA1ストランドの切断によりオープン構造になったC末端側のA1’ストランドが,前方の線毛タンパク質のA1ストランドが除去されることにより生じる空隙にはまり込んでいるのかどうかを調べるため,in vivoにおいてCys-Cys架橋実験を行った.FimAにある3つのCysをAlaに置換し,この変異FimAも線毛を形成することをイムノブロット解析および電子顕微鏡による観察により確認した.構造解析から,A1’ストランドがD1ストランドとG1ストランドの中間にはまり込むと予想されたので,A1’ストランドの3つの残基をそれぞれCysに置換し,これら3つの残基に近接したD1ストランドおよびG1ストランドにある残基をそれぞれCysに置換した変異FimAをfimA欠損株において発現させた.もしCysどうしが近位にある場合,酸化的な条件においてジスルフィド結合が生じ,100℃で加熱しても単量体へと解離しないことが予想される.Cysに置換した置換FimAを発現させた株を過酸化水素により処理すると単量体への解離が不十分な高分子量のタンパク質のバンドが検出された.さらに,同様な手法により,A2’ストランドのひとつの残基をCysに置換し,近位にあると推測されるA2ストランドおよびG2ストランドに存在する残基をCysに置換した場合には,短いクロスリンカーにより処理するとFimAの高分子量化が認められた.これらの結果から,FimAのC末端側のA1’ストランドおよびA2’ストランドは,それぞれ,N末端側のA1ストランドの除去により生じた空隙,および,A1’ストランドおよびA2’ストランドがオープン構造になることにより生じた空隙にはまり込むことが強く示唆された(図1 a, b).
アンカータンパク質であるFimBおよびMfa2がFim線毛およびMfa線毛の長さを制御することが示唆されている8,10).今回,解析した線毛タンパク質のうち3つは,以前に報告されたB. thetaiotaomicronのBT1062と同様の構造であり,アンカータンパク質と思われた.アンカータンパク質の特徴として,C末端側のA1’ストランドおよびA2’ストランドは線毛タンパク質のように折れ曲がっておらず,短いヘアピンのような構造あるいはオープン構造をとった.また,N末端側のA1ストランドとA2ストランドとのあいだのループ構造にRgpプロテアーゼの切断部位は存在しなかった.つまり,アンカータンパク質はほかの線毛タンパク質のN末端側の領域がプロテアーゼにより切断されるのとは異なり,菌体の表面においてもリポタンパク質として存在すると予想された.
これまでに,野生株のFimAおよびMfa1は,Rgp完全欠損株のそれらより低分子量であることが報告されている5,6,11).そこで,Mfa2についてイムノブロット解析を行ったところ,Rgp完全欠損変異株においても野生株と同じ分子量を示した.Mfa2にはRgpプロテアーゼによる切断が起こらないとすると,リポタンパク質のまま菌体の表面に存在すると予想された.そこで,P. gingivalisにおいてMfa2がリポタンパク質であるかどうかをパルミチン酸標識法により調べた.その結果,Mfa2には脂肪酸が含まれていることがわかった.また,Mfa2は菌体の表面に局在するが脂肪酸の結合部位であるCysをAlaに置換すると菌体の表面へと輸送されないことも確認された.つまり,Mfa2は菌体の表面においてもリポタンパク質であり,アンカータンパク質として機能すると考えられた.Mfa2が菌体の表面にある場合はMfa線毛の長さは短くなるがMfa2がない場合は長くなると報告されていたが8),このことも詳細に確かめられた.Mfa線毛の形成にMfa2のC末端側の領域が関与しているかどうかを知るため,C末端側の領域を欠損したMfa2を発現した株のMfa線毛の長さを調べたところ,C末端側の3残基が欠損すると長くなることがわかった.これらの結果から,Mfa2はそのC末端側の領域がMfa1との重合にかかわることが示唆された(図1c).
約30年まえにP. gingivalisのFim線毛が発見され,線毛タンパク質の大きさがそれまでに報告されていた線毛タンパク質と比べ2倍ほど大きかったことから,ユニークな線毛であることが指摘されていた1,4).今回,解析されたP. gingivalisの線毛タンパク質を含むBacteroidetes門細菌の線毛タンパク質の構造は,グラム陽性細菌であるStreptococcus agalactiaeのマイナー線毛タンパク質と類似していた12).一方,その重合の機構はI型線毛と類似していた.つまり,P. gingivalisの線毛はそれぞれの特徴をあわせもつハイブリッド型であることから,V型線毛と命名した.現在,FimAファミリー,Mfa2ファミリー,DUF3988ファミリーからなるFimAスーパーファミリーに含まれるタンパク質は1800種類以上あり,そのほとんどはBacteroidetes門に存在する.DUF3988ファミリーにはC末端側にリパーゼなどの機能ドメインをもつものが多いことから,線毛とは異なる機能があるのかもしれない.Bacteroidetes門細菌のリポタンパク質の多くは菌体の表面において機能すると思われるが,菌体の表面への輸送機構について,ほかの細菌における先行研究と類似性がなく,今後の解明が待たれる.今回の発見は,歯周病細菌P. gingivalisや虫垂炎などの原因となるB. fragilisなどの病原細菌の付着の機構や,さらには,ヒトの腸において優勢な細菌であるBacteroidetes門細菌がどのように生体に安定に維持されるかを解明するうえで重要な手がかりとなるものと思われる.
略歴:長崎大学大学院医歯薬学総合研究科 助教.
研究テーマ:歯周病細菌の病原機構.
中山 浩次(Koji Nakayama)
長崎大学大学院医歯薬学総合研究科 教授.
研究室URL:http://www.med.nagasaki-u.ac.jp/mmi/ob/
© 2016 庄子幹郎・中山浩次 Licensed under CC 表示 2.1 日本
(長崎大学大学院医歯薬学総合研究科 口腔病原微生物学分野)
email:庄子幹郎,中山浩次
DOI: 10.7875/first.author.2016.032
A distinct type of pilus from the human microbiome.
Qingping Xu, Mikio Shoji, Satoshi Shibata, Mariko Naito, Keiko Sato, Marc-André Elsliger, Joanna C. Grant, Herbert L. Axelrod, Hsiu-Ju Chiu, Carol L. Farr, Lukasz Jaroszewski, Mark W. Knuth, Ashley M. Deacon, Adam Godzik, Scott A. Lesley, Michael A. Curtis, Koji Nakayama, Ian A. Wilson
Cell, 165, 690-703 (2016)
要 約
腸管や口腔に定着するBacteroidetes門細菌の線毛タンパク質20個についてのX線結晶構造解析から,多くの線毛タンパク質はC末端側のβストランドが内向きに折れ曲がった構造をとることがわかった.そこで,Bacteroidetes門に属する歯周病細菌Porphyromonas gingivalisを用いて,in vivoにおける線毛の形成機構について詳細に解析した.それらの結果から,菌体の表面のプロテアーゼにより線毛タンパク質のN末端側のβストランドが除去されるとそこに空隙が生じ,C末端側のβストランドが外をむいた状態になり,さらに,N末端側のβストランドが除去された空隙に,つぎの線毛タンパク質のC末端側のβストランドがはまり込む,という線毛タンパク質の重合の機構が示唆された.この機構はこれまでに報告されていた線毛の形成機構とは異なっていたことから,これらの線毛をV型線毛と命名した.
はじめに
細菌の線毛はタンパク質が数珠状に連なった構造体であり,付着因子としての機能があり病原性に関与する.これまで,細菌の線毛としては形成過程の相違により,I型線毛,IV型線毛,Curli型線毛の3種類が報告されている.歯周病細菌として知られるPorphyromonas gingivalisはFim線毛およびMfa線毛とよばれる2種類の線毛をもつ1,2).また,腸内細菌のBacteroides fragilisも線毛をもつことが報告されている3).P. gingivalisやB. fragilisはBacteroidetes門Bacteroidia綱に属し,I型線毛,IV型線毛,Curli型線毛をもつ細菌とは進化系統において近縁ではないことから,Bacteroidetes門細菌の線毛はユニークな特徴をもつ可能性があった.
P. gingivalisのFim線毛から得られる主要な線毛タンパク質であるFimAのN末端はAlaであるが,FimAをコードするfimA遺伝子を大腸菌において発現させることにより得られたFimA前駆体はこのAlaより46残基ほど上流のMetがN末端でありこのAlaの1残基まえはArgであること,さらに,P. gingivalisのトリプシン様酵素であるRgpプロテアーゼをコードするrgpA遺伝子とrgpB遺伝子の二重変異株は線毛の形成不全を示すことから,P. gingivalisのFim線毛の形成にはRgpプロテアーゼによるFimAのN末端側の領域のプロセシングが必要であることが示唆された4,5).そののち,筆者らは,FimAおよびMfa線毛の主要な線毛タンパク質であるMfa1は,リポタンパク質としてペリプラスムから菌体の表面へと輸送されることを解明した6).Fim線毛およびMfa線毛は,それぞれ,主要な線毛タンパク質であるFimAおよびMfa1,アンカータンパク質であるFimBおよびMfa2,マイナーなタンパク質であるFimC,FimD,FimEおよびMfa3,Mfa4,Mfa5からなり,それらをコードする遺伝子はそれぞれオペロンを形成する7,8).これらのうち,Mfa5のほかはN末端側にリポタンパク質に特有の膜透過シグナル配列をもち,アンカータンパク質を除く線毛タンパク質にはRgpプロテアーゼにより切断されるArgが膜透過シグナル配列につづく配列に存在する.これらの知見から,線毛の形成においては,線毛タンパク質がリポタンパク質として菌体の表面に輸送され,Rgpプロテアーゼなどのプロテアーゼにより切断されたのち,重合が開始されると示唆されていた.しかし,線毛タンパク質の重合の詳細な機構については不明であった.
そこで,筆者らは,Bacteroidetes門細菌に存在する線毛タンパク質の包括的な構造解析を行い,その知見にもとづき線毛の形成機構の解明を試みた.
1.Bacteroidetes門細菌に存在する線毛タンパク質の結晶構造
Bacteroides thetaiotaomicronの線毛タンパク質であるBT1062について結晶構造が明らかにされている9).その構造は,N末端ドメインとC末端ドメインがそれぞれ7つのβストランド構造よりなり,C末端側にはさらに2つのβシート構造があるものであった.今回,主要な線毛タンパク質であるFimAファミリーとして8個,アンカータンパク質であるMfa2ファミリーとして3個,構造において類似性の推測されるDUF3988ファミリーとして8個の,計19個の結晶構造が明らかにされた.C末端側のβストランドであるA1’ストランドがタンパク質の内部に折れ曲がったクローズ構造をとるもの14個と,折れ曲がらずに突出したオープン構造をとるもの4個,C末端側の突出末端をもたないもの1個が存在した.さらに,クローズ構造をとるFimAファミリーは,C末端側のA1’ストランドがN末端側のβストランドであるA1ストランドとB1ストランドとのあいだのループ構造により抑え込まれていると推測された.Rgpプロテアーゼによる切断部位はA1ストランドとB1ストランドのあいだにあった.したがって,後述するアンカータンパク質を除き,線毛タンパク質はRgpプロテアーゼに遭遇するまではクローズ構造をとり,RgpプロテアーゼによりA1ストランドが切断されると,C末端側のA1’ストランドは構造変換を起こしてオープン構造をとり,つぎに,A1ストランドが除去されたことにより生じた空隙に,つぎにくる線毛タンパク質のC末端側のA1’ストランドがはまり込むという機構が連続的に起こることにより,線毛が形成されるのではないかと推測された.
2.線毛タンパク質のC末端側の領域は重合に必須である
P. gingivalis ATCC 33277株は長いFim線毛と短いMfa線毛をもつ.この株のFim線毛が長い理由は,アンカータンパク質であるFimBが遺伝子変異により欠失しているためと考えられている10).FimAのC末端側の突出末端はA1’ストランドおよびA2’ストランドからなり,それらの中央にTrp328が存在する.C末端側の領域が線毛タンパク質の重合にかかわるかどうかを明らかにするため,以下の方法で解析した.Trp328をAlaに置換した変異FimA,および,C末端側のA2’ストランドの3~10残基を欠損させた変異FimAをそれぞれfimA欠損株において発現させ,イムノブロット解析および電子顕微鏡により線毛の有無を調べた.その結果,Trp328をAlaに置換した変異FimAにおいては重合が起こるが,C末端側の少なくとも3残基が欠損すると重合は起こらないことがわかった.同様に,Mfa線毛についても,Mfa1のC末端側の3残基が欠損すると重合が起こらなくなった.また,in vitroにおいて組換えFimAによる多量体の形成について調べたところ,Trp328をAlaに置換した変異FimAにおいては多量体が形成されたが,A2’ストランドを欠損したFimAにおいては形成されなかった.
RgpプロテアーゼによるA1ストランドの切断によりオープン構造になったC末端側のA1’ストランドが,前方の線毛タンパク質のA1ストランドが除去されることにより生じる空隙にはまり込んでいるのかどうかを調べるため,in vivoにおいてCys-Cys架橋実験を行った.FimAにある3つのCysをAlaに置換し,この変異FimAも線毛を形成することをイムノブロット解析および電子顕微鏡による観察により確認した.構造解析から,A1’ストランドがD1ストランドとG1ストランドの中間にはまり込むと予想されたので,A1’ストランドの3つの残基をそれぞれCysに置換し,これら3つの残基に近接したD1ストランドおよびG1ストランドにある残基をそれぞれCysに置換した変異FimAをfimA欠損株において発現させた.もしCysどうしが近位にある場合,酸化的な条件においてジスルフィド結合が生じ,100℃で加熱しても単量体へと解離しないことが予想される.Cysに置換した置換FimAを発現させた株を過酸化水素により処理すると単量体への解離が不十分な高分子量のタンパク質のバンドが検出された.さらに,同様な手法により,A2’ストランドのひとつの残基をCysに置換し,近位にあると推測されるA2ストランドおよびG2ストランドに存在する残基をCysに置換した場合には,短いクロスリンカーにより処理するとFimAの高分子量化が認められた.これらの結果から,FimAのC末端側のA1’ストランドおよびA2’ストランドは,それぞれ,N末端側のA1ストランドの除去により生じた空隙,および,A1’ストランドおよびA2’ストランドがオープン構造になることにより生じた空隙にはまり込むことが強く示唆された(図1 a, b).
3.アンカータンパク質のC末端側の領域は線毛タンパク質と結合する
アンカータンパク質であるFimBおよびMfa2がFim線毛およびMfa線毛の長さを制御することが示唆されている8,10).今回,解析した線毛タンパク質のうち3つは,以前に報告されたB. thetaiotaomicronのBT1062と同様の構造であり,アンカータンパク質と思われた.アンカータンパク質の特徴として,C末端側のA1’ストランドおよびA2’ストランドは線毛タンパク質のように折れ曲がっておらず,短いヘアピンのような構造あるいはオープン構造をとった.また,N末端側のA1ストランドとA2ストランドとのあいだのループ構造にRgpプロテアーゼの切断部位は存在しなかった.つまり,アンカータンパク質はほかの線毛タンパク質のN末端側の領域がプロテアーゼにより切断されるのとは異なり,菌体の表面においてもリポタンパク質として存在すると予想された.
これまでに,野生株のFimAおよびMfa1は,Rgp完全欠損株のそれらより低分子量であることが報告されている5,6,11).そこで,Mfa2についてイムノブロット解析を行ったところ,Rgp完全欠損変異株においても野生株と同じ分子量を示した.Mfa2にはRgpプロテアーゼによる切断が起こらないとすると,リポタンパク質のまま菌体の表面に存在すると予想された.そこで,P. gingivalisにおいてMfa2がリポタンパク質であるかどうかをパルミチン酸標識法により調べた.その結果,Mfa2には脂肪酸が含まれていることがわかった.また,Mfa2は菌体の表面に局在するが脂肪酸の結合部位であるCysをAlaに置換すると菌体の表面へと輸送されないことも確認された.つまり,Mfa2は菌体の表面においてもリポタンパク質であり,アンカータンパク質として機能すると考えられた.Mfa2が菌体の表面にある場合はMfa線毛の長さは短くなるがMfa2がない場合は長くなると報告されていたが8),このことも詳細に確かめられた.Mfa線毛の形成にMfa2のC末端側の領域が関与しているかどうかを知るため,C末端側の領域を欠損したMfa2を発現した株のMfa線毛の長さを調べたところ,C末端側の3残基が欠損すると長くなることがわかった.これらの結果から,Mfa2はそのC末端側の領域がMfa1との重合にかかわることが示唆された(図1c).
おわりに
約30年まえにP. gingivalisのFim線毛が発見され,線毛タンパク質の大きさがそれまでに報告されていた線毛タンパク質と比べ2倍ほど大きかったことから,ユニークな線毛であることが指摘されていた1,4).今回,解析されたP. gingivalisの線毛タンパク質を含むBacteroidetes門細菌の線毛タンパク質の構造は,グラム陽性細菌であるStreptococcus agalactiaeのマイナー線毛タンパク質と類似していた12).一方,その重合の機構はI型線毛と類似していた.つまり,P. gingivalisの線毛はそれぞれの特徴をあわせもつハイブリッド型であることから,V型線毛と命名した.現在,FimAファミリー,Mfa2ファミリー,DUF3988ファミリーからなるFimAスーパーファミリーに含まれるタンパク質は1800種類以上あり,そのほとんどはBacteroidetes門に存在する.DUF3988ファミリーにはC末端側にリパーゼなどの機能ドメインをもつものが多いことから,線毛とは異なる機能があるのかもしれない.Bacteroidetes門細菌のリポタンパク質の多くは菌体の表面において機能すると思われるが,菌体の表面への輸送機構について,ほかの細菌における先行研究と類似性がなく,今後の解明が待たれる.今回の発見は,歯周病細菌P. gingivalisや虫垂炎などの原因となるB. fragilisなどの病原細菌の付着の機構や,さらには,ヒトの腸において優勢な細菌であるBacteroidetes門細菌がどのように生体に安定に維持されるかを解明するうえで重要な手がかりとなるものと思われる.
文 献
- Yoshimura, F., Takahashi, K., Nodasaka, Y. et al.: Purification and characterization of a novel type of fimbriae from the oral anaerobe Bacteroides gingivalis. J. Bacteriol., 160, 949-957 (1984)[PubMed]
- Hamada, N., Sojar, H. T., Cho, M. I. et al.: Isolation and characterization of a minor fimbria from Porphyromonas gingivalis. Infect. Immun., 64, 4788-4794 (1996)[PubMed]
- van Doorn, J., Mooi, F. R., Verweij-van Vught, A. M. et al.: Characterization of fimbriae from Bacteroides fragilis. Microb. Pathog., 3, 87-95 (1987)[PubMed]
- Onoe, T., Hoover, C. I., Nakayama, K. et al.: Identification of Porphyromonas gingivalis prefimbrilin possessing a long leader peptide: possible involvement of trypsin-like protease in fimbrilin maturation. Microb. Pathog., 19, 351-64 (1995)[PubMed]
- Nakayama, K., Yoshimura, F., Kadowaki, T. et al.: Involvement of arginine-specific cysteine proteinase (Arg-gingipain) in fimbriation of Porphyromonas gingivalis. J. Bacteriol., 178, 2818-2824 (1996)[PubMed]
- Shoji, M., Naito, M., Yukitake, H. et al.: The major structural components of two cell surface filaments of Porphyromonas gingivalis are matured through lipoprotein precursors. Mol. Microbiol., 52, 1513-1525 (2004)[PubMed]
- Nishiyama, S., Murakami, Y., Nagata, H. et al.: Involvement of minor components associated with the FimA fimbriae of Porphyromonas gingivalis in adhesive functions. Microbiology, 153, 1916-1925 (2007)[PubMed]
- Hasegawa, Y., Iwami, J., Sato, K. et al.: Anchoring and length regulation of Porphyromonas gingivalis Mfa1 fimbriae by the downstream gene product Mfa2. Microbiology, 155, 3333-3347 (2009)[PubMed]
- Xu, Q., Abdubek, P., Astakhova, T. et al.: A conserved fold for fimbrial components revealed by the crystal structure of a putative fimbrial assembly protein (BT1062) from Bacteroides thetaiotaomicron at 2.2Å resolution. Acta Crystallogr. Sect. F Struct. Biol. Cryst. Commun., 66, 1281-1286 (2010)[PubMed]
- Nagano, K., Hasegawa, Y., Murakami, Y. et al.: FimB regulates FimA fimbriation in Porphyromonas gingivalis. J. Dent. Res., 89, 903-908 (2010)[PubMed]
- Kadowaki, T., Nakayama, K., Yoshimura, F. et al.: Arg-gingipain acts as a major processing enzyme for various cell surface proteins in Porphyromonas gingivalis. J. Biol. Chem., 273, 29072-29076 (1998)[PubMed]
- Krishnan, V., Gaspar, A. H., Ye, N. et al.: An IgG-like domain in the minor pilin GBS52 of Streptococcus agalactiae mediates lung epithelial cell adhesion. Structure, 15, 893-903 (2007)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:長崎大学大学院医歯薬学総合研究科 助教.
研究テーマ:歯周病細菌の病原機構.
中山 浩次(Koji Nakayama)
長崎大学大学院医歯薬学総合研究科 教授.
研究室URL:http://www.med.nagasaki-u.ac.jp/mmi/ob/
© 2016 庄子幹郎・中山浩次 Licensed under CC 表示 2.1 日本