Lypd8は鞭毛をもつ細菌と大腸上皮とを分け隔てる
奥村 龍・竹田 潔
(大阪大学大学院医学系研究科 免疫制御学)
email:奥村 龍
DOI: 10.7875/first.author.2016.031
Lypd8 promotes the segregation of flagellated microbiota and colonic epithelia.
Ryu Okumura, Takashi Kurakawa, Takashi Nakano, Hisako Kayama, Makoto Kinoshita, Daisuke Motooka, Kazuyoshi Gotoh, Taishi Kimura, Naganori Kamiyama, Takashi Kusu, Yoshiyasu Ueda, Hong Wu, Hideki Iijima, Soumik Barman, Hideki Osawa, Hiroshi Matsuno, Junichi Nishimura, Yusuke Ohba, Shota Nakamura, Tetsuya Iida, Masahiro Yamamoto, Eiji Umemoto, Koichi Sano, Kiyoshi Takeda
Nature, 532, 117-121 (2016)
おびただしい数の細菌の存在する大腸上皮は,内粘液層と外粘液層により構成される厚い粘液層によりおおわれている.大腸上皮の直上に存在する内粘液層には細菌はほとんど存在せず,細菌と大腸上皮とは分け隔てられている.しかしながら,どのような機構により細菌と大腸上皮とが分け隔てられるかは不明であった.筆者らは,大腸上皮に特異的に発現するLypd8というGPIアンカー型の膜タンパク質が細菌の鞭毛と結合し,内粘液層への侵入を抑制するという新たな機構について明らかにした.また,Lypd8ノックアウトマウスにおいては実験的な腸炎に対する感受性が亢進しており,Lypd8が鞭毛をもつ細菌と大腸上皮とを分け隔てることにより腸炎を制御していることが明らかにされた.
近年,潰瘍性大腸炎やクローン病に代表される炎症性腸疾患の患者は増加の一途をたどっているが,根治的な治療法といえるものは存在せず,発症機構の解明が急務となっている.最近の研究により,炎症性腸疾患の発症の原因のひとつとして,粘液層や抗菌ペプチドなど腸管上皮バリアの機能の破綻が指摘されている1).ほかの臓器とは異なり,微生物や食物など外界からの異物がおびただしく存在する腸管においては,腸管上皮バリアによりそれらと腸管とを隔離することは,過剰な免疫応答を回避し炎症を制御するうえで重要とされている.小腸と比較して多数の細菌が存在する大腸においては,腸管上皮バリアのひとつである粘液層は分厚く,外粘液層と内粘液層の2つの層に分けられる.細菌は外粘液層に存在し,内粘液層はほぼ無菌の状態に保たれているが2,3),腸炎を自然発症するマウスにおいては多くの細菌の内粘液層への侵入が認められることから4),細菌と大腸上皮とを分け隔てることは炎症の制御において重要であると考えられている.小腸においては細菌と小腸上皮とを分け隔てる機構として,Paneth細胞から産生されるαディフェンシンなどの抗菌ペプチドがとくに重要であることが明らかにされてきており,近年では,RegIIIγがグラム陽性細菌に対し抗菌活性をもち,グラム陽性細菌と小腸上皮とを分け隔てるのに重要であることが報告されている5-7).しかし,さらにおびただしい数の微生物が存在する大腸には抗菌ペプチドの産生に特化したPaneth細胞は存在せず,これまで,内粘液層が無菌の状態に保たれる機構については十分に解明されていなかった.
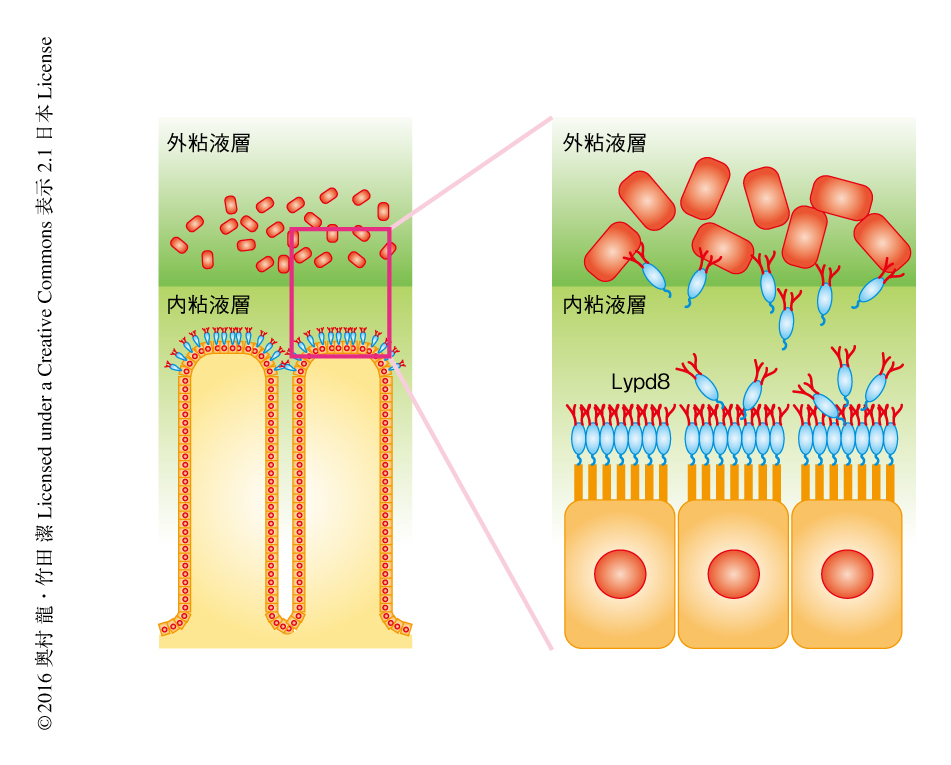
大腸において内粘液層が無菌の状態に保たれる機序について解明するため,大腸上皮に特異的に高発現する遺伝子をデータベース,マイクロアレイ法,リアルタイムPCR法により探索した.その結果,Lypd8遺伝子が大腸上皮において特異的に高発現していることが見い出された.Lypd8は,Ly6/PlaurドメインをもつLy6/Plaurファミリータンパク質のひとつであり,GPIアンカー型の膜タンパク質であった.また,ほかのLy6/Plaurファミリータンパク質とは異なりN-結合型糖鎖の修飾を高度にうけており,その分子量は約110,000であった.マウスの大腸におけるLypd8の発現パターンを抗Lypd8抗体を用いた免疫染色により調べたところ,Lypd8は大腸の腺組織の最表層に存在する上皮細胞の頂端側に発現し,大腸の管腔に恒常的に分泌されていた(図1).大腸がんの患者の正常な粘膜の組織切片を免疫染色により観察したところ,Lypd8はヒトにおいてもマウスと同様に大腸の腺組織の最表層に存在する上皮細胞に高発現しており,また,潰瘍性大腸炎の患者の炎症を起こした粘膜を同様に観察したところ,Lypd8の発現はいちじるしく低下していた.このことから,Lypd8が潰瘍性大腸炎の病態に関与する可能性が示唆された.
これまで,Lypd8の機能はまったく解明されていなかったため,Lypd8ノックアウトマウスを作製し生体におけるLypd8の機能を解析した.野生型のマウスおよびLypd8ノックアウトマウスの大腸の組織切片を観察したところ,Lypd8ノックアウトマウスの大腸上皮には多数の細菌が付着し,野生型のマウスであれば細菌が認められない大腸上皮の直上の内粘液層や腸陰窩深部にも多数の細菌が存在していた.Lypd8ノックアウトマウスの大腸に付着している細菌をリアルタイムPCR法により解析したところ,大腸菌,Proteus属細菌,Helicobacter属細菌といった鞭毛をもち運動性の高い細菌が野生型のマウスと比べ有意に多く検出され,Lypd8ノックアウトマウスの大腸の組織破砕液を培養すると細菌Proteus mirabilisが有意に多く検出された.マウスに蛍光標識したP. mirabilisを経肛門的に投与したところ,Lypd8ノックアウトマウスにおいて多くのP. mirabilisの大腸上皮への接着が観察された.これらの結果から,Lypd8が大腸においてP. mirabilisを含む鞭毛をもつ細菌の内粘液層への侵入を抑制していることが示唆された.
Proteus属細菌やHelicobacter属細菌は腸炎との関連が報告されているため8-10),Lypd8ノックアウトマウスにデキストラン硫酸ナトリウムの投与による実験的な腸炎をひき起こし,野生型のマウスと比較した.その結果,Lypd8ノックアウトマウスは体重の減少がいちじるしく,高い死亡率,激しい炎症像が認められ,腸炎が重症化した.
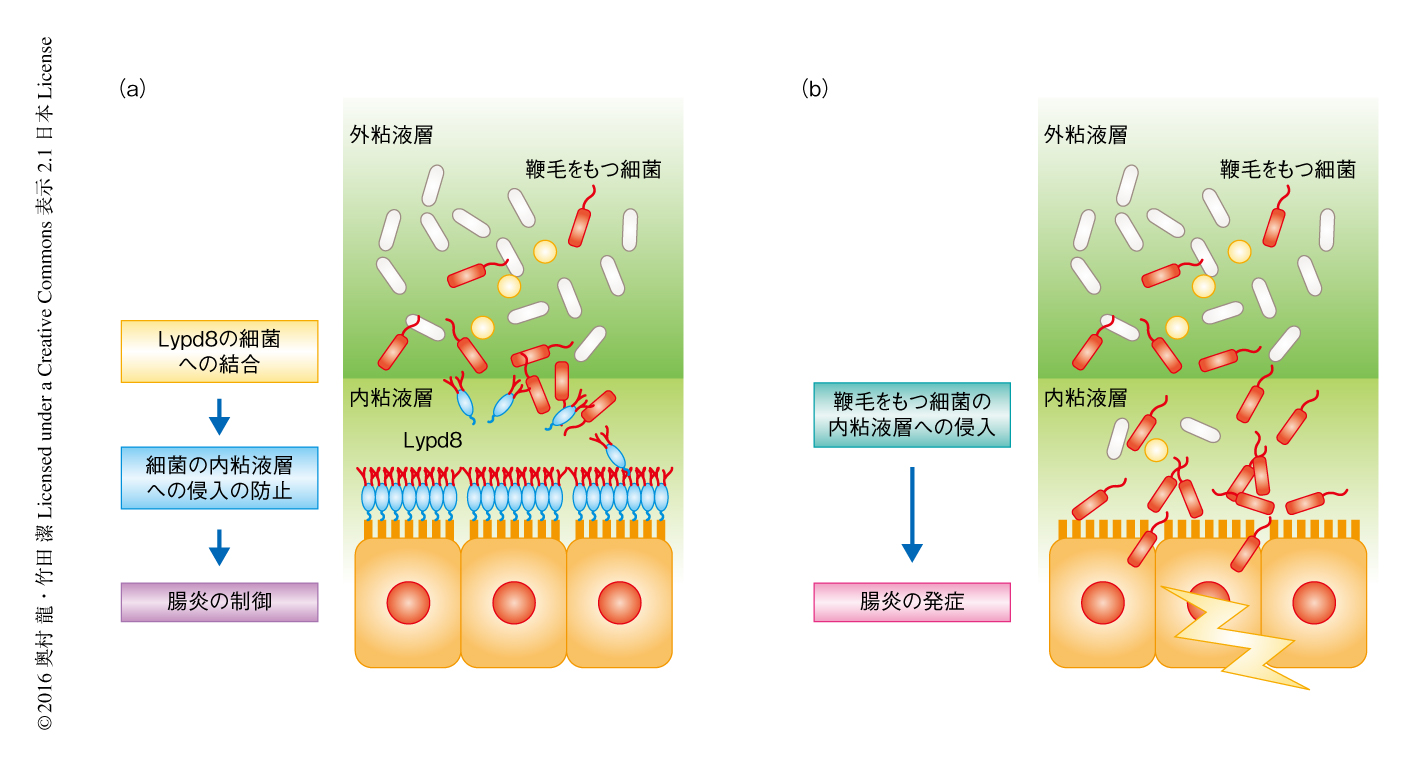
Lypd8ノックアウトマウスにおいて,腸炎に対する感受性が亢進していることと鞭毛をもつ細菌の存在とが関連するかどうかを調べるため,マウスに抗生剤を投与して腸管において鞭毛をもつ細菌が減少または増加する状態をつくりだして腸炎に対する感受性について調べた.抗生剤としては,Proteus属細菌や大腸菌などのグラム陰性細菌に感受性のあるゲンタマイシンと,それらに感受性のないバンコマイシンを使用した.2週間にわたり抗生剤を投与し野生型のマウスおよびLypd8ノックアウトマウスの大腸の組織切片を観察した.Lypd8ノックアウトマウスにゲンタマイシンを投与し鞭毛をもつ細菌を排除すると,大腸上皮の直上に無菌の内粘液層が認められるようになった.また,バンコマイシンを投与し細菌の交代現象により鞭毛をもつ細菌が増加した状態にしても,内粘液層に変化はみられなかった.実験的な腸炎をひき起こしたところ,Lypd8ノックアウトマウスにおいては,ゲンタマイシンの投与により腸炎は軽症化し,バンコマイシンの投与により腸炎は悪化した.このことから,Lypd8ノックアウトマウスにおいて腸炎に対する感受性は鞭毛をもつ細菌の存在と関連していることが示され,Lypd8は鞭毛をもつ細菌の内粘液層への侵入を抑制し腸炎を制御していることが示唆された(図2).
Lypd8がどのような機序により鞭毛をもつ細菌を含む細菌の内粘液層への侵入を抑制しているのかを解析した.Lypd8は大腸の管腔に恒常的に分泌されていることから,生体においてLypd8は細菌と結合しているかどうか調べるため,マウスの糞便から細菌の画分を分離し,抗Lypd8抗体を反応させフローサイトメトリーにより解析した.その結果,Lypd8は糞便に含まれる一部の細菌と結合していた.Lypd8がどういった細菌と結合しているかを調べるため,Lypd8と結合している細菌と結合していない細菌とをフローサイトメトリーを用いて分離しそれぞれDNAを解析したところ,Lypd8と結合している細菌には大腸菌など鞭毛をもつ細菌が多く含まれ,Lypd8が腸管において鞭毛をもつ細菌と優先的に結合することが示唆された.また,純粋培養したP. mirabilisに組換えLypd8をくわえフローサイトメトリーにより解析したところ,Lypd8はP. mirabilisと優先的に結合することが明らかにされ,さらに,走査型電子顕微鏡を用いてLypd8とP. mirabilisとの結合の部分を観察したところ,Lypd8は鞭毛と結合していた.Lypd8が鞭毛と結合するかどうかさらに解析するため,純粋培養したP. mirabilisあるいは大腸菌を激しく振とうし,はがれ落ちた鞭毛を超遠心法により分離した.分離した鞭毛に組換えLypd8をくわえたのち超遠心法により鞭毛を沈殿させ,沈殿物および上清に含まれるLypd8の量をウェスタンブロッティング法により評価した.その結果,Lypd8はP. mirabilisあるいは大腸菌の鞭毛と結合し,超遠心法により共沈した.また,P. mirabilisの鞭毛あるいは鞭毛の主要な構成タンパク質であるフラジェリンをプレートにコートしLypd8との結合をELISA法により解析したところ,Lypd8と鞭毛との結合は認められたが,Lypd8とフラジェリンとの結合は認められなかった.この結果から,Lypd8は単体のフラジェリンとは結合せず,フラジェリン多量体の高次構造を認識して結合する可能性が示唆された.
in vitroにおいてLypd8がP. mirabilisの大腸上皮への接着を抑制するかどうか解析した.ヒトの大腸上皮細胞株であるCaco-2細胞にはLYPD8は発現していないため,マウスのLypd8をCaco-2細胞に強制発現させLypd8を恒常的に発現するCaco-2細胞株を作製した.このCaco-2細胞を培養し免疫染色によりLypd8の発現を解析したところ,Lypd8はCaco-2細胞の頂端側に発現し,また,一部は上清にも分泌されていた.Lypd8を発現するCaco-2細胞を培養し,上清にP. mirabilisをくわえてCaco-2細胞への接着について評価した.Lypd8を発現するCaco-2細胞では発現しないCaco-2細胞と比較し,P. mirabilisの接着が抑制され,かつ,その作用はN-グリカナーゼによる脱グリコシル化により失われた.このことから,Lypd8は細菌の接着を抑制し,その作用にはN-結合型糖鎖の修飾が重要であることが示された.
Lypd8は細菌の運動をつかさどる鞭毛と結合することから,Lypd8が細菌の運動性におよぼす影響について評価した.寒天培地に培養したP. mirabilisに対しLypd8を発現したCaco-2細胞を頂端側から接触させたところ,P. mirabilisの運動性は抑制された.また,Lypd8を含んだ軟寒天培地において,P. mirabilisおよび大腸菌の運動性は対照と比べ有意に抑制された.以上の結果から,Lypd8は細菌の鞭毛と結合し,その運動性を抑制することが示された(図2).
Lypd8は大腸上皮に特異的に高発現するGPIアンカー型の膜タンパク質であり,大腸の管腔に恒常的に分泌され,大腸菌やProteus属細菌など鞭毛をもつ細菌の鞭毛と結合してその運動性を抑制することにより,内粘液層への侵入を防止し腸炎を制御していることが明らかにされた.潰瘍性大腸炎の患者の炎症を起こした粘膜においてはLypd8の発現の低下が認められたことから,Lypd8の発現を回復させることなどにより腸管上皮バリアの機能を強化するといった,潰瘍性大腸炎の新たな治療法の開発が期待される.
略歴:大阪大学大学院医学系研究科 助教.
研究テーマ:大腸における腸管上皮バリアの機構.
抱負:基礎医学の研究から小児医療に貢献したい.
竹田 潔(Kiyoshi Takeda)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/ongene/
© 2016 奥村 龍・竹田 潔 Licensed under CC 表示 2.1 日本
(大阪大学大学院医学系研究科 免疫制御学)
email:奥村 龍
DOI: 10.7875/first.author.2016.031
Lypd8 promotes the segregation of flagellated microbiota and colonic epithelia.
Ryu Okumura, Takashi Kurakawa, Takashi Nakano, Hisako Kayama, Makoto Kinoshita, Daisuke Motooka, Kazuyoshi Gotoh, Taishi Kimura, Naganori Kamiyama, Takashi Kusu, Yoshiyasu Ueda, Hong Wu, Hideki Iijima, Soumik Barman, Hideki Osawa, Hiroshi Matsuno, Junichi Nishimura, Yusuke Ohba, Shota Nakamura, Tetsuya Iida, Masahiro Yamamoto, Eiji Umemoto, Koichi Sano, Kiyoshi Takeda
Nature, 532, 117-121 (2016)
要 約
おびただしい数の細菌の存在する大腸上皮は,内粘液層と外粘液層により構成される厚い粘液層によりおおわれている.大腸上皮の直上に存在する内粘液層には細菌はほとんど存在せず,細菌と大腸上皮とは分け隔てられている.しかしながら,どのような機構により細菌と大腸上皮とが分け隔てられるかは不明であった.筆者らは,大腸上皮に特異的に発現するLypd8というGPIアンカー型の膜タンパク質が細菌の鞭毛と結合し,内粘液層への侵入を抑制するという新たな機構について明らかにした.また,Lypd8ノックアウトマウスにおいては実験的な腸炎に対する感受性が亢進しており,Lypd8が鞭毛をもつ細菌と大腸上皮とを分け隔てることにより腸炎を制御していることが明らかにされた.
はじめに
近年,潰瘍性大腸炎やクローン病に代表される炎症性腸疾患の患者は増加の一途をたどっているが,根治的な治療法といえるものは存在せず,発症機構の解明が急務となっている.最近の研究により,炎症性腸疾患の発症の原因のひとつとして,粘液層や抗菌ペプチドなど腸管上皮バリアの機能の破綻が指摘されている1).ほかの臓器とは異なり,微生物や食物など外界からの異物がおびただしく存在する腸管においては,腸管上皮バリアによりそれらと腸管とを隔離することは,過剰な免疫応答を回避し炎症を制御するうえで重要とされている.小腸と比較して多数の細菌が存在する大腸においては,腸管上皮バリアのひとつである粘液層は分厚く,外粘液層と内粘液層の2つの層に分けられる.細菌は外粘液層に存在し,内粘液層はほぼ無菌の状態に保たれているが2,3),腸炎を自然発症するマウスにおいては多くの細菌の内粘液層への侵入が認められることから4),細菌と大腸上皮とを分け隔てることは炎症の制御において重要であると考えられている.小腸においては細菌と小腸上皮とを分け隔てる機構として,Paneth細胞から産生されるαディフェンシンなどの抗菌ペプチドがとくに重要であることが明らかにされてきており,近年では,RegIIIγがグラム陽性細菌に対し抗菌活性をもち,グラム陽性細菌と小腸上皮とを分け隔てるのに重要であることが報告されている5-7).しかし,さらにおびただしい数の微生物が存在する大腸には抗菌ペプチドの産生に特化したPaneth細胞は存在せず,これまで,内粘液層が無菌の状態に保たれる機構については十分に解明されていなかった.
1.Lypd8は大腸上皮の最上層に特異的に高発現し大腸の管腔に分泌される
大腸において内粘液層が無菌の状態に保たれる機序について解明するため,大腸上皮に特異的に高発現する遺伝子をデータベース,マイクロアレイ法,リアルタイムPCR法により探索した.その結果,Lypd8遺伝子が大腸上皮において特異的に高発現していることが見い出された.Lypd8は,Ly6/PlaurドメインをもつLy6/Plaurファミリータンパク質のひとつであり,GPIアンカー型の膜タンパク質であった.また,ほかのLy6/Plaurファミリータンパク質とは異なりN-結合型糖鎖の修飾を高度にうけており,その分子量は約110,000であった.マウスの大腸におけるLypd8の発現パターンを抗Lypd8抗体を用いた免疫染色により調べたところ,Lypd8は大腸の腺組織の最表層に存在する上皮細胞の頂端側に発現し,大腸の管腔に恒常的に分泌されていた(図1).大腸がんの患者の正常な粘膜の組織切片を免疫染色により観察したところ,Lypd8はヒトにおいてもマウスと同様に大腸の腺組織の最表層に存在する上皮細胞に高発現しており,また,潰瘍性大腸炎の患者の炎症を起こした粘膜を同様に観察したところ,Lypd8の発現はいちじるしく低下していた.このことから,Lypd8が潰瘍性大腸炎の病態に関与する可能性が示唆された.
2.Lypd8は鞭毛をもつ細菌の内粘液層への侵入を抑制する
これまで,Lypd8の機能はまったく解明されていなかったため,Lypd8ノックアウトマウスを作製し生体におけるLypd8の機能を解析した.野生型のマウスおよびLypd8ノックアウトマウスの大腸の組織切片を観察したところ,Lypd8ノックアウトマウスの大腸上皮には多数の細菌が付着し,野生型のマウスであれば細菌が認められない大腸上皮の直上の内粘液層や腸陰窩深部にも多数の細菌が存在していた.Lypd8ノックアウトマウスの大腸に付着している細菌をリアルタイムPCR法により解析したところ,大腸菌,Proteus属細菌,Helicobacter属細菌といった鞭毛をもち運動性の高い細菌が野生型のマウスと比べ有意に多く検出され,Lypd8ノックアウトマウスの大腸の組織破砕液を培養すると細菌Proteus mirabilisが有意に多く検出された.マウスに蛍光標識したP. mirabilisを経肛門的に投与したところ,Lypd8ノックアウトマウスにおいて多くのP. mirabilisの大腸上皮への接着が観察された.これらの結果から,Lypd8が大腸においてP. mirabilisを含む鞭毛をもつ細菌の内粘液層への侵入を抑制していることが示唆された.
3.Lypd8は鞭毛をもつ細菌の内粘液層への侵入を抑制することにより腸炎を制御する
Proteus属細菌やHelicobacter属細菌は腸炎との関連が報告されているため8-10),Lypd8ノックアウトマウスにデキストラン硫酸ナトリウムの投与による実験的な腸炎をひき起こし,野生型のマウスと比較した.その結果,Lypd8ノックアウトマウスは体重の減少がいちじるしく,高い死亡率,激しい炎症像が認められ,腸炎が重症化した.
Lypd8ノックアウトマウスにおいて,腸炎に対する感受性が亢進していることと鞭毛をもつ細菌の存在とが関連するかどうかを調べるため,マウスに抗生剤を投与して腸管において鞭毛をもつ細菌が減少または増加する状態をつくりだして腸炎に対する感受性について調べた.抗生剤としては,Proteus属細菌や大腸菌などのグラム陰性細菌に感受性のあるゲンタマイシンと,それらに感受性のないバンコマイシンを使用した.2週間にわたり抗生剤を投与し野生型のマウスおよびLypd8ノックアウトマウスの大腸の組織切片を観察した.Lypd8ノックアウトマウスにゲンタマイシンを投与し鞭毛をもつ細菌を排除すると,大腸上皮の直上に無菌の内粘液層が認められるようになった.また,バンコマイシンを投与し細菌の交代現象により鞭毛をもつ細菌が増加した状態にしても,内粘液層に変化はみられなかった.実験的な腸炎をひき起こしたところ,Lypd8ノックアウトマウスにおいては,ゲンタマイシンの投与により腸炎は軽症化し,バンコマイシンの投与により腸炎は悪化した.このことから,Lypd8ノックアウトマウスにおいて腸炎に対する感受性は鞭毛をもつ細菌の存在と関連していることが示され,Lypd8は鞭毛をもつ細菌の内粘液層への侵入を抑制し腸炎を制御していることが示唆された(図2).
4.Lypd8は細菌の鞭毛と結合しその運動性を抑制する
Lypd8がどのような機序により鞭毛をもつ細菌を含む細菌の内粘液層への侵入を抑制しているのかを解析した.Lypd8は大腸の管腔に恒常的に分泌されていることから,生体においてLypd8は細菌と結合しているかどうか調べるため,マウスの糞便から細菌の画分を分離し,抗Lypd8抗体を反応させフローサイトメトリーにより解析した.その結果,Lypd8は糞便に含まれる一部の細菌と結合していた.Lypd8がどういった細菌と結合しているかを調べるため,Lypd8と結合している細菌と結合していない細菌とをフローサイトメトリーを用いて分離しそれぞれDNAを解析したところ,Lypd8と結合している細菌には大腸菌など鞭毛をもつ細菌が多く含まれ,Lypd8が腸管において鞭毛をもつ細菌と優先的に結合することが示唆された.また,純粋培養したP. mirabilisに組換えLypd8をくわえフローサイトメトリーにより解析したところ,Lypd8はP. mirabilisと優先的に結合することが明らかにされ,さらに,走査型電子顕微鏡を用いてLypd8とP. mirabilisとの結合の部分を観察したところ,Lypd8は鞭毛と結合していた.Lypd8が鞭毛と結合するかどうかさらに解析するため,純粋培養したP. mirabilisあるいは大腸菌を激しく振とうし,はがれ落ちた鞭毛を超遠心法により分離した.分離した鞭毛に組換えLypd8をくわえたのち超遠心法により鞭毛を沈殿させ,沈殿物および上清に含まれるLypd8の量をウェスタンブロッティング法により評価した.その結果,Lypd8はP. mirabilisあるいは大腸菌の鞭毛と結合し,超遠心法により共沈した.また,P. mirabilisの鞭毛あるいは鞭毛の主要な構成タンパク質であるフラジェリンをプレートにコートしLypd8との結合をELISA法により解析したところ,Lypd8と鞭毛との結合は認められたが,Lypd8とフラジェリンとの結合は認められなかった.この結果から,Lypd8は単体のフラジェリンとは結合せず,フラジェリン多量体の高次構造を認識して結合する可能性が示唆された.
in vitroにおいてLypd8がP. mirabilisの大腸上皮への接着を抑制するかどうか解析した.ヒトの大腸上皮細胞株であるCaco-2細胞にはLYPD8は発現していないため,マウスのLypd8をCaco-2細胞に強制発現させLypd8を恒常的に発現するCaco-2細胞株を作製した.このCaco-2細胞を培養し免疫染色によりLypd8の発現を解析したところ,Lypd8はCaco-2細胞の頂端側に発現し,また,一部は上清にも分泌されていた.Lypd8を発現するCaco-2細胞を培養し,上清にP. mirabilisをくわえてCaco-2細胞への接着について評価した.Lypd8を発現するCaco-2細胞では発現しないCaco-2細胞と比較し,P. mirabilisの接着が抑制され,かつ,その作用はN-グリカナーゼによる脱グリコシル化により失われた.このことから,Lypd8は細菌の接着を抑制し,その作用にはN-結合型糖鎖の修飾が重要であることが示された.
Lypd8は細菌の運動をつかさどる鞭毛と結合することから,Lypd8が細菌の運動性におよぼす影響について評価した.寒天培地に培養したP. mirabilisに対しLypd8を発現したCaco-2細胞を頂端側から接触させたところ,P. mirabilisの運動性は抑制された.また,Lypd8を含んだ軟寒天培地において,P. mirabilisおよび大腸菌の運動性は対照と比べ有意に抑制された.以上の結果から,Lypd8は細菌の鞭毛と結合し,その運動性を抑制することが示された(図2).
おわりに
Lypd8は大腸上皮に特異的に高発現するGPIアンカー型の膜タンパク質であり,大腸の管腔に恒常的に分泌され,大腸菌やProteus属細菌など鞭毛をもつ細菌の鞭毛と結合してその運動性を抑制することにより,内粘液層への侵入を防止し腸炎を制御していることが明らかにされた.潰瘍性大腸炎の患者の炎症を起こした粘膜においてはLypd8の発現の低下が認められたことから,Lypd8の発現を回復させることなどにより腸管上皮バリアの機能を強化するといった,潰瘍性大腸炎の新たな治療法の開発が期待される.
文 献
- Jager, S., Stange, E. F. & Wehkamp, J.: Inflammatory bowel disease: an impaired barrier disease. Langenbecks Arch. Surg., 398, 1-12 (2013)[PubMed]
- McGuckin, M. A., Linden, S. K., Sutton, P. et al.: Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol., 9, 265-278 (2011)[PubMed]
- Johansson, M. E., Larsson, J. M. & Hansson, G. C.: The two mucus layers of colon are organized by the MUC2 mucin, whereas the outer layer is a legislator of host-microbial interactions. Proc. Natl. Acad. Sci. USA, 108 (Suppl. 1), 4659-4665 (2011)[PubMed]
- Johansson, M. E. Gustafsson, J. K., Holmen-Larsson, J. et al.: Bacteria penetrate the normally impenetrable inner colon mucus layer in both murine colitis models and patients with ulcerative colitis. Gut, 63, 281-291 (2014)[PubMed]
- Ayabe, T., Satchell, D. P., Wilson, C. L. et al.: Secretion of microbicidal α-defensins by intestinal Paneth cells in response to bacteria. Nat. Immunol., 1, 113-118 (2000)[PubMed]
- Vaishnava, S. Yamamoto, M., Severson, K. M. et al.: The antibacterial lectin RegIIIγ promotes the spatial segregation of microbiota and host in the intestine. Science, 334, 255-258 (2011)[PubMed]
- Cash, H. L., Whitham, C. V., Behrendt, C. L. et al.: Symbiotic bacteria direct expression of an intestinal bactericidal lectin. Science, 313, 1126-1130 (2006)[PubMed]
- Garrett, W. S., Gallini, C. A., Yatsunenko, T. et al.: Enterobacteriaceae act in concert with the gut microbiota to induce spontaneous and maternally transmitted colitis. Cell Host Microbe, 8, 292-300 (2010)[PubMed]
- Mukhopadhya, I., Hansen, R., El-Omar, E. M. et al.: IBD-what role do Proteobacteria play? Nat. Rev. Gastroenterol. Hepatol., 9, 219-230 (2012)[PubMed]
- Hansen, R., Thomson, J. M., Fox, J. G. et al.: Could Helicobacter organisms cause inflammatory bowel disease? FEMS Immunol. Med. Microbiol., 61, 1-14 (2011)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:大阪大学大学院医学系研究科 助教.
研究テーマ:大腸における腸管上皮バリアの機構.
抱負:基礎医学の研究から小児医療に貢献したい.
竹田 潔(Kiyoshi Takeda)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/ongene/
© 2016 奥村 龍・竹田 潔 Licensed under CC 表示 2.1 日本