細胞表面抗原CD93はMLL遺伝子の再構成をともなう急性骨髄性白血病の発症に必須である
岩崎 正幸
(米国Stanford大学School of Medicine,Department of Pathology)
email:岩崎正幸
DOI: 10.7875/first.author.2015.126
CD93 marks a non-quiescent human leukemia stem cell population and is required for development of MLL-rearranged acute myeloid leukemia.
Masayuki Iwasaki, Michaela Liedtke, Andrew J. Gentles, Michael L. Cleary
Cell Stem Cell, 17, 412-421 (2015)
正常な造血幹細胞と白血病幹細胞は,免疫表現型,細胞周期が静止期にあること,自己複製能をもつことなど,多くの特徴を共有する.このことは,正常な造血幹細胞を傷害することなく白血病幹細胞だけを根絶させる治療法の開発を困難にしている.筆者らは,MLL遺伝子の再構成をともなう急性骨髄性白血病の白血病幹細胞において,細胞表面抗原CD93が特異的に発現していることを見い出した.通常,CD34陽性CD38陰性の白血病幹細胞は細胞周期が静止期にあるが,MLL遺伝子の再構成をともなう急性骨髄性白血病においてCD34陽性CD38陰性CD93陽性の白血病幹細胞は細胞周期が非静止期にあった.さらに,CD93は機能的にもMLL遺伝子の再構成をともなう急性骨髄性白血病の発症に必須であり,サイクリン依存性キナーゼの阻害タンパク質であるCDKN2Bの発現を抑制することにより白血病幹細胞の自己複製能を制御していることが明らかにされた.
近年,白血病をはじめとするさまざまな腫瘍においてがん幹細胞の存在が証明されている1,2).がん幹細胞は腫瘍の起源となる細胞であり,化学療法や放射線療法に対し高い抵抗性をもつため,再発や転移の原因になると考えられている3).がんの根治にはこのがん幹細胞を標的にすることが重要である.白血病幹細胞はCD34陽性CD38陰性の画分に多く存在するが,正常な造血幹細胞も同様の免疫表現型をもつ.白血病幹細胞を標的とした治療においては,白血病幹細胞と正常な造血幹細胞とを区別する必要がある.白血病はがん幹細胞の研究がもっとも進んでいる腫瘍のひとつであり,これまでに白血病幹細胞のマーカーが多く同定されている.今回,筆者らは,白血病のなかでも非常に予後の悪いもののひとつであるMLL遺伝子の再構成をともなう急性骨髄性白血病において,白血病幹細胞に特異的に発現する細胞表面抗原としてCD93を同定した.
MLL遺伝子の再構成をともなう急性骨髄性白血病のモデルマウスを用いて,白血病幹細胞が濃縮される画分を同定するため,蛍光フローサイトメーターによりさまざまな細胞の画分を純化し限界希釈法を用いて同系のマウスに移植する実験を行った.その結果,顆粒球-マクロファージ前駆細胞の画分に白血病幹細胞が濃縮されていることがわかった.マイクロアレイを用いた遺伝子発現プロファイルの解析により,急性骨髄性白血病モデルマウスと正常なマウスとのあいだで顆粒球-マクロファージ前駆細胞の画分における遺伝子発現を比較したところ,MLL遺伝子の再構成を含むHox遺伝子に関連する白血病において特異的な細胞表面抗原として,既知のCD47 4,5) とともに,CD93が高く発現していることが見い出された.CD93の発現はMLL遺伝子の再編成によりその下流に存在するMeis1遺伝子により誘導されることもわかった.CD93はC型レクチン膜貫通型受容体であり,貪食作用,炎症,細胞接着に関与すると考えられているが,いまだ不明な点が多い.
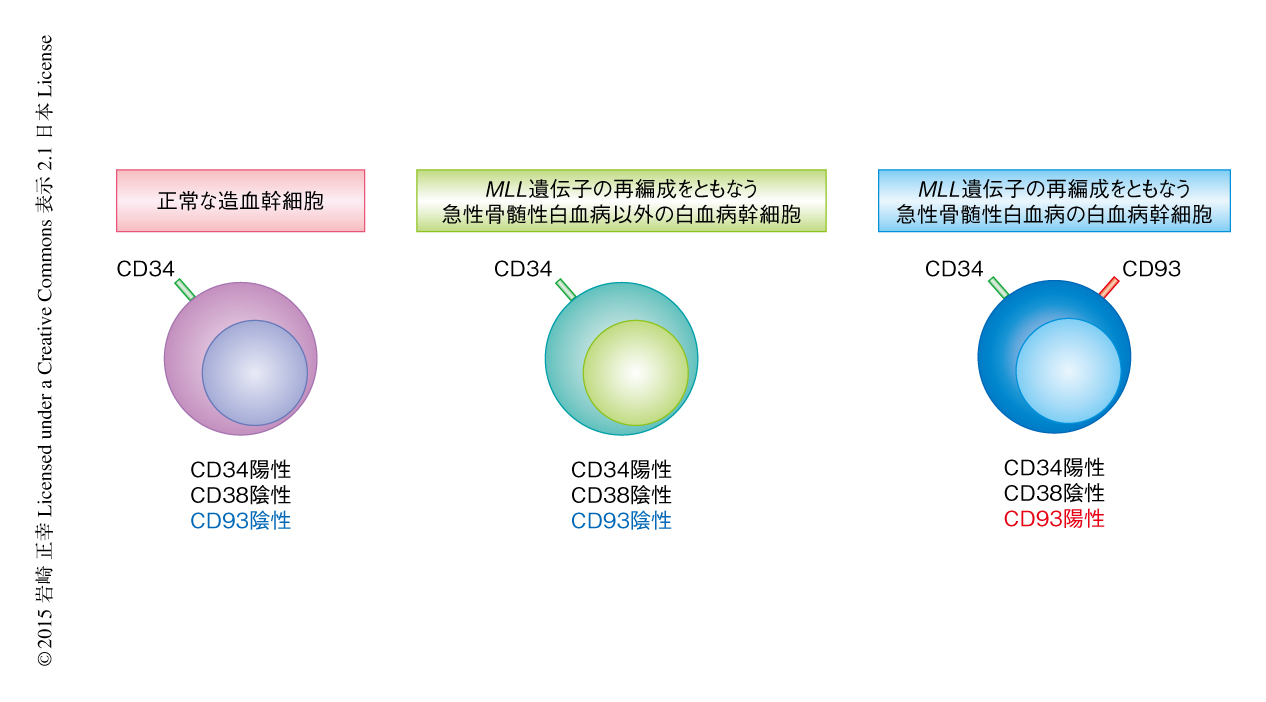
MLL遺伝子の再構成をともなう急性骨髄性白血病の患者の試料を用いて,蛍光フローサイトメーターによりCD34陽性CD38陰性の白血病幹細胞の画分におけるCD93の発現を解析したところ,CD93はCD34陽性CD38陰性の細胞に特異的に高く発現していた.一方,正常な造血幹細胞およびMLL遺伝子の再構成をともなう急性骨髄性白血病以外の急性骨髄性白血病において,CD93はCD34陽性CD38陰性の細胞には発現していなかった(図1).
機能的な白血病幹細胞がCD93を発現しているかどうかを評価するため,ヒトのMLL遺伝子再構成をともなう急性骨髄性白血病の細胞からCD34陽性CD38陰性CD93陽性の細胞およびCD34陽性CD38陰性CD93陰性の細胞を純化してコロニーアッセイを行った.その結果,CD34陽性CD38陰性CD93陽性の細胞はCD34陽性CD38陰性CD93陰性の細胞に比べ10倍以上のコロニー形成能をもつことがわかった.MLL遺伝子の再構成をともなう急性骨髄性白血病の白血病幹細胞がCD93陽性細胞の集団に濃縮されるかどうかを確認するため,限界希釈法を用いて免疫不全マウスに異種移植したときにヒトの急性骨髄性白血病がマウスにおいて再構築されるかどうか調べた.その結果,MLL遺伝子の再構成をともなう急性骨髄性白血病の患者に由来するCD34陽性CD38陰性CD93陽性の細胞は,CD34陽性CD38陰性CD93陰性の細胞に比べ,白血病の再構築能は少なくても100倍以上も高いことがわかった.さらに,移植ののち急性骨髄性白血病を発症したマウスの骨髄からCD34陽性CD38陰性CD93陽性の細胞を純化してマウスに2次移植したところ,同様に急性骨髄性白血病の発症が確認された.このことから,これまで,白血病幹細胞の濃縮した画分であると報告されていたCD34陽性CD38陰性の画分からCD93陽性の細胞を分離することにより,白血病幹細胞をさらに濃縮できることが示された.
MLL遺伝子の再構成をともなう急性骨髄性白血病の白血病幹細胞においてCD93の発現と相関する遺伝子を同定する目的で,同一の患者に由来する白血病幹細胞のCD34陽性CD38陰性CD93陽性の画分および白血病幹細胞を除去したCD34陽性CD38陰性CD93陰性の画分を純化し,マイクロアレイを用いて遺伝子発現プロファイルを解析した.その結果,遺伝子オントロジー解析およびGSEA(gene set enrichment analysis)解析により,白血病幹細胞の画分の細胞は細胞周期に関連する遺伝子の発現が有意に亢進していることが明らかにされた.つまり,MLL遺伝子の再構成をともなう急性骨髄性白血病の白血病幹細胞においては,細胞周期にはたらく遺伝子が差次的に発現していることがわかった.以前に筆者らは,白血病モデルマウスにおいて,MLL遺伝子の再編成により誘導された白血病幹細胞は細胞周期が必ずしも静止期にはないことを報告しており6),今回,実際のヒトの白血病においてもこのことが示唆された.
この結果を確認するため,MLL遺伝子の再構成をともなうヒトの急性骨髄性白血病の細胞を使用して,蛍光フローサイトメーターを用いて細胞周期を解析した.その結果,これまでの報告と一致して,急性骨髄性白血病において白血病幹細胞の濃縮される画分であるCD34陽性CD38陰性の画分においては静止期が優位であった.しかしながら,このCD34陽性CD38陰性の画分をさらにCD93の発現の有無により分画したところ,マイクロアレイ法による結果を裏づけるように,CD34陽性CD38陰性CD93陽性の画分はCD34陽性CD38陰性CD93陰性の画分に比べ,G1期が優位に亢進していた.CD34陽性CD38陰性CD93陽性の画分をG1期の細胞と静止期の細胞とに分画して純化しコロニーアッセイを行ったところ,G1期の細胞は静止期の細胞に比べコロニー形成能が約30倍も高かった.これとは対照的に,CD34陽性CD38陰性の正常な造血幹細胞においては,むしろ静止期の細胞のほうがコロニー形成能が高かった.
ヒトのMLL遺伝子の再構成をともなう急性骨髄性白血病に由来するCD34陽性CD38陰性CD93陽性の細胞からG1期の細胞および静止期の細胞を純化して免疫不全マウスへ異種移植し,白血病の再構築能を比較した.その結果,G1期の細胞は静止期の細胞に比べ白血病の再構築能が高いとともに,白血病の発症までの期間が有意に短かった.一方,ヒトのMLL遺伝子の再構成をともなう急性骨髄性白血病以外の急性骨髄性白血病の細胞ではCD34陽性CD38陰性のG1期の細胞を移植しても白血病を発症せず,CD34陽性CD38陰性の静止期の細胞にのみ白血病の発症能が確認された.以上の結果から,MLL遺伝子の再構成をともなう急性骨髄性白血病以外の急性骨髄性白血病の白血病幹細胞やがん幹細胞は全般的に細胞周期が静止期にあるのとは対照的に,MLL遺伝子の再構成をともなう急性骨髄性白血病の白血病幹細胞は細胞周期が非静止期にあることが証明された.
CD93の発現がMLL遺伝子の再構成をともなう急性骨髄性白血病の維持にどのような影響をおよぼすのかを明らかにするため,ヒトのMLL遺伝子の再構成をともなう急性骨髄性白血病の細胞においてshRNAによりCD93をノックダウンしたところ,コロニー形成能がいちじるしく低下し,白血病細胞の形態は未分化な細胞から最終分化した細胞に変化していた.これとは対照的に,正常な造血幹細胞はCD93をノックダウンさせてもコロニー形成能に差異は生じなかった.CD93をノックダウンさせたヒトのMLL遺伝子の再構成をともなう急性骨髄性白血病の細胞を免疫不全マウスへ異種移植して白血病の再構築能を調べたところ,CD93をノックダウンした細胞はマウスにおいて白血病を再構築しなかった.一方,ヒトのMLL遺伝子の再構成をともなう急性骨髄性白血病以外の急性骨髄性白血病の細胞は,CD93をノックダウンしてもマウスにおいて白血病を再構築した.このことから,CD93はMLL遺伝子の再構成をともなう急性骨髄性白血病の発症および維持に必須であることが明らかにされた.
MLL遺伝子の再構成をともなう急性骨髄性白血病モデルマウスにおいて,急性骨髄性白血病の発症におけるCD93の役割について調べた.マウスのMLL遺伝子の再構成をともなう急性骨髄性白血病の細胞においてCD93をノックダウンすると,ヒトの場合と同様に,コロニー形成能が顕著に低下し,この細胞を同系のマウスに移植しても白血病を発症しなかった.これらの細胞を使用して蛍光フローサイトメーターを用いて細胞周期を解析したところ,CD93をノックダウンした細胞の細胞周期はG1期から静止期に移行していた.この現象はヒトのMLL遺伝子の再構成をともなう急性骨髄性白血病の細胞においてCD93をノックダウンしたときにも観察された.これらの結果から,CD93はMLL遺伝子の再構成をともなう急性骨髄性白血病細胞において細胞周期を制御する重要な役割をはたすことが示唆された.
定量PCR法により細胞周期に関連する遺伝子の発現について調べたところ,MLL遺伝子の再構成をともなう急性骨髄性白血病の細胞においてCD93をノックダウンすると,サイクリン依存性キナーゼの阻害タンパク質であるCDKN2Bの発現が顕著に亢進することがわかった.この結果は,CD93がCDKN2Bの発現を機能的に抑制し,白血病幹細胞の自己複製能を促進させるため細胞周期が静止期にあることをさまたげている可能性を示唆した.この仮説を検証するため,CDKN2Bノックアウトマウスにおいては,CD93のノックダウンによるコロニー形成能の低下および静止期への移行が回避されるかどうかを検討した.その結果,MLL遺伝子の再編成により不死化させたCDKN2B欠損細胞は,野生型の細胞に比べCD93のノックダウンによるコロニー形成能の低下が大きく改善された.細胞周期の解析においても,CDKN2B欠損細胞においてはCD93のノックダウンによる静止期への移行が回避されていた.この細胞を同系のマウスに移植したところ,野生型の細胞の移植に比べ,白血病の発症までの期間にわずかな延長はみられたものの,すべての例において白血病を発症した.これらの結果と一致して,逆に,MLL遺伝子の再構成をともなう急性骨髄性白血病の細胞においてCDKN2Bを過剰に発現させると分化が誘導され,コロニー形成能が顕著に低下し,この細胞を同系のマウスに移植しても白血病を発症しなかった.
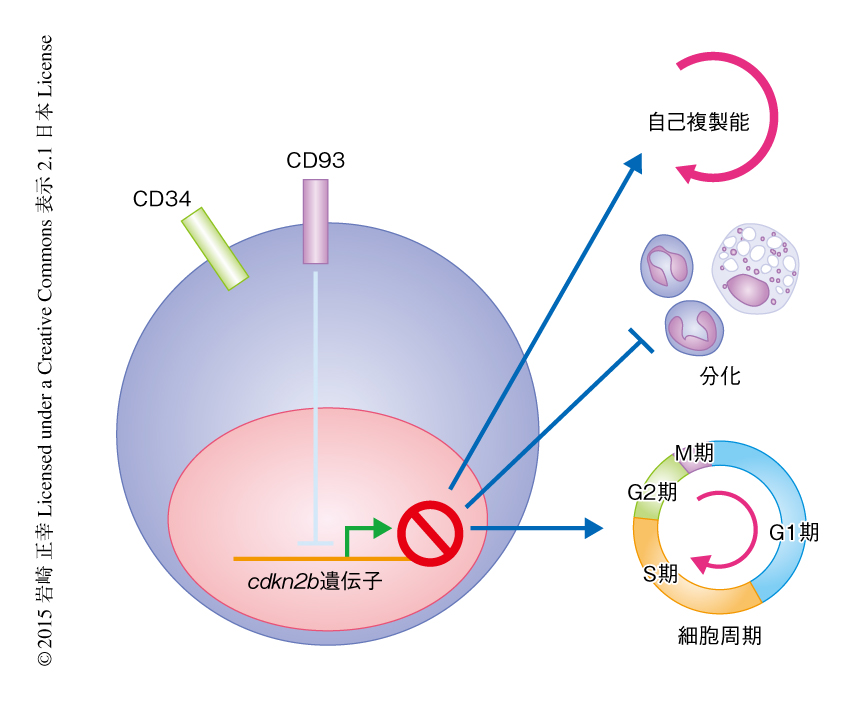
以上の結果から,CD93はCDKN2Bの発現を抑制することによりMLL遺伝子の再構成をともなう急性骨髄性白血病の白血病幹細胞において白血病の発症能を維持していることが明らかにされた(図2).白血病において遺伝子の変異やエピジェネティックな異常によるCDKN2Bの不活性化が報告されているが7-10),今回の発見はCDKN2Bの新しい不活性化の機構を示すものであり,新規の治療法の開発につながるものと考えられた.
今回の研究により,予後不良の白血病のひとつであるMLL遺伝子の再構成をともなう急性骨髄性白血病において,白血病幹細胞に特異的に高く発現する細胞表面抗原CD93を同定し,その機能を明らかにした.この研究の結果は,MLL遺伝子の再構成をともなう急性骨髄性白血病において,CD93を標的とする分子標的治療法の開発および微少残存白血病細胞の検出による予後予測マーカーの可能性に寄与するものと考えられ,今後の展開が期待される.
略歴:2001年 大阪大学大学院医学研究科博士課程 修了,同年 癌研究会癌研究所 研究員,2004年 米国Stanford大学School of MedicineにてPostdoctoral fellowを経て,2009年より同 研究員.
研究テーマ:急性骨髄性白血病の分子病態,とくに,白血病におけるMEIS1の分子機構.
抱負:CD93を標的とした分子標的治療法の開発.
© 2015 岩崎 正幸 Licensed under CC 表示 2.1 日本
(米国Stanford大学School of Medicine,Department of Pathology)
email:岩崎正幸
DOI: 10.7875/first.author.2015.126
CD93 marks a non-quiescent human leukemia stem cell population and is required for development of MLL-rearranged acute myeloid leukemia.
Masayuki Iwasaki, Michaela Liedtke, Andrew J. Gentles, Michael L. Cleary
Cell Stem Cell, 17, 412-421 (2015)
要 約
正常な造血幹細胞と白血病幹細胞は,免疫表現型,細胞周期が静止期にあること,自己複製能をもつことなど,多くの特徴を共有する.このことは,正常な造血幹細胞を傷害することなく白血病幹細胞だけを根絶させる治療法の開発を困難にしている.筆者らは,MLL遺伝子の再構成をともなう急性骨髄性白血病の白血病幹細胞において,細胞表面抗原CD93が特異的に発現していることを見い出した.通常,CD34陽性CD38陰性の白血病幹細胞は細胞周期が静止期にあるが,MLL遺伝子の再構成をともなう急性骨髄性白血病においてCD34陽性CD38陰性CD93陽性の白血病幹細胞は細胞周期が非静止期にあった.さらに,CD93は機能的にもMLL遺伝子の再構成をともなう急性骨髄性白血病の発症に必須であり,サイクリン依存性キナーゼの阻害タンパク質であるCDKN2Bの発現を抑制することにより白血病幹細胞の自己複製能を制御していることが明らかにされた.
はじめに
近年,白血病をはじめとするさまざまな腫瘍においてがん幹細胞の存在が証明されている1,2).がん幹細胞は腫瘍の起源となる細胞であり,化学療法や放射線療法に対し高い抵抗性をもつため,再発や転移の原因になると考えられている3).がんの根治にはこのがん幹細胞を標的にすることが重要である.白血病幹細胞はCD34陽性CD38陰性の画分に多く存在するが,正常な造血幹細胞も同様の免疫表現型をもつ.白血病幹細胞を標的とした治療においては,白血病幹細胞と正常な造血幹細胞とを区別する必要がある.白血病はがん幹細胞の研究がもっとも進んでいる腫瘍のひとつであり,これまでに白血病幹細胞のマーカーが多く同定されている.今回,筆者らは,白血病のなかでも非常に予後の悪いもののひとつであるMLL遺伝子の再構成をともなう急性骨髄性白血病において,白血病幹細胞に特異的に発現する細胞表面抗原としてCD93を同定した.
1.MLL遺伝子の再構成をともなう急性骨髄性白血病における白血病幹細胞に特異的な細胞表面抗原CD93の同定
MLL遺伝子の再構成をともなう急性骨髄性白血病のモデルマウスを用いて,白血病幹細胞が濃縮される画分を同定するため,蛍光フローサイトメーターによりさまざまな細胞の画分を純化し限界希釈法を用いて同系のマウスに移植する実験を行った.その結果,顆粒球-マクロファージ前駆細胞の画分に白血病幹細胞が濃縮されていることがわかった.マイクロアレイを用いた遺伝子発現プロファイルの解析により,急性骨髄性白血病モデルマウスと正常なマウスとのあいだで顆粒球-マクロファージ前駆細胞の画分における遺伝子発現を比較したところ,MLL遺伝子の再構成を含むHox遺伝子に関連する白血病において特異的な細胞表面抗原として,既知のCD47 4,5) とともに,CD93が高く発現していることが見い出された.CD93の発現はMLL遺伝子の再編成によりその下流に存在するMeis1遺伝子により誘導されることもわかった.CD93はC型レクチン膜貫通型受容体であり,貪食作用,炎症,細胞接着に関与すると考えられているが,いまだ不明な点が多い.
MLL遺伝子の再構成をともなう急性骨髄性白血病の患者の試料を用いて,蛍光フローサイトメーターによりCD34陽性CD38陰性の白血病幹細胞の画分におけるCD93の発現を解析したところ,CD93はCD34陽性CD38陰性の細胞に特異的に高く発現していた.一方,正常な造血幹細胞およびMLL遺伝子の再構成をともなう急性骨髄性白血病以外の急性骨髄性白血病において,CD93はCD34陽性CD38陰性の細胞には発現していなかった(図1).
2.CD93はMLL遺伝子の再構成をともなう急性骨髄性白血病の機能的な白血病幹細胞のマーカーである
機能的な白血病幹細胞がCD93を発現しているかどうかを評価するため,ヒトのMLL遺伝子再構成をともなう急性骨髄性白血病の細胞からCD34陽性CD38陰性CD93陽性の細胞およびCD34陽性CD38陰性CD93陰性の細胞を純化してコロニーアッセイを行った.その結果,CD34陽性CD38陰性CD93陽性の細胞はCD34陽性CD38陰性CD93陰性の細胞に比べ10倍以上のコロニー形成能をもつことがわかった.MLL遺伝子の再構成をともなう急性骨髄性白血病の白血病幹細胞がCD93陽性細胞の集団に濃縮されるかどうかを確認するため,限界希釈法を用いて免疫不全マウスに異種移植したときにヒトの急性骨髄性白血病がマウスにおいて再構築されるかどうか調べた.その結果,MLL遺伝子の再構成をともなう急性骨髄性白血病の患者に由来するCD34陽性CD38陰性CD93陽性の細胞は,CD34陽性CD38陰性CD93陰性の細胞に比べ,白血病の再構築能は少なくても100倍以上も高いことがわかった.さらに,移植ののち急性骨髄性白血病を発症したマウスの骨髄からCD34陽性CD38陰性CD93陽性の細胞を純化してマウスに2次移植したところ,同様に急性骨髄性白血病の発症が確認された.このことから,これまで,白血病幹細胞の濃縮した画分であると報告されていたCD34陽性CD38陰性の画分からCD93陽性の細胞を分離することにより,白血病幹細胞をさらに濃縮できることが示された.
3.MLL遺伝子の再構成をともなう急性骨髄性白血病においてCD93陽性の白血病幹細胞は細胞周期が非静止期にある
MLL遺伝子の再構成をともなう急性骨髄性白血病の白血病幹細胞においてCD93の発現と相関する遺伝子を同定する目的で,同一の患者に由来する白血病幹細胞のCD34陽性CD38陰性CD93陽性の画分および白血病幹細胞を除去したCD34陽性CD38陰性CD93陰性の画分を純化し,マイクロアレイを用いて遺伝子発現プロファイルを解析した.その結果,遺伝子オントロジー解析およびGSEA(gene set enrichment analysis)解析により,白血病幹細胞の画分の細胞は細胞周期に関連する遺伝子の発現が有意に亢進していることが明らかにされた.つまり,MLL遺伝子の再構成をともなう急性骨髄性白血病の白血病幹細胞においては,細胞周期にはたらく遺伝子が差次的に発現していることがわかった.以前に筆者らは,白血病モデルマウスにおいて,MLL遺伝子の再編成により誘導された白血病幹細胞は細胞周期が必ずしも静止期にはないことを報告しており6),今回,実際のヒトの白血病においてもこのことが示唆された.
この結果を確認するため,MLL遺伝子の再構成をともなうヒトの急性骨髄性白血病の細胞を使用して,蛍光フローサイトメーターを用いて細胞周期を解析した.その結果,これまでの報告と一致して,急性骨髄性白血病において白血病幹細胞の濃縮される画分であるCD34陽性CD38陰性の画分においては静止期が優位であった.しかしながら,このCD34陽性CD38陰性の画分をさらにCD93の発現の有無により分画したところ,マイクロアレイ法による結果を裏づけるように,CD34陽性CD38陰性CD93陽性の画分はCD34陽性CD38陰性CD93陰性の画分に比べ,G1期が優位に亢進していた.CD34陽性CD38陰性CD93陽性の画分をG1期の細胞と静止期の細胞とに分画して純化しコロニーアッセイを行ったところ,G1期の細胞は静止期の細胞に比べコロニー形成能が約30倍も高かった.これとは対照的に,CD34陽性CD38陰性の正常な造血幹細胞においては,むしろ静止期の細胞のほうがコロニー形成能が高かった.
ヒトのMLL遺伝子の再構成をともなう急性骨髄性白血病に由来するCD34陽性CD38陰性CD93陽性の細胞からG1期の細胞および静止期の細胞を純化して免疫不全マウスへ異種移植し,白血病の再構築能を比較した.その結果,G1期の細胞は静止期の細胞に比べ白血病の再構築能が高いとともに,白血病の発症までの期間が有意に短かった.一方,ヒトのMLL遺伝子の再構成をともなう急性骨髄性白血病以外の急性骨髄性白血病の細胞ではCD34陽性CD38陰性のG1期の細胞を移植しても白血病を発症せず,CD34陽性CD38陰性の静止期の細胞にのみ白血病の発症能が確認された.以上の結果から,MLL遺伝子の再構成をともなう急性骨髄性白血病以外の急性骨髄性白血病の白血病幹細胞やがん幹細胞は全般的に細胞周期が静止期にあるのとは対照的に,MLL遺伝子の再構成をともなう急性骨髄性白血病の白血病幹細胞は細胞周期が非静止期にあることが証明された.
4.CD93はMLL遺伝子の再構成をともなう急性骨髄性白血病の発症に必須である
CD93の発現がMLL遺伝子の再構成をともなう急性骨髄性白血病の維持にどのような影響をおよぼすのかを明らかにするため,ヒトのMLL遺伝子の再構成をともなう急性骨髄性白血病の細胞においてshRNAによりCD93をノックダウンしたところ,コロニー形成能がいちじるしく低下し,白血病細胞の形態は未分化な細胞から最終分化した細胞に変化していた.これとは対照的に,正常な造血幹細胞はCD93をノックダウンさせてもコロニー形成能に差異は生じなかった.CD93をノックダウンさせたヒトのMLL遺伝子の再構成をともなう急性骨髄性白血病の細胞を免疫不全マウスへ異種移植して白血病の再構築能を調べたところ,CD93をノックダウンした細胞はマウスにおいて白血病を再構築しなかった.一方,ヒトのMLL遺伝子の再構成をともなう急性骨髄性白血病以外の急性骨髄性白血病の細胞は,CD93をノックダウンしてもマウスにおいて白血病を再構築した.このことから,CD93はMLL遺伝子の再構成をともなう急性骨髄性白血病の発症および維持に必須であることが明らかにされた.
5.CD93はMLL遺伝子の再構成をともなう急性骨髄性白血病において白血病幹細胞の自己複製能を制御する
MLL遺伝子の再構成をともなう急性骨髄性白血病モデルマウスにおいて,急性骨髄性白血病の発症におけるCD93の役割について調べた.マウスのMLL遺伝子の再構成をともなう急性骨髄性白血病の細胞においてCD93をノックダウンすると,ヒトの場合と同様に,コロニー形成能が顕著に低下し,この細胞を同系のマウスに移植しても白血病を発症しなかった.これらの細胞を使用して蛍光フローサイトメーターを用いて細胞周期を解析したところ,CD93をノックダウンした細胞の細胞周期はG1期から静止期に移行していた.この現象はヒトのMLL遺伝子の再構成をともなう急性骨髄性白血病の細胞においてCD93をノックダウンしたときにも観察された.これらの結果から,CD93はMLL遺伝子の再構成をともなう急性骨髄性白血病細胞において細胞周期を制御する重要な役割をはたすことが示唆された.
定量PCR法により細胞周期に関連する遺伝子の発現について調べたところ,MLL遺伝子の再構成をともなう急性骨髄性白血病の細胞においてCD93をノックダウンすると,サイクリン依存性キナーゼの阻害タンパク質であるCDKN2Bの発現が顕著に亢進することがわかった.この結果は,CD93がCDKN2Bの発現を機能的に抑制し,白血病幹細胞の自己複製能を促進させるため細胞周期が静止期にあることをさまたげている可能性を示唆した.この仮説を検証するため,CDKN2Bノックアウトマウスにおいては,CD93のノックダウンによるコロニー形成能の低下および静止期への移行が回避されるかどうかを検討した.その結果,MLL遺伝子の再編成により不死化させたCDKN2B欠損細胞は,野生型の細胞に比べCD93のノックダウンによるコロニー形成能の低下が大きく改善された.細胞周期の解析においても,CDKN2B欠損細胞においてはCD93のノックダウンによる静止期への移行が回避されていた.この細胞を同系のマウスに移植したところ,野生型の細胞の移植に比べ,白血病の発症までの期間にわずかな延長はみられたものの,すべての例において白血病を発症した.これらの結果と一致して,逆に,MLL遺伝子の再構成をともなう急性骨髄性白血病の細胞においてCDKN2Bを過剰に発現させると分化が誘導され,コロニー形成能が顕著に低下し,この細胞を同系のマウスに移植しても白血病を発症しなかった.
以上の結果から,CD93はCDKN2Bの発現を抑制することによりMLL遺伝子の再構成をともなう急性骨髄性白血病の白血病幹細胞において白血病の発症能を維持していることが明らかにされた(図2).白血病において遺伝子の変異やエピジェネティックな異常によるCDKN2Bの不活性化が報告されているが7-10),今回の発見はCDKN2Bの新しい不活性化の機構を示すものであり,新規の治療法の開発につながるものと考えられた.
おわりに
今回の研究により,予後不良の白血病のひとつであるMLL遺伝子の再構成をともなう急性骨髄性白血病において,白血病幹細胞に特異的に高く発現する細胞表面抗原CD93を同定し,その機能を明らかにした.この研究の結果は,MLL遺伝子の再構成をともなう急性骨髄性白血病において,CD93を標的とする分子標的治療法の開発および微少残存白血病細胞の検出による予後予測マーカーの可能性に寄与するものと考えられ,今後の展開が期待される.
文 献
- Lapidot, T., Sirard, C., Vormoor, J. et al.: A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature, 367, 645-648 (1994)[PubMed]
- Bonnet, D. & Dick, J. E.: Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med., 3, 730-737 (1997)[PubMed]
- Jordan, C. T., Guzman, M. L. & Noble, M.: Cancer stem cells. N. Engl. J. Med., 355, 1253-1261 (2006)[PubMed]
- Jaiswal, S., Jamieson, C. H., Pang, W. W. et al.: CD47 is upregulated on circulating hematopoietic stem cells and leukemia cells to avoid phagocytosis. Cell, 138, 271-285 (2009)[PubMed]
- Majeti, R., Chao, M. P., Alizadeh, A. A. et al.: CD47 is an adverse prognostic factor and therapeutic antibody target on human acute myeloid leukemia stem cells. Cell, 138, 286-299 (2009)[PubMed]
- Somervaille, T. C. P., Matheny, C. J., Spencer, G. J. et al.: Hierarchical maintenance of MLL myeloid leukemia stem cells employs a transcriptional program shared with embryonic rather than adult stem cells. Cell Stem Cell, 4, 129-140 (2009)[PubMed]
- Herman, J. G., Jen, J., Merlo, A. et al.: Hypermethylation-associated inactivation indicates a tumor suppressor role for p15INK4B1. Cancer Res., 56, 722-727 (1996)[PubMed]
- Drexler, H. G.: Review of alterations of the cyclin-dependent kinase inhibitor INK4 family genes p15, p16, p18 and p19 in human leukemia-lymphoma cells. Leukemia, 12, 845-859 (1998)[PubMed]
- Chim, C. S., Liang, R., Tam, C. Y. Y. et al.: Methylation of p15 and p16 genes in acute promyelocytic leukemia: potential diagnostic and prognostic significance. J. Clin. Oncol., 19, 2033-2040 (2001)[PubMed]
- Krug, U., Ganser, A. & Koeffler, H. P. et al.: Tumor suppressor genes in normal and malignant hematopoiesis. Oncogene, 21, 3475-3495 (2002)[PubMed]
著者プロフィール
略歴:2001年 大阪大学大学院医学研究科博士課程 修了,同年 癌研究会癌研究所 研究員,2004年 米国Stanford大学School of MedicineにてPostdoctoral fellowを経て,2009年より同 研究員.
研究テーマ:急性骨髄性白血病の分子病態,とくに,白血病におけるMEIS1の分子機構.
抱負:CD93を標的とした分子標的治療法の開発.
© 2015 岩崎 正幸 Licensed under CC 表示 2.1 日本