AMP活性化キナーゼは急性骨髄性白血病の骨髄において代謝ストレスから白血病幹細胞を保護する
齋藤祐介・中田大介
(米国Baylor College of Medicine,Department of Molecular and Human Genetics)
email:齋藤祐介
DOI: 10.7875/first.author.2015.125
AMPK protects leukemia-initiating cells in myeloid leukemias from metabolic stress in the bone marrow.
Yusuke Saito, Richard H. Chapple, Angelique Lin, Ayumi Kitano, Daisuke Nakada
Cell Stem Cell, 17, 585-596 (2015)
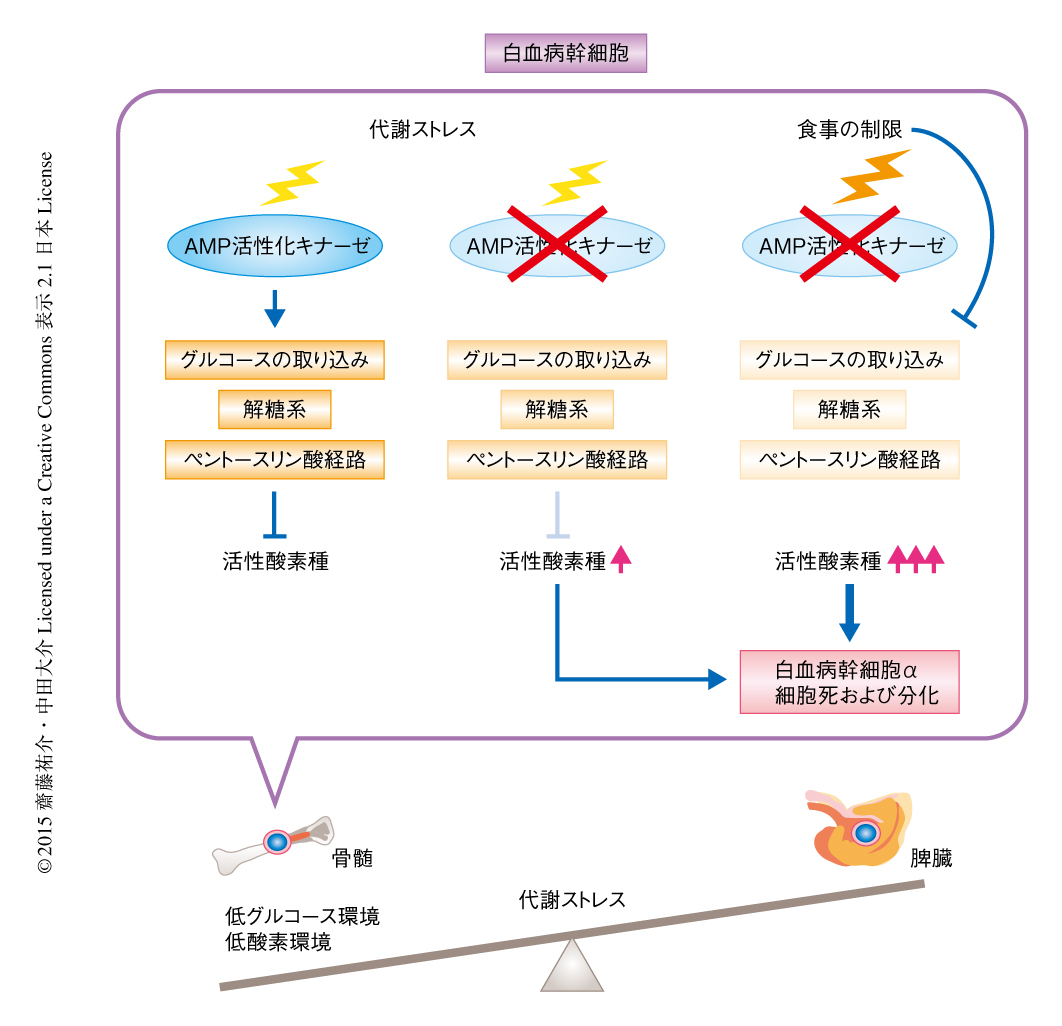
がん細胞が代謝にとり厳しい環境にどのように適応し,過酷な環境をどのように克服して増殖しているのか,これはがんの生物学の根底にある疑問である.筆者らは,AMP活性化キナーゼが白血病幹細胞に代謝ストレスに対する抵抗性をあたえ,白血病の発症を促進していることを見い出した.食事を制限した急性骨髄性白血病のモデルマウスにおいて,AMP活性化キナーゼを活性化させることにより白血病の発症能は維持された.さらに,AMP活性化キナーゼを欠損させると白血病の発症能は有意に低下し,Glut1の発現の低下によるグルコース取り込みの減少,解糖系の抑制,酸化ストレスの蓄積によるDNAの損傷がひき起こされることにより白血病幹細胞はいちじるしく減少した.低グルコース環境である骨髄においては,白血病幹細胞における酸化ストレスの抑制能の多くはAMP活性化キナーゼに依存していた.さらに,AMP活性化キナーゼの阻害は食事の制限という生理学的な代謝ストレスとの相乗効果により,急性骨髄性白血病の発症をさらに効果的に抑制した.これらの結果から,AMP活性化キナーゼは白血病幹細胞を代謝ストレスから保護し,AMP活性化キナーゼの阻害と食事制限との併用により酸化ストレスおよびDNAの損傷をひき起こすことで,急性骨髄性白血病を抑制できることが明らかにされた.
がん細胞がどのように低栄養あるいは低グルコースといった厳しい環境に適応し増殖しているのか解き明かすことは,がんの分子生物学においてきわめて重要な課題である.食事の制限によりインスリン,IGF-1,グルコースといった代謝のパラメーターが変化し腫瘍の増殖が抑制されることが報告されている1).一方で,いくつかのがんにおいてはPI3K-Akt経路を活性化する変異により,低インスリン環境あるいは低IGF-1環境における感受性が低下し食事の制限に抵抗性を示すことが報告された2).しかし,これまで,PI3Kに非依存的な代謝ストレスからの保護の機構,さらには,がん幹細胞による代謝ストレスの制御の機構については明らかにされていなかった.
この研究において着目したAMP活性化キナーゼは,異化を促進し同化を抑制することにより代謝の恒常性を維持するタンパク質である3).代謝ストレスによりAMPとATPの比が上昇することによりLkb1のリン酸化に依存してAMP活性化キナーゼが活性化し4),グルコース輸送体であるGlut1やGlut4の亢進5),解糖系の亢進6),脂肪酸の酸化の亢進3) により異化が促進される.また,AMP活性化キナーゼは腫瘍の増殖に関与するmTOR経路を抑制し7),AMP活性化キナーゼの活性化剤は腫瘍を抑制する効果をもつことから,がん抑制遺伝子産物としての側面が報告されている4).一方で,AMP活性化キナーゼは活性酸素種の恒常性の制御によりがん細胞の生存に寄与していることも明らかにされた8).このように,がん細胞におけるAMP活性化キナーゼの機能については解明されていない部分がある.そこで,筆者らは,急性骨髄性白血病のモデルマウスを用いて代謝ストレスのもとでのAMP活性化キナーゼの機能を解析した.
食事の制限による代謝ストレスが急性骨髄性白血病細胞にどのように影響するかを検討するため,急性骨髄性白血病のモデルマウスを対照群と30%カロリー制限群に分けて生存日数を比較したが,有意差は認められなかった.これまで,PI3K-Akt経路が活性化している腫瘍は食事の制限に抵抗性であることが報告されていたが,この急性骨髄性白血病モデルマウスの白血病幹細胞においてAktは抑制されており,ほかの代謝制御機構が関与していることが示唆された.そこで,食事を制限した急性骨髄性白血病モデルマウスから白血病細胞を分離し,いくつかの代謝制御タンパク質の活性を評価したところ,AMP活性化キナーゼが骨髄においていちじるしく活性化していることが見い出された.
急性骨髄性白血病におけるAMP活性化キナーゼの機能を明らかにするため,骨髄系細胞において特異的にAMP活性化キナーゼを欠損させた骨髄前駆細胞および骨髄幹細胞にレトロウイルスベクターを用いてMLL-AF9遺伝子を導入しマウスに移植した.野生型の細胞の移植においてはすべての例において急性骨髄性白血病が発症し移植ののち130日以内に死亡したのに対し,AMP活性化キナーゼを欠損した細胞の移植においては生存期間が有意に延長した.AMP活性化キナーゼを欠損した細胞の移植においても骨髄や末梢血には白血病細胞が確認されたものの,野生型の細胞の移植と比較して白血病細胞の増殖は有意に抑制されていた.ほかの白血病モデルマウスを用いた解析においても同様に,AMP活性化キナーゼを欠損した細胞の移植により白血病の発症は抑制された.急性骨髄性白血病を発症したマウスから白血病細胞を採取して2次移植および3次移植をしたところ,AMP活性化キナーゼを欠損した細胞を移植したマウスの白血病細胞は白血病の発症能がいちじるしく低下していた.さらに,AMP活性化キナーゼを欠損した細胞を移植することにより急性骨髄性白血病を発症したマウスを解析したところ,白血病の発症能のもっとも高い顆粒球-マクロファージ前駆細胞様白血病細胞9) が著明に減少していた.AMP活性化キナーゼを欠損した細胞を移植したマウスの顆粒球-マクロファージ前駆細胞様白血病細胞においては形態学的および遺伝子発現パターンにより細胞分化の傾向が認められ,さらに,同数の顆粒球-マクロファージ前駆細胞様白血病細胞を分離して2次移植をしてもAMP活性化キナーゼを欠損した細胞を移植したマウスからの細胞においては発症が有意に抑制された.このことから,AMP活性化キナーゼは顆粒球-マクロファージ前駆細胞様白血病細胞の分化を抑制し,急性骨髄性白血病の発症および顆粒球-マクロファージ前駆細胞様白血病細胞のプールの維持に促進的に寄与していることが明らかにされた.
急性骨髄性白血病を発症したのちAMP活性化キナーゼを欠損させるマウスのモデルを樹立し解析した.骨髄前駆細胞および骨髄幹細胞を移植したマウスから白血病細胞を分離し,2次移植したのち14日目にAMP活性化キナーゼを欠損させたところ,骨髄において顆粒球-マクロファージ前駆細胞様白血病細胞は有意に減少し生存期間も延長した.この結果から,AMP活性化キナーゼは急性骨髄性白血病を発症したのちの顆粒球-マクロファージ前駆細胞様白血病細胞の維持においても重要であることが示された.
この2つの実験系においては,いずれも骨髄において顆粒球-マクロファージ前駆細胞様白血病細胞の有意な減少が認められ,脾臓における効果は限定的であった.そのため,AMP活性化キナーゼは骨髄における顆粒球-マクロファージ前駆細胞様白血病細胞の維持により重要であることが示唆された.
AMP活性化キナーゼを欠損した顆粒球-マクロファージ前駆細胞様白血病細胞においてはカスパーゼに依存的なアポトーシスによる細胞死が増加していた.さらに,AMP活性化キナーゼの欠損により骨髄における活性酸素種の蓄積およびミトコンドリアにおける活性酸素種の産生が亢進していた.脾臓においては活性酸素種の蓄積は顕著ではなく,骨髄は酸化ストレスの高い環境であることが示された.また,活性酸素種の蓄積を反映して,NADP+/NADPH比の上昇およびGSH/GSSG比の低下が認められた.さらに,活性酸素種の蓄積した骨髄に存在する急性骨髄性白血病細胞においてはDNAの損傷がひき起こされていた.AMP活性化キナーゼの欠損による細胞死は活性酸素種によりひき起こされているのかどうかを明らかにするため,AMP活性化キナーゼを欠損した急性骨髄性白血病のモデルマウスに抗酸化剤であるTEMPOLを投与したところ,白血病細胞のアポトーシス,活性酸素種の蓄積,DNAの損傷は抑制され,発症までの期間も短縮した.この結果から,AMP活性化キナーゼの欠損による急性骨髄性白血病の発症の抑制は,活性酸素種の蓄積およびDNAの損傷による細胞死がその原因の一部であることが示された.
急性骨髄性白血病におけるAMP活性化キナーゼによるエネルギー代謝の制御について明らかにするため,グルコースの取り込みを解析した.蛍光により標識したグルコースを急性骨髄性白血病のモデルマウスに投与しフローサイトメトリーにより検出したところ,AMP活性化キナーゼを欠損した急性骨髄性白血病細胞および顆粒球-マクロファージ前駆細胞様白血病細胞においてグルコース取り込みの低下が認められた.この機序は,AMP活性化キナーゼの欠損によりグルコース輸送体Glut1の発現を抑制するTxnipのタンパク質量の増加が誘導されていることが原因であった.また,AMP活性化キナーゼを欠損した細胞にGlut1を発現させることにより,増殖能は部分的に改善した.さらに,急性骨髄性白血病のモデルマウスにおいてGlut1をノックダウンしたところ,細胞の増殖は有意に抑制された.この結果から,AMP活性化キナーゼはGlut1の発現を制御することにより急性骨髄性白血病の発症および白血病細胞におけるエネルギー代謝を維持していることが示された.
グルコースの代謝をより詳細に解析するため,13Cグルコースを用いてフラックス解析を行った.その結果,AMP活性化キナーゼを欠損した急性骨髄性白血病においては,とくに3-ホスホグリセリン酸,2-ホスホグリセリン酸,乳酸,ATP,NADHにおいて13Cの割合が低下していた.また,XFアナライザーによる解析においても解糖系のエネルギー代謝の指標が有意に低下していた.この結果から,AMP活性化キナーゼは急性骨髄性白血病においてグルコースの代謝の維持に必須であることが示された.また,ペントースリン酸経路についても同様に解析したところ,低グルコース環境にてリボース5-リン酸,キシルロース5-リン酸,セドヘプツロース7-リン酸において13Cの割合が低下しており,AMP活性化キナーゼは低グルコース環境である骨髄における抗酸化能の低下および活性酸素種の蓄積に寄与していることが示された.
食事を制限した急性骨髄性白血病のモデルマウスにおいて,AMP活性化キナーゼは脾臓よりも骨髄においていちじるしく活性化しており,急性骨髄性白血病細胞における骨髄での代謝ストレスの制御はAMP活性化キナーゼに依存すると考えられた.とくに,グルコースの濃度は末梢血や脾臓に比べ骨髄においてより低値であった.AMP活性化キナーゼを欠損した細胞をグルコースなしあるいは低濃度で培養すると細胞の生存率はいちじるしく低下し活性酸素種が蓄積した.このことから,AMP活性化キナーゼはとくに骨髄のような低グルコース環境において活性酸素種の蓄積を抑制するために必須であることが明らかにされた.さらに,AMP活性化キナーゼを欠損したマウスにおいて食事を制限したところ,生存期間が有意に延長した.一方で,AMP活性化キナーゼを欠損した正常な造血幹細胞および造血前駆細胞に変化は認められなかった.AMP活性化キナーゼは正常な造血幹細胞および急性骨髄性白血病細胞において代謝ストレスにより活性化されるものの,急性骨髄性白血病細胞ではAMP活性化キナーゼが酸化ストレス,DNAの損傷,アポトーシスの防護に寄与しており,その貢献度は非常に高いといえた.
AMP活性化キナーゼの阻害剤であるCompound Cによる急性骨髄性白血病の抑制の効果について検討した.in vitroにおける解析から,Compound Cは急性骨髄性白血病細胞の増殖を抑制しアポトーシスを誘導することが示された.さらに,その抑制の効果は顆粒球-マクロファージ前駆細胞様白血病細胞においてより高かった.急性骨髄性白血病のモデルマウスの解析においては,骨髄前駆細胞および骨髄幹細胞を移植したのち7日目からCompound Cを投与したところ生存期間が有意に延長した.さらに,食事の制限との併用によりその効果は増強した.このことから,AMP活性化キナーゼの阻害剤により代謝ストレスへの感受性を亢進させ,さらに,食事の制限によりその効果をさらに増強させることが可能であることが明らかにされた.
骨髄は代謝ストレスの非常に強い環境であるが,急性骨髄性白血病細胞は代謝の恒常性を維持することが可能である.今回の研究により,AMP活性化キナーゼは骨髄における急性骨髄性白血病細胞の維持に必須であることが見い出された(図1).そして,この機能は低グルコース環境である骨髄においてより重要であること,また,正常な造血幹細胞におけるAMP活性化キナーゼの依存度は高くはないことが示された.AMP活性化キナーゼの阻害によりグルコースの代謝を抑制することによって代謝ストレスへの脆弱性を生じさせ,さらに,食事の制限などの代謝ストレスをあたえることにより,急性骨髄性白血病細胞を死滅させることが可能であった.さらに,このAMP活性化キナーゼの阻害と食事の制限の併用は,低グルコースおよび低酸素といった過酷な環境において生存する既存の治療がむずかしい腫瘍に対し効果をもたらすかもしれない.
略歴:2011年 宮崎大学大学院医学研究科博士課程 修了,2012年 米国Baylor College of Medicine博士研究員を経て,2015年より宮崎大学医学部 講師.
研究テーマ:白血病細胞におけるストレス耐性の機構.
抱負:白血病幹細胞のさまざまなストレスに対する防御の機構を明らかにし,その機構を破綻させることにより難治性の白血病の根治をめざしたい.
中田 大介(Daisuke Nakada)
米国Baylor College of Medicine助教.
© 2015 齋藤祐介・中田大介 Licensed under CC 表示 2.1 日本
(米国Baylor College of Medicine,Department of Molecular and Human Genetics)
email:齋藤祐介
DOI: 10.7875/first.author.2015.125
AMPK protects leukemia-initiating cells in myeloid leukemias from metabolic stress in the bone marrow.
Yusuke Saito, Richard H. Chapple, Angelique Lin, Ayumi Kitano, Daisuke Nakada
Cell Stem Cell, 17, 585-596 (2015)
要 約
がん細胞が代謝にとり厳しい環境にどのように適応し,過酷な環境をどのように克服して増殖しているのか,これはがんの生物学の根底にある疑問である.筆者らは,AMP活性化キナーゼが白血病幹細胞に代謝ストレスに対する抵抗性をあたえ,白血病の発症を促進していることを見い出した.食事を制限した急性骨髄性白血病のモデルマウスにおいて,AMP活性化キナーゼを活性化させることにより白血病の発症能は維持された.さらに,AMP活性化キナーゼを欠損させると白血病の発症能は有意に低下し,Glut1の発現の低下によるグルコース取り込みの減少,解糖系の抑制,酸化ストレスの蓄積によるDNAの損傷がひき起こされることにより白血病幹細胞はいちじるしく減少した.低グルコース環境である骨髄においては,白血病幹細胞における酸化ストレスの抑制能の多くはAMP活性化キナーゼに依存していた.さらに,AMP活性化キナーゼの阻害は食事の制限という生理学的な代謝ストレスとの相乗効果により,急性骨髄性白血病の発症をさらに効果的に抑制した.これらの結果から,AMP活性化キナーゼは白血病幹細胞を代謝ストレスから保護し,AMP活性化キナーゼの阻害と食事制限との併用により酸化ストレスおよびDNAの損傷をひき起こすことで,急性骨髄性白血病を抑制できることが明らかにされた.
はじめに
がん細胞がどのように低栄養あるいは低グルコースといった厳しい環境に適応し増殖しているのか解き明かすことは,がんの分子生物学においてきわめて重要な課題である.食事の制限によりインスリン,IGF-1,グルコースといった代謝のパラメーターが変化し腫瘍の増殖が抑制されることが報告されている1).一方で,いくつかのがんにおいてはPI3K-Akt経路を活性化する変異により,低インスリン環境あるいは低IGF-1環境における感受性が低下し食事の制限に抵抗性を示すことが報告された2).しかし,これまで,PI3Kに非依存的な代謝ストレスからの保護の機構,さらには,がん幹細胞による代謝ストレスの制御の機構については明らかにされていなかった.
この研究において着目したAMP活性化キナーゼは,異化を促進し同化を抑制することにより代謝の恒常性を維持するタンパク質である3).代謝ストレスによりAMPとATPの比が上昇することによりLkb1のリン酸化に依存してAMP活性化キナーゼが活性化し4),グルコース輸送体であるGlut1やGlut4の亢進5),解糖系の亢進6),脂肪酸の酸化の亢進3) により異化が促進される.また,AMP活性化キナーゼは腫瘍の増殖に関与するmTOR経路を抑制し7),AMP活性化キナーゼの活性化剤は腫瘍を抑制する効果をもつことから,がん抑制遺伝子産物としての側面が報告されている4).一方で,AMP活性化キナーゼは活性酸素種の恒常性の制御によりがん細胞の生存に寄与していることも明らかにされた8).このように,がん細胞におけるAMP活性化キナーゼの機能については解明されていない部分がある.そこで,筆者らは,急性骨髄性白血病のモデルマウスを用いて代謝ストレスのもとでのAMP活性化キナーゼの機能を解析した.
1.食事の制限は急性骨髄性白血病マウスにおいてAMP活性化キナーゼを活性化する
食事の制限による代謝ストレスが急性骨髄性白血病細胞にどのように影響するかを検討するため,急性骨髄性白血病のモデルマウスを対照群と30%カロリー制限群に分けて生存日数を比較したが,有意差は認められなかった.これまで,PI3K-Akt経路が活性化している腫瘍は食事の制限に抵抗性であることが報告されていたが,この急性骨髄性白血病モデルマウスの白血病幹細胞においてAktは抑制されており,ほかの代謝制御機構が関与していることが示唆された.そこで,食事を制限した急性骨髄性白血病モデルマウスから白血病細胞を分離し,いくつかの代謝制御タンパク質の活性を評価したところ,AMP活性化キナーゼが骨髄においていちじるしく活性化していることが見い出された.
2.AMP活性化キナーゼは急性骨髄性白血病における白血病幹細胞の維持に必須である
急性骨髄性白血病におけるAMP活性化キナーゼの機能を明らかにするため,骨髄系細胞において特異的にAMP活性化キナーゼを欠損させた骨髄前駆細胞および骨髄幹細胞にレトロウイルスベクターを用いてMLL-AF9遺伝子を導入しマウスに移植した.野生型の細胞の移植においてはすべての例において急性骨髄性白血病が発症し移植ののち130日以内に死亡したのに対し,AMP活性化キナーゼを欠損した細胞の移植においては生存期間が有意に延長した.AMP活性化キナーゼを欠損した細胞の移植においても骨髄や末梢血には白血病細胞が確認されたものの,野生型の細胞の移植と比較して白血病細胞の増殖は有意に抑制されていた.ほかの白血病モデルマウスを用いた解析においても同様に,AMP活性化キナーゼを欠損した細胞の移植により白血病の発症は抑制された.急性骨髄性白血病を発症したマウスから白血病細胞を採取して2次移植および3次移植をしたところ,AMP活性化キナーゼを欠損した細胞を移植したマウスの白血病細胞は白血病の発症能がいちじるしく低下していた.さらに,AMP活性化キナーゼを欠損した細胞を移植することにより急性骨髄性白血病を発症したマウスを解析したところ,白血病の発症能のもっとも高い顆粒球-マクロファージ前駆細胞様白血病細胞9) が著明に減少していた.AMP活性化キナーゼを欠損した細胞を移植したマウスの顆粒球-マクロファージ前駆細胞様白血病細胞においては形態学的および遺伝子発現パターンにより細胞分化の傾向が認められ,さらに,同数の顆粒球-マクロファージ前駆細胞様白血病細胞を分離して2次移植をしてもAMP活性化キナーゼを欠損した細胞を移植したマウスからの細胞においては発症が有意に抑制された.このことから,AMP活性化キナーゼは顆粒球-マクロファージ前駆細胞様白血病細胞の分化を抑制し,急性骨髄性白血病の発症および顆粒球-マクロファージ前駆細胞様白血病細胞のプールの維持に促進的に寄与していることが明らかにされた.
急性骨髄性白血病を発症したのちAMP活性化キナーゼを欠損させるマウスのモデルを樹立し解析した.骨髄前駆細胞および骨髄幹細胞を移植したマウスから白血病細胞を分離し,2次移植したのち14日目にAMP活性化キナーゼを欠損させたところ,骨髄において顆粒球-マクロファージ前駆細胞様白血病細胞は有意に減少し生存期間も延長した.この結果から,AMP活性化キナーゼは急性骨髄性白血病を発症したのちの顆粒球-マクロファージ前駆細胞様白血病細胞の維持においても重要であることが示された.
この2つの実験系においては,いずれも骨髄において顆粒球-マクロファージ前駆細胞様白血病細胞の有意な減少が認められ,脾臓における効果は限定的であった.そのため,AMP活性化キナーゼは骨髄における顆粒球-マクロファージ前駆細胞様白血病細胞の維持により重要であることが示唆された.
3.AMP活性化キナーゼは急性骨髄性白血病において活性酸素種の蓄積およびDNAの損傷を抑制する
AMP活性化キナーゼを欠損した顆粒球-マクロファージ前駆細胞様白血病細胞においてはカスパーゼに依存的なアポトーシスによる細胞死が増加していた.さらに,AMP活性化キナーゼの欠損により骨髄における活性酸素種の蓄積およびミトコンドリアにおける活性酸素種の産生が亢進していた.脾臓においては活性酸素種の蓄積は顕著ではなく,骨髄は酸化ストレスの高い環境であることが示された.また,活性酸素種の蓄積を反映して,NADP+/NADPH比の上昇およびGSH/GSSG比の低下が認められた.さらに,活性酸素種の蓄積した骨髄に存在する急性骨髄性白血病細胞においてはDNAの損傷がひき起こされていた.AMP活性化キナーゼの欠損による細胞死は活性酸素種によりひき起こされているのかどうかを明らかにするため,AMP活性化キナーゼを欠損した急性骨髄性白血病のモデルマウスに抗酸化剤であるTEMPOLを投与したところ,白血病細胞のアポトーシス,活性酸素種の蓄積,DNAの損傷は抑制され,発症までの期間も短縮した.この結果から,AMP活性化キナーゼの欠損による急性骨髄性白血病の発症の抑制は,活性酸素種の蓄積およびDNAの損傷による細胞死がその原因の一部であることが示された.
4.AMP活性化キナーゼは急性骨髄性白血病におけるグルコースの取り込みおよび代謝を促進する
急性骨髄性白血病におけるAMP活性化キナーゼによるエネルギー代謝の制御について明らかにするため,グルコースの取り込みを解析した.蛍光により標識したグルコースを急性骨髄性白血病のモデルマウスに投与しフローサイトメトリーにより検出したところ,AMP活性化キナーゼを欠損した急性骨髄性白血病細胞および顆粒球-マクロファージ前駆細胞様白血病細胞においてグルコース取り込みの低下が認められた.この機序は,AMP活性化キナーゼの欠損によりグルコース輸送体Glut1の発現を抑制するTxnipのタンパク質量の増加が誘導されていることが原因であった.また,AMP活性化キナーゼを欠損した細胞にGlut1を発現させることにより,増殖能は部分的に改善した.さらに,急性骨髄性白血病のモデルマウスにおいてGlut1をノックダウンしたところ,細胞の増殖は有意に抑制された.この結果から,AMP活性化キナーゼはGlut1の発現を制御することにより急性骨髄性白血病の発症および白血病細胞におけるエネルギー代謝を維持していることが示された.
グルコースの代謝をより詳細に解析するため,13Cグルコースを用いてフラックス解析を行った.その結果,AMP活性化キナーゼを欠損した急性骨髄性白血病においては,とくに3-ホスホグリセリン酸,2-ホスホグリセリン酸,乳酸,ATP,NADHにおいて13Cの割合が低下していた.また,XFアナライザーによる解析においても解糖系のエネルギー代謝の指標が有意に低下していた.この結果から,AMP活性化キナーゼは急性骨髄性白血病においてグルコースの代謝の維持に必須であることが示された.また,ペントースリン酸経路についても同様に解析したところ,低グルコース環境にてリボース5-リン酸,キシルロース5-リン酸,セドヘプツロース7-リン酸において13Cの割合が低下しており,AMP活性化キナーゼは低グルコース環境である骨髄における抗酸化能の低下および活性酸素種の蓄積に寄与していることが示された.
5.食事の制限はAMP活性化キナーゼを欠損した急性骨髄性白血病を抑制する
食事を制限した急性骨髄性白血病のモデルマウスにおいて,AMP活性化キナーゼは脾臓よりも骨髄においていちじるしく活性化しており,急性骨髄性白血病細胞における骨髄での代謝ストレスの制御はAMP活性化キナーゼに依存すると考えられた.とくに,グルコースの濃度は末梢血や脾臓に比べ骨髄においてより低値であった.AMP活性化キナーゼを欠損した細胞をグルコースなしあるいは低濃度で培養すると細胞の生存率はいちじるしく低下し活性酸素種が蓄積した.このことから,AMP活性化キナーゼはとくに骨髄のような低グルコース環境において活性酸素種の蓄積を抑制するために必須であることが明らかにされた.さらに,AMP活性化キナーゼを欠損したマウスにおいて食事を制限したところ,生存期間が有意に延長した.一方で,AMP活性化キナーゼを欠損した正常な造血幹細胞および造血前駆細胞に変化は認められなかった.AMP活性化キナーゼは正常な造血幹細胞および急性骨髄性白血病細胞において代謝ストレスにより活性化されるものの,急性骨髄性白血病細胞ではAMP活性化キナーゼが酸化ストレス,DNAの損傷,アポトーシスの防護に寄与しており,その貢献度は非常に高いといえた.
AMP活性化キナーゼの阻害剤であるCompound Cによる急性骨髄性白血病の抑制の効果について検討した.in vitroにおける解析から,Compound Cは急性骨髄性白血病細胞の増殖を抑制しアポトーシスを誘導することが示された.さらに,その抑制の効果は顆粒球-マクロファージ前駆細胞様白血病細胞においてより高かった.急性骨髄性白血病のモデルマウスの解析においては,骨髄前駆細胞および骨髄幹細胞を移植したのち7日目からCompound Cを投与したところ生存期間が有意に延長した.さらに,食事の制限との併用によりその効果は増強した.このことから,AMP活性化キナーゼの阻害剤により代謝ストレスへの感受性を亢進させ,さらに,食事の制限によりその効果をさらに増強させることが可能であることが明らかにされた.
おわりに
骨髄は代謝ストレスの非常に強い環境であるが,急性骨髄性白血病細胞は代謝の恒常性を維持することが可能である.今回の研究により,AMP活性化キナーゼは骨髄における急性骨髄性白血病細胞の維持に必須であることが見い出された(図1).そして,この機能は低グルコース環境である骨髄においてより重要であること,また,正常な造血幹細胞におけるAMP活性化キナーゼの依存度は高くはないことが示された.AMP活性化キナーゼの阻害によりグルコースの代謝を抑制することによって代謝ストレスへの脆弱性を生じさせ,さらに,食事の制限などの代謝ストレスをあたえることにより,急性骨髄性白血病細胞を死滅させることが可能であった.さらに,このAMP活性化キナーゼの阻害と食事の制限の併用は,低グルコースおよび低酸素といった過酷な環境において生存する既存の治療がむずかしい腫瘍に対し効果をもたらすかもしれない.
文 献
- Mihaylova, M. M., Sabatini, D. M. & Yilmaz, O. H.: Dietary and metabolic control of stem cell function in physiology and cancer. Cell Stem Cell, 14, 292-305 (2014)[PubMed]
- Kalaany, N. Y. & Sabatini, D. M.: Tumors with PI3K activation are resistant to dietary restriction. Nature, 458, 725-731 (2009)[PubMed]
- Hardie, D. G., Ross, F. A. & Hawley, S. A.: AMPK: a nutrient and energy sensor that maintains energy homeostasis. Nat. Rev. Mol. Cell Biol., 13, 251-262 (2012)[PubMed]
- Shackelford, D. B. & Shaw, R. J.: The LKB1-AMPK pathway: metabolism and growth control in tumor suppression. Nat. Rev. Cancer, 9, 563-575 (2009)[PubMed]
- Barnes, K., Ingram, J. C., Porras, O. H. et al.: Activation of Glut1 by metabolic and osmotic stress: potential involvement of AMP-activated protein kinase (AMPK). J. Cell Sci., 115, 2422-2442 (2002)[PubMed]
- Almeida, A., Moncada, S. & Bolanos, J. P.: Nitric oxide switches on glycolysis through the AMP protein kinase and 6-phosphofructo-2-kinase pathway. Nat. Cell Biol., 6, 45-51 (2004)[PubMed]
- Laplante, M. & Sabatini, D. M.: mTOR signaling in growth control and disease. Cell, 149, 274-293 (2012)[PubMed]
- Jeon, S. M., Chandel, N. S. & Hey, N.: AMPK regulates NADPH homeostasis to promote tumor cell survival during energy stress. Nature, 485, 661-665 (2012)[PubMed]
- Krivtsov, A. V., Twomey, D., Feng, Z. et al.: Transformation from committed progenitor to leukemia stem cell initiated by MLL-AF9. Nature, 442, 818-822 (2006)[PubMed]
著者プロフィール
略歴:2011年 宮崎大学大学院医学研究科博士課程 修了,2012年 米国Baylor College of Medicine博士研究員を経て,2015年より宮崎大学医学部 講師.
研究テーマ:白血病細胞におけるストレス耐性の機構.
抱負:白血病幹細胞のさまざまなストレスに対する防御の機構を明らかにし,その機構を破綻させることにより難治性の白血病の根治をめざしたい.
中田 大介(Daisuke Nakada)
米国Baylor College of Medicine助教.
© 2015 齋藤祐介・中田大介 Licensed under CC 表示 2.1 日本