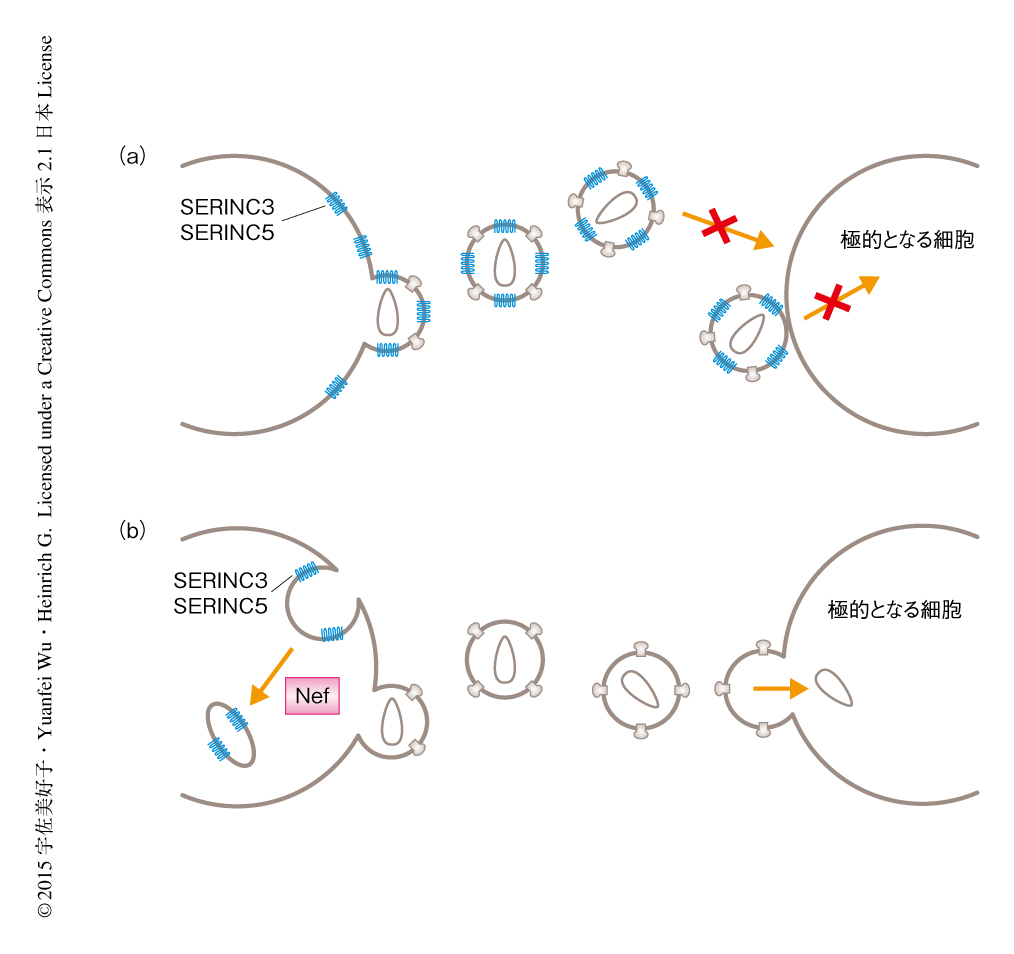
HIV-1のもつNefは膜貫通タンパク質であるSERINC3およびSERINC5の局在を変化させることにより感染力を維持する
宇佐美好子・Yuanfei Wu・Heinrich G. Göttlinger
(米国Massachusetts大学Medical School,Department of Molecular, Cell, and Cancer Biology)
email:宇佐美好子
DOI: 10.7875/first.author.2015.119
SERINC3 and SERINC5 restrict HIV-1 infectivity and are counteracted by Nef.
Yoshiko Usami, Yuanfei Wu, Heinrich G. Göttlinger
Nature, 526, 218-223 (2015)
HIV-1にコードされるNefおよびマウス白血病ウイルスにコードされるglycoGagはHIV-1の感染力を増強させる.筆者らは,NefおよびglycoGagが複数回膜貫通タンパク質であるSERINC3およびSERINC5の細胞の表面への局在を阻害することにより,その感染力の増強能を維持することを発見した.SERINC3あるいはSERINC5のノックダウンは,HIV-1の感染力に対しNefと同様の効果を示した.SERINC3およびSERINC5の二重欠損細胞において,Nefを欠損したHIV-1は野生型の細胞に比べ100倍も高い感染力を示した.この二重欠損細胞にSERINC3およびSERINC5を発現させると感染力の上昇は消失した.また,SERIN3およびSERINC5はHIV-1の複製を阻害した.SERINC3およびSERINC5はHIV-1の標的となる細胞に多く発現していることから,NefによるSERINC3およびSERINC5の抑制を阻害することはAIDSの治療に新しい道を開くと思われる.
AIDS(acquired immune deficiency syndrome,後天性免疫不全症候群)を発症させるHIV-1(human immunodeficiency virus type1,ヒト免疫不全ウイルス1型)にコードされるアクセサリータンパク質Nefは,HIV-1の複製に必須ではないがその感染力を増強し,HIV-1の病原性において重要な役割をはたしている1,2).しかし,その分子機構はいまだ明らかにされていない.マウス白血病ウイルスにコードされるglycoGagもまた,HIV-1の感染力についてNefと同様の効果を示す3).NefはHIV-1を産生する細胞の表面に存在するCD4を抑制するが,その作用は感染力の増強には関与しない4).一方,glycoGagはCD4を抑制しない3).glycoGagはII型膜貫通タンパク質であり,細胞質側にあるNefとは関係のない領域がNef様の活性に関与する5).これらの違いにもかかわらず,NefとglycoGagがHIV-1の感染力に関して同様の効果を示すことは非常に興味深く,関連する分子機構が存在すると思われた.
T細胞にNefをもつあるいは欠損したHIV-1,あるいは,活性を示す最小の大きさのglycoGagをコードするHIV-1を感染させたのち,産生されたHIV-1を精製しプロテオーム解析を行った.Nefを欠損したHIV-1から検出されたがNefをもつHIV-1あるいは最小の大きさのglycoGagをコードするHIV-1からは検出されなかった唯一のタンパク質が,SERINC3であった.HAタグを付加したSERINC3が種々のタイプのNefあるいはglycoGagの存在のもとウイルス粒子に取り込まれるかどうかをイムノブロッティング法により確認したところ,NefSF2およびNef90CF056を除くNefおよびglycoGagの存在のもとではSERINC3は取り込まれなかった.Nef90CF056はHIV-1の感染力を増強しなかった一方,NefSF2はHIV-1の感染力を中程度に増強させたことから,ほかのSERINCファミリーのメンバーがウイルス粒子に取り込まれるかどうか調べたところ,NefSF2はSERINC5の取り込みを強く阻害した.SERINC3およびSERINC5をウイルス粒子に取り込まないNefを欠損したHIV-1は高い感染力を示し,NefによるSERINC3あるいはSERINC5のウイルス粒子への取り込みの効果と,HIV-1の感染力の増強の効果には相関が認められた.
SERINC5と蛍光タンパク質mCherryとの融合タンパク質を単独で発現させたところ,細胞膜およびフィロポディア様の突起にその存在が確認された.一方,NefあるいはglycoGagとともに発現させると,核の周囲に存在した.また,内部にHAタグを挿入したSERINC5をJurkatTAg細胞に発現させフローサイトメトリーにより解析したところ,細胞の表面に存在し,その局在はNefSF2あるいはglycoGagとの共発現により低下した.これらの結果から,NefおよびglycoGagはSERINC5の細胞の表面への局在を減少させると考えられた.
293T細胞にてSERINC3あるいはSERINC5の存在下あるいは非存在下において産生させたNefを欠損したHIV-1を,TZM-bl細胞に感染させ感染力の違いを検討した.SERINC5の存在下で産生させたNefを欠損したHIV-1の感染力は,非存在下で産生させたときの100倍以下,SERINC3の場合は2~3倍以下だった.外部からくわえたSERINC3あるいはSERINC5は,ウイルス粒子の産生,Gagのプロセシング,HIV-1エンベロープの取り込みに影響しなかった.しかしながら,TZM-bl細胞における後期の逆転写産物は,SERINC5存在下で産生させたNefを欠損したHIV-1において,非存在下で産生させた場合の100倍以下であった.SERINC5の存在下で産生させたNefを欠損したHIV-1は,ヒトの末梢血単核球への感染力も低下していた.
JurkatTAg細胞は比較的高い濃度でSERINC3およびSERIN5を発現するが,siRNA法によりSERINC3あるいはSERINC5をノックダウンしたところ,Nefを欠損したHIV-1の感染力は,SERINC3のノックダウンでは4倍以上,SERINC5のノックダウンでは8倍以上,ダブルノックダウンでは最大で45倍以上も増強した.
Nefを欠損したHIV-1は,野生型のJurkatTAg細胞に比べ,SERINC3を欠損したJurkatTAg細胞において産生させると5倍,SERINC5を欠損したJurkatTAg細胞において産生させると13~20倍,SERINC3およびSERIN5の二重欠損細胞においては100倍以上も高い感染力を示した.野生型の細胞においてすでに高い感染力を示すNefをもつHIV-1およびglycoGagをもつHIV-1については,SERINC3およびSERIN5の二重欠損により有意の感染力の上昇は認められなかった.SERINC3およびSERIN5の二重欠損細胞にSERINC3あるいはSERIN5を発現させNefを欠損したHIV-1を産生させたとき,その感染力は二重欠損細胞に比べ,SERINC3の発現により4倍,SERINC5の発現により6倍,SERINC3およびSERIN5の発現により32倍も低下した.
SERINC3およびSERIN5のHIV-1の複製に及ぼす効果について検討した.293T細胞において産生させたHIV-1を野生型の細胞に感染させると,Nefを欠損したHIV-1の複製はNefをもつHIV-1に比べ抑制された.しかし,SERINC3およびSERIN5の二重欠損細胞に感染させるとNefを欠損したHIV-1の複製は抑制されず,NefをもつHIV-1と同じ程度の複製が観察された.二重欠損細胞にSERINC3あるいはSERIN5を発現させると,Nefを欠損したHIV-1の複製は抑制された.
HIV-1のもつNefおよびマウス白血病ウイルスのもつglycoGagは,SERINC3およびSERINC5の細胞の表面への局在を効果的に阻害し,ウイルス粒子への取り込みを阻害することによりHIV-1の感染力を維持すると考えられた(図1).SERINCファミリーのメンバーの機能についてはまだよく解明されていないが,すべての真核生物に存在し,ホスファチジルセリンおよびスフィンゴ脂質へのセリンの取り込みを増加させることが報告されている6).この活性は,ウイルスの感染力において重要であるウイルスエンベロープの脂質の組成7) に影響を及ぼす可能性がある.
この研究において明らかにされたSERINC3およびSERINC5の抗ウイルス効果は,AIDSに対する新規の治療法を提供するだけでなく,すべてのウイルスに対抗する手段として有効である可能性がある.
略歴:1993年 岐阜薬科大学大学院にて博士号取得,藤田保健衛生大学 研究員,岐阜薬科大学 助手,エイズ予防財団 リサーチレジデントを経て,2004年より米国Massachusetts大学Medical School.
Yuanfei Wu
米国Massachusetts大学Medical SchoolにてResearch Specialist.
Heinrich G. Göttlinger
米国Massachusetts大学Medical SchoolにてProfessor.
© 2015 宇佐美好子・Yuanfei Wu・Heinrich G. Göttlinger Licensed under CC 表示 2.1 日本
(米国Massachusetts大学Medical School,Department of Molecular, Cell, and Cancer Biology)
email:宇佐美好子
DOI: 10.7875/first.author.2015.119
SERINC3 and SERINC5 restrict HIV-1 infectivity and are counteracted by Nef.
Yoshiko Usami, Yuanfei Wu, Heinrich G. Göttlinger
Nature, 526, 218-223 (2015)
要 約
HIV-1にコードされるNefおよびマウス白血病ウイルスにコードされるglycoGagはHIV-1の感染力を増強させる.筆者らは,NefおよびglycoGagが複数回膜貫通タンパク質であるSERINC3およびSERINC5の細胞の表面への局在を阻害することにより,その感染力の増強能を維持することを発見した.SERINC3あるいはSERINC5のノックダウンは,HIV-1の感染力に対しNefと同様の効果を示した.SERINC3およびSERINC5の二重欠損細胞において,Nefを欠損したHIV-1は野生型の細胞に比べ100倍も高い感染力を示した.この二重欠損細胞にSERINC3およびSERINC5を発現させると感染力の上昇は消失した.また,SERIN3およびSERINC5はHIV-1の複製を阻害した.SERINC3およびSERINC5はHIV-1の標的となる細胞に多く発現していることから,NefによるSERINC3およびSERINC5の抑制を阻害することはAIDSの治療に新しい道を開くと思われる.
はじめに
AIDS(acquired immune deficiency syndrome,後天性免疫不全症候群)を発症させるHIV-1(human immunodeficiency virus type1,ヒト免疫不全ウイルス1型)にコードされるアクセサリータンパク質Nefは,HIV-1の複製に必須ではないがその感染力を増強し,HIV-1の病原性において重要な役割をはたしている1,2).しかし,その分子機構はいまだ明らかにされていない.マウス白血病ウイルスにコードされるglycoGagもまた,HIV-1の感染力についてNefと同様の効果を示す3).NefはHIV-1を産生する細胞の表面に存在するCD4を抑制するが,その作用は感染力の増強には関与しない4).一方,glycoGagはCD4を抑制しない3).glycoGagはII型膜貫通タンパク質であり,細胞質側にあるNefとは関係のない領域がNef様の活性に関与する5).これらの違いにもかかわらず,NefとglycoGagがHIV-1の感染力に関して同様の効果を示すことは非常に興味深く,関連する分子機構が存在すると思われた.
1.NefおよびglycoGagはSERINC3およびSERINC5のウイルス粒子への取り込みを阻害する
T細胞にNefをもつあるいは欠損したHIV-1,あるいは,活性を示す最小の大きさのglycoGagをコードするHIV-1を感染させたのち,産生されたHIV-1を精製しプロテオーム解析を行った.Nefを欠損したHIV-1から検出されたがNefをもつHIV-1あるいは最小の大きさのglycoGagをコードするHIV-1からは検出されなかった唯一のタンパク質が,SERINC3であった.HAタグを付加したSERINC3が種々のタイプのNefあるいはglycoGagの存在のもとウイルス粒子に取り込まれるかどうかをイムノブロッティング法により確認したところ,NefSF2およびNef90CF056を除くNefおよびglycoGagの存在のもとではSERINC3は取り込まれなかった.Nef90CF056はHIV-1の感染力を増強しなかった一方,NefSF2はHIV-1の感染力を中程度に増強させたことから,ほかのSERINCファミリーのメンバーがウイルス粒子に取り込まれるかどうか調べたところ,NefSF2はSERINC5の取り込みを強く阻害した.SERINC3およびSERINC5をウイルス粒子に取り込まないNefを欠損したHIV-1は高い感染力を示し,NefによるSERINC3あるいはSERINC5のウイルス粒子への取り込みの効果と,HIV-1の感染力の増強の効果には相関が認められた.
2.NefおよびglycoGagはSERINC5の局在を変化させる
SERINC5と蛍光タンパク質mCherryとの融合タンパク質を単独で発現させたところ,細胞膜およびフィロポディア様の突起にその存在が確認された.一方,NefあるいはglycoGagとともに発現させると,核の周囲に存在した.また,内部にHAタグを挿入したSERINC5をJurkatTAg細胞に発現させフローサイトメトリーにより解析したところ,細胞の表面に存在し,その局在はNefSF2あるいはglycoGagとの共発現により低下した.これらの結果から,NefおよびglycoGagはSERINC5の細胞の表面への局在を減少させると考えられた.
3.外部からくわえたSERINC3およびSERINC5はNefを欠損したHIV-1の感染力を低下させる
293T細胞にてSERINC3あるいはSERINC5の存在下あるいは非存在下において産生させたNefを欠損したHIV-1を,TZM-bl細胞に感染させ感染力の違いを検討した.SERINC5の存在下で産生させたNefを欠損したHIV-1の感染力は,非存在下で産生させたときの100倍以下,SERINC3の場合は2~3倍以下だった.外部からくわえたSERINC3あるいはSERINC5は,ウイルス粒子の産生,Gagのプロセシング,HIV-1エンベロープの取り込みに影響しなかった.しかしながら,TZM-bl細胞における後期の逆転写産物は,SERINC5存在下で産生させたNefを欠損したHIV-1において,非存在下で産生させた場合の100倍以下であった.SERINC5の存在下で産生させたNefを欠損したHIV-1は,ヒトの末梢血単核球への感染力も低下していた.
4.SERINC3およびSERIN5のノックダウンはNefを欠損したHIV-1の感染力を増強させる
JurkatTAg細胞は比較的高い濃度でSERINC3およびSERIN5を発現するが,siRNA法によりSERINC3あるいはSERINC5をノックダウンしたところ,Nefを欠損したHIV-1の感染力は,SERINC3のノックダウンでは4倍以上,SERINC5のノックダウンでは8倍以上,ダブルノックダウンでは最大で45倍以上も増強した.
5.Nefを欠損したHIV-1をSERINC3あるいはSERIN5を欠損した細胞で産生させると感染力は増強する
Nefを欠損したHIV-1は,野生型のJurkatTAg細胞に比べ,SERINC3を欠損したJurkatTAg細胞において産生させると5倍,SERINC5を欠損したJurkatTAg細胞において産生させると13~20倍,SERINC3およびSERIN5の二重欠損細胞においては100倍以上も高い感染力を示した.野生型の細胞においてすでに高い感染力を示すNefをもつHIV-1およびglycoGagをもつHIV-1については,SERINC3およびSERIN5の二重欠損により有意の感染力の上昇は認められなかった.SERINC3およびSERIN5の二重欠損細胞にSERINC3あるいはSERIN5を発現させNefを欠損したHIV-1を産生させたとき,その感染力は二重欠損細胞に比べ,SERINC3の発現により4倍,SERINC5の発現により6倍,SERINC3およびSERIN5の発現により32倍も低下した.
SERINC3およびSERIN5のHIV-1の複製に及ぼす効果について検討した.293T細胞において産生させたHIV-1を野生型の細胞に感染させると,Nefを欠損したHIV-1の複製はNefをもつHIV-1に比べ抑制された.しかし,SERINC3およびSERIN5の二重欠損細胞に感染させるとNefを欠損したHIV-1の複製は抑制されず,NefをもつHIV-1と同じ程度の複製が観察された.二重欠損細胞にSERINC3あるいはSERIN5を発現させると,Nefを欠損したHIV-1の複製は抑制された.
おわりに
HIV-1のもつNefおよびマウス白血病ウイルスのもつglycoGagは,SERINC3およびSERINC5の細胞の表面への局在を効果的に阻害し,ウイルス粒子への取り込みを阻害することによりHIV-1の感染力を維持すると考えられた(図1).SERINCファミリーのメンバーの機能についてはまだよく解明されていないが,すべての真核生物に存在し,ホスファチジルセリンおよびスフィンゴ脂質へのセリンの取り込みを増加させることが報告されている6).この活性は,ウイルスの感染力において重要であるウイルスエンベロープの脂質の組成7) に影響を及ぼす可能性がある.
この研究において明らかにされたSERINC3およびSERINC5の抗ウイルス効果は,AIDSに対する新規の治療法を提供するだけでなく,すべてのウイルスに対抗する手段として有効である可能性がある.
文 献
- Chowers, M. Y., Pandori, M. W., Spina, C. A. et al.: The growth advantage conferred by HIV-1 nef is determined at the level of viral DNA formation and is independent of CD4 downregulation. Virology, 212, 451-457 (1995)[PubMed]
- Munch, J., Rajan, D., Schindler, M. et al.: Nef-mediated enhancement of virion infectivity and simulation of viral replication are fundamental properties of primate lentiviruses. J. Virol., 81, 13852-13864 (2007)[PubMed]
- Pizzato, M.: MLV glycosylated-Gag is an infectivity factor that rescues Nef-deficient HIV-1. Proc. Natl. Acad. Sci. USA, 107, 9364-9369 (2010)[PubMed]
- Goldsmith, M. A., Warmerdam, M. T., Atchinson, R. E. et al.: Dissociation of the CD4 downregulation and viral infectivity enhancement functions of human immunodeficiency virus type 1 Nef. J. Virol., 69, 4112-4121 (1995)[PubMed]
- Usami, Y., Popov, S. & Gottlinger, H.: The Nef-like effect of murine leukemia virus glycosylated gag on HIV-1 infectivity is mediated by its cytoplasmic domain and depends on the AP-2 adaptor complex. J. Virol., 88, 3443-3454 (2014)[PubMed]
- Inuzuka, M., Hayakawa, M. & Ingi, T.: Serinc, an activity-regulated protein family, incorporates serine into membrane lipid synthesis. J. Biol. Chem., 280, 35776-35783 (2005)[PubMed]
- Waheed, A. A. & Freed, E. O.: The role of lipids in retrovirus replication. Viruses, 2, 1146-1180 (2010)[PubMed]
著者プロフィール
略歴:1993年 岐阜薬科大学大学院にて博士号取得,藤田保健衛生大学 研究員,岐阜薬科大学 助手,エイズ予防財団 リサーチレジデントを経て,2004年より米国Massachusetts大学Medical School.
Yuanfei Wu
米国Massachusetts大学Medical SchoolにてResearch Specialist.
Heinrich G. Göttlinger
米国Massachusetts大学Medical SchoolにてProfessor.
© 2015 宇佐美好子・Yuanfei Wu・Heinrich G. Göttlinger Licensed under CC 表示 2.1 日本