ミトコンドリアタンパク質の入り口の分子構造
塩田拓也1・遠藤斗志也2
(1オーストラリアMonash大学Department of Microbiology,2京都産業大学総合生命科学部 生命システム学科)
email:遠藤斗志也
DOI: 10.7875/first.author.2015.112
Molecular architecture of the active mitochondrial protein gate.
Takuya Shiota, Kenichiro Imai, Jian Qiu, Victoria L. Hewitt, Khershing Tan, Hsin-Hui Shen, Noriyuki Sakiyama, Yoshinori Fukasawa, Sikander Hayat, Megumi Kamiya, Arne Elofsson, Kentaro Tomii, Paul Horton, Nils Wiedemann, Nikolaus Pfanner, Trevor Lithgow, Toshiya Endo
Science, 349, 1544-1548 (2015)
ミトコンドリアは構成タンパク質をサイトゾルから取り込むため,トランスロケーターとよばれる膜タンパク質複合体によりミトコンドリアへのタンパク質の交通を厳密に制御している.TOM複合体はミトコンドリア外膜に存在するトランスロケーターで,ほとんどすべてのミトコンドリアタンパク質の入り口として機能する.今回,in silicoにおけるサブユニットの構造予測とin vivoにおける部位特異的な光架橋法とを組み合わせることにより,ミトコンドリアにおけるTOM複合体のアセンブリー構造を明らかにした.TOM複合体におけるチャネルタンパク質であるTom40のつくるβバレル構造の内側は前駆体タンパク質の通り道として機能し,多様な前駆体タンパク質に対応するために複数のカスタマイズされた通り道を用意していた.また,Tom40のN末端側の領域はβバレル構造の内側を貫通して膜間部側に到達しており,膜間部におけるシャペロンタンパク質であるsmall Timをあつめて,効率のよい前駆体タンパク質の受け渡しを実現していた.この研究により,TOM複合体が多種多様な前駆体タンパク質を効率よく取り込むためのインテリジェントな装置としてはたらく構造的な基盤がはじめて明らかにされた.
細胞でのエネルギー生産において中心的な役割をはたすミトコンドリアは,外膜と内膜の2枚の生体膜にかこまれ1000種類以上のタンパク質から構成される.これらミトコンドリアタンパク質をコードする遺伝子のほとんどは核のゲノムに移行しており,サイトゾルにおいて前駆体タンパク質として合成されたのちミトコンドリアへと輸送される.前駆体タンパク質のもつ行き先を示すシグナル配列は,ミトコンドリア外膜に存在するトランスロケーター(膜透過装置)であるTOM(translocase of the outer membrane)複合体の受容体サブユニットに認識され,TOM複合体の形成するチャネルを介して外膜を通過しミトコンドリアの内部へと取り込まれる.つづいて,前駆体タンパク質は膜間部にあるsmall Timとよばれるシャペロンタンパク質や,内膜および外膜に存在するほかのトランスロケーターにより,最終的な目的地となる区画へと仕分けられる1).
TOM複合体はチャネルを構成するβバレル型膜タンパク質のTom40と1回膜貫通ヘリックスをもつ6~7種のサブユニットから構成される.おのおののサブユニットの機能についてはくわしい解析がなされているが,TOM複合体の全体の高分解能での構造が決定されていないため,おのおののサブユニットがどのように集合してTOM複合体を形成し,また,おのおののサブユニットがどのように連携して前駆体タンパク質を効率よく膜透過させているかについては明らかにされていなかった.そこで,筆者らは,in silicoにおける構造予測とin vivoにおける部位特異的な光架橋法とを組み合わせることにより,TOM複合体のアセンブリー構造を決定し,それにもとづく機能解析を行った.
TOM複合体のアセンブリー構造を決定するために,ホモロジーモデリング法によりTom40の予測構造を得た.鋳型には,Tom40と同じくミトコンドリア外膜においてβバレル構造をとり,Tom40と相同性の高いことが示されているVDACの結晶構造を用いた2).この構造にもとづき,出芽酵母を用いたin vivoにおける部位特異的な光架橋法により,Tom40と相互作用するタンパク質をアミノ酸残基レベルの空間分解能で解析した.この手法は,光架橋性の側鎖をもつ非天然アミノ酸であるp-ベンゾイルフェニルアラニンをin vivoサプレッサーtRNA法により目的となるタンパク質の任意の部位に導入し3),紫外線の照射により光架橋させてタンパク質のあいだの相互作用を解析する方法である.出芽酵母においてTom40の100箇所以上の部位にひとつずつp-ベンゾイルフェニルアラニンを導入し,ほかのサブユニットと相互作用するアミノ酸残基を決定して相互作用をマッピングした.予測構造は光架橋実験の結果ともよく一致し,過去に報告されたさまざまな生化学的な知見とも矛盾はなく,予測構造が十分に信頼できるものであることが示された.
TOM複合体の機能に関する大きな論争は,前駆体タンパク質の通り道の実体が何かということであった.膜透過する前駆体タンパク質はTom40の“円筒形のβバレル構造の孔”をとおるのか,複数のTom40のβバレル構造が集合して形成する“分子のあいだの隙間の空間”をとおるのか,という問題である.さまざまな部位にp-ベンゾイルフェニルアラニンを導入したTom40を発現させた出芽酵母からミトコンドリアを単離し,in vitro合成法により放射能標識した前駆体タンパク質をくわえ,ここで膜透過の反応を停止させて膜透過中間体を作製し光架橋実験を行った.βバレル構造を構成するβストランドにおいては,あるアミノ酸残基の側鎖が外側を向けば,そのとなりの残基の側鎖は内側を向く.したがって,Tom22などほかのサブユニットと架橋された残基のとなりの残基の側鎖は,必ず内側を向くはずである.光架橋実験の結果,膜透過中間体は内側を向く残基にp-ベンゾイルフェニルアラニンを導入したときのみ架橋されることがわかった.したがって,前駆体タンパク質はβバレル構造の孔の内側をとおり膜透過することがはじめて実験的に証明された.
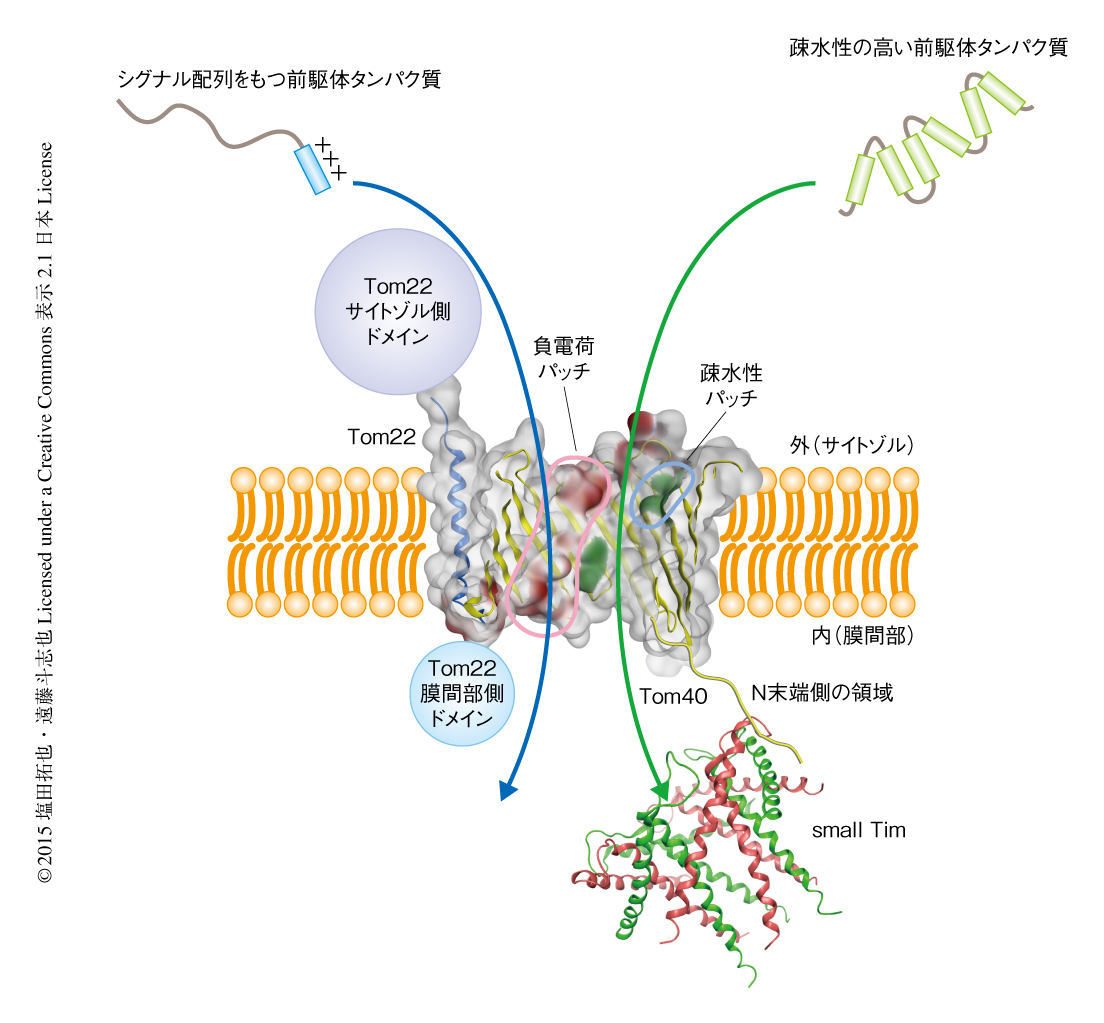
前駆体タンパク質の種類を変えて膜透過中間体を形成させ,Tom40の孔の内側のどの残基と架橋されるか詳細に調べたところ,正に荷電したミトコンドリア行きのシグナル配列をもつ前駆体タンパク質はTom40の孔の内側の負に荷電した部分と接触しながら孔をとおりぬけ,シグナル配列をもたず全体として疎水性の高い前駆体タンパク質はTom40の孔の内側の疎水性の高い部分と接触しながらとおりぬけることが示された.これらの結果から,Tom40は1000種類にも及ぶさまざまな前駆体タンパク質を効率よくとおすため,孔の内側に前駆体タンパク質の性質に応じてカスタマイズされた複数の通り道を用意していることがわかった(図1).ホモロジー解析によりこれらのカスタマイズされた通り道がほかの生物種においても存在するかどうか調べたところ,ヒトやシロイヌナズナにおいても保存されていることがわかった.
Tom40はVDACと比べより長いN末端側の領域をもち,予測構造からはこの領域は膜間部に露出しているだろうと推測されたものの,どのような機能をもつかは不明であった.そこで,この領域にp-ベンゾイルフェニルアラニンを導入して光架橋実験を行った.その結果,膜間部に存在するsmall TimのひとつTim10と架橋し,Tom40のN末端側の領域はβバレル構造の内部を貫いて膜間部に到達していることがわかった.small Timは疎水性の高い外膜や内膜の前駆体タンパク質を水溶液の環境である膜間部を通過させるためにはたらくシャペロンタンパク質である1).Tom40のN末端側の領域を欠失した変異体を作製したところ,small Timを必要とする疎水性の高い前駆体タンパク質のin vitroにおけるミトコンドリアへの輸送に阻害がみられ,さらに,これらの変異Tom40を発現する出芽酵母においてsmall Timを必要とする前駆体タンパク質を過剰に発現すると生育に阻害がみられた.これらの結果から,Tom40のN末端側の領域はsmall Timを前駆体タンパク質の通り道の膜間部側の出口の付近にあつめ,前駆体タンパク質を効率よくsmall Timに受け渡すはたらきのあることが示された(図1).
クライオ電子顕微鏡を用いた解析からTOM複合体は2つの孔がある分子種と3つの孔がある分子種の2種類が報告されているが4,5),どちらが実際にミトコンドリアではたらくインタクトな複合体の構造を反映しているのかは不明なままであった.そこで,Tom40とTom22の幾何学的な配置を光架橋実験から推定することを試みた.以前に筆者らは,Tom22の膜貫通ヘリックスは2分子のTom40と相互作用し,Tom40と相互作用する面はTom22のヘリックスの軸について対称な位置関係にはないことを見い出していた6).今回の解析により,Tom40も同様に2分子のTom22と相互作用すること,Tom22と相互作用する面はTom40のβバレル構造の軸についてやはり対称な位置関係にはないことが明らかにされた.そこで,Tom22とTom40のおのおの2つの相互作用面がどのような組合せで結合するのか光架橋実験から明らかにすることにより,Tom40とTom22の幾何学的な位置関係を再構築した.再構築されたTOM複合体はクライオ電子顕微鏡により観察された3つの孔がある構造とよく一致した.したがって,3分子のTom40を3分子のTom22が糊づけするかたちで,3つの孔があるTom40三量体として集合することが明らかにされた.
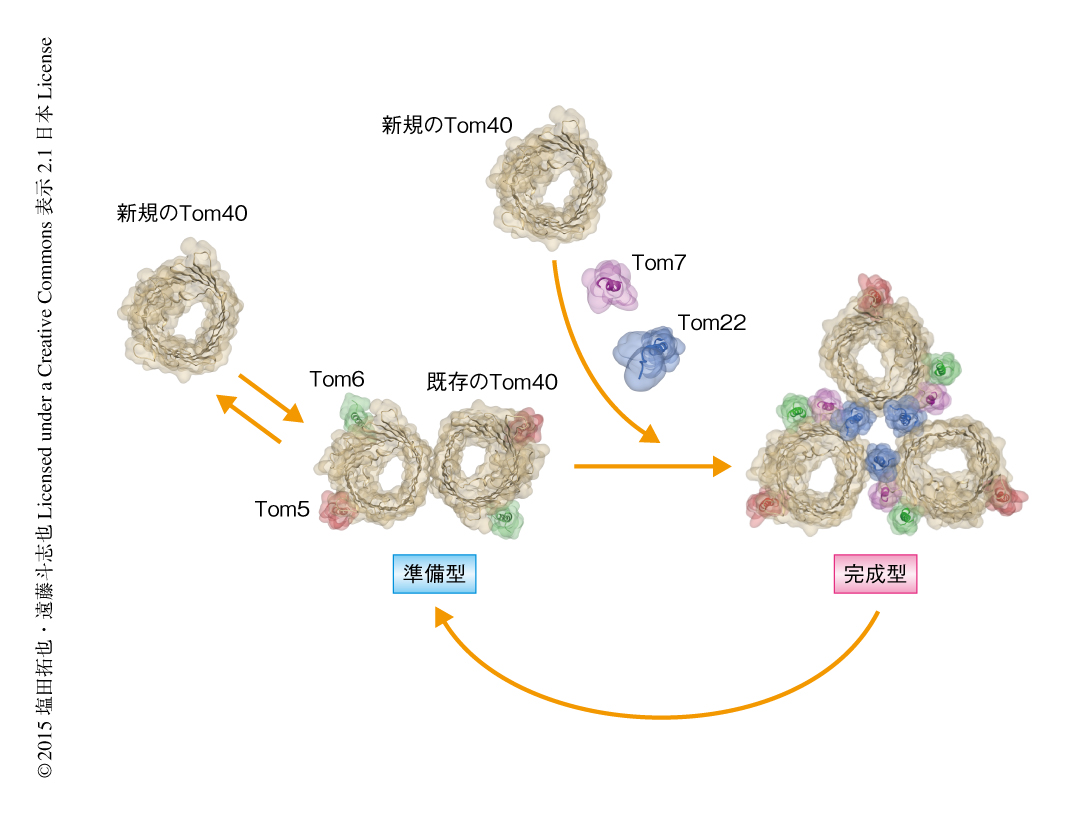
ところが,二価性の架橋剤によりTom40どうしの架橋を試みたところ,Tom40どうしが直接に架橋され,Tom22が糊づけするかたちの三量体複合体の構造とは一致しなかった.詳細な解析により,三量体複合体は糊のTom22が外れることで一部が壊れて2分子のTom40からなる2つの孔がある二量体複合体に可逆的に変換すること,すなわち,Tom40は二量体複合体と三量体複合体とのあいだを行き来することがわかった.三量体複合体はタンパク質のチャネルとなるTom40,糊のTom22,受容体サブユニットがすべてあつまり前駆体タンパク質を膜透過させるためにはたらく完成型(機能複合体)であり,一方,二量体複合体はミトコンドリアに入ってきた新規のTom40を三量体複合体に組み込むための足場としてはたらく準備型(Tom40組み込み用複合体)と考えられた(図2).膜タンパク質複合体が完成したのちもその構造や構成タンパク質を変えることにより,新しいサブユニットを古いサブユニットと入れ替えて完全な機能をもつ複合体を維持していることが,はじめて具体的に証明されたといえるだろう.
この研究により,TOM複合体の機能に関する大きな論争のひとつであった,前駆体タンパク質の通り道がどこであるかについての答えをだすことができた.それだけでなく,Tom40は多様な前駆体タンパク質に対応するためβバレル構造の内側に複数の通り道を用意していることも明らかにされた.正に荷電したミトコンドリア行きのシグナル配列をもつ前駆体タンパク質のための負に荷電した通り道の出口の付近には,やはり負に荷電したTom22の膜間部ドメインが存在し,他方,疎水性の高い前駆体タンパク質のための通り道の出口の付近には,おそらくTom40のN末端側の領域によりあつめられたsmall Timが待ち構えることにより,それぞれの前駆体タンパク質の効率のよい受け渡しを実現しているのであろう.このように,TOM複合体が多種多様な前駆体タンパク質を効率よく輸送するため,巧妙でインテリジェントな装置としてはたらいていることは驚きであった.
また,この研究では,in silicoにおける構造予測とin vivoにおける部位特異的な光架橋法とを組み合わせることにより,アミノ酸残基レベルの空間分解能でTOM複合体の動的なアセンブリー構造を決定した.近年,X線回折,NMR法,クライオ電子顕微鏡解析などの技術の進歩により,膜タンパク質の精密な構造がつぎつぎに明らかにされている.しかし,TOM複合体のように巨大な膜タンパク質複合体で,しかも,組成の異なる複数のアセンブリー構造を動的に行き来するような複合体の構造生物学的な解析はいまだにきわめて困難である.この研究のアプローチがこれまで構造解析の困難であったほかの膜タンパク質複合体についても適用され,機能に結びつく有用な構造情報をあたえることが期待される.
略歴:2012年 名古屋大学大学院理学研究科 修了,同年よりオーストラリアMonash大学 博士研究員.
研究テーマ:ミトコンドリアおよび細菌における外膜タンパク質の輸送装置の解析
抱負:自分ができることすべて使って,柔らかな分子機械タンパク質の作動機序を明らかにしたい.
遠藤 斗志也(Toshiya Endo)
京都産業大学総合生命科学部 教授.
研究室URL:http://endolab.jp/wp/
© 2015 塩田拓也・遠藤斗志也 Licensed under CC 表示 2.1 日本
(1オーストラリアMonash大学Department of Microbiology,2京都産業大学総合生命科学部 生命システム学科)
email:遠藤斗志也
DOI: 10.7875/first.author.2015.112
Molecular architecture of the active mitochondrial protein gate.
Takuya Shiota, Kenichiro Imai, Jian Qiu, Victoria L. Hewitt, Khershing Tan, Hsin-Hui Shen, Noriyuki Sakiyama, Yoshinori Fukasawa, Sikander Hayat, Megumi Kamiya, Arne Elofsson, Kentaro Tomii, Paul Horton, Nils Wiedemann, Nikolaus Pfanner, Trevor Lithgow, Toshiya Endo
Science, 349, 1544-1548 (2015)
この論文に出現する遺伝子・タンパク質のUniprot ID
トランスロケーター, TOM, Tom40(P23644), シャペロン, small Tim, translocase of the outer membrane, VDAC(Q60932), Tom22(P49334), Tim10(P87108)
要 約
ミトコンドリアは構成タンパク質をサイトゾルから取り込むため,トランスロケーターとよばれる膜タンパク質複合体によりミトコンドリアへのタンパク質の交通を厳密に制御している.TOM複合体はミトコンドリア外膜に存在するトランスロケーターで,ほとんどすべてのミトコンドリアタンパク質の入り口として機能する.今回,in silicoにおけるサブユニットの構造予測とin vivoにおける部位特異的な光架橋法とを組み合わせることにより,ミトコンドリアにおけるTOM複合体のアセンブリー構造を明らかにした.TOM複合体におけるチャネルタンパク質であるTom40のつくるβバレル構造の内側は前駆体タンパク質の通り道として機能し,多様な前駆体タンパク質に対応するために複数のカスタマイズされた通り道を用意していた.また,Tom40のN末端側の領域はβバレル構造の内側を貫通して膜間部側に到達しており,膜間部におけるシャペロンタンパク質であるsmall Timをあつめて,効率のよい前駆体タンパク質の受け渡しを実現していた.この研究により,TOM複合体が多種多様な前駆体タンパク質を効率よく取り込むためのインテリジェントな装置としてはたらく構造的な基盤がはじめて明らかにされた.
はじめに
細胞でのエネルギー生産において中心的な役割をはたすミトコンドリアは,外膜と内膜の2枚の生体膜にかこまれ1000種類以上のタンパク質から構成される.これらミトコンドリアタンパク質をコードする遺伝子のほとんどは核のゲノムに移行しており,サイトゾルにおいて前駆体タンパク質として合成されたのちミトコンドリアへと輸送される.前駆体タンパク質のもつ行き先を示すシグナル配列は,ミトコンドリア外膜に存在するトランスロケーター(膜透過装置)であるTOM(translocase of the outer membrane)複合体の受容体サブユニットに認識され,TOM複合体の形成するチャネルを介して外膜を通過しミトコンドリアの内部へと取り込まれる.つづいて,前駆体タンパク質は膜間部にあるsmall Timとよばれるシャペロンタンパク質や,内膜および外膜に存在するほかのトランスロケーターにより,最終的な目的地となる区画へと仕分けられる1).
TOM複合体はチャネルを構成するβバレル型膜タンパク質のTom40と1回膜貫通ヘリックスをもつ6~7種のサブユニットから構成される.おのおののサブユニットの機能についてはくわしい解析がなされているが,TOM複合体の全体の高分解能での構造が決定されていないため,おのおののサブユニットがどのように集合してTOM複合体を形成し,また,おのおののサブユニットがどのように連携して前駆体タンパク質を効率よく膜透過させているかについては明らかにされていなかった.そこで,筆者らは,in silicoにおける構造予測とin vivoにおける部位特異的な光架橋法とを組み合わせることにより,TOM複合体のアセンブリー構造を決定し,それにもとづく機能解析を行った.
1.前駆体タンパク質はTom40が形成するβバレル構造の内側を通過する
TOM複合体のアセンブリー構造を決定するために,ホモロジーモデリング法によりTom40の予測構造を得た.鋳型には,Tom40と同じくミトコンドリア外膜においてβバレル構造をとり,Tom40と相同性の高いことが示されているVDACの結晶構造を用いた2).この構造にもとづき,出芽酵母を用いたin vivoにおける部位特異的な光架橋法により,Tom40と相互作用するタンパク質をアミノ酸残基レベルの空間分解能で解析した.この手法は,光架橋性の側鎖をもつ非天然アミノ酸であるp-ベンゾイルフェニルアラニンをin vivoサプレッサーtRNA法により目的となるタンパク質の任意の部位に導入し3),紫外線の照射により光架橋させてタンパク質のあいだの相互作用を解析する方法である.出芽酵母においてTom40の100箇所以上の部位にひとつずつp-ベンゾイルフェニルアラニンを導入し,ほかのサブユニットと相互作用するアミノ酸残基を決定して相互作用をマッピングした.予測構造は光架橋実験の結果ともよく一致し,過去に報告されたさまざまな生化学的な知見とも矛盾はなく,予測構造が十分に信頼できるものであることが示された.
TOM複合体の機能に関する大きな論争は,前駆体タンパク質の通り道の実体が何かということであった.膜透過する前駆体タンパク質はTom40の“円筒形のβバレル構造の孔”をとおるのか,複数のTom40のβバレル構造が集合して形成する“分子のあいだの隙間の空間”をとおるのか,という問題である.さまざまな部位にp-ベンゾイルフェニルアラニンを導入したTom40を発現させた出芽酵母からミトコンドリアを単離し,in vitro合成法により放射能標識した前駆体タンパク質をくわえ,ここで膜透過の反応を停止させて膜透過中間体を作製し光架橋実験を行った.βバレル構造を構成するβストランドにおいては,あるアミノ酸残基の側鎖が外側を向けば,そのとなりの残基の側鎖は内側を向く.したがって,Tom22などほかのサブユニットと架橋された残基のとなりの残基の側鎖は,必ず内側を向くはずである.光架橋実験の結果,膜透過中間体は内側を向く残基にp-ベンゾイルフェニルアラニンを導入したときのみ架橋されることがわかった.したがって,前駆体タンパク質はβバレル構造の孔の内側をとおり膜透過することがはじめて実験的に証明された.
前駆体タンパク質の種類を変えて膜透過中間体を形成させ,Tom40の孔の内側のどの残基と架橋されるか詳細に調べたところ,正に荷電したミトコンドリア行きのシグナル配列をもつ前駆体タンパク質はTom40の孔の内側の負に荷電した部分と接触しながら孔をとおりぬけ,シグナル配列をもたず全体として疎水性の高い前駆体タンパク質はTom40の孔の内側の疎水性の高い部分と接触しながらとおりぬけることが示された.これらの結果から,Tom40は1000種類にも及ぶさまざまな前駆体タンパク質を効率よくとおすため,孔の内側に前駆体タンパク質の性質に応じてカスタマイズされた複数の通り道を用意していることがわかった(図1).ホモロジー解析によりこれらのカスタマイズされた通り道がほかの生物種においても存在するかどうか調べたところ,ヒトやシロイヌナズナにおいても保存されていることがわかった.
2.Tom40のN末端側の領域は前駆体タンパク質の通り道の出口の付近にsmall Timをあつめる
Tom40はVDACと比べより長いN末端側の領域をもち,予測構造からはこの領域は膜間部に露出しているだろうと推測されたものの,どのような機能をもつかは不明であった.そこで,この領域にp-ベンゾイルフェニルアラニンを導入して光架橋実験を行った.その結果,膜間部に存在するsmall TimのひとつTim10と架橋し,Tom40のN末端側の領域はβバレル構造の内部を貫いて膜間部に到達していることがわかった.small Timは疎水性の高い外膜や内膜の前駆体タンパク質を水溶液の環境である膜間部を通過させるためにはたらくシャペロンタンパク質である1).Tom40のN末端側の領域を欠失した変異体を作製したところ,small Timを必要とする疎水性の高い前駆体タンパク質のin vitroにおけるミトコンドリアへの輸送に阻害がみられ,さらに,これらの変異Tom40を発現する出芽酵母においてsmall Timを必要とする前駆体タンパク質を過剰に発現すると生育に阻害がみられた.これらの結果から,Tom40のN末端側の領域はsmall Timを前駆体タンパク質の通り道の膜間部側の出口の付近にあつめ,前駆体タンパク質を効率よくsmall Timに受け渡すはたらきのあることが示された(図1).
3.TOM複合体の構成の動的な変化
クライオ電子顕微鏡を用いた解析からTOM複合体は2つの孔がある分子種と3つの孔がある分子種の2種類が報告されているが4,5),どちらが実際にミトコンドリアではたらくインタクトな複合体の構造を反映しているのかは不明なままであった.そこで,Tom40とTom22の幾何学的な配置を光架橋実験から推定することを試みた.以前に筆者らは,Tom22の膜貫通ヘリックスは2分子のTom40と相互作用し,Tom40と相互作用する面はTom22のヘリックスの軸について対称な位置関係にはないことを見い出していた6).今回の解析により,Tom40も同様に2分子のTom22と相互作用すること,Tom22と相互作用する面はTom40のβバレル構造の軸についてやはり対称な位置関係にはないことが明らかにされた.そこで,Tom22とTom40のおのおの2つの相互作用面がどのような組合せで結合するのか光架橋実験から明らかにすることにより,Tom40とTom22の幾何学的な位置関係を再構築した.再構築されたTOM複合体はクライオ電子顕微鏡により観察された3つの孔がある構造とよく一致した.したがって,3分子のTom40を3分子のTom22が糊づけするかたちで,3つの孔があるTom40三量体として集合することが明らかにされた.
ところが,二価性の架橋剤によりTom40どうしの架橋を試みたところ,Tom40どうしが直接に架橋され,Tom22が糊づけするかたちの三量体複合体の構造とは一致しなかった.詳細な解析により,三量体複合体は糊のTom22が外れることで一部が壊れて2分子のTom40からなる2つの孔がある二量体複合体に可逆的に変換すること,すなわち,Tom40は二量体複合体と三量体複合体とのあいだを行き来することがわかった.三量体複合体はタンパク質のチャネルとなるTom40,糊のTom22,受容体サブユニットがすべてあつまり前駆体タンパク質を膜透過させるためにはたらく完成型(機能複合体)であり,一方,二量体複合体はミトコンドリアに入ってきた新規のTom40を三量体複合体に組み込むための足場としてはたらく準備型(Tom40組み込み用複合体)と考えられた(図2).膜タンパク質複合体が完成したのちもその構造や構成タンパク質を変えることにより,新しいサブユニットを古いサブユニットと入れ替えて完全な機能をもつ複合体を維持していることが,はじめて具体的に証明されたといえるだろう.
おわりに
この研究により,TOM複合体の機能に関する大きな論争のひとつであった,前駆体タンパク質の通り道がどこであるかについての答えをだすことができた.それだけでなく,Tom40は多様な前駆体タンパク質に対応するためβバレル構造の内側に複数の通り道を用意していることも明らかにされた.正に荷電したミトコンドリア行きのシグナル配列をもつ前駆体タンパク質のための負に荷電した通り道の出口の付近には,やはり負に荷電したTom22の膜間部ドメインが存在し,他方,疎水性の高い前駆体タンパク質のための通り道の出口の付近には,おそらくTom40のN末端側の領域によりあつめられたsmall Timが待ち構えることにより,それぞれの前駆体タンパク質の効率のよい受け渡しを実現しているのであろう.このように,TOM複合体が多種多様な前駆体タンパク質を効率よく輸送するため,巧妙でインテリジェントな装置としてはたらいていることは驚きであった.
また,この研究では,in silicoにおける構造予測とin vivoにおける部位特異的な光架橋法とを組み合わせることにより,アミノ酸残基レベルの空間分解能でTOM複合体の動的なアセンブリー構造を決定した.近年,X線回折,NMR法,クライオ電子顕微鏡解析などの技術の進歩により,膜タンパク質の精密な構造がつぎつぎに明らかにされている.しかし,TOM複合体のように巨大な膜タンパク質複合体で,しかも,組成の異なる複数のアセンブリー構造を動的に行き来するような複合体の構造生物学的な解析はいまだにきわめて困難である.この研究のアプローチがこれまで構造解析の困難であったほかの膜タンパク質複合体についても適用され,機能に結びつく有用な構造情報をあたえることが期待される.
文 献
- Endo, T. & Yamano, K.: Multiple pathways for mitochondrial protein traffic. Biol. Chem., 390, 723-730 (2009)[PubMed]
- Ujwal, R., Cascio, D., Colletier, J. P. et al.: The crystal structure of mouse VDAC1 at 2.3Å resolution reveals mechanistic insights into metabolite gating. Proc. Natl. Acad. Sci. USA, 105, 17742-17747 (2008)[PubMed]
- Chin, J. W., Cropp, T. A., Anderson, J. C. et al.: An expanded eukaryotic genetic code. Science, 301, 964-967 (2003)[PubMed]
- Ahting, U., Thun, C., Hegerl, R. et al.: The TOM core complex: the general protein import pore of the outer membrane of mitochondria. J. Cell Biol., 147, 959-968 (1999)[PubMed]
- Model, K., Meisinger, C. & Kuhlbrandt, W.: Cryo-electron microscopy structure of a yeast mitochondrial preprotein translocase. J. Mol. Biol., 383, 1049-1057 (2008)[PubMed]
- Shiota, T., Mabuchi, H., Tanaka-Yamano, S. et al.: In vivo protein-interaction mapping of a mitochondrial translocator protein Tom22 at work. Proc. Natl. Acad. Sci. USA, 108, 15179-15183 (2011)[PubMed]
著者プロフィール
略歴:2012年 名古屋大学大学院理学研究科 修了,同年よりオーストラリアMonash大学 博士研究員.
研究テーマ:ミトコンドリアおよび細菌における外膜タンパク質の輸送装置の解析
抱負:自分ができることすべて使って,柔らかな分子機械タンパク質の作動機序を明らかにしたい.
遠藤 斗志也(Toshiya Endo)
京都産業大学総合生命科学部 教授.
研究室URL:http://endolab.jp/wp/
© 2015 塩田拓也・遠藤斗志也 Licensed under CC 表示 2.1 日本