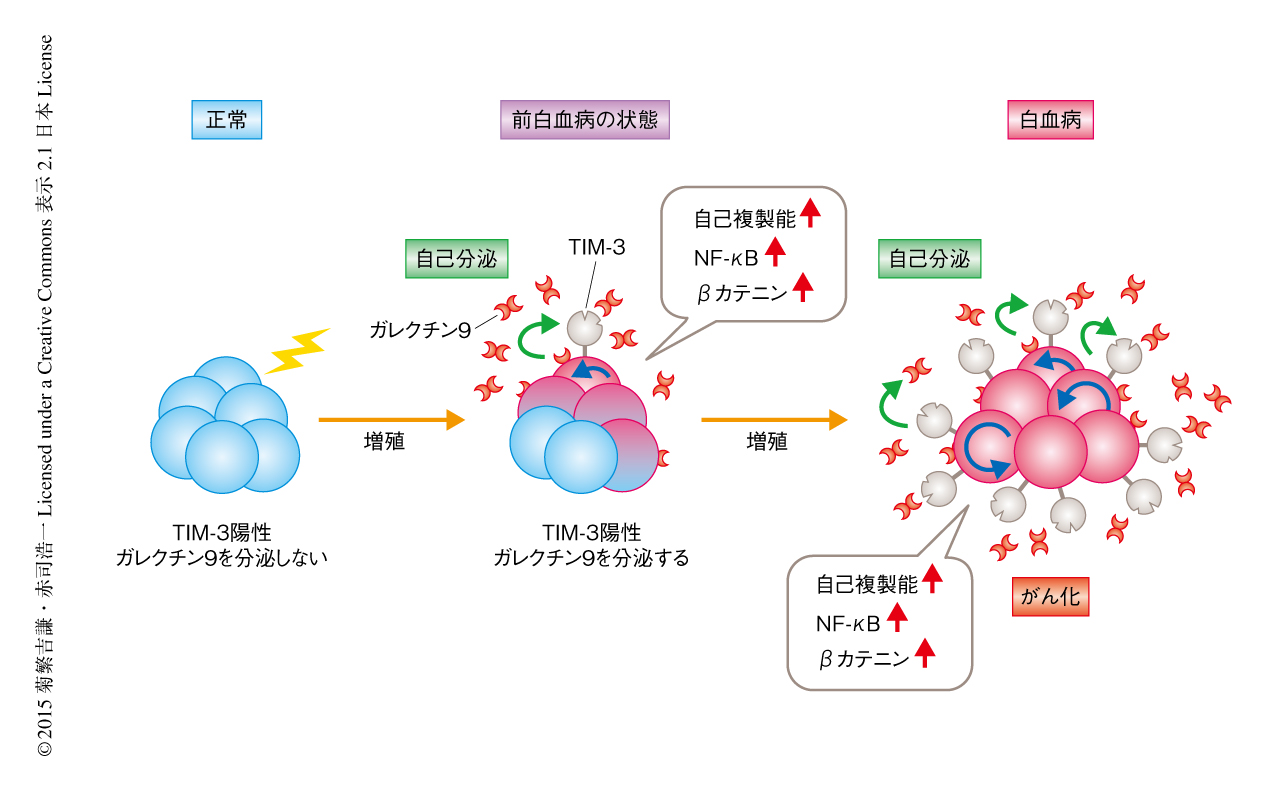
ガレクチン9の自己分泌機構は骨髄系腫瘍において白血病幹細胞の自己複製を強化し白血病の進展に寄与する
菊繁吉謙・赤司浩一
(九州大学大学院医学研究院 病態修復内科学)
email:菊繁吉謙
DOI: 10.7875/first.author.2015.108
A TIM-3/Gal-9 autocrine stimulatory loop drives self-renewal of human myeloid leukemia stem cells and leukemic progression.
Yoshikane Kikushige, Toshihiro Miyamoto, Junichiro Yuda, Siamak Jabbarzadeh-Tabrizi, Takahiro Shima, Shin-ichiro Takayanagi, Hiroaki Niiro, Ayano Yurino, Kohta Miyawaki, Katsuto Takenaka, Hiromi Iwasaki, Koichi Akashi
Cell Stem Cell, 17, 341-352 (2015)
白血病幹細胞は自己複製能と白血病細胞への分化能をもつ白血病の本体ともいえる細胞である.筆者らは,以前に,ヒト急性骨髄性白血病における白血病幹細胞に特異的な表面タンパク質としてTIM-3を同定したが,その白血病幹細胞における機能は不明であった.この研究においては,TIM-3を発現するヒトの白血病幹細胞がそのリガンドであるガレクチン9を自己分泌することにより,白血病幹細胞それ自体にTIM-3シグナルを生じるというユニークな機構を見い出した.このTIM-3シグナルはTIM-3陽性の白血病幹細胞においてがん幹細胞の自己複製において重要な役割を担うことの知られているNF-κBとβカテニンの共活性化を生じていた.さらにこの自己分泌機構は,急性骨髄性白血病のみならずヒトの骨髄系腫瘍の全般において,TIM-3陽性の造血幹細胞がクローンの大きさを拡大させていく過程において機能している可能性が示唆された.
近年,注目をあつめているがん幹細胞モデルは,腫瘍組織を構成するがん細胞のすべてが均一に造腫瘍能をもつのではなく,少数のがん幹細胞のみが自己複製しながら腫瘍を再構築する能力をもつという階層的なモデルである.このようながん幹細胞の存在をはじめて実験的に証明したのは,免疫不全マウスへの異種移植実験による急性骨髄性白血病における白血病幹細胞の同定であった1).白血病幹細胞は正常な造血幹細胞と同じくCD34陽性CD38陰性という表面形質をもつ細胞の画分に存在することが知られている.白血病幹細胞は自己複製能および白血病細胞への限定的な分化能をもつ白血病の本体ともいえる細胞であり,白血病の治癒のためには白血病幹細胞の根絶が必須である.
筆者らは,造血幹細胞にはまったく発現せず急性骨髄性白血病において白血病幹細胞に高く発現する表面タンパク質としてTIM-3を同定し,急性骨髄性白血病の治療の標的として有望であると報告した2)(新着論文レビュー でも掲載).TIM-3はマウスのTh1細胞に特異的なタンパク質として同定されたが3),現在では,exhausted CD8陽性T細胞,制御性T細胞の一部,単球,樹状細胞などにも発現することが知られている.しかしながら,急性骨髄性白血病におけるTIM-3の生物学的な機能についてはまったく不明であった.
TIM-3のリガンドとしてもっとも研究の進んでいたガレクチン9に注目した4).表面プラズモン共鳴法により,ヒトのガレクチン9はヒトのTIM-3に結合することが確認された.すなわち,マウスと同様に,ヒトにおいてもガレクチン9はTIM-3のリガンドであった.ELISA法により血清におけるガレクチン9の濃度を測定したところ,健常者および造血器腫瘍の患者であってもB細胞性腫瘍の患者においてはきわめて低い一方,急性骨髄性白血病の患者においては著明に上昇していた.そこで,急性骨髄性白血病細胞それ自体がガレクチン9を産生し分泌している可能性を考えた.蛍光フローサイトメーターを用いた細胞内染色により,急性骨髄性白血病細胞および白血病幹細胞は細胞質においてガレクチン9を高く発現していることが確認された.
しかしながら,細胞におけるガレクチン9の存在は必ずしもその分泌を意味するものでないことが知られており,急性骨髄性白血病細胞および白血病幹細胞がガレクチン9を分泌しているかどうかを評価する必要があった.近年,細胞膜にガレクチン9を発現している細胞がガレクチン9の産生細胞であるとの報告があったことから5),急性骨髄性白血病細胞および白血病幹細胞の細胞膜においてTIM-3非結合型のガレクチン9の発現について評価した.その結果,ガレクチン9の発現が確認された.
急性骨髄性白血病細胞あるいは白血病幹細胞が実際にガレクチン9を分泌しているかどうかを異種移植実験により評価した.ヒトのCD34陽性の急性骨髄性白血病細胞を免疫不全マウスに移植してヒトの急性骨髄性白血病をマウスにおいて再構築し,マウスの血清におけるヒトのガレクチン9の濃度を測定したところ,急性骨髄性白血病を再構築したマウスにおいては高濃度に検出されたが,臍帯血に由来するCD34陽性細胞を移植してヒトの正常な造血を再構築したマウス,および,B細胞性急性リンパ球性白血病を再構築したマウスにおいてはほとんど検出されなかった.すなわち,ヒトのTIM-3陽性の急性骨髄性白血病細胞あるいは白血病幹細胞は,in vivoにおいてTIM-3のリガンドであるガレクチン9を自己分泌していることが証明された.
ガレクチン9の自己分泌による刺激は白血病幹細胞の機能にどのような影響を及ぼしているかを評価するため,in vivoにおいてガレクチン9とTIM-3との結合を阻害する抗体を用いたガレクチン9の中和実験を行った.ヒトのCD34陽性の急性骨髄性白血病細胞を免疫不全マウスに移植し,移植ののち48時間から抗体の投与を開始し,TIM-3とガレクチン9との結合の阻害が白血病幹細胞の再構築能に及ぼす影響を評価した.その結果,中和抗体を投与しつづけたマウスでは急性骨髄性白血病のキメリズムが有意に低下した.さらに,中和実験のあとに残存する白血病幹細胞を含むCD34陽性の急性骨髄性白血病細胞を純化し2次レシピエントマウスに移植した.対照の抗体を投与したマウスから回収した急性骨髄性白血病細胞は効率的に急性骨髄性白血病を再構築したが,中和抗体を投与したキメリズムの低下したマウスから回収した急性骨髄性白血病細胞は急性骨髄性白血病の再構築が障害されていた.すなわち,TIM-3シグナルの長期間にわたる遮断により自己複製能をもつ白血病幹細胞の数が減少したものと考えられた.これらのデータから,ガレクチン9の自己分泌機構は白血病幹細胞において急性骨髄性白血病の再構築能および自己複製能を正に制御していると考えられた.
ガレクチン9の自己分泌による刺激の下流のシグナルについて明らかにするため,CD34陽性TIM-3陽性の急性骨髄性白血病細胞において,ガレクチン9による刺激の前後で網羅的な遺伝子発現プロファイルを比較した.発現の有意に変化した遺伝子のリストを用いたパスウェイ解析の結果,NF-κBシグナル伝達経路およびβカテニン伝達経路がTIM-3シグナルの下流に位置する可能性が示唆された.そこで,TIM-3シグナルにより急性骨髄性白血病においてNF-κBとβカテニンの共活性化が生じるかどうか検討した.ウェスタンブロット法および細胞内フローサイトメトリー法により,TIM-3陽性の急性骨髄性白血病細胞において生理的な濃度のガレクチン9による刺激によりp65のリン酸化の亢進が生じることが確認され,さらに,p65のリン酸化はAKTおよびERKのリン酸化の亢進と並行して生じており,TIM-3シグナルの下流にMAPキナーゼシグナル伝達経路およびPI3K-AKTシグナル伝達経路の存在する可能性が示唆された.
βカテニンの活性化について検討した.活性化のためβカテニンは核へと移行する必要があることから,CD34陽性TIM-3陽性の急性骨髄性白血病細胞においてガレクチン9による刺激ののちのβカテニンの核への移行を定量した.CD34陽性TIM-3陽性の急性骨髄性白血病細胞を生理的な濃度のガレクチン9のもと20時間にわたり培養すると,βカテニンの核への移行が促進されていることが確認された.さらに,TIM-3シグナルによりPI3K-AKTシグナル伝達経路の活性化の生じることが示唆されていたことから,活性化したAKTによるβカテニンの安定化に重要なSer552のリン酸化をウェスタンブロット法により評価したところ,CD34陽性TIM-3陽性の急性骨髄性白血病細胞においてTIM-3による刺激ののちβカテニンのリン酸化が亢進していることが確認された.MAPキナーゼシグナル伝達経路やPI3K-AKTシグナル伝達経路の活性化はβカテニンを分解するGSK3βの活性を抑制することが複数の悪性腫瘍において報告されている.すなわち,急性骨髄性白血病においては,GSK3βの阻害とともに,βカテニンの直接的な安定化の両方の作用機序により,TIM-3シグナルがβカテニンの核への移行を促進している可能性が考えられた.
近年の研究により,NF-κBとβカテニンの共活性化はがん幹細胞の幹細胞活性において非常に重要な役割を担うことが明らかにされている6).さらに,βカテニンは造血幹細胞あるいは白血病幹細胞の自己複製能において重要な役割を担うことが知られており,実際に,慢性骨髄性白血病の急性転化の過程においてβカテニンの核への移行の生じていることが知られている7).そこで,急性骨髄性白血病のほかの骨髄系腫瘍においても,ガレクチン9の自己分泌機構が機能している可能性について検討した.
骨髄異形成症候群について,病期別にCD34陽性CD38陰性の幹細胞の画分におけるTIM-3の発現を評価した.骨髄異形成症候群は造血幹細胞に蓄積した遺伝子異常を背景として生じるクローナルな造血器疾患であり,一部は急性骨髄性白血病へと進展する前白血病的な性格をもつ.初期においては,CD34陽性CD38陰性TIM-3陽性の白血病幹細胞様の表面形質をもつ異常な造血幹細胞がわずかに認められたが,進展とともにTIM-3陽性の白血病幹細胞様の細胞の割合は増加した.最終的に急性骨髄性白血病へと進展した際には,もともとの急性骨髄性白血病と同様に,CD34陽性CD38陰性の造血幹細胞の画分はTIM-3陽性の白血病幹細胞によりほぼ完全に占拠された.さらに,血清におけるガレクチン9の濃度を測定したところ,初期の段階から上昇していた.すなわち,TIM-3シグナルが骨髄異形成症候群の初期からTIM-3陽性の異常な造血幹細胞において作用している可能性が示唆された.また,骨髄異形成症候群におけるCD34陽性TIM-3陽性の細胞においても,TIM-3陽性の急性骨髄性白血病細胞と同様に,生理的な濃度のガレクチン9による刺激によりNF-κBとβカテニンの共活性化の生じることが確認された.
慢性骨髄性白血病を含む骨髄増殖性腫瘍において,ガレクチン9の自己分泌機構のはたす役割について検討した.骨髄増殖性腫瘍も急性骨髄性白血病や骨髄異形成症候群と同様に造血幹細胞を腫瘍化の起点とする骨髄系腫瘍であり,一部は最終的に急性骨髄性白血病へと進展する前白血病的な性格をもつ.初期(慢性期)において,CD34陽性CD38陰性の造血幹細胞の画分にはTIM-3陽性の白血病幹細胞様の異常な表面形質をもつ造血幹細胞がわずかに存在した.このような慢性期から急性骨髄性白血病へと進展(急性転化)した際には,骨髄異形成症候群と同様に,CD34陽性CD38陰性の造血幹細胞の画分はTIM-3陽性の白血病幹細胞により占拠された.さらに,血清におけるガレクチン9の濃度を測定したところ,慢性期の時点より高値であった.また,慢性骨髄性白血病におけるCD34陽性TIM-3陽性の細胞においても,TIM-3陽性の急性骨髄性白血病細胞と同様に,生理的な濃度のガレクチン9による刺激によりNF-κBとβカテニンの共活性化の生じることが確認された.
これらの結果から,ガレクチン9の自己分泌機構が急性骨髄性白血病のみならず骨髄性腫瘍の全般において機能し,TIM-3陽性の白血病幹細胞にNF-κBとβカテニンの共活性化を誘導し,自己複製能の強化をもたらすことが示唆された.骨髄系腫瘍において白血病幹細胞が残存する正常な造血幹細胞との競合に打ち勝ち白血病の進展の過程においてクローン優位性を獲得するひとつの機序として,ガレクチン9の自己分泌機構の存在が示された.
次世代シークエンサー技術の進展により,自己複製能をもつ造血幹細胞に種々の遺伝子変異が蓄積しプレ白血病幹細胞とよばれる異常な造血幹細胞が出現することが明らかにされてきた8,9).プレ白血病幹細胞にさらにドライバー変異がくわわることにより最終的な白血病幹細胞の出現にいたると考えられている.骨髄系腫瘍の全般において,プレ白血病幹細胞が正常な造血幹細胞と競合しながらもある程度のクローンの大きさを維持し,さらには造血幹細胞との生存競争に打ち勝ちクローン優位性を獲得するひとつの機序として,ガレクチン9の自己分泌機構が提唱された(図1).TIM-3シグナルは急性骨髄性白血病における白血病幹細胞のみならず,骨髄系腫瘍の全般において前白血病状態から白血病への進展の過程においても重要な役割を担う可能性が示された.したがって,TIM-3シグナルを標的としたアプローチは,急性骨髄性白血病における白血病幹細胞を標的とした治療の戦略としてのみならず,慢性期の骨髄系腫瘍から急性骨髄性白血病への進展の抑制を目標とした治療の戦略としても意義があると考えている.
略歴:2009年 九州大学大学院医学系学府博士課程 修了,同年 九州大学病院 医員,2011年 同 助教を経て,2012年より九州大学大学院医学研究院 研究員.
研究テーマ:ヒトの正常および悪性の造血幹細胞.
抱負:分子生物学的な手法を用いたヒトの造血器の疾患,とくに,白血病幹細胞の解析により,白血病の発症機構を明らかにし,造血器の悪性腫瘍の克服をめざす.
赤司 浩一(Koichi Akashi)
九州大学大学院医学研究院 教授.
研究室URL:http://www.med.kyushu-u.ac.jp/intmed1/
© 2015 菊繁吉謙・赤司浩一 Licensed under CC 表示 2.1 日本
(九州大学大学院医学研究院 病態修復内科学)
email:菊繁吉謙
DOI: 10.7875/first.author.2015.108
A TIM-3/Gal-9 autocrine stimulatory loop drives self-renewal of human myeloid leukemia stem cells and leukemic progression.
Yoshikane Kikushige, Toshihiro Miyamoto, Junichiro Yuda, Siamak Jabbarzadeh-Tabrizi, Takahiro Shima, Shin-ichiro Takayanagi, Hiroaki Niiro, Ayano Yurino, Kohta Miyawaki, Katsuto Takenaka, Hiromi Iwasaki, Koichi Akashi
Cell Stem Cell, 17, 341-352 (2015)
要 約
白血病幹細胞は自己複製能と白血病細胞への分化能をもつ白血病の本体ともいえる細胞である.筆者らは,以前に,ヒト急性骨髄性白血病における白血病幹細胞に特異的な表面タンパク質としてTIM-3を同定したが,その白血病幹細胞における機能は不明であった.この研究においては,TIM-3を発現するヒトの白血病幹細胞がそのリガンドであるガレクチン9を自己分泌することにより,白血病幹細胞それ自体にTIM-3シグナルを生じるというユニークな機構を見い出した.このTIM-3シグナルはTIM-3陽性の白血病幹細胞においてがん幹細胞の自己複製において重要な役割を担うことの知られているNF-κBとβカテニンの共活性化を生じていた.さらにこの自己分泌機構は,急性骨髄性白血病のみならずヒトの骨髄系腫瘍の全般において,TIM-3陽性の造血幹細胞がクローンの大きさを拡大させていく過程において機能している可能性が示唆された.
はじめに
近年,注目をあつめているがん幹細胞モデルは,腫瘍組織を構成するがん細胞のすべてが均一に造腫瘍能をもつのではなく,少数のがん幹細胞のみが自己複製しながら腫瘍を再構築する能力をもつという階層的なモデルである.このようながん幹細胞の存在をはじめて実験的に証明したのは,免疫不全マウスへの異種移植実験による急性骨髄性白血病における白血病幹細胞の同定であった1).白血病幹細胞は正常な造血幹細胞と同じくCD34陽性CD38陰性という表面形質をもつ細胞の画分に存在することが知られている.白血病幹細胞は自己複製能および白血病細胞への限定的な分化能をもつ白血病の本体ともいえる細胞であり,白血病の治癒のためには白血病幹細胞の根絶が必須である.
筆者らは,造血幹細胞にはまったく発現せず急性骨髄性白血病において白血病幹細胞に高く発現する表面タンパク質としてTIM-3を同定し,急性骨髄性白血病の治療の標的として有望であると報告した2)(新着論文レビュー でも掲載).TIM-3はマウスのTh1細胞に特異的なタンパク質として同定されたが3),現在では,exhausted CD8陽性T細胞,制御性T細胞の一部,単球,樹状細胞などにも発現することが知られている.しかしながら,急性骨髄性白血病におけるTIM-3の生物学的な機能についてはまったく不明であった.
1.TIM-3陽性の急性骨髄性白血病細胞はガレクチン9を自己分泌している
TIM-3のリガンドとしてもっとも研究の進んでいたガレクチン9に注目した4).表面プラズモン共鳴法により,ヒトのガレクチン9はヒトのTIM-3に結合することが確認された.すなわち,マウスと同様に,ヒトにおいてもガレクチン9はTIM-3のリガンドであった.ELISA法により血清におけるガレクチン9の濃度を測定したところ,健常者および造血器腫瘍の患者であってもB細胞性腫瘍の患者においてはきわめて低い一方,急性骨髄性白血病の患者においては著明に上昇していた.そこで,急性骨髄性白血病細胞それ自体がガレクチン9を産生し分泌している可能性を考えた.蛍光フローサイトメーターを用いた細胞内染色により,急性骨髄性白血病細胞および白血病幹細胞は細胞質においてガレクチン9を高く発現していることが確認された.
しかしながら,細胞におけるガレクチン9の存在は必ずしもその分泌を意味するものでないことが知られており,急性骨髄性白血病細胞および白血病幹細胞がガレクチン9を分泌しているかどうかを評価する必要があった.近年,細胞膜にガレクチン9を発現している細胞がガレクチン9の産生細胞であるとの報告があったことから5),急性骨髄性白血病細胞および白血病幹細胞の細胞膜においてTIM-3非結合型のガレクチン9の発現について評価した.その結果,ガレクチン9の発現が確認された.
急性骨髄性白血病細胞あるいは白血病幹細胞が実際にガレクチン9を分泌しているかどうかを異種移植実験により評価した.ヒトのCD34陽性の急性骨髄性白血病細胞を免疫不全マウスに移植してヒトの急性骨髄性白血病をマウスにおいて再構築し,マウスの血清におけるヒトのガレクチン9の濃度を測定したところ,急性骨髄性白血病を再構築したマウスにおいては高濃度に検出されたが,臍帯血に由来するCD34陽性細胞を移植してヒトの正常な造血を再構築したマウス,および,B細胞性急性リンパ球性白血病を再構築したマウスにおいてはほとんど検出されなかった.すなわち,ヒトのTIM-3陽性の急性骨髄性白血病細胞あるいは白血病幹細胞は,in vivoにおいてTIM-3のリガンドであるガレクチン9を自己分泌していることが証明された.
2.ガレクチン9の自己分泌機構は急性骨髄性白血病の再構築能および自己複製能を正に制御する
ガレクチン9の自己分泌による刺激は白血病幹細胞の機能にどのような影響を及ぼしているかを評価するため,in vivoにおいてガレクチン9とTIM-3との結合を阻害する抗体を用いたガレクチン9の中和実験を行った.ヒトのCD34陽性の急性骨髄性白血病細胞を免疫不全マウスに移植し,移植ののち48時間から抗体の投与を開始し,TIM-3とガレクチン9との結合の阻害が白血病幹細胞の再構築能に及ぼす影響を評価した.その結果,中和抗体を投与しつづけたマウスでは急性骨髄性白血病のキメリズムが有意に低下した.さらに,中和実験のあとに残存する白血病幹細胞を含むCD34陽性の急性骨髄性白血病細胞を純化し2次レシピエントマウスに移植した.対照の抗体を投与したマウスから回収した急性骨髄性白血病細胞は効率的に急性骨髄性白血病を再構築したが,中和抗体を投与したキメリズムの低下したマウスから回収した急性骨髄性白血病細胞は急性骨髄性白血病の再構築が障害されていた.すなわち,TIM-3シグナルの長期間にわたる遮断により自己複製能をもつ白血病幹細胞の数が減少したものと考えられた.これらのデータから,ガレクチン9の自己分泌機構は白血病幹細胞において急性骨髄性白血病の再構築能および自己複製能を正に制御していると考えられた.
3.ガレクチン9の自己分泌機構はNF-κBとβカテニンの共活性化を生じる
ガレクチン9の自己分泌による刺激の下流のシグナルについて明らかにするため,CD34陽性TIM-3陽性の急性骨髄性白血病細胞において,ガレクチン9による刺激の前後で網羅的な遺伝子発現プロファイルを比較した.発現の有意に変化した遺伝子のリストを用いたパスウェイ解析の結果,NF-κBシグナル伝達経路およびβカテニン伝達経路がTIM-3シグナルの下流に位置する可能性が示唆された.そこで,TIM-3シグナルにより急性骨髄性白血病においてNF-κBとβカテニンの共活性化が生じるかどうか検討した.ウェスタンブロット法および細胞内フローサイトメトリー法により,TIM-3陽性の急性骨髄性白血病細胞において生理的な濃度のガレクチン9による刺激によりp65のリン酸化の亢進が生じることが確認され,さらに,p65のリン酸化はAKTおよびERKのリン酸化の亢進と並行して生じており,TIM-3シグナルの下流にMAPキナーゼシグナル伝達経路およびPI3K-AKTシグナル伝達経路の存在する可能性が示唆された.
βカテニンの活性化について検討した.活性化のためβカテニンは核へと移行する必要があることから,CD34陽性TIM-3陽性の急性骨髄性白血病細胞においてガレクチン9による刺激ののちのβカテニンの核への移行を定量した.CD34陽性TIM-3陽性の急性骨髄性白血病細胞を生理的な濃度のガレクチン9のもと20時間にわたり培養すると,βカテニンの核への移行が促進されていることが確認された.さらに,TIM-3シグナルによりPI3K-AKTシグナル伝達経路の活性化の生じることが示唆されていたことから,活性化したAKTによるβカテニンの安定化に重要なSer552のリン酸化をウェスタンブロット法により評価したところ,CD34陽性TIM-3陽性の急性骨髄性白血病細胞においてTIM-3による刺激ののちβカテニンのリン酸化が亢進していることが確認された.MAPキナーゼシグナル伝達経路やPI3K-AKTシグナル伝達経路の活性化はβカテニンを分解するGSK3βの活性を抑制することが複数の悪性腫瘍において報告されている.すなわち,急性骨髄性白血病においては,GSK3βの阻害とともに,βカテニンの直接的な安定化の両方の作用機序により,TIM-3シグナルがβカテニンの核への移行を促進している可能性が考えられた.
4.ガレクチン9の自己分泌機構は骨髄系腫瘍の全般において白血病幹細胞のクローン優位性の獲得に寄与する
近年の研究により,NF-κBとβカテニンの共活性化はがん幹細胞の幹細胞活性において非常に重要な役割を担うことが明らかにされている6).さらに,βカテニンは造血幹細胞あるいは白血病幹細胞の自己複製能において重要な役割を担うことが知られており,実際に,慢性骨髄性白血病の急性転化の過程においてβカテニンの核への移行の生じていることが知られている7).そこで,急性骨髄性白血病のほかの骨髄系腫瘍においても,ガレクチン9の自己分泌機構が機能している可能性について検討した.
骨髄異形成症候群について,病期別にCD34陽性CD38陰性の幹細胞の画分におけるTIM-3の発現を評価した.骨髄異形成症候群は造血幹細胞に蓄積した遺伝子異常を背景として生じるクローナルな造血器疾患であり,一部は急性骨髄性白血病へと進展する前白血病的な性格をもつ.初期においては,CD34陽性CD38陰性TIM-3陽性の白血病幹細胞様の表面形質をもつ異常な造血幹細胞がわずかに認められたが,進展とともにTIM-3陽性の白血病幹細胞様の細胞の割合は増加した.最終的に急性骨髄性白血病へと進展した際には,もともとの急性骨髄性白血病と同様に,CD34陽性CD38陰性の造血幹細胞の画分はTIM-3陽性の白血病幹細胞によりほぼ完全に占拠された.さらに,血清におけるガレクチン9の濃度を測定したところ,初期の段階から上昇していた.すなわち,TIM-3シグナルが骨髄異形成症候群の初期からTIM-3陽性の異常な造血幹細胞において作用している可能性が示唆された.また,骨髄異形成症候群におけるCD34陽性TIM-3陽性の細胞においても,TIM-3陽性の急性骨髄性白血病細胞と同様に,生理的な濃度のガレクチン9による刺激によりNF-κBとβカテニンの共活性化の生じることが確認された.
慢性骨髄性白血病を含む骨髄増殖性腫瘍において,ガレクチン9の自己分泌機構のはたす役割について検討した.骨髄増殖性腫瘍も急性骨髄性白血病や骨髄異形成症候群と同様に造血幹細胞を腫瘍化の起点とする骨髄系腫瘍であり,一部は最終的に急性骨髄性白血病へと進展する前白血病的な性格をもつ.初期(慢性期)において,CD34陽性CD38陰性の造血幹細胞の画分にはTIM-3陽性の白血病幹細胞様の異常な表面形質をもつ造血幹細胞がわずかに存在した.このような慢性期から急性骨髄性白血病へと進展(急性転化)した際には,骨髄異形成症候群と同様に,CD34陽性CD38陰性の造血幹細胞の画分はTIM-3陽性の白血病幹細胞により占拠された.さらに,血清におけるガレクチン9の濃度を測定したところ,慢性期の時点より高値であった.また,慢性骨髄性白血病におけるCD34陽性TIM-3陽性の細胞においても,TIM-3陽性の急性骨髄性白血病細胞と同様に,生理的な濃度のガレクチン9による刺激によりNF-κBとβカテニンの共活性化の生じることが確認された.
これらの結果から,ガレクチン9の自己分泌機構が急性骨髄性白血病のみならず骨髄性腫瘍の全般において機能し,TIM-3陽性の白血病幹細胞にNF-κBとβカテニンの共活性化を誘導し,自己複製能の強化をもたらすことが示唆された.骨髄系腫瘍において白血病幹細胞が残存する正常な造血幹細胞との競合に打ち勝ち白血病の進展の過程においてクローン優位性を獲得するひとつの機序として,ガレクチン9の自己分泌機構の存在が示された.
おわりに
次世代シークエンサー技術の進展により,自己複製能をもつ造血幹細胞に種々の遺伝子変異が蓄積しプレ白血病幹細胞とよばれる異常な造血幹細胞が出現することが明らかにされてきた8,9).プレ白血病幹細胞にさらにドライバー変異がくわわることにより最終的な白血病幹細胞の出現にいたると考えられている.骨髄系腫瘍の全般において,プレ白血病幹細胞が正常な造血幹細胞と競合しながらもある程度のクローンの大きさを維持し,さらには造血幹細胞との生存競争に打ち勝ちクローン優位性を獲得するひとつの機序として,ガレクチン9の自己分泌機構が提唱された(図1).TIM-3シグナルは急性骨髄性白血病における白血病幹細胞のみならず,骨髄系腫瘍の全般において前白血病状態から白血病への進展の過程においても重要な役割を担う可能性が示された.したがって,TIM-3シグナルを標的としたアプローチは,急性骨髄性白血病における白血病幹細胞を標的とした治療の戦略としてのみならず,慢性期の骨髄系腫瘍から急性骨髄性白血病への進展の抑制を目標とした治療の戦略としても意義があると考えている.
文 献
- Bonnet, D. & Dick, J. E.: Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med., 3, 730-737 (1997)[PubMed]
- Kikushige, Y., Shima, T., Takayanagi, S. et al.: TIM-3 is a promising target to selectively kill acute myeloid leukemia stem cells. Cell Stem Cell, 7, 708-717 (2010)[PubMed] [新着論文レビュー]
- Monney, L., Sabatos, C. A., Gaglia, J. L. et al.: Th1-specific cell surface protein Tim-3 regulates macrophage activation and severity of an autoimmune disease. Nature, 415, 536-541 (2002)[PubMed]
- Zhu, C., Anderson, A. C., Schubart, A. et al.: The Tim-3 ligand galectin-9 negatively regulates T helper type 1 immunity. Nat. Immunol., 6, 1245-1252 (2005)[PubMed]
- Oomizu, S., Arikawa, T., Niki, T. et al.: Cell surface galectin-9 expressing Th cells regulate Th17 and Foxp3+ Treg development by galectin-9 secretion. PLoS One, 7, e48574 (2012)[PubMed]
- Schwitalla, S., Fingerle, A. A., Cammareri, P. et al.: Intestinal tumorigenesis initiated by dedifferentiation and acquisition of stem-cell-like properties. Cell, 152, 25-38 (2013)[PubMed]
- Jamieson, C. H., Ailles, L. E., Dylla, S. J. et al.: Granulocyte-macrophage progenitors as candidate leukemic stem cells in blast-crisis CML. N. Engl. J. Med., 351, 657-667 (2004)[PubMed]
- Jan, M., Snyder, T. M., Corces-Zimmerman, M. R. et al.: Clonal evolution of preleukemic hematopoietic stem cells precedes human acute myeloid leukemia. Sci. Transl. Med., 4, 149ra118 (2012)[PubMed]
- Shlush, L. I., Zandi, S., Mitchell, A. et al.: Identification of pre-leukaemic haematopoietic stem cells in acute leukaemia. Nature, 506, 328-333 (2014)[PubMed]
著者プロフィール
略歴:2009年 九州大学大学院医学系学府博士課程 修了,同年 九州大学病院 医員,2011年 同 助教を経て,2012年より九州大学大学院医学研究院 研究員.
研究テーマ:ヒトの正常および悪性の造血幹細胞.
抱負:分子生物学的な手法を用いたヒトの造血器の疾患,とくに,白血病幹細胞の解析により,白血病の発症機構を明らかにし,造血器の悪性腫瘍の克服をめざす.
赤司 浩一(Koichi Akashi)
九州大学大学院医学研究院 教授.
研究室URL:http://www.med.kyushu-u.ac.jp/intmed1/
© 2015 菊繁吉謙・赤司浩一 Licensed under CC 表示 2.1 日本