キネシンスーパーファミリーKIF3Aは神経の活動に依存してリン酸化されNカドヘリンを輸送する
一ノ瀬聡太郎・廣川信隆
(東京大学大学院医学系研究科 分子構造・動態学講座)
email:廣川信隆
DOI: 10.7875/first.author.2015.107
Mechanism of activity-dependent cargo loading via the phosphorylation of KIF3A by PKA and CaMKIIa.
Sotaro Ichinose, Tadayuki Ogawa, Nobutaka Hirokawa
Neuron, 87, 1022-1035 (2015)
シナプス接着タンパク質のひとつであるNカドヘリンはニューロンの機能において重要な役割をはたしており,シナプスの活動や可塑性に応じて転写および翻訳されたのち,KIF3ヘテロ三量体によりシナプスへと輸送される.しかしながら,その輸送の制御機構,とくに,KIF3ヘテロ三量体との結合の機構についてはこれまで不明であった.この研究において,キネシンスーパーファミリーのメンバーであるKIF3Aは,カーゴと結合しているときには結合していないときと比較して高くリン酸化されていることが明らかにされた.質量分析法によるリン酸化部位の検出により,このリン酸化を触媒するキナーゼはプロテインキナーゼAおよびCa2+/カルモジュリン依存性キナーゼIIaであると特定された.さらに,KIF3Aのリン酸化変異体およびキナーゼの阻害剤を用いて,このリン酸化がKIF3Aとの結合および輸送を促進していることが示され,このリン酸化およびそれにともなうNカドヘリンとの結合が神経活動の慢性的な抑制により促進されていることが明らかにされた.以上の結果より,神経の活動に依存的なリン酸化によるKIF3ヘテロ三量体による輸送の制御機構が解明された.
キネシンスーパーファミリーは微小管のうえをカーゴを輸送するモータータンパク質であり,さまざまなタンパク質,オルガネラ,mRNAなどの細胞における輸送を担っている.キネシンスーパーファミリーによる輸送の制御機構はさまざまであり,リン酸化,Rab GTPase,Ca2+シグナル伝達系によるものが代表的である1,2).カーゴとの解離がリン酸化により制御されている一方で,カーゴとの結合の制御機構についてはこれまで不明であった.
Nカドヘリンはシナプス接着タンパク質のひとつであり,シナプス強度とNカドヘリンのシナプスへの集積量とのあいだに相関のあることが報告され,長期増強や恒常的な可塑性におけるシナプス強度の変化において重要な役割をはたしている3,4).筆者らによる以前の研究により,NカドヘリンはキネシンスーパーファミリーのメンバーであるKIF3A,KIF3B,KAP3からなるKIF3ヘテロ三量体により輸送されていることが示されている5).今回の研究においては,神経の活動に依存的なNカドヘリンの輸送の制御機構について追究した.
カーゴと結合しているKIF3Aとカーゴと結合していないKIF3Aのリン酸化の状態を比較するため,遠心分離による細胞質画分および顆粒画分から,KIF3AおよびKAP3に対する混合抗体,および,抗Nカドヘリン抗体を用いてKIF3Aを共免疫沈降した.リン酸化タグ電気泳動法によりリン酸化KIF3Aと非リン酸化KIF3Aを分離し,ウェスタンブロッティング法によりリン酸化KIF3Aの割合を比較したところ,Nカドヘリンを含むカーゴと結合しているKIF3Aは,カーゴと結合していないKIF3Aと比べ,高度にリン酸化されていることがわかった.質量分析法を用いてリン酸化部位を特定したところ,C末端のカーゴとの結合領域にあるSer689,Thr694,Ser698の3つの部位が検出された.
Ser689,Thr694,Ser698の3つの部位のリン酸化を触媒するキナーゼを特定するため,大腸菌において発現させたKIF3AのC末端のカーゴとの結合領域を試験管内において40種類のキナーゼと反応させ,リン酸化タグ電気泳動法によりリン酸化を検出した.その結果,17種類のキナーゼがKIF3Aをリン酸化することがわかった.このなかから,ニューロンにおける機能およびキナーゼの反応モチーフを参考にして,候補をCa2+/カルモジュリン依存性キナーゼIIa,Ca2+/カルモジュリン依存性キナーゼIIb,プロテインキナーゼA,プロテインキナーゼCa,RSKの5種類にしぼった.試験管内においてこれらのキナーゼと反応させたKIF3Aのカーゴとの結合領域に由来するペプチドを安定同位体により標識したのち,高速液体クロマトグラフィー-質量分析法によりリン酸化を定量した.その結果,Ser689のリン酸化したペプチド,および,Thr694およびSer698のリン酸化したペプチドが分離され,Ser689をリン酸化しているキナーゼはプロテインキナーゼA,Thr694およびSer698をリン酸化しているキナーゼはCa2+/カルモジュリン依存性キナーゼIIaであることがわかった.これら3つのリン酸化部位をAlaに置換した非リン酸型KIF3A変異体を用いてin vivoおよびin vitroにおいてプロテインキナーゼAあるいはCa2+/カルモジュリン依存性キナーゼIIaと反応させたところ,リン酸化が減少したことから,これら3つのリン酸化部位を触媒するキナーゼはプロテインキナーゼAおよびCa2+/カルモジュリン依存性キナーゼIIaであることが強く示唆された.
これらのリン酸化はどのような役割をはたしているであろうか.このリン酸化部位がKIF3AのC末端のカーゴとの結合領域に存在することに着目し,KIF3Aとカーゴとの結合を比較した.Ser689,Thr694,Ser698の3つのリン酸化部位をGluに置換したリン酸化型KIF3A変異体,および,Alaに置換した非リン酸化型KIF3A変異体を用いて,脳の抽出液においてGSTプルダウン法によりNカドヘリンとの結合量を比較したところ,リン酸化型KIF3A変異体は非リン酸化型KIF3A変異体に比べ結合量の多いことがわかった.さらに,リン酸化型KIF3A変異体あるいは非リン酸化型KIF3A変異体を分散培養したニューロンにおいて発現させ,顕微鏡によりNカドヘリンとの共局在を観察したところ,リン酸化型KIF3A変異体は非リン酸化型KIF3A変異体に比べNカドヘリンとの局在が増加していた.つまり,KIF3Aはリン酸化によりNカドヘリンと結合していると考えられた.このリン酸化がカーゴとの結合のほか,微小管のうえでの動きにも影響するかどうか,微小管グライディングアッセイおよびATPase活性の測定の2つの方法により調べたが,影響はみられなかった.このことから,KIF3AのC末端のカーゴとの結合領域のリン酸化はカーゴとの結合の制御において重要であることが示唆された.
カーゴとの結合の制御はNカドヘリンの輸送あるいはニューロンの機能にどのような影響をあたえているのだろうか.Ser689,Thr694,Ser698のリン酸化型KIF3A変異体,非リン酸化型KIF3A変異体,野生型のKIF3Aをそれぞれ,分散培養したニューロンにおいて発現させ,その形態を共焦点レーザー顕微鏡により観察した.すると,リン酸化型KIF3A変異体を発現させたニューロンにおいては野生型KIF3Aを発現させたニューロンに比べスパインの肥大が,逆に,非リン酸化型KIF3A変異体を発現させたニューロンにおいてはスパインの縮小が観察された.さらに,リン酸化型KIF3A変異体を発現させたニューロンにおいてはNカドヘリンが正常にスパインに局在しているのに対し,非リン酸化型KIF3A変異体を発現させたニューロンにおいてはNカドヘリンが細胞体の周辺に蓄積しスパインにはほとんど局在していないことが観察された.この結果は,スパインの大きさはNカドヘリンのスパインへの集積に左右されるという過去の報告と一致した6,7).そこで,Nカドヘリンの輸送を蛍光顕微鏡を用いたライブイメージング法により観察した.プロテインキナーゼAの阻害剤およびCa2+/カルモジュリン依存性キナーゼIIaの阻害剤を培地に添加したところ,30分のちにNカドヘリンの輸送は有意に減少した.以上の結果から,KIF3Aのリン酸化はNカドヘリンの輸送を促進してNカドヘリンをスパインへと集積させ,その結果,スパインの形態を変化させると考えられた.
KIF3Aのリン酸化はどのようなときに生じるのだろうか.ニューロンの慢性的な抑制のときAMPA型グルタミン酸受容体やシナプス接着タンパク質がスパインに集積しシナプスの伝達効率を上昇させる8,9),シナプスの伝達効率の変化にはAMPA型グルタミン酸受容体だけでなくNカドヘリンのスパインへの集積が重要である10),という2つの別の報告を参考にして,ニューロンの慢性的な抑制のときのNカドヘリンの輸送およびKIF3Aのリン酸化について調べた.ニューロンの分散培養において培地にテトロドトキシンを添加することによりニューロンを慢性的に抑制し,このときのNカドヘリンの輸送および局在をスピニングディスク共焦点顕微鏡を用いたライブイメージング法により観察した.その結果,テトロドトキシンを添加してから3時間のちにNカドヘリンの輸送の増加,および,Nカドヘリンのスパインへの集積が同時に観察された.また,このときのKIF3AとNカドヘリンの結合量を定量したところ,細胞体および樹状突起において有意に増加していた.ニューロンを抑制したときのKIF3Aのリン酸化をリン酸化タグ電気泳動法により定量したところ,テトロドトキシンを添加してから3時間のちにKIF3Aのリン酸化が有意に増加していた.
リン酸化の増加した部位がさきに特定されたSer689,Thr694,Ser698であるかどうかを確かめるため,これらの部位の非リン酸化型KIF3A変異体あるいは野生型のKIF3Aを発現させたニューロンの培地にテトロドトキシンを添加し,KIF3Aのリン酸化をリン酸化タグ電気泳動法により定量したところ,非リン酸化型KIF3A変異体を発現させたニューロンにおいては野生型KIF3Aを発現させたニューロンに比べKIF3Aのリン酸化が減少していた.また同様に,非リン酸化型KIF3A変異体あるいは野生型KIF3Aを発現させたニューロンの培地にテトロドトキシンを添加したときのNカドヘリンの輸送および局在をライブイメージング法により観察したところ,野生型KIF3Aを発現させたニューロンにおいてはテトロドトキシンの添加によりNカドヘリンの輸送およびスパインへの局在が促進されたが,非リン酸化型KIF3A変異体を発現させたニューロンではNカドヘリンの輸送もスパインへの局在もほとんど観察されなかった.
以上の結果から,ニューロンの慢性的な抑制のときにKIF3AのSer689,Thr694,Ser698がリン酸化され,それによりNカドヘリンを輸送しスパインへと集積させていると考えられた.
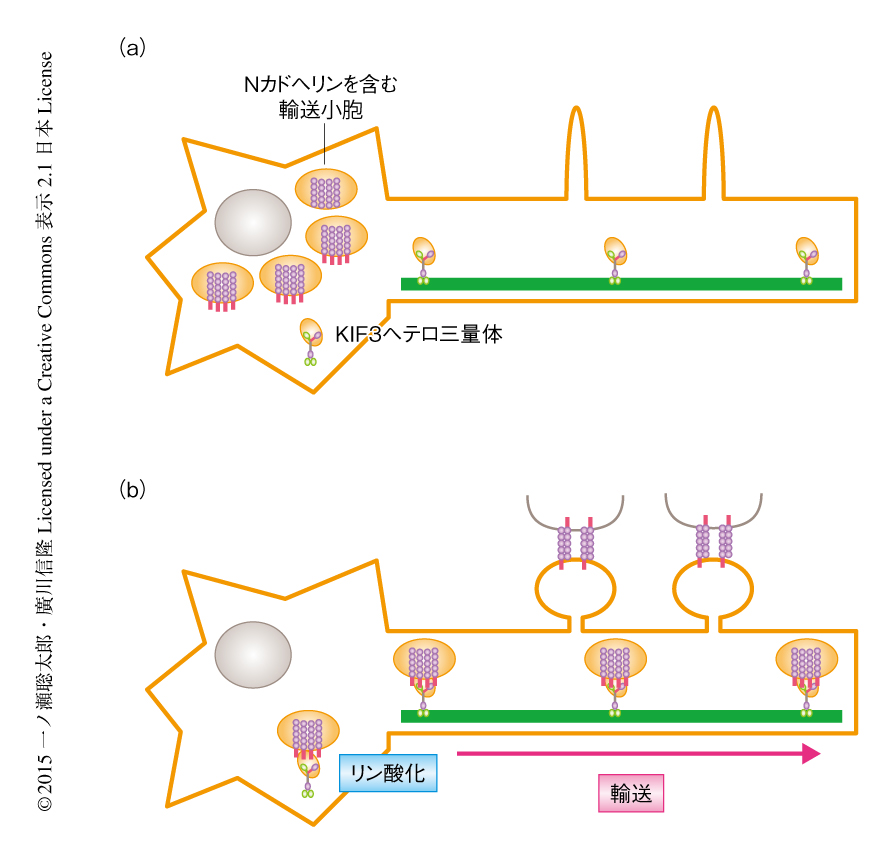
今回の研究により,ニューロンを慢性的に抑制するとリン酸化されたKIF3AがNカドヘリンと結合して輸送しスパインへと集積させるという結論が得られた(図1).この結論は,ニューロンを慢性的に抑制したときにシナプスの伝達効率が上昇すること,シナプスの伝達効率の上昇にはNカドヘリンが重要であること,という過去の報告と矛盾しなかった10-12).これらの恒常的な可塑性はニューロンの全体において生じるため,KIF3Aのリン酸化の増加やNカドヘリンの輸送の増加は容易に観察されたが,可塑性の生じる場所が限定される場合にも同様の反応が起こっている可能性が高い.今後,微小ダイナミクスの解析によるさらに詳細な輸送機構の解明が期待され,また,睡眠のときの記憶の固定などのときのシグナル伝達の解明や13),記憶が低下する状況の改善への応用なども可能であろう.
略歴:2013年 東京大学大学院医学系研究科博士課程 修了,同年より同 特任研究員.
研究テーマ:ニューロンにおけるキネシンスーパーファミリーのリン酸化.
抱負:日進月歩.
廣川 信隆(Nobutaka Hirokawa)
東京大学大学院医学系研究科 特任教授.
研究室URL:http://cb.m.u-tokyo.ac.jp/index-ja.html
© 2015 一ノ瀬聡太郎・廣川信隆 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 分子構造・動態学講座)
email:廣川信隆
DOI: 10.7875/first.author.2015.107
Mechanism of activity-dependent cargo loading via the phosphorylation of KIF3A by PKA and CaMKIIa.
Sotaro Ichinose, Tadayuki Ogawa, Nobutaka Hirokawa
Neuron, 87, 1022-1035 (2015)
要 約
シナプス接着タンパク質のひとつであるNカドヘリンはニューロンの機能において重要な役割をはたしており,シナプスの活動や可塑性に応じて転写および翻訳されたのち,KIF3ヘテロ三量体によりシナプスへと輸送される.しかしながら,その輸送の制御機構,とくに,KIF3ヘテロ三量体との結合の機構についてはこれまで不明であった.この研究において,キネシンスーパーファミリーのメンバーであるKIF3Aは,カーゴと結合しているときには結合していないときと比較して高くリン酸化されていることが明らかにされた.質量分析法によるリン酸化部位の検出により,このリン酸化を触媒するキナーゼはプロテインキナーゼAおよびCa2+/カルモジュリン依存性キナーゼIIaであると特定された.さらに,KIF3Aのリン酸化変異体およびキナーゼの阻害剤を用いて,このリン酸化がKIF3Aとの結合および輸送を促進していることが示され,このリン酸化およびそれにともなうNカドヘリンとの結合が神経活動の慢性的な抑制により促進されていることが明らかにされた.以上の結果より,神経の活動に依存的なリン酸化によるKIF3ヘテロ三量体による輸送の制御機構が解明された.
はじめに
キネシンスーパーファミリーは微小管のうえをカーゴを輸送するモータータンパク質であり,さまざまなタンパク質,オルガネラ,mRNAなどの細胞における輸送を担っている.キネシンスーパーファミリーによる輸送の制御機構はさまざまであり,リン酸化,Rab GTPase,Ca2+シグナル伝達系によるものが代表的である1,2).カーゴとの解離がリン酸化により制御されている一方で,カーゴとの結合の制御機構についてはこれまで不明であった.
Nカドヘリンはシナプス接着タンパク質のひとつであり,シナプス強度とNカドヘリンのシナプスへの集積量とのあいだに相関のあることが報告され,長期増強や恒常的な可塑性におけるシナプス強度の変化において重要な役割をはたしている3,4).筆者らによる以前の研究により,NカドヘリンはキネシンスーパーファミリーのメンバーであるKIF3A,KIF3B,KAP3からなるKIF3ヘテロ三量体により輸送されていることが示されている5).今回の研究においては,神経の活動に依存的なNカドヘリンの輸送の制御機構について追究した.
1.カーゴと結合しているKIF3Aにおけるリン酸化部位の特定
カーゴと結合しているKIF3Aとカーゴと結合していないKIF3Aのリン酸化の状態を比較するため,遠心分離による細胞質画分および顆粒画分から,KIF3AおよびKAP3に対する混合抗体,および,抗Nカドヘリン抗体を用いてKIF3Aを共免疫沈降した.リン酸化タグ電気泳動法によりリン酸化KIF3Aと非リン酸化KIF3Aを分離し,ウェスタンブロッティング法によりリン酸化KIF3Aの割合を比較したところ,Nカドヘリンを含むカーゴと結合しているKIF3Aは,カーゴと結合していないKIF3Aと比べ,高度にリン酸化されていることがわかった.質量分析法を用いてリン酸化部位を特定したところ,C末端のカーゴとの結合領域にあるSer689,Thr694,Ser698の3つの部位が検出された.
2.KIF3AはプロテインキナーゼAおよびCa2+/カルモジュリン依存性キナーゼIIaによりリン酸化される
Ser689,Thr694,Ser698の3つの部位のリン酸化を触媒するキナーゼを特定するため,大腸菌において発現させたKIF3AのC末端のカーゴとの結合領域を試験管内において40種類のキナーゼと反応させ,リン酸化タグ電気泳動法によりリン酸化を検出した.その結果,17種類のキナーゼがKIF3Aをリン酸化することがわかった.このなかから,ニューロンにおける機能およびキナーゼの反応モチーフを参考にして,候補をCa2+/カルモジュリン依存性キナーゼIIa,Ca2+/カルモジュリン依存性キナーゼIIb,プロテインキナーゼA,プロテインキナーゼCa,RSKの5種類にしぼった.試験管内においてこれらのキナーゼと反応させたKIF3Aのカーゴとの結合領域に由来するペプチドを安定同位体により標識したのち,高速液体クロマトグラフィー-質量分析法によりリン酸化を定量した.その結果,Ser689のリン酸化したペプチド,および,Thr694およびSer698のリン酸化したペプチドが分離され,Ser689をリン酸化しているキナーゼはプロテインキナーゼA,Thr694およびSer698をリン酸化しているキナーゼはCa2+/カルモジュリン依存性キナーゼIIaであることがわかった.これら3つのリン酸化部位をAlaに置換した非リン酸型KIF3A変異体を用いてin vivoおよびin vitroにおいてプロテインキナーゼAあるいはCa2+/カルモジュリン依存性キナーゼIIaと反応させたところ,リン酸化が減少したことから,これら3つのリン酸化部位を触媒するキナーゼはプロテインキナーゼAおよびCa2+/カルモジュリン依存性キナーゼIIaであることが強く示唆された.
3.KIF3Aはカーゴとの結合領域のリン酸化によりカーゴと結合する
これらのリン酸化はどのような役割をはたしているであろうか.このリン酸化部位がKIF3AのC末端のカーゴとの結合領域に存在することに着目し,KIF3Aとカーゴとの結合を比較した.Ser689,Thr694,Ser698の3つのリン酸化部位をGluに置換したリン酸化型KIF3A変異体,および,Alaに置換した非リン酸化型KIF3A変異体を用いて,脳の抽出液においてGSTプルダウン法によりNカドヘリンとの結合量を比較したところ,リン酸化型KIF3A変異体は非リン酸化型KIF3A変異体に比べ結合量の多いことがわかった.さらに,リン酸化型KIF3A変異体あるいは非リン酸化型KIF3A変異体を分散培養したニューロンにおいて発現させ,顕微鏡によりNカドヘリンとの共局在を観察したところ,リン酸化型KIF3A変異体は非リン酸化型KIF3A変異体に比べNカドヘリンとの局在が増加していた.つまり,KIF3Aはリン酸化によりNカドヘリンと結合していると考えられた.このリン酸化がカーゴとの結合のほか,微小管のうえでの動きにも影響するかどうか,微小管グライディングアッセイおよびATPase活性の測定の2つの方法により調べたが,影響はみられなかった.このことから,KIF3AのC末端のカーゴとの結合領域のリン酸化はカーゴとの結合の制御において重要であることが示唆された.
4.KIF3Aのカーゴとの結合領域のリン酸化はNカドヘリンの輸送を促進する
カーゴとの結合の制御はNカドヘリンの輸送あるいはニューロンの機能にどのような影響をあたえているのだろうか.Ser689,Thr694,Ser698のリン酸化型KIF3A変異体,非リン酸化型KIF3A変異体,野生型のKIF3Aをそれぞれ,分散培養したニューロンにおいて発現させ,その形態を共焦点レーザー顕微鏡により観察した.すると,リン酸化型KIF3A変異体を発現させたニューロンにおいては野生型KIF3Aを発現させたニューロンに比べスパインの肥大が,逆に,非リン酸化型KIF3A変異体を発現させたニューロンにおいてはスパインの縮小が観察された.さらに,リン酸化型KIF3A変異体を発現させたニューロンにおいてはNカドヘリンが正常にスパインに局在しているのに対し,非リン酸化型KIF3A変異体を発現させたニューロンにおいてはNカドヘリンが細胞体の周辺に蓄積しスパインにはほとんど局在していないことが観察された.この結果は,スパインの大きさはNカドヘリンのスパインへの集積に左右されるという過去の報告と一致した6,7).そこで,Nカドヘリンの輸送を蛍光顕微鏡を用いたライブイメージング法により観察した.プロテインキナーゼAの阻害剤およびCa2+/カルモジュリン依存性キナーゼIIaの阻害剤を培地に添加したところ,30分のちにNカドヘリンの輸送は有意に減少した.以上の結果から,KIF3Aのリン酸化はNカドヘリンの輸送を促進してNカドヘリンをスパインへと集積させ,その結果,スパインの形態を変化させると考えられた.
5.KIF3Aはニューロンの慢性的な抑制のときにリン酸化される
KIF3Aのリン酸化はどのようなときに生じるのだろうか.ニューロンの慢性的な抑制のときAMPA型グルタミン酸受容体やシナプス接着タンパク質がスパインに集積しシナプスの伝達効率を上昇させる8,9),シナプスの伝達効率の変化にはAMPA型グルタミン酸受容体だけでなくNカドヘリンのスパインへの集積が重要である10),という2つの別の報告を参考にして,ニューロンの慢性的な抑制のときのNカドヘリンの輸送およびKIF3Aのリン酸化について調べた.ニューロンの分散培養において培地にテトロドトキシンを添加することによりニューロンを慢性的に抑制し,このときのNカドヘリンの輸送および局在をスピニングディスク共焦点顕微鏡を用いたライブイメージング法により観察した.その結果,テトロドトキシンを添加してから3時間のちにNカドヘリンの輸送の増加,および,Nカドヘリンのスパインへの集積が同時に観察された.また,このときのKIF3AとNカドヘリンの結合量を定量したところ,細胞体および樹状突起において有意に増加していた.ニューロンを抑制したときのKIF3Aのリン酸化をリン酸化タグ電気泳動法により定量したところ,テトロドトキシンを添加してから3時間のちにKIF3Aのリン酸化が有意に増加していた.
リン酸化の増加した部位がさきに特定されたSer689,Thr694,Ser698であるかどうかを確かめるため,これらの部位の非リン酸化型KIF3A変異体あるいは野生型のKIF3Aを発現させたニューロンの培地にテトロドトキシンを添加し,KIF3Aのリン酸化をリン酸化タグ電気泳動法により定量したところ,非リン酸化型KIF3A変異体を発現させたニューロンにおいては野生型KIF3Aを発現させたニューロンに比べKIF3Aのリン酸化が減少していた.また同様に,非リン酸化型KIF3A変異体あるいは野生型KIF3Aを発現させたニューロンの培地にテトロドトキシンを添加したときのNカドヘリンの輸送および局在をライブイメージング法により観察したところ,野生型KIF3Aを発現させたニューロンにおいてはテトロドトキシンの添加によりNカドヘリンの輸送およびスパインへの局在が促進されたが,非リン酸化型KIF3A変異体を発現させたニューロンではNカドヘリンの輸送もスパインへの局在もほとんど観察されなかった.
以上の結果から,ニューロンの慢性的な抑制のときにKIF3AのSer689,Thr694,Ser698がリン酸化され,それによりNカドヘリンを輸送しスパインへと集積させていると考えられた.
おわりに
今回の研究により,ニューロンを慢性的に抑制するとリン酸化されたKIF3AがNカドヘリンと結合して輸送しスパインへと集積させるという結論が得られた(図1).この結論は,ニューロンを慢性的に抑制したときにシナプスの伝達効率が上昇すること,シナプスの伝達効率の上昇にはNカドヘリンが重要であること,という過去の報告と矛盾しなかった10-12).これらの恒常的な可塑性はニューロンの全体において生じるため,KIF3Aのリン酸化の増加やNカドヘリンの輸送の増加は容易に観察されたが,可塑性の生じる場所が限定される場合にも同様の反応が起こっている可能性が高い.今後,微小ダイナミクスの解析によるさらに詳細な輸送機構の解明が期待され,また,睡眠のときの記憶の固定などのときのシグナル伝達の解明や13),記憶が低下する状況の改善への応用なども可能であろう.
文 献
- Hirokawa, N., Niwa, S. & Tanaka, Y.: Molecular motors in neurons: transport mechanisms and roles in brain function, development, and disease. Neuron, 68, 610-638 (2010)[PubMed]
- Guillaud, L., Wong, R. & Hirokawa, N.: Disruption of KIF17-Mint1 interaction by CaMKII-dependent phosphorylation: a molecular model of kinesin-cargo release. Nat. Cell Biol., 10, 19-29 (2008)[PubMed]
- Takeichi, M.: Dynamic contacts: rearranging adherens junctions to drive epithelial remodelling. Nat. Rev. Mol. Cell Biol., 15, 397-410 (2014)[PubMed]
- Vitureira, N. & Goda, Y.: The interplay between Hebbian and homeostatic synaptic plasticity. J. Cell Biol., 203, 175-186 (2013)[PubMed]
- Teng, J., Rai, T., Tanaka, Y. et al.: The KIF3 motor transports N-cadherin and organizes the developing neuroepithelium. Nat. Cell Biol., 7, 474-482 (2005)[PubMed]
- Benson, D. L. & Tanaka, H.: N-cadherin redistribution during synaptogenesis in hippocampal neurons. J. Neurosci., 18, 6892-6904 (1998)[PubMed]
- Bozdagi, O., Shan, W., Tanaka, H. et al.: Increasing numbers of synaptic puncta during late-phase LTP: N-cadherin is synthesized, recruited to synaptic sites, and required for potentiation. Neuron, 28, 245-259 (2000)[PubMed]
- Lee, K. J, Queenan, B. N., Rozeboom, A. M. et al.: Mossy fiber-CA3 synapses mediate homeostatic plasticity in mature hippocampal neurons. Neuron, 77, 99-114 (2013)[PubMed]
- Vitureira, N., Letellier, M., White, I. J. et al.: Differential control of presynaptic efficacy by postsynaptic N-cadherin and β-catenin. Nat. Neurosci., 15, 81-89 (2012)[PubMed]
- Mendez, P., De Roo, M., Poglia, L. et al.: N-cadherin mediates plasticity-induced long-term spine stabilization. J. Cell Biol., 189, 589-600 (2010)[PubMed]
- Okamura, K., Tanaka, H., Yagita, Y. et al.: Cadherin activity is required for activity-induced spine remodeling. J. Cell Biol., 167, 961-972 (2004)[PubMed]
- Togashi, H., Abe, K., Mizoguchi, A. et al.: Cadherin regulates dendritic spine morphogenesis. Neuron, 35, 77-89 (2002)[PubMed]
- Tononi, G. & Cirelli, C.: Sleep and the price of plasticity: from synaptic and cellular homeostasis to memory consolidation and integration. Neuron, 81, 12-34 (2014)[PubMed]
著者プロフィール
略歴:2013年 東京大学大学院医学系研究科博士課程 修了,同年より同 特任研究員.
研究テーマ:ニューロンにおけるキネシンスーパーファミリーのリン酸化.
抱負:日進月歩.
廣川 信隆(Nobutaka Hirokawa)
東京大学大学院医学系研究科 特任教授.
研究室URL:http://cb.m.u-tokyo.ac.jp/index-ja.html
© 2015 一ノ瀬聡太郎・廣川信隆 Licensed under CC 表示 2.1 日本