Pias3依存的なSUMO化による網膜および錐体視細胞の分化決定制御
大西暁士1・Seth Blackshaw2
(1大阪バイオサイエンス研究所 発生生物学部門,2米国Johns Hopkins大学School of Medicine,Deparment of Neuroscience)
email:大西暁士
DOI: 10.7875/first.author.2010.034
Pias3-dependent SUMOylation controls mammalian cone photoreceptor differentiation.
Akishi Onishi, Guang-Hua Peng, Shiming Chen, Seth Blackshaw
Nature Neuroscience, 13, 1059-1065 (2010)
網膜および視細胞は外界の光情報を電気シグナルに変換する光受容細胞である.多くの哺乳類は,明暗を感知する杆体視細胞と,色覚を担う緑色感受性のM錐体および青色感受性のS錐体の2種類の錐体視細胞をもつ.M錐体とS錐体は波長感受性(色感受性)の異なる2種類の光受容タンパク質MオプシンおよびSオプシンを発現するが,その選択的な発現の分子機構はよくわかっていなかった.筆者らは,転写制御因子Pias3のSUMO化活性がこの選択的な発現を制御していることを見い出した.すなわち,Pias3はオプシン発現に関与する転写因子をSUMO化することにより,Mオプシン発現の活性化およびSオプシン発現の抑制をしていることがわかった.また,これまでに錐体視細胞におけるオプシンの選択的な発現に関与すると報告されていた転写因子Trβ2およびRxrγは,リガンド依存的にPias3の発現を促進していることがわかった.
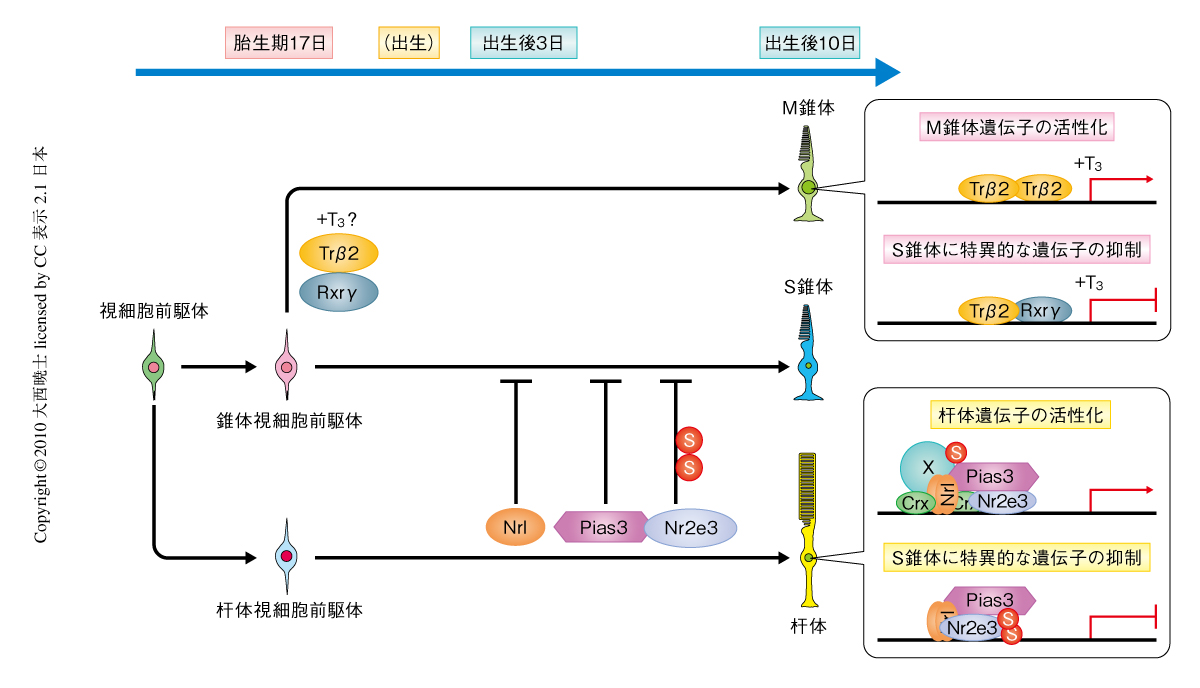
多くの生物にとって視覚は生命活動を営むうえで必須の感覚である.網膜の外顆粒層に位置する視細胞は外界の視覚情報(光情報)を電気信号に変換する光受容細胞であり,明暗を感知するための杆体視細胞と,色弁別(色覚)を担う錐体視細胞とに大別される.錐体視細胞はおのおのの波長感受性に対応する光受容タンパク質(オプシン)を発現しており,多くの哺乳類は緑色感受性のM錐体(medium wavelength-sensitive)に発現するMオプシン,および,青色感受性性のS錐体(short wavelength-sensitive)に発現するSオプシンに起因する2色性色覚をもつ.魚類や鳥類などはこれらに分子進化的に異なる2種類のオプシンをくわえた4色性色覚をもつ.マウス網膜におけるオプシンの発現は背腹軸にそった勾配を示し,Mオプシンは背側,Sオプシンは腹側で高く発現し,中間部分の錐体視細胞の多くはMオプシンとSオプシンとを共発現している1).
視細胞が正常に発生・分化することは正常な視覚情報伝達に不可欠であり,網膜疾患の分子遺伝学的解析などにより視細胞の発生に関与する多くの転写因子が同定されている2).Maf群転写因子Nrl(neural retina leucine zipper)および核内受容体Nr2e3(nuclear receptor subfamily 2,group E,member 3)は杆体視細胞に特異的に発現し,杆体視細胞に特異的な遺伝子発現を活性化,S錐体に特異的な遺伝子発現を抑制する(図1).錐体視細胞の分化において,甲状腺ホルモン核内受容体Trβ2(thyroid hormone receptor β2)のノックアウトマウスではMオプシンを発現する錐体視細胞の消失とそれにともなうSオプシンを発現する錐体視細胞の増加がみられる3).同じく,核内受容体Rxrγ(retinoid X receptor γ)のノックアウトマウスではMオプシンの発現は消失しないが,すべての錐体視細胞でSオプシンを発現することが報告された4).Trβ2の転写活性は甲状腺ホルモンに依存的であり,その誘導体であるトリヨウ化チロニンの腹腔内注射によりMオプシンの発現増加およびSオプシンの発現抑制が観察されたことから,これらの転写因子が錐体視細胞におけるオプシンの選択的な発現を担うものと考えられていた5)(図1).
しかし,筆者らは,以下の理由よりTrβ2あるいはRxrγが直接にM錐体およびS錐体の分化決定に関与する可能性は低く,別の分子機構がその分化制御を担うものと予想した.1)Trβ2およびRxrγは錐体視細胞の前駆体が分化する胎生期17日に発現のピークを示すが,Mオプシンが発現する出生後10日には発現が低下している3,6).2)甲状腺機能低下症マウスにおいて錐体視細胞におけるオプシンの発現遅延はみられるが背腹軸の空間分布に変化はなく,これは甲状腺ホルモンがM錐体およびS錐体の分化決定に関与する可能性の低いことを示唆する7).3)Trβ2はMオプシン遺伝子のプロモーターおよびSオプシン遺伝子のプロモーターの両方に結合しており,発現の活性化および抑制を実現するには転写制御因子の存在が示唆される8).
筆者らは,発生時期の網膜を用いたトランスクリプトーム解析およびin situハイブリダイゼーションによる発現解析により,SUMOリガーゼ活性をもつ転写制御因子Pias3(protein inhibitor of activated STAT3)が視細胞で高い発現を示すことを示していた9).SUMO化は翻訳後修飾のひとつであり,SUMO(small ubiquitin-like modifier)を結合させることで標的タンパク質の生理機能に影響を及ぼす10).筆者らは,杆体視細胞に特異的な転写因子Nr2e3がS錐体に特異的な遺伝子を抑制するには,Pias3依存的なSUMO化が必須であること示していた11)(図1).さらに筆者らは,Pias3が発生期の杆体視細胞だけでなく錐体視細胞にも強く発現することを報告していた.この論文では,Pias3依存的なSUMO化活性がMオプシンとSオプシンとの発現制御に必須であることを示した.Pias3は錐体視細胞におけるオプシンの発現に関与する複数の転写因子の活性を制御することにより,M錐体への分化を促進し,S錐体への分化を抑制した.また,Trβ2およびRxrγはリガンド依存的にPias3の発現を活性化することを明らかにした.
網膜切片の免疫組織化学的な解析により,Pias3の発現量はおのおのの錐体視細胞で異なることが観察されていた11).まず,発現量の違いが錐体視細胞の種類により異なるかどうかを検証するため,抗Mオプシン抗体,抗Sオプシン抗体,抗Pias3抗体を用いたホールマウント染色を行った.成体マウスの錐体視細胞におけるPias3の発現量はS錐体と比べM錐体では3倍ほど高いことがわかった.また,網膜中間部分のMオプシンとSオプシンとを共発現する錐体視細胞におけるPias3の発現量はその中間を示した.
つぎに,発生期の錐体視細胞におけるPias3の発現パターンをホールマウント染色により検証した.出生後0日および出生後2日の錐体視細胞ではPias3の高い発現が観察されず,すべての錐体視細胞がSオプシンを発現していたが,出生後4日~8日と発生が進むにつれ背側の網膜で高い発現量を示すPias3陽性細胞が増加するとともにSオプシン陽性錐体視細胞が減少した.出生後10日においては成体マウスと同様に,背側のPias3陽性細胞でMオプシンの発現が観察された.すなわち,Pias3は錐体視細胞の前駆体の発生時期(胎生期17日)からM錐体およびS錐体の分化決定期(出生後10日)のあいだで発現が誘導されることがわかった.
M錐体およびS錐体におけるオプシンの発現制御がPias3の発現量に依存することを検証するため,エレクトロポレーションによる過剰発現およびノックダウンの解析を行った.網膜背腹軸の中間部分のほとんどの錐体視細胞はMオプシンとSオプシンとを共発現している.Pias3を過剰発現した錐体視細胞を抗Mオプシン抗体および抗Sオプシン抗体で染色し,中間領域におけるM錐体,S錐体,これらを共発現する錐体視細胞の割合を定量した.Pias3を過剰発現した網膜ではSオプシンの発現が抑制され,Mオプシンのみを発現する錐体視細胞が増加した.反対に,Pias3をノックダウンした網膜ではMオプシンの発現が抑制され,Sオプシンのみを発現する錐体視細胞が増加した.
つぎに,Pias3のSUMO化活性が錐体視細胞におけるオプシンの発現制御に関与することを検証するため,Pias3のSUMO化活性欠損変異体をエレクトロポレーションにより遺伝子導入した.ノックダウンの結果と同様に,Mオプシンの発現が抑制されSオプシンのみを発現する錐体視細胞が増加した.また,アデノウイルスに由来する遺伝子Gam1を導入して錐体視細胞のSUMO化カスケードを阻害したところ,SUMO化欠損変異体と同様の結果が得られた.
この結果は,Pias3依存的なSUMO化がMオプシン遺伝子の転写を活性化し,Sオプシン遺伝子の転写を抑制することを示していた.そこで,SUMO化により制御される転写因子を同定した.
Trβ2およびRxrγは錐体視細胞において胎生期17日に発現のピークを示すが,成体の錐体視細胞でも発現が確認されている.成体網膜を用いてクロマチン免疫沈降(chromatin immunoprecipitation:ChIP)法により解析した結果,TRβ2およびRXRγはMオプシン遺伝子のプロモーターおよびSオプシン遺伝子のプロモーターに結合することがわかった.つぎに,Trβ2のスプライスバリアントであるTrβ1に着目した.Trβ1は胎生期の網膜では発現が低く,出生後10日以降に高い発現を示すことが報告されており3),これはMオプシンの発現開始時期と一致する.Trβ1に特異的なプローブを用いたin situハイブリダイゼーションの結果,Trβ1も錐体視細胞に発現し,ChIP解析の結果,TRβ1も錐体視細胞に特異的な遺伝子のプロモーターに結合することがわかった.さらに,核内受容体であるRorα(RAR-related orphan receptor α)の発現が出生後3日より錐体視細胞において上昇し,Sオプシン遺伝子の転写に関与することが報告された12).また,別のグループより,RORαはPias3依存的なSUMO化をうけることが報告されたことから13),出生後3日以降の背側の網膜におけるSオプシンの発現抑制にはRorαが関与するものと予想した.
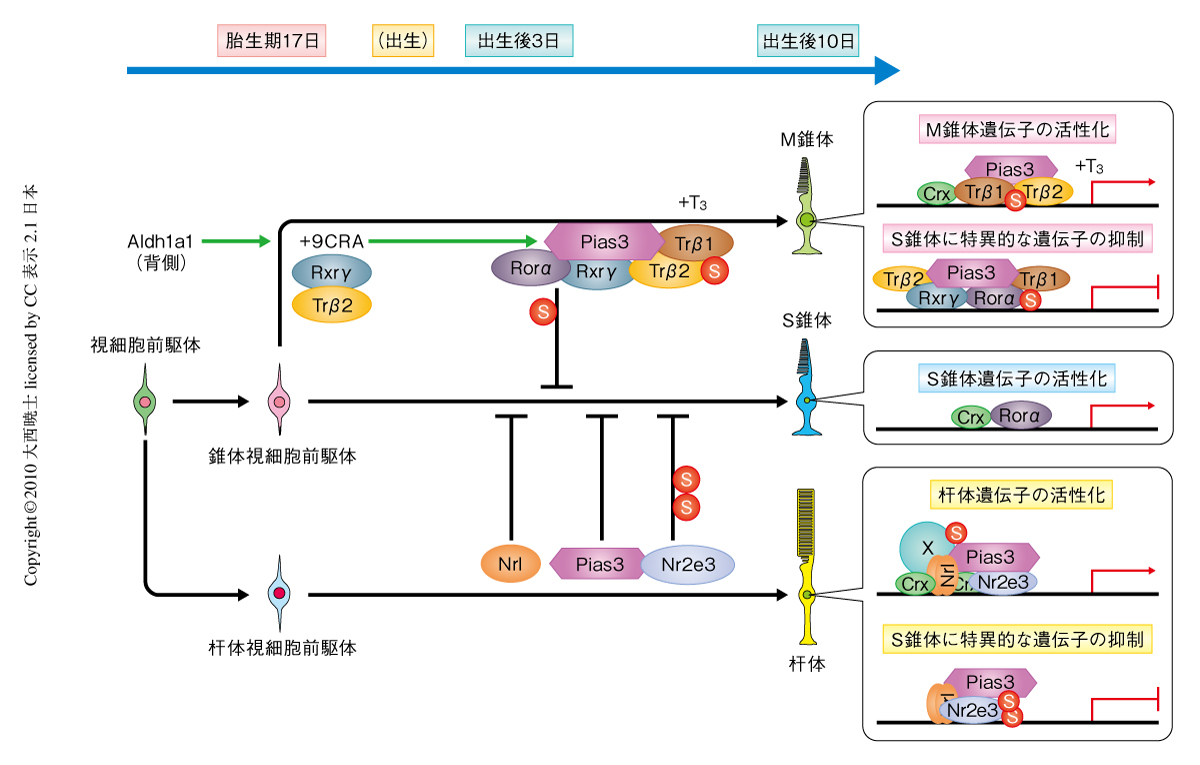
これらの核内受容体転写因子のMオプシン遺伝子プロモーターおよびSオプシン遺伝子プロモーターにおける転写活性およびPias3依存的なSUMO化による活性制御を検証するため,ルシフェラーゼアッセイを行った.まず,Mオプシン遺伝子プロモーターにおいてTRβ1およびTRβ2は視細胞に特異的な転写因子CRXと共役して転写を活性化した.Pias3はこの活性を上昇させたが,Pias3のSUMO化活性欠損変異体では上昇が認められなかった.成体マウスでは発現量の高いTRβ1がMオプシンの発現に機能しているものと考えられた.つぎに,Sオプシン遺伝子プロモーターにおいてTRβ2およびRXRγはCRXと共役して転写を活性化した.そして,RORαの添加により転写活性は抑制され,さらに,Pias3により転写活性は減少した.SUMO化活性欠損変異体でも転写活性の抑制が認められたが,野生型と比べ抑制能は低下していた.この結果をさらに検証するために,同様の実験をRORαのSUMO化モチーフ変異体を用いて行った.この結果,RORαの転写抑制能の減少およびPias3による転写抑制の減少が認められた.一連の実験より,Pias3依存的なSUMO化は,Mオプシン遺伝子プロモーターにある転写因子には活性化に,Sオプシン遺伝子プロモーターにある転写因子には抑制に,それぞれ作用することが明らかになった(図2).
この実験より,Trβ2およびRxrγは錐体視細胞におけるオプシンの転写制御に関与することがわかったが,発現ピーク時(胎生期17日)における機能は不明であった.Pias3遺伝子のプロモーター領域には哺乳類のあいだで保存された核内受容体結合モチーフが存在することから,Pias3の発現はTrβ2およびRxrγの制御下にあるものと予想した.
まず,Trβ2ノックアウトマウスにおけるPias3の発現パターンを野生型マウスと比較した.この結果,野生型マウスの網膜の背側部分で観察されたPias3の強い発現がTrβ2ノックアウトマウスでは消失しており,腹側の錐体視細胞でのPias3と同等の発現量に減少していた.つぎに,Pias3遺伝子のプロモーターを用いてルシフェラーゼアッセイを行った.TRβ2単体もしくはRXRγ単体では転写活性は認められなかったが,これらを共発現することにより活性が上昇した.この活性は9-cis型レチノイン酸の添加により濃度依存的に増幅された.9-cis型レチノイン酸はアルデヒドデヒドロゲナーゼのひとつであるAldh1a1により産生される.Aldh1a1はマウス網膜では背側のミュラー細胞において高い発現を示すことから6),錐体視細胞におけるPias3発現の背腹軸勾配はAldh1a1に産生される9-cis型レチノイン酸が担うことが示唆された(図2).なお,腹側の網膜には全trans型レチノイン酸を産生するAldh1a3が発現しているが,全trans型レチノイン酸による転写活性は認められなかった.
このように,Pias3依存的なSUMO化は錐体視細胞のサブタイプの決定に重要な役割を担うことが示された.杆体視細胞および錐体視細胞の分化に関与する転写因子を欠損したマウスでは総じてSオプシンの異所的な発現が観察されることから,視細胞の発生プログラムの初期値はS錐体に設定されているようにみうけられる.Pias3は視細胞に発現するさまざまな転写因子の活性を制御して,杆体視細胞およびM錐体への分化を誘導するマスター因子として機能しているものと考えられる(図2).
網膜を含む中枢神経系の神経細胞にはさまざまなサブタイプが存在し,複雑な神経回路を形成している.錐体視細胞においてSUMO化がMオプシンとSオプシンとの発現制御に関与していたように,ほかの神経細胞種でも特定の転写因子の活性をSUMO化によって制御することがサブタイプの分化に機能しているものと予想される.
略歴:2002年 京都大学大学院理学研究科博士課程 修了,日本学術振興会 特別研究員,米国Johns Hopkins大学School of Medicine研究員(Seth Blackshaw研究室)を経て,2009年より大阪バイオサイエンス研究所 研究員.
研究テーマ:視覚機能を分子で説明すること.
Seth Blackshaw
米国Johns Hopkins大学School of Medicine准教授.
© 2010 大西暁士・Seth Blackshaw Licensed under CC 表示 2.1 日本
(1大阪バイオサイエンス研究所 発生生物学部門,2米国Johns Hopkins大学School of Medicine,Deparment of Neuroscience)
email:大西暁士
DOI: 10.7875/first.author.2010.034
Pias3-dependent SUMOylation controls mammalian cone photoreceptor differentiation.
Akishi Onishi, Guang-Hua Peng, Shiming Chen, Seth Blackshaw
Nature Neuroscience, 13, 1059-1065 (2010)
要 約
網膜および視細胞は外界の光情報を電気シグナルに変換する光受容細胞である.多くの哺乳類は,明暗を感知する杆体視細胞と,色覚を担う緑色感受性のM錐体および青色感受性のS錐体の2種類の錐体視細胞をもつ.M錐体とS錐体は波長感受性(色感受性)の異なる2種類の光受容タンパク質MオプシンおよびSオプシンを発現するが,その選択的な発現の分子機構はよくわかっていなかった.筆者らは,転写制御因子Pias3のSUMO化活性がこの選択的な発現を制御していることを見い出した.すなわち,Pias3はオプシン発現に関与する転写因子をSUMO化することにより,Mオプシン発現の活性化およびSオプシン発現の抑制をしていることがわかった.また,これまでに錐体視細胞におけるオプシンの選択的な発現に関与すると報告されていた転写因子Trβ2およびRxrγは,リガンド依存的にPias3の発現を促進していることがわかった.
はじめに
多くの生物にとって視覚は生命活動を営むうえで必須の感覚である.網膜の外顆粒層に位置する視細胞は外界の視覚情報(光情報)を電気信号に変換する光受容細胞であり,明暗を感知するための杆体視細胞と,色弁別(色覚)を担う錐体視細胞とに大別される.錐体視細胞はおのおのの波長感受性に対応する光受容タンパク質(オプシン)を発現しており,多くの哺乳類は緑色感受性のM錐体(medium wavelength-sensitive)に発現するMオプシン,および,青色感受性性のS錐体(short wavelength-sensitive)に発現するSオプシンに起因する2色性色覚をもつ.魚類や鳥類などはこれらに分子進化的に異なる2種類のオプシンをくわえた4色性色覚をもつ.マウス網膜におけるオプシンの発現は背腹軸にそった勾配を示し,Mオプシンは背側,Sオプシンは腹側で高く発現し,中間部分の錐体視細胞の多くはMオプシンとSオプシンとを共発現している1).
視細胞が正常に発生・分化することは正常な視覚情報伝達に不可欠であり,網膜疾患の分子遺伝学的解析などにより視細胞の発生に関与する多くの転写因子が同定されている2).Maf群転写因子Nrl(neural retina leucine zipper)および核内受容体Nr2e3(nuclear receptor subfamily 2,group E,member 3)は杆体視細胞に特異的に発現し,杆体視細胞に特異的な遺伝子発現を活性化,S錐体に特異的な遺伝子発現を抑制する(図1).錐体視細胞の分化において,甲状腺ホルモン核内受容体Trβ2(thyroid hormone receptor β2)のノックアウトマウスではMオプシンを発現する錐体視細胞の消失とそれにともなうSオプシンを発現する錐体視細胞の増加がみられる3).同じく,核内受容体Rxrγ(retinoid X receptor γ)のノックアウトマウスではMオプシンの発現は消失しないが,すべての錐体視細胞でSオプシンを発現することが報告された4).Trβ2の転写活性は甲状腺ホルモンに依存的であり,その誘導体であるトリヨウ化チロニンの腹腔内注射によりMオプシンの発現増加およびSオプシンの発現抑制が観察されたことから,これらの転写因子が錐体視細胞におけるオプシンの選択的な発現を担うものと考えられていた5)(図1).
しかし,筆者らは,以下の理由よりTrβ2あるいはRxrγが直接にM錐体およびS錐体の分化決定に関与する可能性は低く,別の分子機構がその分化制御を担うものと予想した.1)Trβ2およびRxrγは錐体視細胞の前駆体が分化する胎生期17日に発現のピークを示すが,Mオプシンが発現する出生後10日には発現が低下している3,6).2)甲状腺機能低下症マウスにおいて錐体視細胞におけるオプシンの発現遅延はみられるが背腹軸の空間分布に変化はなく,これは甲状腺ホルモンがM錐体およびS錐体の分化決定に関与する可能性の低いことを示唆する7).3)Trβ2はMオプシン遺伝子のプロモーターおよびSオプシン遺伝子のプロモーターの両方に結合しており,発現の活性化および抑制を実現するには転写制御因子の存在が示唆される8).
筆者らは,発生時期の網膜を用いたトランスクリプトーム解析およびin situハイブリダイゼーションによる発現解析により,SUMOリガーゼ活性をもつ転写制御因子Pias3(protein inhibitor of activated STAT3)が視細胞で高い発現を示すことを示していた9).SUMO化は翻訳後修飾のひとつであり,SUMO(small ubiquitin-like modifier)を結合させることで標的タンパク質の生理機能に影響を及ぼす10).筆者らは,杆体視細胞に特異的な転写因子Nr2e3がS錐体に特異的な遺伝子を抑制するには,Pias3依存的なSUMO化が必須であること示していた11)(図1).さらに筆者らは,Pias3が発生期の杆体視細胞だけでなく錐体視細胞にも強く発現することを報告していた.この論文では,Pias3依存的なSUMO化活性がMオプシンとSオプシンとの発現制御に必須であることを示した.Pias3は錐体視細胞におけるオプシンの発現に関与する複数の転写因子の活性を制御することにより,M錐体への分化を促進し,S錐体への分化を抑制した.また,Trβ2およびRxrγはリガンド依存的にPias3の発現を活性化することを明らかにした.
1.Pias3はM錐体で高い発現を示す
網膜切片の免疫組織化学的な解析により,Pias3の発現量はおのおのの錐体視細胞で異なることが観察されていた11).まず,発現量の違いが錐体視細胞の種類により異なるかどうかを検証するため,抗Mオプシン抗体,抗Sオプシン抗体,抗Pias3抗体を用いたホールマウント染色を行った.成体マウスの錐体視細胞におけるPias3の発現量はS錐体と比べM錐体では3倍ほど高いことがわかった.また,網膜中間部分のMオプシンとSオプシンとを共発現する錐体視細胞におけるPias3の発現量はその中間を示した.
つぎに,発生期の錐体視細胞におけるPias3の発現パターンをホールマウント染色により検証した.出生後0日および出生後2日の錐体視細胞ではPias3の高い発現が観察されず,すべての錐体視細胞がSオプシンを発現していたが,出生後4日~8日と発生が進むにつれ背側の網膜で高い発現量を示すPias3陽性細胞が増加するとともにSオプシン陽性錐体視細胞が減少した.出生後10日においては成体マウスと同様に,背側のPias3陽性細胞でMオプシンの発現が観察された.すなわち,Pias3は錐体視細胞の前駆体の発生時期(胎生期17日)からM錐体およびS錐体の分化決定期(出生後10日)のあいだで発現が誘導されることがわかった.
2.M錐体への分化にはPias3依存的なSUMO化が必須である
M錐体およびS錐体におけるオプシンの発現制御がPias3の発現量に依存することを検証するため,エレクトロポレーションによる過剰発現およびノックダウンの解析を行った.網膜背腹軸の中間部分のほとんどの錐体視細胞はMオプシンとSオプシンとを共発現している.Pias3を過剰発現した錐体視細胞を抗Mオプシン抗体および抗Sオプシン抗体で染色し,中間領域におけるM錐体,S錐体,これらを共発現する錐体視細胞の割合を定量した.Pias3を過剰発現した網膜ではSオプシンの発現が抑制され,Mオプシンのみを発現する錐体視細胞が増加した.反対に,Pias3をノックダウンした網膜ではMオプシンの発現が抑制され,Sオプシンのみを発現する錐体視細胞が増加した.
つぎに,Pias3のSUMO化活性が錐体視細胞におけるオプシンの発現制御に関与することを検証するため,Pias3のSUMO化活性欠損変異体をエレクトロポレーションにより遺伝子導入した.ノックダウンの結果と同様に,Mオプシンの発現が抑制されSオプシンのみを発現する錐体視細胞が増加した.また,アデノウイルスに由来する遺伝子Gam1を導入して錐体視細胞のSUMO化カスケードを阻害したところ,SUMO化欠損変異体と同様の結果が得られた.
3.Pias3はSUMO化によりM錐体およびS錐体で発現する多くの転写因子を制御する
この結果は,Pias3依存的なSUMO化がMオプシン遺伝子の転写を活性化し,Sオプシン遺伝子の転写を抑制することを示していた.そこで,SUMO化により制御される転写因子を同定した.
Trβ2およびRxrγは錐体視細胞において胎生期17日に発現のピークを示すが,成体の錐体視細胞でも発現が確認されている.成体網膜を用いてクロマチン免疫沈降(chromatin immunoprecipitation:ChIP)法により解析した結果,TRβ2およびRXRγはMオプシン遺伝子のプロモーターおよびSオプシン遺伝子のプロモーターに結合することがわかった.つぎに,Trβ2のスプライスバリアントであるTrβ1に着目した.Trβ1は胎生期の網膜では発現が低く,出生後10日以降に高い発現を示すことが報告されており3),これはMオプシンの発現開始時期と一致する.Trβ1に特異的なプローブを用いたin situハイブリダイゼーションの結果,Trβ1も錐体視細胞に発現し,ChIP解析の結果,TRβ1も錐体視細胞に特異的な遺伝子のプロモーターに結合することがわかった.さらに,核内受容体であるRorα(RAR-related orphan receptor α)の発現が出生後3日より錐体視細胞において上昇し,Sオプシン遺伝子の転写に関与することが報告された12).また,別のグループより,RORαはPias3依存的なSUMO化をうけることが報告されたことから13),出生後3日以降の背側の網膜におけるSオプシンの発現抑制にはRorαが関与するものと予想した.
これらの核内受容体転写因子のMオプシン遺伝子プロモーターおよびSオプシン遺伝子プロモーターにおける転写活性およびPias3依存的なSUMO化による活性制御を検証するため,ルシフェラーゼアッセイを行った.まず,Mオプシン遺伝子プロモーターにおいてTRβ1およびTRβ2は視細胞に特異的な転写因子CRXと共役して転写を活性化した.Pias3はこの活性を上昇させたが,Pias3のSUMO化活性欠損変異体では上昇が認められなかった.成体マウスでは発現量の高いTRβ1がMオプシンの発現に機能しているものと考えられた.つぎに,Sオプシン遺伝子プロモーターにおいてTRβ2およびRXRγはCRXと共役して転写を活性化した.そして,RORαの添加により転写活性は抑制され,さらに,Pias3により転写活性は減少した.SUMO化活性欠損変異体でも転写活性の抑制が認められたが,野生型と比べ抑制能は低下していた.この結果をさらに検証するために,同様の実験をRORαのSUMO化モチーフ変異体を用いて行った.この結果,RORαの転写抑制能の減少およびPias3による転写抑制の減少が認められた.一連の実験より,Pias3依存的なSUMO化は,Mオプシン遺伝子プロモーターにある転写因子には活性化に,Sオプシン遺伝子プロモーターにある転写因子には抑制に,それぞれ作用することが明らかになった(図2).
4.Pias3発現の背腹軸勾配は9-cis型レチノイン酸の濃度勾配によってつくられる
この実験より,Trβ2およびRxrγは錐体視細胞におけるオプシンの転写制御に関与することがわかったが,発現ピーク時(胎生期17日)における機能は不明であった.Pias3遺伝子のプロモーター領域には哺乳類のあいだで保存された核内受容体結合モチーフが存在することから,Pias3の発現はTrβ2およびRxrγの制御下にあるものと予想した.
まず,Trβ2ノックアウトマウスにおけるPias3の発現パターンを野生型マウスと比較した.この結果,野生型マウスの網膜の背側部分で観察されたPias3の強い発現がTrβ2ノックアウトマウスでは消失しており,腹側の錐体視細胞でのPias3と同等の発現量に減少していた.つぎに,Pias3遺伝子のプロモーターを用いてルシフェラーゼアッセイを行った.TRβ2単体もしくはRXRγ単体では転写活性は認められなかったが,これらを共発現することにより活性が上昇した.この活性は9-cis型レチノイン酸の添加により濃度依存的に増幅された.9-cis型レチノイン酸はアルデヒドデヒドロゲナーゼのひとつであるAldh1a1により産生される.Aldh1a1はマウス網膜では背側のミュラー細胞において高い発現を示すことから6),錐体視細胞におけるPias3発現の背腹軸勾配はAldh1a1に産生される9-cis型レチノイン酸が担うことが示唆された(図2).なお,腹側の網膜には全trans型レチノイン酸を産生するAldh1a3が発現しているが,全trans型レチノイン酸による転写活性は認められなかった.
おわりに
このように,Pias3依存的なSUMO化は錐体視細胞のサブタイプの決定に重要な役割を担うことが示された.杆体視細胞および錐体視細胞の分化に関与する転写因子を欠損したマウスでは総じてSオプシンの異所的な発現が観察されることから,視細胞の発生プログラムの初期値はS錐体に設定されているようにみうけられる.Pias3は視細胞に発現するさまざまな転写因子の活性を制御して,杆体視細胞およびM錐体への分化を誘導するマスター因子として機能しているものと考えられる(図2).
網膜を含む中枢神経系の神経細胞にはさまざまなサブタイプが存在し,複雑な神経回路を形成している.錐体視細胞においてSUMO化がMオプシンとSオプシンとの発現制御に関与していたように,ほかの神経細胞種でも特定の転写因子の活性をSUMO化によって制御することがサブタイプの分化に機能しているものと予想される.
文 献
- Rohlich, P., van Veen, T. & Szel, A.: Two different visual pigments in one retinal cone cell. Neuron, 13, 1159-1166 (1994)[PubMed]
- Swaroop, A., Kim, D. & Forrest, D.: Transcriptional regulation of photoreceptor development and homeostasis in the mammalian retina. Nat. Rev. Neurosci., 11, 563-576 (2010)[PubMed]
- Ng, L., Hurley, J. B., Dierks, B. et al.: A thyroid hormone receptor that is required for the development of green cone photoreceptors. Nat. Genet., 27, 94-98 (2001)[PubMed]
- Roberts, M. R., Hendrickson, A., McGuire, C. R. et al.: Retinoid X receptor γ is necessary to establish the S-opsin gradient in cone photoreceptors of the developing mouse retina. Invest. Ophthalmol. Vis. Sci., 46, 2897-2904 (2005)[PubMed]
- Roberts, M. R., Srinivas, M., Forrest, D. et al.: Making the gradient: thyroid hormone regulates cone opsin expression in the developing mouse retina. Proc. Natl. Acad. Sci. USA, 103, 6218-6223 (2006)[PubMed]
- McCaffery, P., Wagner, E., O'Neil, J. et al.: Dorsal and ventral retinal territories defined by retinoic acid synthesis, break-down and nuclear receptor expression. Mech. Dev., 82, 119-130 (1999)[PubMed]
- Lu, A., Ng, L., Ma, M. et al.: Retarded developmental expression and patterning of retinal cone opsins in hypothyroid mice. Endocrinology, 150, 1536-1544 (2009)[PubMed]
- Hennig, A. K., Peng, G. H. & Chen, S.: Regulation of photoreceptor gene expression by Crx-associated transcription factor network. Brain Res., 1192, 114-133 (2008)[PubMed]
- Blackshaw, S., Harpavat, S., Trimarchi, J. et al.: Genomic analysis of mouse retinal development. PLoS Biol., 2, e247 (2004)[PubMed]
- Wilkinson, K. A., Nakamura, Y. & Henley, J. M.: Targets and consequences of protein SUMOylation in neurons. Brain Res. Rev., 64, 195-212 (2010)[PubMed]
- Onishi, A., Peng, G. H., Hsu, C. et al.: Pias3-dependent SUMOylation directs rod photoreceptor development. Neuron, 61, 234-246 (2009)[PubMed]
- Fujieda, H., Bremner, R., Mears, A. J. et al.: Retinoic acid receptor-related orphan receptor alpha regulates a subset of cone genes during mouse retinal development. J. Neurochem., 108, 91-101 (2009)[PubMed]
- Hwang, E. J., Lee, J. M., Jeong, J. et al.: SUMOylation of RORα potentiates transcriptional activation function. Biochem. Biophys. Res. Commun., 378, 513-517 (2009)[PubMed]
著者プロフィール
略歴:2002年 京都大学大学院理学研究科博士課程 修了,日本学術振興会 特別研究員,米国Johns Hopkins大学School of Medicine研究員(Seth Blackshaw研究室)を経て,2009年より大阪バイオサイエンス研究所 研究員.
研究テーマ:視覚機能を分子で説明すること.
Seth Blackshaw
米国Johns Hopkins大学School of Medicine准教授.
© 2010 大西暁士・Seth Blackshaw Licensed under CC 表示 2.1 日本