Smad2およびSmad3はClostridium butyricumにより活性化された樹状細胞においてTGFβの自己産生を反対に制御する
柏木一公・吉村昭彦
(慶應義塾大学医学部 微生物学・免疫学教室)
email:吉村昭彦
DOI: 10.7875/first.author.2015.095
Smad2 and Smad3 inversely regulate TGF-β autoinduction in Clostridium butyricum-activated dendritic cells.
Ikkou Kashiwagi, Rimpei Morita, Takashi Schichita, Kyoko Komai, Keita Saeki, Makoto Matsumoto, Kiyoshi Takeda, Masatoshi Nomura, Atsushi Hayashi, Takanori Kanai, Akihiko Yoshimura
Immunity, 43, 65-79 (2015)
近年の研究により,Clostridium属細菌は腸管において誘導性制御性T細胞の分化を誘導することが明らかにされた.しかし,どのような分子機構により誘導性制御性T細胞の分化が誘導されるのかは明らかでなかった.TGFβはこの誘導性制御性T細胞の分化に必須のサイトカインであることから,筆者らは,Clostridium属細菌およびTGFβに着目した.整腸作用のあるClostridium butyricumは腸管においてTGFβに依存して誘導性制御性T細胞を増加させた.詳細な解析により,C. butyricumは腸管の樹状細胞に存在するToll様受容体TLR2からERK-AP-1経路を活性化し,初期のTGFβの分泌を促進することがわかった.さらに,TGFβの自己分泌によりTGFβの産生が加速されること,TGFβの自己分泌には転写因子Smad3が促進的なはたらきをするのに対し転写因子Smad2は抑制にはたらくことが明らかにされた.Smad2を欠損した樹状細胞においてはTGFβの発現が亢進し,誘導性制御性T細胞の分化をより強力に誘導して腸炎モデルマウスにおいて症状を軽減した.この研究により,C. butyricumによるTLR2-AP-1-TGFβ経路およびTGFβ-Smadシグナルを介したTGFβの発現機構が明らかにされた.
ヒトの消化管にはつねに100兆個以上の腸内細菌が生息しており,腸内細菌が免疫のバランスをとることにより免疫における恒常性は維持されると考えられている1,2).また,腸内細菌に対する免疫応答の異常は,潰瘍性大腸炎やクローン病など炎症性腸疾患とよばれる消化管の粘膜に炎症を生じる疾患の原因でもある.これらの疾患は厚生労働省により特定疾患に指定されている難病であり,就学あるいは就労をひかえた20歳代を中心に発症し国内の患者数が約16万人をこえたことから社会的にも大きな問題になりつつあり,その原因の解明および治療法の確立が望まれている.また,腸内細菌はアレルギーのほか,糖尿病,肥満,自閉症などさまざまな疾患との関連が示唆されている.
消化管における免疫において制御性T細胞は主要な役割をはたしている.とくに,消化管に存在する制御性T細胞は強力な抗炎症作用をもつTGFβにより分化の誘導される誘導性制御性T細胞であることが報告されている.また,誘導性制御性T細胞の分化は腸内細菌の存在により誘導されるが,近年の研究により,とくにClostridium属細菌が誘導性制御性T細胞の分化を誘導することが明らかにされた3-5).しかし,Clostridium属細菌がどのような分子機構により誘導性制御性T細胞の分化を誘導するのかは解明されていない.Clostridium属細菌の産生する酪酸のような短鎖脂肪酸が誘導性制御性T細胞を増加させることは知られているが6),短鎖脂肪酸だけでは誘導性制御性T細胞の分化は誘導できずTGFβが不可欠である.筆者らは,Clostridium属細菌がTGFβの発現を誘導することにより誘導性制御性T細胞を増加させるという仮説をたて,プロバイオティクスとして知られるClostridium butyricumを用いることにより誘導性制御性T細胞の分化の誘導における腸内細菌の役割について検討した.
なお,免疫系における恒常性の維持と制御性T細胞については,濱口真英・坂口志文, 領域融合レビュー, 2, e005, 2013 も参照されたい.
C. butyricumとTGFβおよび誘導性制御性T細胞との関連を示すため,C. butyricumを経口投与したマウスに対しデキスラン硫酸誘導性腸炎を発症させてその効果を検証した.既報のとおり,C. butyricumはデキスラン硫酸誘導性腸炎を軽減させ7),腸管の粘膜固有層において炎症性サイトカインであるインターロイキン12,TNFα,インターロイキン6の発現を低下させ,逆に,抗炎症性サイトカインであるインターロイキン10およびTGFβの発現を上昇させた.さらに,C. butyricumは腸管において誘導性制御性T細胞を増加させた.この腸炎モデルマウスにおけるTGFβの役割について明らかにするため,TGFβの作用を中和する抗体を投与した.その結果,C. butyricumによるデキスラン硫酸誘導性腸炎の軽減および誘導性制御性T細胞の増加はみられなくなったことから,C. butyricumによるデキスラン硫酸誘導性腸炎の軽減にはTGFβの発現およびそれによる誘導性制御性T細胞の分化の誘導が重要であることがわかった.さらに,細胞分画により,TGFβはおもに腸管樹状細胞により産生されていることがわかった.
C. butyricumによるデキスラン硫酸誘導性腸炎の軽減は死菌体を用いてもみられたことから,TGFβの分泌を促進させるC. butyricumの菌体成分を探索した.グラム陰性細菌の細胞壁の構成成分であるリポ多糖およびグラム陽性細菌の細胞壁の主要成分であるペプチドグリカンを用いて腸管樹状細胞あるいは骨髄由来樹状細胞を刺激したところ,リポ多糖よりもペプチドグリカンにTGFβの強い誘導活性が認められた.さらに,ペプチドグリカンはToll様受容体(Toll-like receptor:TLR)のひとつであるTLR2のリガンドであることから,TLR2ノックアウトマウスおよびTLR4ノックアウトマウスから採取した腸管樹状細胞および骨髄由来樹状細胞においてTGFβの発現を解析したところ,TLR2の欠損によりTGFβの発現が有意に低下することがわかった.試験管内において骨髄由来樹状細胞とT細胞を共培養する誘導性制御性T細胞の分化誘導系においても同様に,リポ多糖よりもペプチドグリカンの刺激により誘導性制御性T細胞の分化が促進された.これらの結果から,C. butyricumのもつペプチドグリカンが樹状細胞に存在するTLR2を介しTGFβの発現を誘導することにより,誘導性制御性T細胞の分化を誘導していることが明らかにされた.
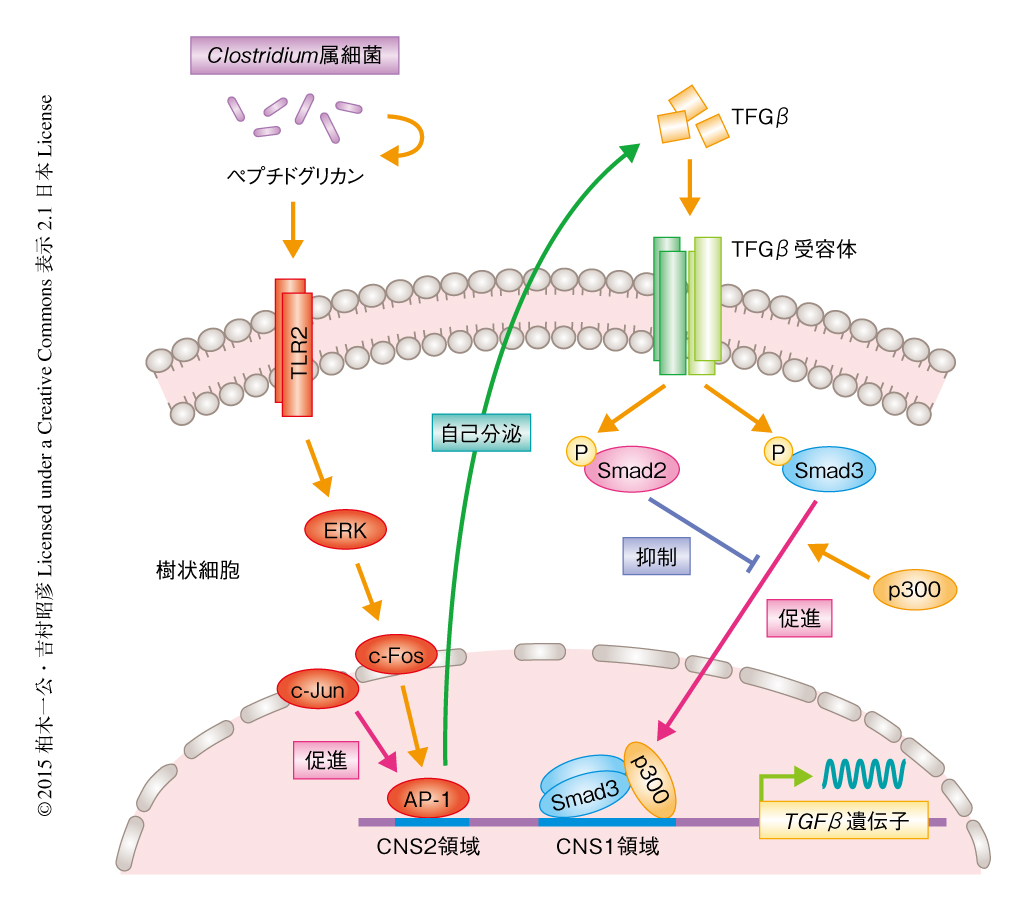
TLR2の下流においてどのようなシグナルがはたらくことによりTGFβの発現が誘導されているのかを明らかにするため阻害剤を用いたスクリーニングを行った.その結果,ERK阻害剤あるいはTGFβ受容体阻害剤を作用させたときにTGFβの発現量が減少することを見い出した.さらに,ウェスタンブロット法によりペプチドグリカンの刺激に特異的にERKのリン酸化およびc-Fosの発現の上昇が促進されることが明らかにされた.c-Fosはc-Junと複合体を形成して転写因子AP-1になる.TGFβをコードする遺伝子のプロモーター領域において相同性解析を行ったところヒト,ウシ,そのほか哺乳類において高度に保存された領域を見い出され,転写開始点の直上の領域をCNS1領域,転写開始点から-1783~-1273の領域をCNS2領域と定義した.CNS2領域にはAP-1結合配列が存在し,クロマチン免疫沈降法によりCNS2領域にAP-1がリクルートされることが確認された.さらに,ペプチドグリカンの刺激によりヒストンのアセチル化など転写促進性の修飾も誘導された(図1).以上の結果より,ペプチドグリカン-TLR2シグナルはERK-AP-1経路を介しTGFβの遺伝子プロモーターを活性化することが明らかにされた.
阻害剤を用いたスクリーニングの際に,TGFβ受容体阻害剤の作用によりTGFβの発現が低下することが見い出された.このことから,分泌されたTGFβが自己分泌によりさらにTGFβの発現を誘導していることが予想された.そこで,TGFβ受容体の下流の転写因子であるSmad2およびSmad3に着目した.Smad2あるいはSmad3を欠損した樹状細胞においてペプチドグリカンの刺激によるTGFβの産生を比較したところ,Smad2を欠損した樹状細胞においては産生量が上昇し,逆に,Smad3を欠損した樹状細胞においては産生量が低下した.すなわち,TGFβの産生の制御において,Smad3は正の,Smad2は負の制御を担うことが示された.
プロモーター解析により,TGFβの刺激により転写開始点の直上に存在するCNS1領域の近傍のヒストンのアセチル化が促進されることがわかった.CNS1領域にはSmad結合配列が密集して存在しており,クロマチン免疫沈降法によりCNS1領域にSmad2およびSmad3がリクルートされることがわかった.さらに,免疫沈降法およびクロマチン免疫沈降法により,Smad3のみがヒストンアセチルトランスフェラーゼであるp300と複合体を形成してCNS1領域にリクルートされることが示唆された(図1).Smad2を欠損した樹状細胞ではCNS1領域へのSmad3のリクルートが亢進し,ヒストンのアセチル化も亢進した.一方,Smad3を欠損した樹状細胞ではSmad2のリクルートが亢進し,ヒストンH3のLys27のメチル化など転写抑制型のクロマチン修飾が誘導された.
Smad2を欠損した樹状細胞はTGFβを過剰に産生するため誘導性制御性T細胞の分化を強く誘導する可能性が考えられた.そこで,樹状細胞において特異的にSmad2を欠損したノックアウトマウスを作製したところ,腸管において誘導性制御性T細胞が増加しており,デキスラン硫酸誘導性腸炎に対し抵抗性を示した.さらに,このノックアウトマウスから採取したSmad2を欠損した樹状細胞を詳細に解析したところ,炎症性サイトカインの分泌能が低下しており,T細胞共刺激タンパク質の発現およびMHCクラスII分子の発現も低下していることがわかった.試験管内における誘導性制御性T細胞の分化誘導系においても,Smad2を欠損した樹状細胞は誘導性制御性T細胞の分化誘導能が亢進していた.さらに,Rag2ノックアウトマウスにナイーブT細胞を移入することにより誘導されるT細胞に依存性の腸炎モデルマウスに対し,Smad2を欠損した樹状細胞を同時に移入したところ腸炎の症状が軽減した(図2).
近年,腸内フローラの撹乱(dysbiosis)がさまざまな疾患に関連することが指摘されている.このようなdysbiosisを改善する方法として,プロバイオティクスを用いた治療法が注目されている.この研究により明らかにされた,Clostridium属細菌および転写因子SmadによるTGFβの発現および誘導性制御性T細胞の分化の誘導の分子機構は,炎症性腸疾患に対するより安全かつ安価な治療法および予防法の開発につながることが期待される.
略歴:慶應義塾大学大学院医学研究科博士課程 在学中.
研究テーマ:免疫における恒常性の維持の機構.
吉村 昭彦(Akihiko Yoshimura)
慶應義塾大学医学部 教授.
研究室URL:http://new2.immunoreg.jp/
© 2015 柏木一公・吉村昭彦 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 微生物学・免疫学教室)
email:吉村昭彦
DOI: 10.7875/first.author.2015.095
Smad2 and Smad3 inversely regulate TGF-β autoinduction in Clostridium butyricum-activated dendritic cells.
Ikkou Kashiwagi, Rimpei Morita, Takashi Schichita, Kyoko Komai, Keita Saeki, Makoto Matsumoto, Kiyoshi Takeda, Masatoshi Nomura, Atsushi Hayashi, Takanori Kanai, Akihiko Yoshimura
Immunity, 43, 65-79 (2015)
要 約
近年の研究により,Clostridium属細菌は腸管において誘導性制御性T細胞の分化を誘導することが明らかにされた.しかし,どのような分子機構により誘導性制御性T細胞の分化が誘導されるのかは明らかでなかった.TGFβはこの誘導性制御性T細胞の分化に必須のサイトカインであることから,筆者らは,Clostridium属細菌およびTGFβに着目した.整腸作用のあるClostridium butyricumは腸管においてTGFβに依存して誘導性制御性T細胞を増加させた.詳細な解析により,C. butyricumは腸管の樹状細胞に存在するToll様受容体TLR2からERK-AP-1経路を活性化し,初期のTGFβの分泌を促進することがわかった.さらに,TGFβの自己分泌によりTGFβの産生が加速されること,TGFβの自己分泌には転写因子Smad3が促進的なはたらきをするのに対し転写因子Smad2は抑制にはたらくことが明らかにされた.Smad2を欠損した樹状細胞においてはTGFβの発現が亢進し,誘導性制御性T細胞の分化をより強力に誘導して腸炎モデルマウスにおいて症状を軽減した.この研究により,C. butyricumによるTLR2-AP-1-TGFβ経路およびTGFβ-Smadシグナルを介したTGFβの発現機構が明らかにされた.
はじめに
ヒトの消化管にはつねに100兆個以上の腸内細菌が生息しており,腸内細菌が免疫のバランスをとることにより免疫における恒常性は維持されると考えられている1,2).また,腸内細菌に対する免疫応答の異常は,潰瘍性大腸炎やクローン病など炎症性腸疾患とよばれる消化管の粘膜に炎症を生じる疾患の原因でもある.これらの疾患は厚生労働省により特定疾患に指定されている難病であり,就学あるいは就労をひかえた20歳代を中心に発症し国内の患者数が約16万人をこえたことから社会的にも大きな問題になりつつあり,その原因の解明および治療法の確立が望まれている.また,腸内細菌はアレルギーのほか,糖尿病,肥満,自閉症などさまざまな疾患との関連が示唆されている.
消化管における免疫において制御性T細胞は主要な役割をはたしている.とくに,消化管に存在する制御性T細胞は強力な抗炎症作用をもつTGFβにより分化の誘導される誘導性制御性T細胞であることが報告されている.また,誘導性制御性T細胞の分化は腸内細菌の存在により誘導されるが,近年の研究により,とくにClostridium属細菌が誘導性制御性T細胞の分化を誘導することが明らかにされた3-5).しかし,Clostridium属細菌がどのような分子機構により誘導性制御性T細胞の分化を誘導するのかは解明されていない.Clostridium属細菌の産生する酪酸のような短鎖脂肪酸が誘導性制御性T細胞を増加させることは知られているが6),短鎖脂肪酸だけでは誘導性制御性T細胞の分化は誘導できずTGFβが不可欠である.筆者らは,Clostridium属細菌がTGFβの発現を誘導することにより誘導性制御性T細胞を増加させるという仮説をたて,プロバイオティクスとして知られるClostridium butyricumを用いることにより誘導性制御性T細胞の分化の誘導における腸内細菌の役割について検討した.
なお,免疫系における恒常性の維持と制御性T細胞については,濱口真英・坂口志文, 領域融合レビュー, 2, e005, 2013 も参照されたい.
1.Clostridium butyricumはTGFβの分泌を介し腸炎を抑制する
C. butyricumとTGFβおよび誘導性制御性T細胞との関連を示すため,C. butyricumを経口投与したマウスに対しデキスラン硫酸誘導性腸炎を発症させてその効果を検証した.既報のとおり,C. butyricumはデキスラン硫酸誘導性腸炎を軽減させ7),腸管の粘膜固有層において炎症性サイトカインであるインターロイキン12,TNFα,インターロイキン6の発現を低下させ,逆に,抗炎症性サイトカインであるインターロイキン10およびTGFβの発現を上昇させた.さらに,C. butyricumは腸管において誘導性制御性T細胞を増加させた.この腸炎モデルマウスにおけるTGFβの役割について明らかにするため,TGFβの作用を中和する抗体を投与した.その結果,C. butyricumによるデキスラン硫酸誘導性腸炎の軽減および誘導性制御性T細胞の増加はみられなくなったことから,C. butyricumによるデキスラン硫酸誘導性腸炎の軽減にはTGFβの発現およびそれによる誘導性制御性T細胞の分化の誘導が重要であることがわかった.さらに,細胞分画により,TGFβはおもに腸管樹状細胞により産生されていることがわかった.
2.TGFβの発現はTLR2シグナルにより促進される
C. butyricumによるデキスラン硫酸誘導性腸炎の軽減は死菌体を用いてもみられたことから,TGFβの分泌を促進させるC. butyricumの菌体成分を探索した.グラム陰性細菌の細胞壁の構成成分であるリポ多糖およびグラム陽性細菌の細胞壁の主要成分であるペプチドグリカンを用いて腸管樹状細胞あるいは骨髄由来樹状細胞を刺激したところ,リポ多糖よりもペプチドグリカンにTGFβの強い誘導活性が認められた.さらに,ペプチドグリカンはToll様受容体(Toll-like receptor:TLR)のひとつであるTLR2のリガンドであることから,TLR2ノックアウトマウスおよびTLR4ノックアウトマウスから採取した腸管樹状細胞および骨髄由来樹状細胞においてTGFβの発現を解析したところ,TLR2の欠損によりTGFβの発現が有意に低下することがわかった.試験管内において骨髄由来樹状細胞とT細胞を共培養する誘導性制御性T細胞の分化誘導系においても同様に,リポ多糖よりもペプチドグリカンの刺激により誘導性制御性T細胞の分化が促進された.これらの結果から,C. butyricumのもつペプチドグリカンが樹状細胞に存在するTLR2を介しTGFβの発現を誘導することにより,誘導性制御性T細胞の分化を誘導していることが明らかにされた.
3.TGFβの発現はERK-AP-1経路により促進される
TLR2の下流においてどのようなシグナルがはたらくことによりTGFβの発現が誘導されているのかを明らかにするため阻害剤を用いたスクリーニングを行った.その結果,ERK阻害剤あるいはTGFβ受容体阻害剤を作用させたときにTGFβの発現量が減少することを見い出した.さらに,ウェスタンブロット法によりペプチドグリカンの刺激に特異的にERKのリン酸化およびc-Fosの発現の上昇が促進されることが明らかにされた.c-Fosはc-Junと複合体を形成して転写因子AP-1になる.TGFβをコードする遺伝子のプロモーター領域において相同性解析を行ったところヒト,ウシ,そのほか哺乳類において高度に保存された領域を見い出され,転写開始点の直上の領域をCNS1領域,転写開始点から-1783~-1273の領域をCNS2領域と定義した.CNS2領域にはAP-1結合配列が存在し,クロマチン免疫沈降法によりCNS2領域にAP-1がリクルートされることが確認された.さらに,ペプチドグリカンの刺激によりヒストンのアセチル化など転写促進性の修飾も誘導された(図1).以上の結果より,ペプチドグリカン-TLR2シグナルはERK-AP-1経路を介しTGFβの遺伝子プロモーターを活性化することが明らかにされた.
4.TGFβの自己分泌にはSmad3が重要でSmad2は抑制にはたらく
阻害剤を用いたスクリーニングの際に,TGFβ受容体阻害剤の作用によりTGFβの発現が低下することが見い出された.このことから,分泌されたTGFβが自己分泌によりさらにTGFβの発現を誘導していることが予想された.そこで,TGFβ受容体の下流の転写因子であるSmad2およびSmad3に着目した.Smad2あるいはSmad3を欠損した樹状細胞においてペプチドグリカンの刺激によるTGFβの産生を比較したところ,Smad2を欠損した樹状細胞においては産生量が上昇し,逆に,Smad3を欠損した樹状細胞においては産生量が低下した.すなわち,TGFβの産生の制御において,Smad3は正の,Smad2は負の制御を担うことが示された.
プロモーター解析により,TGFβの刺激により転写開始点の直上に存在するCNS1領域の近傍のヒストンのアセチル化が促進されることがわかった.CNS1領域にはSmad結合配列が密集して存在しており,クロマチン免疫沈降法によりCNS1領域にSmad2およびSmad3がリクルートされることがわかった.さらに,免疫沈降法およびクロマチン免疫沈降法により,Smad3のみがヒストンアセチルトランスフェラーゼであるp300と複合体を形成してCNS1領域にリクルートされることが示唆された(図1).Smad2を欠損した樹状細胞ではCNS1領域へのSmad3のリクルートが亢進し,ヒストンのアセチル化も亢進した.一方,Smad3を欠損した樹状細胞ではSmad2のリクルートが亢進し,ヒストンH3のLys27のメチル化など転写抑制型のクロマチン修飾が誘導された.
5.Smad2を欠損した樹状細胞は免疫の抑制にはたらく
Smad2を欠損した樹状細胞はTGFβを過剰に産生するため誘導性制御性T細胞の分化を強く誘導する可能性が考えられた.そこで,樹状細胞において特異的にSmad2を欠損したノックアウトマウスを作製したところ,腸管において誘導性制御性T細胞が増加しており,デキスラン硫酸誘導性腸炎に対し抵抗性を示した.さらに,このノックアウトマウスから採取したSmad2を欠損した樹状細胞を詳細に解析したところ,炎症性サイトカインの分泌能が低下しており,T細胞共刺激タンパク質の発現およびMHCクラスII分子の発現も低下していることがわかった.試験管内における誘導性制御性T細胞の分化誘導系においても,Smad2を欠損した樹状細胞は誘導性制御性T細胞の分化誘導能が亢進していた.さらに,Rag2ノックアウトマウスにナイーブT細胞を移入することにより誘導されるT細胞に依存性の腸炎モデルマウスに対し,Smad2を欠損した樹状細胞を同時に移入したところ腸炎の症状が軽減した(図2).
おわりに
近年,腸内フローラの撹乱(dysbiosis)がさまざまな疾患に関連することが指摘されている.このようなdysbiosisを改善する方法として,プロバイオティクスを用いた治療法が注目されている.この研究により明らかにされた,Clostridium属細菌および転写因子SmadによるTGFβの発現および誘導性制御性T細胞の分化の誘導の分子機構は,炎症性腸疾患に対するより安全かつ安価な治療法および予防法の開発につながることが期待される.
文 献
- Hill, D. A. & Artis, D.: Intestinal bacteria and the regulation of immune cell homeostasis. Annu. Rev. Immunol., 28, 623-667 (2010)[PubMed]
- Hooper, L. V., Littman, D. R. & Macpherson, A. J.: Interactions between the microbiota and the immune system. Science, 336, 1268-1273 (2012)[PubMed]
- Ivanov, I. I. & Honda, K.: Intestinal commensal microbes as immune modulators. Cell Host Microbe, 12, 496-508 (2012)[PubMed]
- Atarashi, K., Tanoue, T., Shima, T. et al.: Induction of colonic regulatory T cells by indigenous Clostridium species. Science, 331, 337-341 (2011)[PubMed]
- Atarashi, K., Tanoue, T., Oshima, K. et al.: Treg induction by a rationally selected mixture of Clostridia strains from the human microbiota. Nature, 500, 232-236 (2013)[PubMed]
- Furusawa, Y., Obata, Y., Fukuda, S. et al.: Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature, 504, 446-450 (2013)[PubMed] [新着論文レビュー]
- Hayashi, A., Sato, T., Kamada, N. et al.: A single strain of Clostridium butyricum induces intestinal IL-10-producing macrophages to suppress acute experimental colitis in mice. Cell Host Microbe, 13, 711-722 (2013)[PubMed]
著者プロフィール
略歴:慶應義塾大学大学院医学研究科博士課程 在学中.
研究テーマ:免疫における恒常性の維持の機構.
吉村 昭彦(Akihiko Yoshimura)
慶應義塾大学医学部 教授.
研究室URL:http://new2.immunoreg.jp/
© 2015 柏木一公・吉村昭彦 Licensed under CC 表示 2.1 日本