幹細胞に特異的な細胞突起である微小管依存性ナノチューブはニッチからのシグナルの受容を促進する
稲葉真弓・山下由起子
(米国Michigan大学Life Sciences Institute)
email:稲葉真弓
DOI: 10.7875/first.author.2015.089
Nanotubes mediate niche-stem-cell signalling in the Drosophila testis.
Mayu Inaba, Michael Buszczak, Yukiko M. Yamashita
Nature, 523, 329-332 (2015)
組織幹細胞はニッチとよばれる場所にごく少数が存在する.ニッチは幹細胞の未分化性および長期にわたる自己複製能を維持するために特別な環境を提供する.ショウジョウバエの精子幹細胞は1回の細胞分裂により幹細胞となる娘細胞と分化する娘細胞とを生みだすが,その際に,ニッチからのシグナルは幹細胞となる娘細胞だけに伝達し分化する娘細胞を活性化してはならない.幹細胞となる娘細胞と分化する娘細胞とは隣接しており,ニッチからのシグナルがどのようにして2つの娘細胞うち一方の娘細胞にだけ伝達するようになっているのか,いままではっきりしていなかった.今回,筆者らは,精子幹細胞が微小管を含んだ細胞突起である微小管依存性ナノチューブをニッチにむけて伸長し,幹細胞の維持に必要なDppシグナルを受容していることを明らかにした.ニッチに直接に接触する娘細胞はこの細胞突起を介してDppシグナルを受容するが,もう一方の娘細胞はニッチから離れており細胞突起ももたないためDppシグナルは活性化されない.筆者らは,このしくみは幹細胞となる娘細胞だけがニッチからのシグナルを特異的に受容するための新規の分子機構であると提唱した.
ショウジョウバエの精子幹細胞は精巣の先端に存在するhub細胞とよばれるニッチを形成する細胞と直接に接触している.hub細胞から精子幹細胞へむけ分泌される幹細胞の維持に必要なリガンドとして,Unpaired(Upd)およびDecapentaplegic(Dpp)の少なくとも2種類がある1-4).精子幹細胞に起こる95%以上の細胞分裂は非対称分裂であり,生みだされた2つの娘細胞のうち,自己複製して幹細胞となる娘細胞はhub細胞との接触を維持し,hub細胞から離れてgonialblastとなるもうひとつの娘細胞はhub細胞の分泌するリガンドをそれ以上うけとることなく分化していく5)(図1).
hub細胞と精子幹細胞とのあいだには特別な構造が存在しシグナル伝達にかかわっているのではないかと考えて詳細に観察したところ,精子幹細胞に発現させた蛍光タンパク質GFPと微小管構成タンパク質αチューブリンとの融合タンパク質により可視化された細い細胞突起がhub細胞にむけ伸長していることがわかった.この細胞突起はその形態において,アクチンに依存性のごく細い細胞突起であるcytoneme 6) や細胞のあいだをつなぐ細胞突起であるtunneling nanotube 7) などによく似ていたが,tunneling nanotubeは微小管を含む例もあることから,この精子幹細胞の細胞突起を微小管依存性ナノチューブmicrotubule-dependent-nanotube)と名づけた.微小管依存性ナノチューブは精子幹細胞において細胞あたり0.88本とかなり高い頻度でみられ,その方向は一様にhub細胞をむいていた.ほかの生殖細胞にはまれにしかみられず,みられたとしてもその方向に一定性はなかった.微小管依存性ナノチューブは隣接するhub細胞のなかへ直接に陥入しており,その周囲では精子幹細胞とhub細胞の両方の細胞膜が保たれ,微小管をとりかこんでいた.微小管依存性ナノチューブは非常に脆弱な構造であり,試料の固定液に微小管を安定させるタキソールをくわえなければ容易に消失してしまうため,これまでの長いあいだ発見されることがなかったものと思われた.
微小管依存性ナノチューブがどういったタンパク質により制御されているのかを調べるため,これまで知られていた細胞突起を構成するタンパク質の機能解析をしたところ,繊毛の主要な制御タンパク質であるIFTが同定された.IFTは繊毛の形成および繊毛のうえでの順行性の輸送にかかわるIFT-B複合体と,繊毛のうえでの逆行性の輸送をつかさどるIFT-A複合体とに分類される.ショウジョウバエのIFT-BであるOseg2,Osm-6,Che-13をノックダウンした精子幹細胞においては,微小管依存性ナノチューブの頻度および長さがいちじるしく減少した.微小管の脱重合にたずさわるKinesin13ファミリータンパク質Klp10Aは繊毛の形成を負に制御するが8),このKlp10Aをノックダウンした精子幹細胞においては微小管依存性ナノチューブの直径が有意に増大した.これらのことから,微小管依存性ナノチューブはその形成および制御に繊毛におけるのとよく似たタンパク質を利用していることがわかった.
微小管依存性ナノチューブがニッチから幹細胞へのシグナル伝達にかかわっているかどうかを調べるため,hub細胞から精子幹細胞へむけ分泌されるリガンドDppおよびUpdに対する受容体の局在について調べた.精子幹細胞にDppの受容体であるThickveins(Tkv)を発現させたところ,精子幹細胞からhub細胞へむけ微小管依存性ナノチューブのうえを輸送された.このTkvのhub細胞への局在はIFT-Bのノックダウンにより微小管依存性ナノチューブを破壊することにより抑制された.Tkvはhub細胞において点状に存在するDppと共局在し,さらに,hub細胞においてTkvの活性化センサーであるTIPF 9) と共局在した.これらの結果から,DppとTkvとの相互作用およびTkvの活性化は微小管依存性ナノチューブにおいて起こることがわかった.Updの受容体であるDomeless(Dome)は微小管依存性ナノチューブのうえを輸送されず精子幹細胞にとどまっていた.
微小管依存性ナノチューブを破壊した精子幹細胞において,Dppシグナルの下流において活性化されるMadのリン酸化について調べたところ,野生型の精子幹細胞と比較して有意に減少した.反対に,微小管依存性ナノチューブが太くなるKlp10AのノックダウンにおいてはMadのリン酸化は有意に増加した.これらの結果から,微小管依存性ナノチューブは精子幹細胞においてDppシグナルの受容を促進していることが示唆された.そこで,微小管依存性ナノチューブを破壊した精子幹細胞のクローンが長期にわたり維持されるかどうかを調べたところ,野生型の精子幹細胞と比較してよりすみやかにその頻度が低下した.これは精子幹細胞の維持に必要なDppシグナルの異常の表現型と一致した.これらの結果から,微小管依存性ナノチューブはDppシグナルの受容を正に制御することにより長期にわたる幹細胞の維持に必要である可能性が強く示唆された.
リガンドと受容体との相互作用に特化した既知の細胞突起であるcytonemeは,その形成においてリガンドと受容体との相互作用それ自体が必要である10).同様の機構が微小管依存性ナノチューブにおいても利用されているかどうか調べるため,Dppの温度感受性変異体において微小管依存性ナノチューブの頻度および形態を観察したところ,Dppの機能が抑制される29℃において微小管依存性ナノチューブの頻度がいちじるしく低下した.同様に,Tkvのノックダウンによっても微小管依存性ナノチューブの形成は抑制された.精巣にて分化の途中の生殖細胞をとりかこむ体細胞であるシスト細胞において,特異的な遺伝子プロモーターを用いてDppを異所性に発現させたところ,シスト細胞にとりかこまれた分化の途中の多数の生殖細胞において微小管依存性ナノチューブが形成された.これらのことから,cytonemeの場合と同様に,DppとTkvとの相互作用が微小管依存性ナノチューブの形成に必要十分であることが確認された.
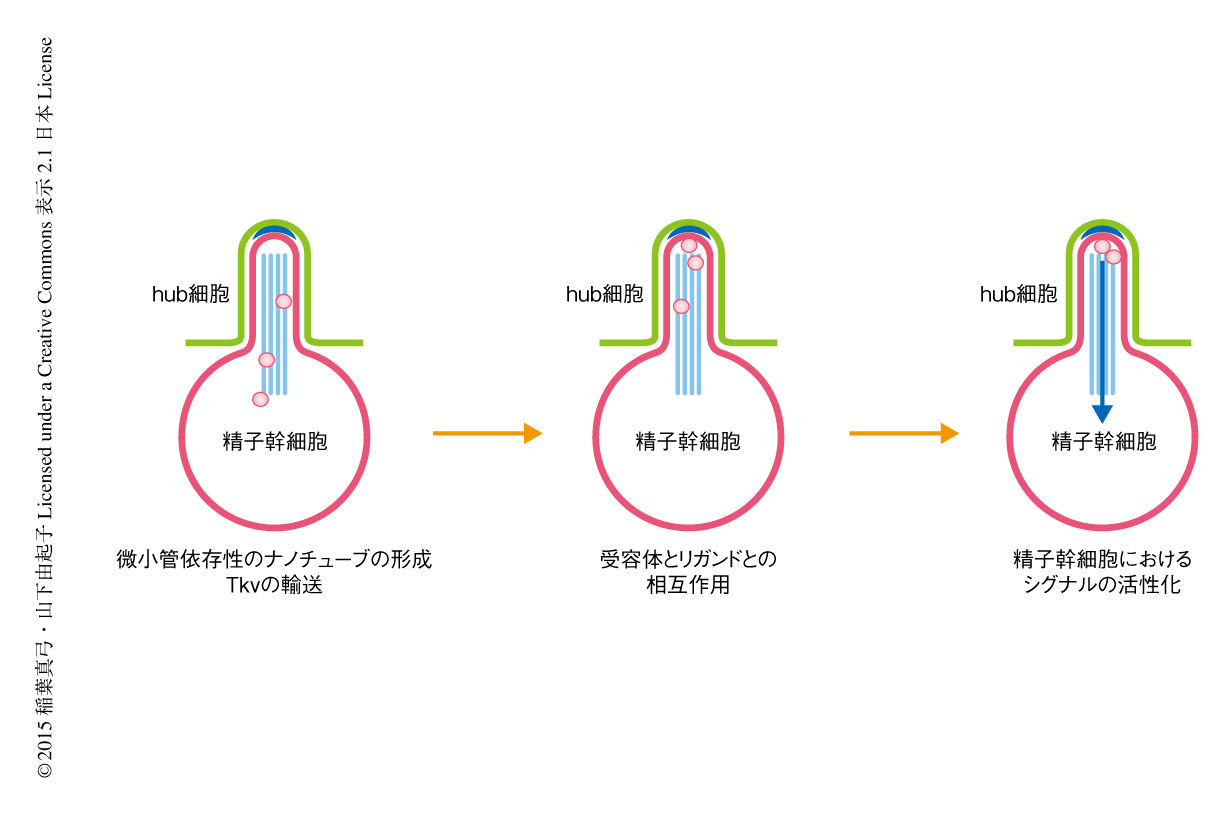
筆者らは,ニッチと幹細胞のあいだの特異的なシグナル伝達を促進する幹細胞の新規の構造体として微小管依存性ナノチューブを発見した.この発見は,ニッチから精子幹細胞へむけ分泌されるリガンドとその受容体とのあいだの相互作用が特異的な細胞のあいだでのみ起こる新たな分子機構を明らかにした.微小管依存性ナノチューブはニッチを形成する細胞に直接に陥入し,受容体であるTkvを送り込みリガンドであるDppと相互作用させる(図2).Dppの局在はニッチの内部に点在し,微小管依存性ナノチューブのうえでTkvと相互作用することが精子幹細胞にとり十分なシグナルを活性化するため必要であると思われた.微小管依存性ナノチューブがどのようにシグナルを受容し活性化するのかといった分子機構はいまだ不明であり今後の解析が待たれる.また,DppおよびUpdはともに幹細胞の維持に必要であるにもかかわらず,なぜDppに対してのみに微小管依存性ナノチューブが利用されているのか,さらに,同様な分子機構がほかの幹細胞においても利用されているかといった点は非常に興味深い.
略歴:2004年 九州大学大学院医学研究科にて博士号取得,同年 東京大学医科学研究所 研究員を経て,2009年より米国Michigan大学Postdoctoral Research Fellow.
研究テーマ:幹細胞における非対称分裂の分子機構およびその生理的な意義.
関心事:研究,音楽,映画,絵画.
山下 由起子(Yukiko M. Yamashita)
米国Michigan大学Associate Professor.
研究室URL:http://www.lsi.umich.edu/labs/yukiko-yamashita-lab
© 2015 稲葉真弓・山下由起子 Licensed under CC 表示 2.1 日本
(米国Michigan大学Life Sciences Institute)
email:稲葉真弓
DOI: 10.7875/first.author.2015.089
Nanotubes mediate niche-stem-cell signalling in the Drosophila testis.
Mayu Inaba, Michael Buszczak, Yukiko M. Yamashita
Nature, 523, 329-332 (2015)
要 約
組織幹細胞はニッチとよばれる場所にごく少数が存在する.ニッチは幹細胞の未分化性および長期にわたる自己複製能を維持するために特別な環境を提供する.ショウジョウバエの精子幹細胞は1回の細胞分裂により幹細胞となる娘細胞と分化する娘細胞とを生みだすが,その際に,ニッチからのシグナルは幹細胞となる娘細胞だけに伝達し分化する娘細胞を活性化してはならない.幹細胞となる娘細胞と分化する娘細胞とは隣接しており,ニッチからのシグナルがどのようにして2つの娘細胞うち一方の娘細胞にだけ伝達するようになっているのか,いままではっきりしていなかった.今回,筆者らは,精子幹細胞が微小管を含んだ細胞突起である微小管依存性ナノチューブをニッチにむけて伸長し,幹細胞の維持に必要なDppシグナルを受容していることを明らかにした.ニッチに直接に接触する娘細胞はこの細胞突起を介してDppシグナルを受容するが,もう一方の娘細胞はニッチから離れており細胞突起ももたないためDppシグナルは活性化されない.筆者らは,このしくみは幹細胞となる娘細胞だけがニッチからのシグナルを特異的に受容するための新規の分子機構であると提唱した.
はじめに
ショウジョウバエの精子幹細胞は精巣の先端に存在するhub細胞とよばれるニッチを形成する細胞と直接に接触している.hub細胞から精子幹細胞へむけ分泌される幹細胞の維持に必要なリガンドとして,Unpaired(Upd)およびDecapentaplegic(Dpp)の少なくとも2種類がある1-4).精子幹細胞に起こる95%以上の細胞分裂は非対称分裂であり,生みだされた2つの娘細胞のうち,自己複製して幹細胞となる娘細胞はhub細胞との接触を維持し,hub細胞から離れてgonialblastとなるもうひとつの娘細胞はhub細胞の分泌するリガンドをそれ以上うけとることなく分化していく5)(図1).
1.微小管依存性ナノチューブは精子幹細胞からニッチにむけ伸長している
hub細胞と精子幹細胞とのあいだには特別な構造が存在しシグナル伝達にかかわっているのではないかと考えて詳細に観察したところ,精子幹細胞に発現させた蛍光タンパク質GFPと微小管構成タンパク質αチューブリンとの融合タンパク質により可視化された細い細胞突起がhub細胞にむけ伸長していることがわかった.この細胞突起はその形態において,アクチンに依存性のごく細い細胞突起であるcytoneme 6) や細胞のあいだをつなぐ細胞突起であるtunneling nanotube 7) などによく似ていたが,tunneling nanotubeは微小管を含む例もあることから,この精子幹細胞の細胞突起を微小管依存性ナノチューブmicrotubule-dependent-nanotube)と名づけた.微小管依存性ナノチューブは精子幹細胞において細胞あたり0.88本とかなり高い頻度でみられ,その方向は一様にhub細胞をむいていた.ほかの生殖細胞にはまれにしかみられず,みられたとしてもその方向に一定性はなかった.微小管依存性ナノチューブは隣接するhub細胞のなかへ直接に陥入しており,その周囲では精子幹細胞とhub細胞の両方の細胞膜が保たれ,微小管をとりかこんでいた.微小管依存性ナノチューブは非常に脆弱な構造であり,試料の固定液に微小管を安定させるタキソールをくわえなければ容易に消失してしまうため,これまでの長いあいだ発見されることがなかったものと思われた.
2.微小管依存性ナノチューブは繊毛の制御タンパク質であるIFTに依存して構成される
微小管依存性ナノチューブがどういったタンパク質により制御されているのかを調べるため,これまで知られていた細胞突起を構成するタンパク質の機能解析をしたところ,繊毛の主要な制御タンパク質であるIFTが同定された.IFTは繊毛の形成および繊毛のうえでの順行性の輸送にかかわるIFT-B複合体と,繊毛のうえでの逆行性の輸送をつかさどるIFT-A複合体とに分類される.ショウジョウバエのIFT-BであるOseg2,Osm-6,Che-13をノックダウンした精子幹細胞においては,微小管依存性ナノチューブの頻度および長さがいちじるしく減少した.微小管の脱重合にたずさわるKinesin13ファミリータンパク質Klp10Aは繊毛の形成を負に制御するが8),このKlp10Aをノックダウンした精子幹細胞においては微小管依存性ナノチューブの直径が有意に増大した.これらのことから,微小管依存性ナノチューブはその形成および制御に繊毛におけるのとよく似たタンパク質を利用していることがわかった.
3.Dppシグナルの伝達に必要なタンパク質は微小管依存性ナノチューブに局在する
微小管依存性ナノチューブがニッチから幹細胞へのシグナル伝達にかかわっているかどうかを調べるため,hub細胞から精子幹細胞へむけ分泌されるリガンドDppおよびUpdに対する受容体の局在について調べた.精子幹細胞にDppの受容体であるThickveins(Tkv)を発現させたところ,精子幹細胞からhub細胞へむけ微小管依存性ナノチューブのうえを輸送された.このTkvのhub細胞への局在はIFT-Bのノックダウンにより微小管依存性ナノチューブを破壊することにより抑制された.Tkvはhub細胞において点状に存在するDppと共局在し,さらに,hub細胞においてTkvの活性化センサーであるTIPF 9) と共局在した.これらの結果から,DppとTkvとの相互作用およびTkvの活性化は微小管依存性ナノチューブにおいて起こることがわかった.Updの受容体であるDomeless(Dome)は微小管依存性ナノチューブのうえを輸送されず精子幹細胞にとどまっていた.
4.微小管依存性ナノチューブはDppシグナルの活性化および幹細胞の維持に必要である
微小管依存性ナノチューブを破壊した精子幹細胞において,Dppシグナルの下流において活性化されるMadのリン酸化について調べたところ,野生型の精子幹細胞と比較して有意に減少した.反対に,微小管依存性ナノチューブが太くなるKlp10AのノックダウンにおいてはMadのリン酸化は有意に増加した.これらの結果から,微小管依存性ナノチューブは精子幹細胞においてDppシグナルの受容を促進していることが示唆された.そこで,微小管依存性ナノチューブを破壊した精子幹細胞のクローンが長期にわたり維持されるかどうかを調べたところ,野生型の精子幹細胞と比較してよりすみやかにその頻度が低下した.これは精子幹細胞の維持に必要なDppシグナルの異常の表現型と一致した.これらの結果から,微小管依存性ナノチューブはDppシグナルの受容を正に制御することにより長期にわたる幹細胞の維持に必要である可能性が強く示唆された.
5.DppとTkvとの相互作用は微小管依存性ナノチューブの形成に必要十分である
リガンドと受容体との相互作用に特化した既知の細胞突起であるcytonemeは,その形成においてリガンドと受容体との相互作用それ自体が必要である10).同様の機構が微小管依存性ナノチューブにおいても利用されているかどうか調べるため,Dppの温度感受性変異体において微小管依存性ナノチューブの頻度および形態を観察したところ,Dppの機能が抑制される29℃において微小管依存性ナノチューブの頻度がいちじるしく低下した.同様に,Tkvのノックダウンによっても微小管依存性ナノチューブの形成は抑制された.精巣にて分化の途中の生殖細胞をとりかこむ体細胞であるシスト細胞において,特異的な遺伝子プロモーターを用いてDppを異所性に発現させたところ,シスト細胞にとりかこまれた分化の途中の多数の生殖細胞において微小管依存性ナノチューブが形成された.これらのことから,cytonemeの場合と同様に,DppとTkvとの相互作用が微小管依存性ナノチューブの形成に必要十分であることが確認された.
おわりに
筆者らは,ニッチと幹細胞のあいだの特異的なシグナル伝達を促進する幹細胞の新規の構造体として微小管依存性ナノチューブを発見した.この発見は,ニッチから精子幹細胞へむけ分泌されるリガンドとその受容体とのあいだの相互作用が特異的な細胞のあいだでのみ起こる新たな分子機構を明らかにした.微小管依存性ナノチューブはニッチを形成する細胞に直接に陥入し,受容体であるTkvを送り込みリガンドであるDppと相互作用させる(図2).Dppの局在はニッチの内部に点在し,微小管依存性ナノチューブのうえでTkvと相互作用することが精子幹細胞にとり十分なシグナルを活性化するため必要であると思われた.微小管依存性ナノチューブがどのようにシグナルを受容し活性化するのかといった分子機構はいまだ不明であり今後の解析が待たれる.また,DppおよびUpdはともに幹細胞の維持に必要であるにもかかわらず,なぜDppに対してのみに微小管依存性ナノチューブが利用されているのか,さらに,同様な分子機構がほかの幹細胞においても利用されているかといった点は非常に興味深い.
文 献
- Tulina, N. & Matunis, E.: Control of stem cell self-renewal in Drosophila spermatogenesis by JAK-STAT signaling. Science, 294, 2546-2549 (2001)[PubMed]
- Kiger, A. A., Jones, D. L., Schulz, C. et al.: Stem cell self-renewal specified by JAK-STAT activation in response to a support cell cue. Science, 294, 2542-2545 (2001)[PubMed]
- Shivdasani, A. A. & Ingham, P. W.: Regulation of stem cell maintenance and transit amplifying cell proliferation by TGF-β signaling in Drosophila spermatogenesis. Curr. Biol., 13, 2065-2072 (2003)[PubMed]
- Kawase, E., Wong, M. D., Ding, B. C. et al.: Gbb/Bmp signaling is essential for maintaining germline stem cells and for repressing bam transcription in the Drosophila testis. Development, 131, 1365-1375 (2004)[PubMed]
- Yamashita, Y. M., Jones, D. L & Fuller, M. T.: Orientation of asymmetric stem cell division by the APC tumor suppressor and centrosome. Science, 301, 1547-1550 (2003)[PubMed]
- Ramirez-Weber, F. A. & Kornberg, T. B.: Cytonemes: cellular processes that project to the principal signaling center in Drosophila imaginal discs. Cell, 97, 599-607 (1999)[PubMed]
- Davis, D. M. & Sowinski, S.: Membrane nanotubes: dynamic long-distance connections between animal cells. Nat. Rev. Mol. Cell Biol., 9, 431-436 (2008)[PubMed]
- Kobayashi, T., Tsang, W. Y., Li, J. et al.: Centriolar kinesin Kif24 interacts with CP110 to remodel microtubules and regulate ciliogenesis. Cell, 145, 914-925 (2011)[PubMed]
- Michel, M., Raabe, I., Kupinski, A. P. et al.: Local BMP receptor activation at adherens junctions in the Drosophila germline stem cell niche. Nat. Commun., 2, 415 (2011)[PubMed]
- Roy, S., Huang, H., Liu, S. et al.: Cytoneme-mediated contact-dependent transport of the Drosophila decapentaplegic signaling protein. Science, 343, 1244624 (2014)[PubMed]
著者プロフィール
略歴:2004年 九州大学大学院医学研究科にて博士号取得,同年 東京大学医科学研究所 研究員を経て,2009年より米国Michigan大学Postdoctoral Research Fellow.
研究テーマ:幹細胞における非対称分裂の分子機構およびその生理的な意義.
関心事:研究,音楽,映画,絵画.
山下 由起子(Yukiko M. Yamashita)
米国Michigan大学Associate Professor.
研究室URL:http://www.lsi.umich.edu/labs/yukiko-yamashita-lab
© 2015 稲葉真弓・山下由起子 Licensed under CC 表示 2.1 日本