精製タンパク質を使って分裂期の染色体をつくる
新冨圭史・平野達也
(理化学研究所 平野染色体ダイナミクス研究室)
email:新冨圭史
DOI: 10.7875/first.author.2015.086
Reconstitution of mitotic chromatids with a minimum set of purified factors.
Keishi Shintomi, Tatsuro S. Takahashi, Tatsuya Hirano
Nature Cell Biology, 17, 1014-1023 (2015)
分裂期における染色体の構築は遺伝情報を娘細胞へと正確に伝えるために不可欠な過程である.しかし,染色体がどのようにつくられるのかという根本的な問題はいまだ解明されていない.筆者らは,この問題を深く掘り下げるため,精製タンパク質のみを使って試験管内において分裂期の染色体をつくる実験系の開発に挑戦した.驚くべきことに,染色体を再構成するにはコアヒストン,ヌクレオプラスミン,Nap1,FACT,トポイソメラーゼII,コンデンシンIのわずか6種類のタンパク質だけで十分であった.この染色体の再構成系は,染色体の構築の鍵となるヌクレオソームや分裂期キナーゼの役割を新たな視点からとらえなおすことを可能にしただけではなく,染色体の機能の人為的な制御へむけ大きなポテンシャルをひめるとも考えられた.
細胞が分裂期に進むと核膜が消失しクロマチンから染色体がかたちづくられる.この劇的かつ美しい現象がはじめて詳細に観察されたのは,19世紀末,じつに130年以上もまえにまでさかのぼる.そののち,20世紀の半ばに,染色体の構成成分であるDNAが遺伝情報を担う分子であることが判明すると,分裂期における染色体の構築は遺伝情報の継承に不可欠な過程と考えられるようになり,その背景にある分子機構を解明すべく多くの研究者による努力が重ねられた.とくに,ここ20年あまりの研究の進展には目をみはるものがあり,なかでも,アフリカツメガエルの卵抽出液の無細胞系を用いた研究が大きなブレイクスルーをもたらした.この実験系を使って,染色体の構築に中心的な役割をはたすタンパク質コンデンシンが同定されたのを皮切りに1),近年では,サブユニット構成の異なるコンデンシンIとコンデンシンIIの機能の違いが明確に示されるにいたった2).また,コンデンシンにくわえトポイソメラーゼIIが染色体の構築に必要なタンパク質であることが証明された3).しかし,現段階では染色体の構築に必要かつ十分な因子が確定されたわけではなく,染色体におけるクロマチンの折りたたみの機構についても推測の域をでない4,5).筆者らは,こうした積年の問題を解決するには,より洗練された新たな実験系をつくりだすこと,すなわち,可能なかぎり少ない種類の精製タンパク質を用いて分裂期の染色体を試験管内において再構成することが有効であると考えた.
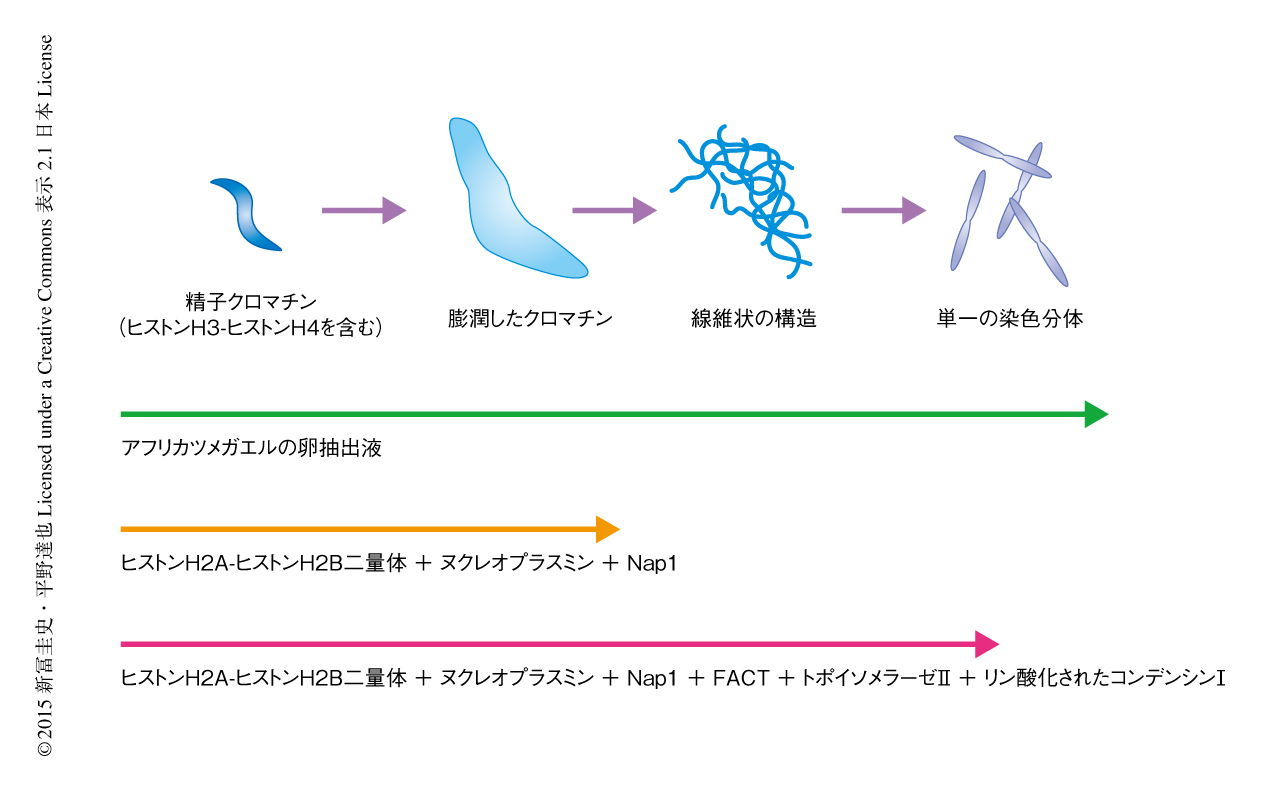
しかし,そのような大胆なアプローチはこれまで報告された例がなかった.その最大の理由は,染色体を再構成するためいったい何種類のタンパク質が必要なのかわかっていないことであろうと思われた.しかし筆者らは,アフリカツメガエルの卵抽出液の無細胞系を用いた実験においてこの問題を解くための大きなヒントを見い出していた.この実験系では,精子を界面活性剤処理したクロマチンを基質としてDNAの複製を介さずに単一の染色分体からなる染色体を形成することができる(図1).この“単純な”染色体を構成する主要なタンパク質を調べたところ,卵抽出液にはおよそ10,000種類のタンパク質が存在するのとは対照的にその種類は驚くほど少なく,ヒストン,トポイソメラーゼII,コンデンシンIのみがとくに多く存在していた6).さらに,卵抽出液から除去した際に染色体の構築が大きく損なわれるタンパク質はトポイソメラーゼIIとコンデンシンIのほかには知られていなかった.一方,直接的な証明はなされていなかったものの,ヌクレオソームを構成するコアヒストンも必要であることは想像にかたくなかった.したがって,コアヒストン,トポイソメラーゼII,コンデンシンIの精製タンパク質をゲノムDNAと適切に相互作用させることができれば,染色体の再構成にむけ大きな一歩になるのではないかと予想した.
精子クロマチンを分裂期のアフリカツメガエルの卵抽出液においてインキュベーションすると,細い単一の染色分体のからまった分裂期に特徴的な線維状の構造が形成される(図1).精製タンパク質のみを使ってこの線維状の構造を再構成することを当面のゴールとした.ヒトやマウスでは精子の形成の過程において大部分のヒストンH3-ヒストンH4が失われるが,出発材料として用いたアフリカツメガエルの精子クロマチンは,プロタミンにくわえ十分な量のヒストンH3-ヒストンH4を含んでいる.ここからプロタミンのみを除去してヌクレオソームをつくるには,ヌクレオプラスミンおよびNap1という2種類のヒストンシャペロンをヒストンH2A-ヒストンH2B二量体とともにくわえれば十分であった.この反応はわずか2~3分間で完了し,同時に,高度にパッキングした精子クロマチンの形状は大きく膨潤した(図1).このようにして得られた構造を分裂期の染色体の構築のための基質とした.しかし,このクロマチンにトポイソメラーゼIIおよびコンデンシンIの精製タンパク質をATPとともにくわえても線維状の構造は形成されなかった.すなわち,ヒストンH2A-ヒストンH2B二量体,ヌクレオプラスミン,Nap1,トポイソメラーゼII,コンデンシンIのほかにも必要なタンパク質のあることが示唆された.
そこで,卵抽出液を生化学的に分画して5種類のタンパク質と混合し,どの画分に線維状の構造を再構成する活性が検出されるか調べた.最終的に絞り込まれた画分は,ヒストンシャペロンFACTの構成サブユニットであるSpt16およびSsrp1 7) をおもに含んでいた.さらに,この画分のもつ活性は組換えFACTにより置き換えることができた.以上の結果から,精子クロマチンにたった6種類のタンパク質をくわえることにより染色体を再構成できることがわかった(図1).
染色体の再構成系にヒストンH2A-ヒストンH2B二量体をくわえない場合にはヒストンH3-ヒストンH4のみを含む膨潤したクロマチンが形成された.このクロマチンにはトポイソメラーゼIIやコンデンシンIが結合するにもかかわらず線維状の構造には変化しなかった.この結果は,ヒストン八量体からなるヌクレオソームの形成が染色体の構築の必要条件であることをはじめて明確に証明したものであった.
ここで,染色体の再構成系にくわえたヒストンH2A-ヒストンH2B二量体についてくわしく述べる.さきに述べた染色体の再構成に成功した実験では,ヒストンH2Aとして初期胚型のヒストンバリアントであるヒストンH2A.X-F,ヒストンH2Bとして標準型のヒストンH2Bを用い,さらに,ともにN末端のヒストンテイルは欠失させていた.これを,同様にN末端のヒストンテイルを欠失させた標準型のヒストンH2A-ヒストンH2B二量体,あるいは,全長の標準型のヒストンH2A-ヒストンH2B二量体に置き換えても,線維状の構造は形成されなかった.これらの結果から,ヌクレオソームにおいてDNAとの相互作用部位に位置するヒストンH2A.X-FのC末端側の領域が染色体の再構成において重要であると考えられた.一方,染色体の再構成系においてヒストンシャペロンであるヌクレオプラスミン,Nap1,FACTはいずれも必須であったことから,これらは重複しない役割をはたしていることが示唆された.なかでも,FACTの機能は興味深い.近年になり報告された構造解析からは,FACTはヌクレオソームにおいてDNAとヒストンとの相互作用を弱めるというモデルが提唱されている8).ヒストンH2A.X-FのC末端側の領域はほかのヒストンH2Aと比べ長く酸性アミノ酸残基を含むことをあわせて考えると,ヒストンH2A.X-FとFACTとの組合せはヌクレオソームの不安定化に寄与することによりトポイソメラーゼIIやコンデンシンIがはたらくために適した場をあたえているのかもしれない.
染色体の再構成に用いた精製タンパク質のうち5種類は組換えタンパク質であり,細胞周期に特異的な修飾をうけていなかった.唯一の例外はコンデンシンIで,これは分裂期のアフリカツメガエルの卵抽出液から精製したものであった.この分裂期型のコンデンシンIを間期型のコンデンシンIに置き換えると染色体は形成されなかった.そこで,この間期型のコンデンシンIを含む反応液に分裂期キナーゼをくわえたときの影響について調べた.その結果,分裂期のマスターキナーゼであるサイクリンB-Cdk1をくわえただけでコンデンシンIのサブユニットがリン酸化され線維状の構造が形成された.一方,染色体において多くの基質をリン酸化することの知られるAurora Bをくわえても線維状の構造は形成されなかった.したがって,6種類のタンパク質のうち分裂期に特異的な制御をうけるのはコンデンシンIのみであり,しかも,Cdk1によるリン酸化が染色体の再構成に必要かつ十分であると結論された.さらにこれらの結果は,Cdk1により活性化されるコンデンシンIのスーパーコイル化活性9) が染色体の構築に直接に関与しているというモデルを強く支持した.
アフリカツメガエルの卵抽出液においては相互のからまりの解消されたような太い単一の染色分体が観察されるのに対し,精製したタンパク質を用いた再構成系においては細い線維のからまりあった構造しか観察されなかった(図1).すなわち,再構成系においては染色体の構築の中間状態まで再現されたと解釈するほうが適切であろう.今後の課題は,染色体の構築がより進むような条件をみつけることである.そのためには,さらにいくつかのタンパク質をくわえる必要があるのもしれない.あるいは,分子混雑度やイオン強度など反応条件をくふうすることにより反応は改善するかもしれない.また,そのさきにある課題として,電子顕微鏡,原子間力顕微鏡,X線小角散乱を用いた構造解析があげられる.染色体の再構成系を用いれば標本を作製する際のアーティファクトや混入物を大幅に低減させられるので,染色体におけるクロマチンの折りたたみを探るための理想的な材料となるだろう.また,いずれかのタンパク質をくわえなかった際の構造を比較することにより,おのおののタンパク質の機能をより詳細に理解できるだろう.
さらに,この染色体の再構成系は実学的な研究にも貢献できるポテンシャルをひめると期待している.たとえば,核移植により体細胞クローンを作出する際には,移植される核がいったん染色体の構造をへることにより効率が向上することが古くから知られている10).染色体の再構成系を用いた研究により,こうした経験則に分子的な説明をあたえることができるばかりでなく,あらかじめ核を精製タンパク質により処理することにより移植ののちのコンピテンシーを向上させることも可能になるかもしれない.
分裂期の染色体を再構成するという挑戦をつうじ,この巨大な構造は驚くほど少ない種類のタンパク質を用いてつくりうることがわかった.最近,複製の開始反応も16種類の精製タンパク質さえあれば再現されることが示された11).このような“つくる”方法論は,細胞における複雑な現象の背景にある本質的な分子のつながりを鮮明にえがきだすことから,今後,さまざまな研究対象に対し適用されていくだろう.さらに,この方法論はひとつの現象に焦点をしぼって解析を進めることができるので,複数の現象に関与する因子の機能を精密に解剖していくうえでも大きな威力を発揮する.かつて,理論物理学という紙と鉛筆の学問に生きたリチャード・ファインマンは “What I cannot create, I do not understand” との名言を残した.実験を軸とする分子細胞生物学においても,“つくってこそわかる事実”が明らかになる時代がついにやってきたようである.
略歴:2005年 東京工業大学大学院生命理工学研究科 修了,同年 米国Cold Spring Harbor Laboratoryポスドク,2007年 理化学研究所 ポスドクを経て,2011年より同 スタッフ研究員.
研究テーマ:ゲノムDNAの複製および分配の機構.
抱負:理知的で創造性に富んだ科学者をめざしたい.
平野 達也(Tatsuya Hirano)
理化学研究所 主任研究員.
研究室URL:http://www.riken.jp/chromdyna/index.html
© 2015 新冨圭史・平野達也 Licensed under CC 表示 2.1 日本
(理化学研究所 平野染色体ダイナミクス研究室)
email:新冨圭史
DOI: 10.7875/first.author.2015.086
Reconstitution of mitotic chromatids with a minimum set of purified factors.
Keishi Shintomi, Tatsuro S. Takahashi, Tatsuya Hirano
Nature Cell Biology, 17, 1014-1023 (2015)
要 約
分裂期における染色体の構築は遺伝情報を娘細胞へと正確に伝えるために不可欠な過程である.しかし,染色体がどのようにつくられるのかという根本的な問題はいまだ解明されていない.筆者らは,この問題を深く掘り下げるため,精製タンパク質のみを使って試験管内において分裂期の染色体をつくる実験系の開発に挑戦した.驚くべきことに,染色体を再構成するにはコアヒストン,ヌクレオプラスミン,Nap1,FACT,トポイソメラーゼII,コンデンシンIのわずか6種類のタンパク質だけで十分であった.この染色体の再構成系は,染色体の構築の鍵となるヌクレオソームや分裂期キナーゼの役割を新たな視点からとらえなおすことを可能にしただけではなく,染色体の機能の人為的な制御へむけ大きなポテンシャルをひめるとも考えられた.
はじめに
細胞が分裂期に進むと核膜が消失しクロマチンから染色体がかたちづくられる.この劇的かつ美しい現象がはじめて詳細に観察されたのは,19世紀末,じつに130年以上もまえにまでさかのぼる.そののち,20世紀の半ばに,染色体の構成成分であるDNAが遺伝情報を担う分子であることが判明すると,分裂期における染色体の構築は遺伝情報の継承に不可欠な過程と考えられるようになり,その背景にある分子機構を解明すべく多くの研究者による努力が重ねられた.とくに,ここ20年あまりの研究の進展には目をみはるものがあり,なかでも,アフリカツメガエルの卵抽出液の無細胞系を用いた研究が大きなブレイクスルーをもたらした.この実験系を使って,染色体の構築に中心的な役割をはたすタンパク質コンデンシンが同定されたのを皮切りに1),近年では,サブユニット構成の異なるコンデンシンIとコンデンシンIIの機能の違いが明確に示されるにいたった2).また,コンデンシンにくわえトポイソメラーゼIIが染色体の構築に必要なタンパク質であることが証明された3).しかし,現段階では染色体の構築に必要かつ十分な因子が確定されたわけではなく,染色体におけるクロマチンの折りたたみの機構についても推測の域をでない4,5).筆者らは,こうした積年の問題を解決するには,より洗練された新たな実験系をつくりだすこと,すなわち,可能なかぎり少ない種類の精製タンパク質を用いて分裂期の染色体を試験管内において再構成することが有効であると考えた.
しかし,そのような大胆なアプローチはこれまで報告された例がなかった.その最大の理由は,染色体を再構成するためいったい何種類のタンパク質が必要なのかわかっていないことであろうと思われた.しかし筆者らは,アフリカツメガエルの卵抽出液の無細胞系を用いた実験においてこの問題を解くための大きなヒントを見い出していた.この実験系では,精子を界面活性剤処理したクロマチンを基質としてDNAの複製を介さずに単一の染色分体からなる染色体を形成することができる(図1).この“単純な”染色体を構成する主要なタンパク質を調べたところ,卵抽出液にはおよそ10,000種類のタンパク質が存在するのとは対照的にその種類は驚くほど少なく,ヒストン,トポイソメラーゼII,コンデンシンIのみがとくに多く存在していた6).さらに,卵抽出液から除去した際に染色体の構築が大きく損なわれるタンパク質はトポイソメラーゼIIとコンデンシンIのほかには知られていなかった.一方,直接的な証明はなされていなかったものの,ヌクレオソームを構成するコアヒストンも必要であることは想像にかたくなかった.したがって,コアヒストン,トポイソメラーゼII,コンデンシンIの精製タンパク質をゲノムDNAと適切に相互作用させることができれば,染色体の再構成にむけ大きな一歩になるのではないかと予想した.
1.分裂期の染色体はたった6種類のタンパク質を用いて再構成することができる
精子クロマチンを分裂期のアフリカツメガエルの卵抽出液においてインキュベーションすると,細い単一の染色分体のからまった分裂期に特徴的な線維状の構造が形成される(図1).精製タンパク質のみを使ってこの線維状の構造を再構成することを当面のゴールとした.ヒトやマウスでは精子の形成の過程において大部分のヒストンH3-ヒストンH4が失われるが,出発材料として用いたアフリカツメガエルの精子クロマチンは,プロタミンにくわえ十分な量のヒストンH3-ヒストンH4を含んでいる.ここからプロタミンのみを除去してヌクレオソームをつくるには,ヌクレオプラスミンおよびNap1という2種類のヒストンシャペロンをヒストンH2A-ヒストンH2B二量体とともにくわえれば十分であった.この反応はわずか2~3分間で完了し,同時に,高度にパッキングした精子クロマチンの形状は大きく膨潤した(図1).このようにして得られた構造を分裂期の染色体の構築のための基質とした.しかし,このクロマチンにトポイソメラーゼIIおよびコンデンシンIの精製タンパク質をATPとともにくわえても線維状の構造は形成されなかった.すなわち,ヒストンH2A-ヒストンH2B二量体,ヌクレオプラスミン,Nap1,トポイソメラーゼII,コンデンシンIのほかにも必要なタンパク質のあることが示唆された.
そこで,卵抽出液を生化学的に分画して5種類のタンパク質と混合し,どの画分に線維状の構造を再構成する活性が検出されるか調べた.最終的に絞り込まれた画分は,ヒストンシャペロンFACTの構成サブユニットであるSpt16およびSsrp1 7) をおもに含んでいた.さらに,この画分のもつ活性は組換えFACTにより置き換えることができた.以上の結果から,精子クロマチンにたった6種類のタンパク質をくわえることにより染色体を再構成できることがわかった(図1).
2.染色体を構築するには動的なヌクレオソームの形成が重要である
染色体の再構成系にヒストンH2A-ヒストンH2B二量体をくわえない場合にはヒストンH3-ヒストンH4のみを含む膨潤したクロマチンが形成された.このクロマチンにはトポイソメラーゼIIやコンデンシンIが結合するにもかかわらず線維状の構造には変化しなかった.この結果は,ヒストン八量体からなるヌクレオソームの形成が染色体の構築の必要条件であることをはじめて明確に証明したものであった.
ここで,染色体の再構成系にくわえたヒストンH2A-ヒストンH2B二量体についてくわしく述べる.さきに述べた染色体の再構成に成功した実験では,ヒストンH2Aとして初期胚型のヒストンバリアントであるヒストンH2A.X-F,ヒストンH2Bとして標準型のヒストンH2Bを用い,さらに,ともにN末端のヒストンテイルは欠失させていた.これを,同様にN末端のヒストンテイルを欠失させた標準型のヒストンH2A-ヒストンH2B二量体,あるいは,全長の標準型のヒストンH2A-ヒストンH2B二量体に置き換えても,線維状の構造は形成されなかった.これらの結果から,ヌクレオソームにおいてDNAとの相互作用部位に位置するヒストンH2A.X-FのC末端側の領域が染色体の再構成において重要であると考えられた.一方,染色体の再構成系においてヒストンシャペロンであるヌクレオプラスミン,Nap1,FACTはいずれも必須であったことから,これらは重複しない役割をはたしていることが示唆された.なかでも,FACTの機能は興味深い.近年になり報告された構造解析からは,FACTはヌクレオソームにおいてDNAとヒストンとの相互作用を弱めるというモデルが提唱されている8).ヒストンH2A.X-FのC末端側の領域はほかのヒストンH2Aと比べ長く酸性アミノ酸残基を含むことをあわせて考えると,ヒストンH2A.X-FとFACTとの組合せはヌクレオソームの不安定化に寄与することによりトポイソメラーゼIIやコンデンシンIがはたらくために適した場をあたえているのかもしれない.
3.染色体の構築においてもっとも重要な分裂期に特異的な制御はCdk1によるリン酸化である
染色体の再構成に用いた精製タンパク質のうち5種類は組換えタンパク質であり,細胞周期に特異的な修飾をうけていなかった.唯一の例外はコンデンシンIで,これは分裂期のアフリカツメガエルの卵抽出液から精製したものであった.この分裂期型のコンデンシンIを間期型のコンデンシンIに置き換えると染色体は形成されなかった.そこで,この間期型のコンデンシンIを含む反応液に分裂期キナーゼをくわえたときの影響について調べた.その結果,分裂期のマスターキナーゼであるサイクリンB-Cdk1をくわえただけでコンデンシンIのサブユニットがリン酸化され線維状の構造が形成された.一方,染色体において多くの基質をリン酸化することの知られるAurora Bをくわえても線維状の構造は形成されなかった.したがって,6種類のタンパク質のうち分裂期に特異的な制御をうけるのはコンデンシンIのみであり,しかも,Cdk1によるリン酸化が染色体の再構成に必要かつ十分であると結論された.さらにこれらの結果は,Cdk1により活性化されるコンデンシンIのスーパーコイル化活性9) が染色体の構築に直接に関与しているというモデルを強く支持した.
4.染色体の再構成系を使って何ができるか?
アフリカツメガエルの卵抽出液においては相互のからまりの解消されたような太い単一の染色分体が観察されるのに対し,精製したタンパク質を用いた再構成系においては細い線維のからまりあった構造しか観察されなかった(図1).すなわち,再構成系においては染色体の構築の中間状態まで再現されたと解釈するほうが適切であろう.今後の課題は,染色体の構築がより進むような条件をみつけることである.そのためには,さらにいくつかのタンパク質をくわえる必要があるのもしれない.あるいは,分子混雑度やイオン強度など反応条件をくふうすることにより反応は改善するかもしれない.また,そのさきにある課題として,電子顕微鏡,原子間力顕微鏡,X線小角散乱を用いた構造解析があげられる.染色体の再構成系を用いれば標本を作製する際のアーティファクトや混入物を大幅に低減させられるので,染色体におけるクロマチンの折りたたみを探るための理想的な材料となるだろう.また,いずれかのタンパク質をくわえなかった際の構造を比較することにより,おのおののタンパク質の機能をより詳細に理解できるだろう.
さらに,この染色体の再構成系は実学的な研究にも貢献できるポテンシャルをひめると期待している.たとえば,核移植により体細胞クローンを作出する際には,移植される核がいったん染色体の構造をへることにより効率が向上することが古くから知られている10).染色体の再構成系を用いた研究により,こうした経験則に分子的な説明をあたえることができるばかりでなく,あらかじめ核を精製タンパク質により処理することにより移植ののちのコンピテンシーを向上させることも可能になるかもしれない.
おわりに
分裂期の染色体を再構成するという挑戦をつうじ,この巨大な構造は驚くほど少ない種類のタンパク質を用いてつくりうることがわかった.最近,複製の開始反応も16種類の精製タンパク質さえあれば再現されることが示された11).このような“つくる”方法論は,細胞における複雑な現象の背景にある本質的な分子のつながりを鮮明にえがきだすことから,今後,さまざまな研究対象に対し適用されていくだろう.さらに,この方法論はひとつの現象に焦点をしぼって解析を進めることができるので,複数の現象に関与する因子の機能を精密に解剖していくうえでも大きな威力を発揮する.かつて,理論物理学という紙と鉛筆の学問に生きたリチャード・ファインマンは “What I cannot create, I do not understand” との名言を残した.実験を軸とする分子細胞生物学においても,“つくってこそわかる事実”が明らかになる時代がついにやってきたようである.
文 献
- Hirano, T., Kobayashi, R. & Hirano, M.: Condensins, chromosome condensation protein complexes containing XCAP-C, XCAP-E and a Xenopus homolog of the Drosophila Barren protein. Cell, 89, 511-521 (1997)[PubMed]
- Shintomi, K. & Hirano, T.: The relative ratio of condensin I to II determines chromosome shapes. Genes Dev., 25, 1464-1469 (2011)[PubMed]
- Hirano, T. & Mitchison, T. J.: Topoisomerase II does not play a scaffolding role in the organization of mitotic chromosomes assembled in Xenopus egg extracts. J. Cell Biol., 120, 601-612 (1993)[PubMed]
- Swedlow, J. R. & Hirano, T.: The making of the mitotic chromosome: modern insights into classical questions. Mol. Cell, 11, 557-569 (2003)[PubMed]
- Maeshima, K., Hihara, S. & Takata, H.: New insight into the mitotic chromosome structure: irregular folding of nucleosome fibers without 30-nm chromatin structure. Cold Spring Harb. Symp. Quant. Biol., 75, 439-444 (2010)[PubMed]
- Hirano, T. & Mitchison, T. J.: A heterodimeric coiled-coil protein required for mitotic chromosome condensation in vitro. Cell, 79, 449-458 (1994)[PubMed]
- Formosa, T.: The role of FACT in making and breaking nucleosomes. Biochim. Biophys. Acta, 1819, 247-255 (2013)[PubMed]
- Hondele, M., Stuwe, T., Hassler, M. et al.: Structural basis of histone H2A-H2B recognition by the essential chaperone FACT. Nature, 499, 111-114 (2013)[PubMed]
- Kimura, K., Hirano, M., Kobayashi, R. et al.: Phosphorylation and activation of 13S condensin by Cdc2 in vitro. Science, 282, 487-490 (1998)[PubMed]
- Gurdon, J. B.: The developmental capacity of nuclei taken from intestinal epithelium cells of feeding tadpoles. J. Embryol. Exp. Morphol., 10, 622-640 (1962)[PubMed]
- Yeeles, J. T., Deegan, T. D., Janska, A. et al.: Regulated eukaryotic DNA replication origin firing with purified proteins. Nature, 519, 431-435 (2015)[PubMed]
著者プロフィール
略歴:2005年 東京工業大学大学院生命理工学研究科 修了,同年 米国Cold Spring Harbor Laboratoryポスドク,2007年 理化学研究所 ポスドクを経て,2011年より同 スタッフ研究員.
研究テーマ:ゲノムDNAの複製および分配の機構.
抱負:理知的で創造性に富んだ科学者をめざしたい.
平野 達也(Tatsuya Hirano)
理化学研究所 主任研究員.
研究室URL:http://www.riken.jp/chromdyna/index.html
© 2015 新冨圭史・平野達也 Licensed under CC 表示 2.1 日本