メダカの生殖細胞における性決定遺伝子の同定
西村俊哉・田中 実
(基礎生物学研究所 生殖遺伝学研究室)
email:西村俊哉,田中 実
DOI: 10.7875/first.author.2015.084
foxl3 is a germ cell-intrinsic factor involved in sperm-egg fate decision in medaka.
Toshiya Nishimura, Tetsuya Sato, Yasuhiro Yamamoto, Ikuko Watakabe, Yasuyuki Ohkawa, Mikita Suyama, Satoru Kobayashi, Minoru Tanaka
Science, 349, 328-331 (2015)
繁殖に重要な精子と卵は,生殖腺とよばれる器官において生殖細胞という共通の細胞から形成される.この生殖腺は生殖細胞とそれをとりかこむ体細胞から構成される.多くの脊椎動物においては体細胞における最初に性が決まり,その影響をうけて生殖細胞は精子あるいは卵への運命決定,すなわち,生殖細胞における性の決定が行われることが知られている.しかしながら,生殖細胞のなかに自律的に性を決めるしくみがあるのか,あるとすればどのような分子機構によるのか,脊椎動物においてはその詳細は明らかではなかった.この研究において,生殖細胞で発現するfoxl3遺伝子とよばれる遺伝子がメダカの生殖細胞における性の決定にかかわることが明らかにされた.foxl3遺伝子の機能を欠損させると卵巣において機能的な精子が形成された.以上のことから,生殖細胞のなかに性を決めるスイッチが存在し,ひとたびオスのスイッチが入ると生殖細胞をとりまく環境がメスであったとしても精子の形成が進行することが示された.
精子と卵は多くの動物において繁殖のために重要な細胞であり,生殖細胞という共通の細胞から形成される.精子は精巣,卵は卵巣において形成され,精巣と卵巣とをあわせて生殖腺とよぶ.生殖腺は生殖細胞とそれをとりかこむ体細胞から構成される.多くの脊椎動物において,生殖細胞から精子あるいは卵が形成される最初のステップは体細胞における性の決定である.メダカはXX-XY型の性決定様式をもち,Y染色体に存在する性決定遺伝子DMY遺伝子により体細胞における性が決まる1).体細胞においてDMY遺伝子が発現すると生殖腺は精巣になり,その影響をうけて生殖細胞も精子への分化が可能になる.一方,DMY遺伝子がはたらかないと生殖腺は卵巣になり,生殖細胞も卵になる.このように,体細胞の性の影響をうけて生殖細胞は精子あるいは卵への運命決定,すなわち,生殖細胞における性の決定が起こる.しかしながら,生殖細胞においてどのような遺伝子がはたらいて性が決定されるのか,脊椎動物においてそのしくみは謎につつまれていた.筆者らは,メダカを用いた研究によりfoxl3遺伝子は生殖細胞における性決定遺伝子であると同定し,生殖細胞における性のスイッチの一端を明らかにした.
foxl2遺伝子の遺伝子重複により生じたfoxl3遺伝子は魚類の生殖腺における発現が報告されていた2-4).foxl2遺伝子は哺乳類や魚類において卵巣の形成に重要な転写因子をコードすることがわかっていたが5,6),foxl3遺伝子の機能については何もわかっていなかった.メダカの生殖腺においてfoxl3遺伝子の発現を調べたところ,性分化の初期のメスの生殖細胞およびオスの生殖細胞において発現していた.そこで,foxl3遺伝子は生殖細胞のどの分化の段階において発現しているのか,FOXL3の発現を免疫染色法により調べた.
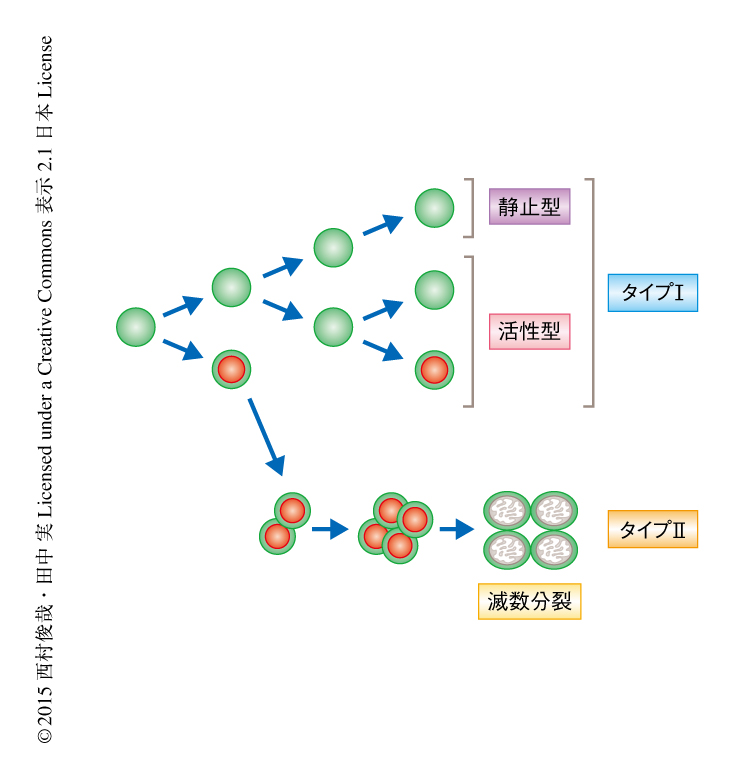
その結果を述べるまえに,メダカの生殖細胞の分化段階の違いを示す分裂の様式について説明する.筆者らは過去の研究において,メダカの生殖細胞の体細胞分裂はタイプIとよばれる幹細胞型の分裂とタイプIIとよばれるシスト型の分裂とに分けられることを報告した1,7)(図1).タイプIの分裂では1つの生殖細胞が完全に分裂し2つの娘細胞はそれぞれ体細胞にとりかこまれ独立して存在する.タイプIIの分裂では1つの生殖細胞は完全には分裂せず細胞のあいだの架橋につながったまま2細胞,4細胞,8細胞,16細胞と同調的に増殖する.生殖腺の形成の直後のメスの生殖細胞およびオスの生殖細胞はタイプIの分裂により増殖する幹細胞型の生殖細胞として存在する.しかし,生殖腺の性分化が初期段階に入ると,DMY遺伝子が存在しないメスでは,生殖細胞の一部はタイプIIの分裂により増殖してシスト型の生殖細胞へと移行し,生殖細胞の数は指数関数的に増加していく.これらのシスト型の生殖細胞はやがて減数分裂へと移行して卵を形成する.一方,体細胞においてDMY遺伝子がはたらくと,オスの生殖細胞ではシスト型の生殖細胞への移行は抑制され,孵化ののち30日目までは幹細胞型の生殖細胞のまま存在しゆるやかにタイプIの分裂を行う.
さて,FOXL3の発現は性分化の初期にはメスおよびオスともに一部の幹細胞型の生殖細胞においてみられた.幹細胞型の生殖細胞は分裂の頻度からさらに分裂頻度の低い静止型と分裂頻度の高い活性型とに二分される8,9)(図1).FOXL3はメスの幹細胞型の生殖細胞にて静止型においては発現しておらず,一部の活性型において発現していた.さらに,FOXL3はメスのすべてのシスト型の生殖細胞においてみられたが,減数分裂へと移行すると発現は消失した(図1).また,オスの幹細胞型の生殖細胞においてはFOXL3を発現していた生殖細胞は孵化ののち10日目までに完全に消失した.
以上の結果は,性分化のごく初期の生殖細胞においてfoxl3遺伝子の発現に性差のあることを示した.そこで,foxl3遺伝子の機能を調べるため,TALENを用いたゲノム編集技術によりfoxl3遺伝子の機能を欠損したメダカを作出した.
孵化ののち7日目ごろになると,野生型のメスの生殖腺においては多数の卵母細胞が形成される.同じ時期のメスのfoxl3機能欠損変異体の生殖腺を調べたところ,卵母細胞はなく精子様の小さな細胞が観察された.それらの細胞は精子の形成の異なる分化の段階に特異的な遺伝子を調べたかぎりすべて発現していたため,メスのfoxl3機能欠損変異体の生殖腺は卵の代わりに精子を形成すると考えられた.
メスのfoxl3機能欠損変異体が精子の形成を開始したのは,体細胞ではなく生殖細胞におけるfoxl3遺伝子の機能の欠損が原因なのかを検証するため,キメラメダカを解析した.メスのfoxl3機能欠損変異体の生殖細胞を野生型のメスの胚に移植すると,野生型の生殖腺のなかにfoxl3遺伝子の機能を欠損した生殖細胞の混ざった状態をつくりだすことができる.ホストに由来する野生型の生殖細胞は卵を形成したのに対し,ドナーに由来するfoxl3遺伝子の機能を欠損した生殖細胞は精子の形成を開始した.よって,精子の形成が開始したのは体細胞の影響ではなく生殖細胞におけるfoxl3遺伝子の機能の欠損が原因であると結論づけられた.
性成熟したメスのfoxl3機能欠損変異体の第2次性徴はメスを示していたが,精子を形成していた.そこで,その成熟した生殖腺の組織の構造および遺伝子発現の詳細について調べた.すると,メスの体細胞のマーカーであるfoxl2遺伝子およびaromatase遺伝子が発現しており,オスの体細胞のマーカーであるdmrt1遺伝子やp45011b遺伝子の発現は検出されなかった.さらに,卵巣に特徴的な卵巣腔が形成され,通常は卵胞が成長する実質部も野生型のメスと同様に存在していた.すなわち,メスのfoxl3機能欠損変異体は身体全体も生殖腺の構造も,さらには,体細胞における遺伝子発現もメスそのものであったが,その卵巣のなかには多量の精子が存在したことになる.興味深いことに,性成熟した卵巣においては少量ではあるが卵母細胞も形成されていた.この卵母細胞をもつメスのfoxl3機能欠損変異体は野生型のオスと交配が可能であり,少量ではあるが卵を産むことも明らかにされた.
メスのfoxl3機能欠損変異体の卵巣において形成された精子が機能的かどうかを調べるため,野生型の卵と人工授精した.その結果,卵は受精し,その卵からは正常な個体が誕生したことから,卵巣において形成された精子は機能的であることが示された.以上を総合すると,メスにおいてfoxl3遺伝子の機能が欠損すると,性成熟のまえの卵巣において精子のみが形成されるが,やがて,性成熟すると少量の卵も形成されるようになり,これらの精子および卵はいずれも受精が可能であることが明らかにされた.
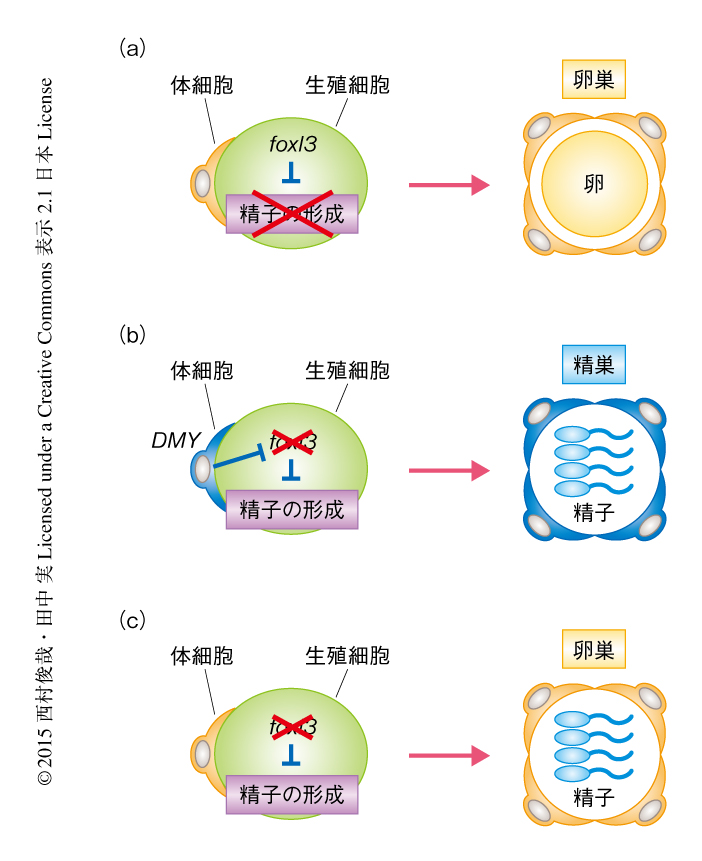
この研究により,foxl3遺伝子は精子になるか卵になるかを決める,生殖細胞における性決定遺伝子であると同定された.foxl3遺伝子は一部の幹細胞型の生殖細胞およびすべてのシスト型の生殖細胞において発現がみられたが,減数分裂へと移行すると発現は消失した.このことから,生殖細胞の性は静止型の生殖幹細胞から減数分裂のまえまでのあいだに決まると考えられた.また,foxl3遺伝子の機能が欠損するとメスにおいて精子の形成が進行することが示されたことから,foxl3遺伝子の精子の形成を抑制する機能が生殖細胞の性を決める過程において重要であることが示された.すなわち,野生型のメスではfoxl3遺伝子により生殖細胞の精子の形成へのコミットが抑制されており,このことが卵巣における卵の形成において重要であると考えられた(図2a).一方,野生型のオスではDMY遺伝子のはたらきでオス化した体細胞によりfoxl3遺伝子の発現が抑制されるため,精子の形成のスイッチが入り精巣において精子が形成されると考えられた(図2b).メスの生殖細胞においてfoxl3遺伝子の機能を欠損させると,この精子の形成の抑制が人為的に解除されるために卵巣で精子の形成が進行したと理解される(図2c).以上のことから,生殖細胞をとりかこむ環境がメスであったとしても精子の形成は進行し,生殖細胞には体細胞とは独立した性決定の機構が存在することが示された.
今後は,オスの体細胞がfoxl3遺伝子の発現を抑制する機構,また,メスの生殖細胞においてfoxl3遺伝子が直接的に制御している遺伝子を明らかにすることにより,生殖細胞の性が決まるしくみについてさらに理解が深まると考えられる.また,foxl3遺伝子がfoxl2遺伝子の遺伝子重複により生じたことはすでに述べたが,哺乳類においてfoxl2遺伝子は体細胞のオス化を抑制する機能をもち,そのことが体細胞のメス化の維持に重要であることが示されている10).よって,foxl2遺伝子およびfoxl3遺伝子がそれぞれ体細胞および生殖細胞においてオス化の抑制という共通の機能をもち,そのことは生殖腺のメス化においても重要なのか,今後,明らかにしていきたい.
略歴:2015年 総合研究大学院大学生命科学研究科 修了,同年より基礎生物学研究所 リサーチフェロー.
研究テーマ:生殖細胞の性決定および性分化.
関心事:落語.
田中 実(Minoru Tanaka)
基礎生物学研究所 准教授.
研究室URL:http://www.nibb.ac.jp/reprogenetics/
© 2015 西村俊哉・田中 実 Licensed under CC 表示 2.1 日本
(基礎生物学研究所 生殖遺伝学研究室)
email:西村俊哉,田中 実
DOI: 10.7875/first.author.2015.084
foxl3 is a germ cell-intrinsic factor involved in sperm-egg fate decision in medaka.
Toshiya Nishimura, Tetsuya Sato, Yasuhiro Yamamoto, Ikuko Watakabe, Yasuyuki Ohkawa, Mikita Suyama, Satoru Kobayashi, Minoru Tanaka
Science, 349, 328-331 (2015)
要 約
繁殖に重要な精子と卵は,生殖腺とよばれる器官において生殖細胞という共通の細胞から形成される.この生殖腺は生殖細胞とそれをとりかこむ体細胞から構成される.多くの脊椎動物においては体細胞における最初に性が決まり,その影響をうけて生殖細胞は精子あるいは卵への運命決定,すなわち,生殖細胞における性の決定が行われることが知られている.しかしながら,生殖細胞のなかに自律的に性を決めるしくみがあるのか,あるとすればどのような分子機構によるのか,脊椎動物においてはその詳細は明らかではなかった.この研究において,生殖細胞で発現するfoxl3遺伝子とよばれる遺伝子がメダカの生殖細胞における性の決定にかかわることが明らかにされた.foxl3遺伝子の機能を欠損させると卵巣において機能的な精子が形成された.以上のことから,生殖細胞のなかに性を決めるスイッチが存在し,ひとたびオスのスイッチが入ると生殖細胞をとりまく環境がメスであったとしても精子の形成が進行することが示された.
はじめに
精子と卵は多くの動物において繁殖のために重要な細胞であり,生殖細胞という共通の細胞から形成される.精子は精巣,卵は卵巣において形成され,精巣と卵巣とをあわせて生殖腺とよぶ.生殖腺は生殖細胞とそれをとりかこむ体細胞から構成される.多くの脊椎動物において,生殖細胞から精子あるいは卵が形成される最初のステップは体細胞における性の決定である.メダカはXX-XY型の性決定様式をもち,Y染色体に存在する性決定遺伝子DMY遺伝子により体細胞における性が決まる1).体細胞においてDMY遺伝子が発現すると生殖腺は精巣になり,その影響をうけて生殖細胞も精子への分化が可能になる.一方,DMY遺伝子がはたらかないと生殖腺は卵巣になり,生殖細胞も卵になる.このように,体細胞の性の影響をうけて生殖細胞は精子あるいは卵への運命決定,すなわち,生殖細胞における性の決定が起こる.しかしながら,生殖細胞においてどのような遺伝子がはたらいて性が決定されるのか,脊椎動物においてそのしくみは謎につつまれていた.筆者らは,メダカを用いた研究によりfoxl3遺伝子は生殖細胞における性決定遺伝子であると同定し,生殖細胞における性のスイッチの一端を明らかにした.
1.生殖細胞においてfoxl3遺伝子の発現は性差を示す
foxl2遺伝子の遺伝子重複により生じたfoxl3遺伝子は魚類の生殖腺における発現が報告されていた2-4).foxl2遺伝子は哺乳類や魚類において卵巣の形成に重要な転写因子をコードすることがわかっていたが5,6),foxl3遺伝子の機能については何もわかっていなかった.メダカの生殖腺においてfoxl3遺伝子の発現を調べたところ,性分化の初期のメスの生殖細胞およびオスの生殖細胞において発現していた.そこで,foxl3遺伝子は生殖細胞のどの分化の段階において発現しているのか,FOXL3の発現を免疫染色法により調べた.
その結果を述べるまえに,メダカの生殖細胞の分化段階の違いを示す分裂の様式について説明する.筆者らは過去の研究において,メダカの生殖細胞の体細胞分裂はタイプIとよばれる幹細胞型の分裂とタイプIIとよばれるシスト型の分裂とに分けられることを報告した1,7)(図1).タイプIの分裂では1つの生殖細胞が完全に分裂し2つの娘細胞はそれぞれ体細胞にとりかこまれ独立して存在する.タイプIIの分裂では1つの生殖細胞は完全には分裂せず細胞のあいだの架橋につながったまま2細胞,4細胞,8細胞,16細胞と同調的に増殖する.生殖腺の形成の直後のメスの生殖細胞およびオスの生殖細胞はタイプIの分裂により増殖する幹細胞型の生殖細胞として存在する.しかし,生殖腺の性分化が初期段階に入ると,DMY遺伝子が存在しないメスでは,生殖細胞の一部はタイプIIの分裂により増殖してシスト型の生殖細胞へと移行し,生殖細胞の数は指数関数的に増加していく.これらのシスト型の生殖細胞はやがて減数分裂へと移行して卵を形成する.一方,体細胞においてDMY遺伝子がはたらくと,オスの生殖細胞ではシスト型の生殖細胞への移行は抑制され,孵化ののち30日目までは幹細胞型の生殖細胞のまま存在しゆるやかにタイプIの分裂を行う.
さて,FOXL3の発現は性分化の初期にはメスおよびオスともに一部の幹細胞型の生殖細胞においてみられた.幹細胞型の生殖細胞は分裂の頻度からさらに分裂頻度の低い静止型と分裂頻度の高い活性型とに二分される8,9)(図1).FOXL3はメスの幹細胞型の生殖細胞にて静止型においては発現しておらず,一部の活性型において発現していた.さらに,FOXL3はメスのすべてのシスト型の生殖細胞においてみられたが,減数分裂へと移行すると発現は消失した(図1).また,オスの幹細胞型の生殖細胞においてはFOXL3を発現していた生殖細胞は孵化ののち10日目までに完全に消失した.
以上の結果は,性分化のごく初期の生殖細胞においてfoxl3遺伝子の発現に性差のあることを示した.そこで,foxl3遺伝子の機能を調べるため,TALENを用いたゲノム編集技術によりfoxl3遺伝子の機能を欠損したメダカを作出した.
2.生殖細胞においてfoxl3遺伝子の機能が欠損するとメスの生殖腺で精子の形成が進行する
孵化ののち7日目ごろになると,野生型のメスの生殖腺においては多数の卵母細胞が形成される.同じ時期のメスのfoxl3機能欠損変異体の生殖腺を調べたところ,卵母細胞はなく精子様の小さな細胞が観察された.それらの細胞は精子の形成の異なる分化の段階に特異的な遺伝子を調べたかぎりすべて発現していたため,メスのfoxl3機能欠損変異体の生殖腺は卵の代わりに精子を形成すると考えられた.
メスのfoxl3機能欠損変異体が精子の形成を開始したのは,体細胞ではなく生殖細胞におけるfoxl3遺伝子の機能の欠損が原因なのかを検証するため,キメラメダカを解析した.メスのfoxl3機能欠損変異体の生殖細胞を野生型のメスの胚に移植すると,野生型の生殖腺のなかにfoxl3遺伝子の機能を欠損した生殖細胞の混ざった状態をつくりだすことができる.ホストに由来する野生型の生殖細胞は卵を形成したのに対し,ドナーに由来するfoxl3遺伝子の機能を欠損した生殖細胞は精子の形成を開始した.よって,精子の形成が開始したのは体細胞の影響ではなく生殖細胞におけるfoxl3遺伝子の機能の欠損が原因であると結論づけられた.
3.foxl3遺伝子の機能が欠損すると卵巣において機能的な精子および少量の卵が形成される
性成熟したメスのfoxl3機能欠損変異体の第2次性徴はメスを示していたが,精子を形成していた.そこで,その成熟した生殖腺の組織の構造および遺伝子発現の詳細について調べた.すると,メスの体細胞のマーカーであるfoxl2遺伝子およびaromatase遺伝子が発現しており,オスの体細胞のマーカーであるdmrt1遺伝子やp45011b遺伝子の発現は検出されなかった.さらに,卵巣に特徴的な卵巣腔が形成され,通常は卵胞が成長する実質部も野生型のメスと同様に存在していた.すなわち,メスのfoxl3機能欠損変異体は身体全体も生殖腺の構造も,さらには,体細胞における遺伝子発現もメスそのものであったが,その卵巣のなかには多量の精子が存在したことになる.興味深いことに,性成熟した卵巣においては少量ではあるが卵母細胞も形成されていた.この卵母細胞をもつメスのfoxl3機能欠損変異体は野生型のオスと交配が可能であり,少量ではあるが卵を産むことも明らかにされた.
メスのfoxl3機能欠損変異体の卵巣において形成された精子が機能的かどうかを調べるため,野生型の卵と人工授精した.その結果,卵は受精し,その卵からは正常な個体が誕生したことから,卵巣において形成された精子は機能的であることが示された.以上を総合すると,メスにおいてfoxl3遺伝子の機能が欠損すると,性成熟のまえの卵巣において精子のみが形成されるが,やがて,性成熟すると少量の卵も形成されるようになり,これらの精子および卵はいずれも受精が可能であることが明らかにされた.
おわりに
この研究により,foxl3遺伝子は精子になるか卵になるかを決める,生殖細胞における性決定遺伝子であると同定された.foxl3遺伝子は一部の幹細胞型の生殖細胞およびすべてのシスト型の生殖細胞において発現がみられたが,減数分裂へと移行すると発現は消失した.このことから,生殖細胞の性は静止型の生殖幹細胞から減数分裂のまえまでのあいだに決まると考えられた.また,foxl3遺伝子の機能が欠損するとメスにおいて精子の形成が進行することが示されたことから,foxl3遺伝子の精子の形成を抑制する機能が生殖細胞の性を決める過程において重要であることが示された.すなわち,野生型のメスではfoxl3遺伝子により生殖細胞の精子の形成へのコミットが抑制されており,このことが卵巣における卵の形成において重要であると考えられた(図2a).一方,野生型のオスではDMY遺伝子のはたらきでオス化した体細胞によりfoxl3遺伝子の発現が抑制されるため,精子の形成のスイッチが入り精巣において精子が形成されると考えられた(図2b).メスの生殖細胞においてfoxl3遺伝子の機能を欠損させると,この精子の形成の抑制が人為的に解除されるために卵巣で精子の形成が進行したと理解される(図2c).以上のことから,生殖細胞をとりかこむ環境がメスであったとしても精子の形成は進行し,生殖細胞には体細胞とは独立した性決定の機構が存在することが示された.
今後は,オスの体細胞がfoxl3遺伝子の発現を抑制する機構,また,メスの生殖細胞においてfoxl3遺伝子が直接的に制御している遺伝子を明らかにすることにより,生殖細胞の性が決まるしくみについてさらに理解が深まると考えられる.また,foxl3遺伝子がfoxl2遺伝子の遺伝子重複により生じたことはすでに述べたが,哺乳類においてfoxl2遺伝子は体細胞のオス化を抑制する機能をもち,そのことが体細胞のメス化の維持に重要であることが示されている10).よって,foxl2遺伝子およびfoxl3遺伝子がそれぞれ体細胞および生殖細胞においてオス化の抑制という共通の機能をもち,そのことは生殖腺のメス化においても重要なのか,今後,明らかにしていきたい.
文 献
- Nishimura, T. & Tanaka, M.: Gonadal development in fish. Sex. Dev., 8, 252-261 (2014)[PubMed]
- Baron, D., Cocquet, J., Xia, X. et al.: An evolutionary and functional analysis of FoxL2 in rainbow trout gonad differentiation. J. Mol. Endocrinol., 33, 705-715 (2004)[PubMed]
- Crespo, B., Lan-Chow-Wing, O., Rocha, A. et al.: foxl2 and foxl3 are two ancient paralogs that remain fully functional in teleosts. Gen. Comp. Endocrinol., 194, 81-93 (2013)[PubMed]
- Geraldo, M., Valente, G., Braz, A. S. et al.: The discovery of Foxl2 paralogs in chondrichthyan, coelacanth and tetrapod genomes reveals an ancient duplication in vertebrates. Heredity, 111, 57-65 (2013)[PubMed]
- Ottolenghi, C., Omari, S., Garcia-Ortiz, J. E. et al.: Foxl2 is required for commitment to ovary differentiation. Hum. Mol. Genet., 14, 2053-2062 (2005)[PubMed]
- Li, M. -H., Yang, H. -H., Li, M. -R. et al.: Antagonistic roles of Dmrt1 and Foxl2 in sex differentiation via estrogen production in tilapia as demonstrated by TALENs. Endocrinology, 154, 4814-4825 (2013)[PubMed]
- Saito, D., Morinaga, C., Aoki, Y. et al.: Proliferation of germ cells during gonadal sex differentiation in medaka: insights from germ cell-depleted mutant zenzai. Dev. Biol., 310, 280-290 (2007)[PubMed]
- Nakamura, S., Watakabe, I., Nishimura, T. et al.: Hyperproliferation of mitotically active germ cells due to defective anti-Mullerian hormone signaling mediates sex reversal in medaka. Development, 139, 2283-2287 (2012)[PubMed]
- Nakamura, S., Kobayashi, K., Nishimura, T. et al.: Identification of germline stem cells in the ovary of the teleost medaka. Science, 328, 1561-1563 (2010)[PubMed]
- Uhlenhaut, N. H., Jakob, S., Anlag, K. et al.: Somatic sex reprogramming of adult ovaries to testes by FOXL2 ablation. Cell, 139, 1130-1142 (2009)[PubMed]
著者プロフィール
略歴:2015年 総合研究大学院大学生命科学研究科 修了,同年より基礎生物学研究所 リサーチフェロー.
研究テーマ:生殖細胞の性決定および性分化.
関心事:落語.
田中 実(Minoru Tanaka)
基礎生物学研究所 准教授.
研究室URL:http://www.nibb.ac.jp/reprogenetics/
© 2015 西村俊哉・田中 実 Licensed under CC 表示 2.1 日本