動脈と静脈の並走したパターンはApelin-APJ系により制御される
木戸屋浩康・高倉伸幸
(大阪大学微生物病研究所 情報伝達分野)
email:木戸屋浩康
DOI: 10.7875/first.author.2015.067
APJ regulates parallel alignment of arteries and veins in the skin.
Hiroyasu Kidoya, Hisamichi Naito, Fumitaka Muramatsu, Daishi Yamakawa, Weizhen Jia, Masahito Ikawa, Takashi Sonobe, Hirotsugu Tsuchimochi, Mikiyasu Shirai, Ralf H. Adams, Akiyoshi Fukamizu, Nobuyuki Takakura
Developmental Cell, 33, 247-259 (2015)
動脈と静脈および神経は並走したパターンを示すことが知られているが,その制御機構や生理的な意義は不明であった.筆者らは,動脈から産生される生理活性ペプチドApelinが,静脈に発現する受容体APJに作用することを見い出した.ApelinノックアウトマウスおよびAPJノックアウトマウスにおいて血管の構造を解析したところ,並走すべき動脈および静脈の一部の走行が大きく乱れ,動脈と静脈は離れて形成されていた.マウスの胎仔において血管の発生の過程を解析したところ,静脈におけるAPJの活性化は血管内皮細胞の運動能を亢進させ,動脈の近傍への静脈の移動を誘起していた.くわえて,Wnt関連タンパク質であるSfrp1の分泌が促進され,周囲の好中球様の細胞によるマトリックスメタロプロテアーゼの産生が誘導されていた.その結果,静脈を固定するコラーゲンが分解され,静脈がより大きく動くことを可能にしていた.さらに,動脈と静脈が離れた走行を示すApelinノックアウトマウスおよびAPJノックアウトマウスにおいて生理機能への影響を解析したところ,周囲の温度の変化への対応力が低下していた.この結果から,並走した動脈と静脈とのあいだの熱の交換が体温の制御において重要であることが示された.
生体の全身にはりめぐらされる血管系は,その形態および機能的な特徴から動脈,静脈,毛細血管に分類される.それぞれを構成する血管内皮細胞も特異的な表現型を示すことが報告されており,分子レベルにおける分化の制御機構も明らかにされつつある.恒温動物において動脈と静脈および神経が並走していることは古くから知られており,16世紀に出版された解剖学の古典である “De humani corporis fabrica” においてもすでに記載が認められる.しかしながら,動脈と静脈の並走性がどのような分子機構により制御され,どのような生理的な意義をもつのかについては不明なままであった.
近年の遺伝子改変動物を用いた解析により,動脈の形成において神経が重要な役割をはたすことが明らかにされつつある.血管の発生の過程においては,まず一様な網目状の毛細血管が形成され,そこに神経が現われると近傍の毛細血管が動脈へと分化することにより,神経と動脈との並走性が構築される.この毛細血管の動脈化においては,神経から産生されるVEGFおよびCXCL12が重要なはたらきを担うことが報告されている1,2).一方で,静脈の形成は動脈が出現したのちひきつづいて進行する.これまでに,動脈に特異的なタンパク質として膜結合型のリガンドであるEphrinB2が,静脈にはその受容体であるEphB4が発現しており,両者のあいだに反発作用を生みだしていることが明らかにされている.実際に,マウスにおいてEphrinB2あるいはEphB4を欠損させると,動脈と静脈とが近接し融合してしまうため胎生致死になることが報告されている3,4).このように,動脈と静脈とのあいだの反発作用は重要であるが,動脈と静脈とが隣接して並走するという適切な位置関係を保つためには,それにくわえて誘引作用も必要であると考えられる.しかしながら,動脈と静脈のあいだの相互作用にはたらくタンパク質はこれまでほとんど同定されていない.今回,筆者らは,動脈と静脈との相互作用において誘引作用に機能するタンパク質としてApelin-APJ系を同定し,動脈と静脈の美しい並走のパターンがいかにして構築されるかを分子レベルおよび細胞レベルにおいて明らかにした.
血管のパターンの形成において動脈と静脈とのあいだの誘引作用にはたらくタンパク質として,生理活性オリゴペプチドであるApelin,および,その受容体であるAPJに着目した.これまでに,Apelin-APJ系は血圧の制御,体液の制御,脂質の代謝など,多様な生理機能に関与することが報告されている5).また,新生された血管において高度に発現することが明らかにされており,血管の形成において重要な役割をはたすことが示唆されていた6).筆者らも,血管におけるApelin-APJ系の役割について検討し,血管の成熟化や安定化に作用していることを報告してきた7,8).その解析の過程において,ApelinおよびAPJの発現が時間的および空間的に興味深い特徴をもつことが見い出された.マウスの胎仔の皮膚において免疫染色を行ったところ,Apelinの発現は胎生13.5日目の動脈化した直後の血管において特異的に認められ,それに対し,APJは胎生14.5日目以降の静脈化した直後の血管において高い発現が確認された.そこで,動脈と静脈とのあいだの相互作用におけるApelin-APJ系の役割を解明するため,ApelinノックアウトマウスおよびAPJノックアウトマウスの血管の構造を解析した.これらのノックアウトマウスは通常の条件においてはめだった異常を示すことなく成体にまで成長したが,血管を観察したところ,本来は並走すべき動脈と静脈の走行が乱れ,静脈が動脈から離れて形成されていた.一方で,神経と動脈の並走性には異常は認められなかった.これらの結果から,Apelin-APJ系が静脈の位置を決めるうえで重要な役割をはたすことが示された.
Apelin-APJ系がいかにして動脈と静脈の並走パターンを制御しているのかを検討するためには,静脈の血管がどのような過程をへて形成されるのか明らかにする必要がある.マウスの皮膚における血管の形成の過程を経時的に詳細に検討したところ,胎生14日目~胎生14.5日目に出現した直後の静脈は動脈から離れていることが明らかにされた.そののち,静脈は徐々に動脈の近傍へと位置を変えていき,胎生15.5日目以降には動脈と静脈とが並走したパターンが完成していた.一方で,Apelinノックアウトマウスにおいては静脈が動脈から離れたまま血管の発生が進行し,結果として,乱れた走行を示す静脈が形成された.この結果から,静脈が構造を保持したまま移動するという新規の血管の形成機構の存在が示唆された.また,“血管移動”と名づけたこの現象において,静脈の血管内皮細胞におけるAPJの活性化が鍵となることが示された.
APJの活性化はどのような分子機構により静脈の血管移動を誘導しているのだろうか? このことを解明するため,血管内皮細胞に対する直接的な作用,および,血管の周囲の環境に対する影響の2つの方向から検討した.まず,静脈血管内皮細胞への作用として運動能への影響について解析した.マウスの胎仔から回収した血管内皮細胞を用いて遊走活性について検討したところ,Apelinが静脈の血管内皮細胞を特異的に遊走させることが明らかにされた.つづいて,血管の周囲の環境への間接的な影響として,血管をとりかこむ主要な細胞外基質であるIV型コラーゲンに着目した.胎生14.5日目のマウスの皮膚において免疫染色を行ったところ,ほぼすべての血管はIV型コラーゲンによりおおわれており,血管が組織に固定されているようすが認められた.一方で,静脈の血管を注意深く観察したところ,血管移動の過程にあると思われる静脈のみにおいてIV型コラーゲンの分解が確認された.以上のように,Apelin-APJ系は血管内皮細胞に対し直接的に運動能を亢進させ,さらに,血管の周囲の細胞外基質の分解を促進するという間接的な作用により静脈の血管移動を誘導していることが明らかにされた.
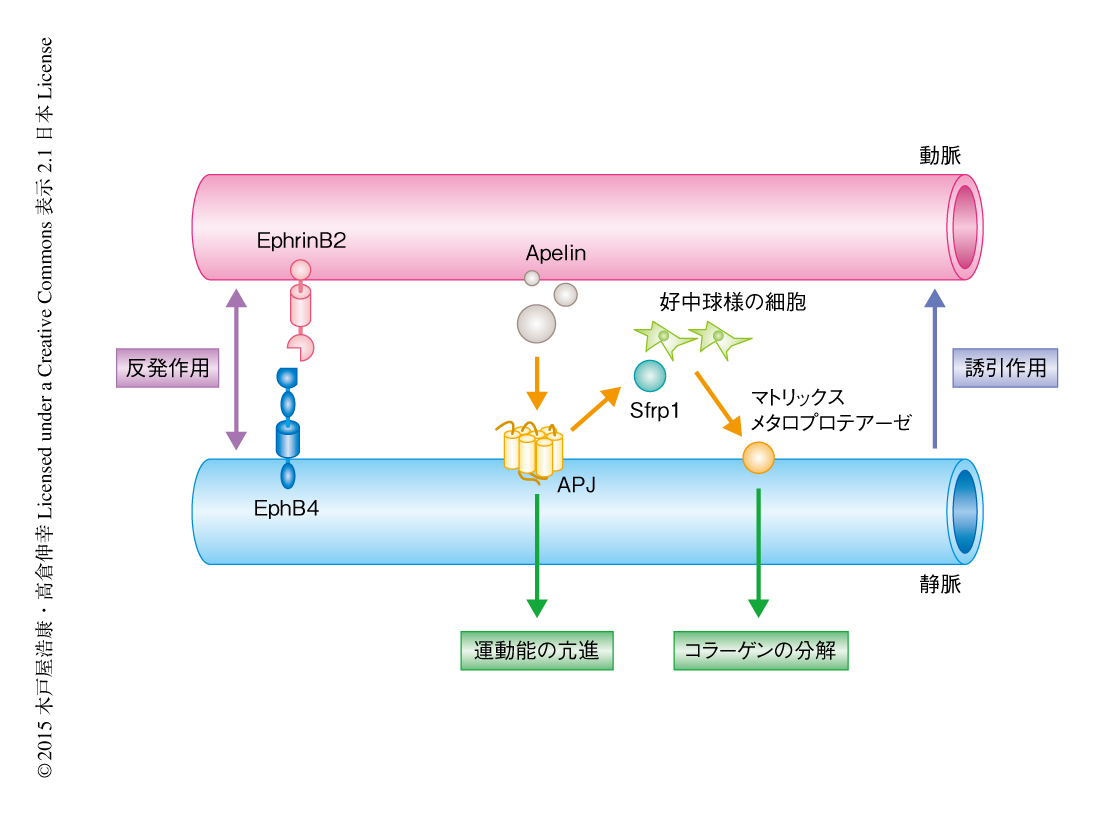
静脈の周囲のIV型コラーゲンの分解には分解酵素であるマトリックスメタロプロテアーゼの関与が予想された.そこで,マウスの胎仔の皮膚から回収した細胞をApelinにより刺激しゼラチンザイモグラフィーにより解析したところ,マトリックスメタロプロテアーゼ9の産生の誘導が確認された.Apelinの受容体であるAPJの発現は静脈の血管内皮細胞に特異的であるが,静脈の血管内皮細胞においてマトリックスメタロプロテアーゼ9の発現はほとんど認められなかったため,その産生はほかの細胞を介した間接的なものであることが示唆された.マトリックスメタロプロテアーゼ9を産生する細胞を探索するため,胎生14.5日目のマウスの皮膚において免疫染色を行ったところ,動脈と静脈とのあいだに集積した好中球様の細胞においてマトリックスメタロプロテアーゼ9の特異的な発現が確認された.これらの結果から,Apelin-APJ系により活性化された静脈の血管内皮細胞が好中球様の細胞にはたらきかけ,マトリックスメタロプロテアーゼ9の産生を誘導していることが示された.そこで,静脈の血管内皮細胞と好中球様の細胞とをつなぐタンパク質を探索するため,APJノックアウトマウスの血管内皮細胞においてマイクロアレイ解析を行った.その結果,Wntシグナル経路のアンタゴニストとして報告されている分泌タンパク質Sfrp1が同定された9).以上をまとめると,Apelin-APJ系は静脈の血管内皮細胞におけるSfrp1の産生を誘導し,このSfrp1が近傍の好中球様の細胞からのマトリックスメタロプロテアーゼ9の分泌を促進させ,静脈の周囲のIV型コラーゲンは分解され血管移動が可能になることが明らかにされた(図1).実際に,阻害剤によるマトリックスメタロプロテアーゼの抑制,抗体を用いた好中球の枯渇,さらには,Sfrp1ノックアウトマウスにおいては,動脈と静脈の並走性に異常が認められた.
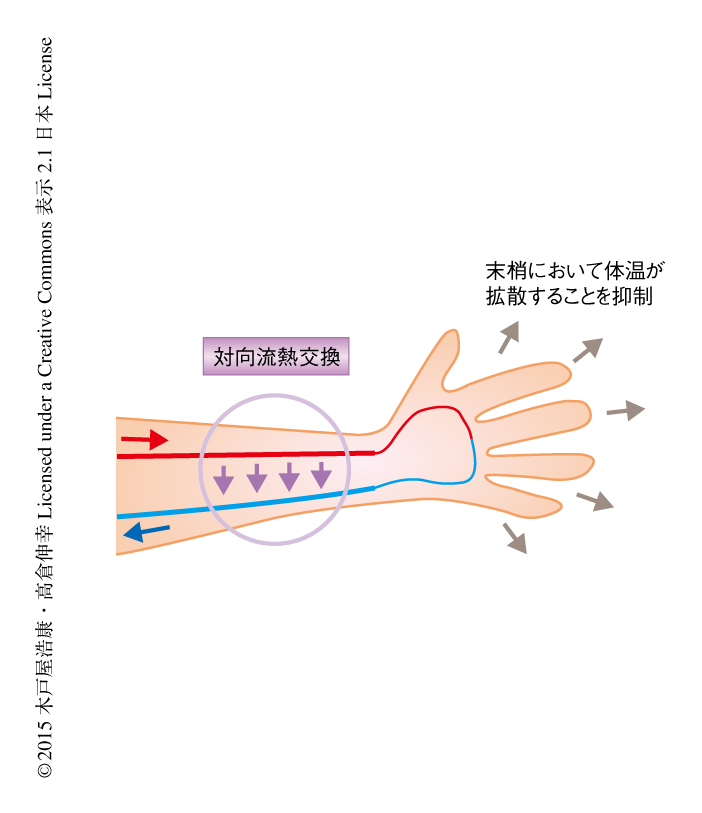
古くから,隣接して並走する動脈と静脈のあいだには対向流熱交換が起こっており,体温の維持にはたらいていると考えられてきた10).しかしながら,これまで生体においてこの現象を実証した例はなく,動脈と静脈との並走性がもたらす生理的な意義は明確にはされていなかった.さきに述べたように,ApelinノックアウトマウスおよびAPJノックアウトマウスは動脈と静脈が並走していないが,通常の条件においてはめだった異常は認められなかった.対向流熱交換は外部の気温と体温とのあいだに大きな差が生じた際に重要であるとされている.たとえば,外部の気温が低下した場合には,心臓から送り出される温かい動脈血が末梢へむかう際にあらかじめ静脈血へ熱を移動させておくことにより,末梢における熱の損失を減少させる役割をはたす(図2).そこで,ApelinノックアウトマウスあるいはAPJノックアウトマウスを低温の環境にさらして体温の変化を観察したところ,野生型マウスと比べ顕著な体温の低下が認められた.また反対に,これらのノックアウトマウスを高温の環境にさらした場合にはいちじるしい体温の上昇が認められ,早期に熱中症様の症状を示した.この結果は,恒温生物において認められる動脈と静脈との並走性の生理的な意義を実証したはじめての報告となった.
静脈と動脈のあいだには反発作用が存在することが知られていたが,今回,ApelinがAPJに作用することにより誘引作用が生じることが明らかにされた.このように相反する力が巧妙なバランスを生みだすことにより動脈と静脈の並走したパターンが形成されることが示された.近年,iPS細胞などの多能性細胞から樹立された組織を用いた再生医療の実現が社会的に望まれているが,そのためには,移植した再生組織へ酸素や栄養分を届けるための血管の再生も重要な問題になる.この研究の成果は,体温の制御という血管の構造のもつ新たな機能を明確にし,血管の再生において動脈と静脈の整然としたパターンを形成させることの重要性を提示した.さらには,機能的な血管のパターンの形成においてApelin-APJ系が重要な役割を担うことを明らかにし,血管の高次のネットワーク形成の分子基盤を提供するものと期待される.
略歴:2008年 大阪大学大学院医学系研究科にて博士号取得,2009年より大阪大学微生物病研究所 助教.
研究テーマ:血管の発生の機構の解明をつうじた,新規の血管の制御法の開発.
抱負:血管の“美しさ”を理解することにより,病的な乱れた血管に対する制御法をみつけ,新しい概念をもつ治療法を開発したい.
高倉 伸幸(Nobuyuki Takakura)
大阪大学微生物病研究所 教授.
研究室URL:http://st.biken.osaka-u.ac.jp/
© 2015 木戸屋浩康・高倉伸幸 Licensed under CC 表示 2.1 日本
(大阪大学微生物病研究所 情報伝達分野)
email:木戸屋浩康
DOI: 10.7875/first.author.2015.067
APJ regulates parallel alignment of arteries and veins in the skin.
Hiroyasu Kidoya, Hisamichi Naito, Fumitaka Muramatsu, Daishi Yamakawa, Weizhen Jia, Masahito Ikawa, Takashi Sonobe, Hirotsugu Tsuchimochi, Mikiyasu Shirai, Ralf H. Adams, Akiyoshi Fukamizu, Nobuyuki Takakura
Developmental Cell, 33, 247-259 (2015)
要 約
動脈と静脈および神経は並走したパターンを示すことが知られているが,その制御機構や生理的な意義は不明であった.筆者らは,動脈から産生される生理活性ペプチドApelinが,静脈に発現する受容体APJに作用することを見い出した.ApelinノックアウトマウスおよびAPJノックアウトマウスにおいて血管の構造を解析したところ,並走すべき動脈および静脈の一部の走行が大きく乱れ,動脈と静脈は離れて形成されていた.マウスの胎仔において血管の発生の過程を解析したところ,静脈におけるAPJの活性化は血管内皮細胞の運動能を亢進させ,動脈の近傍への静脈の移動を誘起していた.くわえて,Wnt関連タンパク質であるSfrp1の分泌が促進され,周囲の好中球様の細胞によるマトリックスメタロプロテアーゼの産生が誘導されていた.その結果,静脈を固定するコラーゲンが分解され,静脈がより大きく動くことを可能にしていた.さらに,動脈と静脈が離れた走行を示すApelinノックアウトマウスおよびAPJノックアウトマウスにおいて生理機能への影響を解析したところ,周囲の温度の変化への対応力が低下していた.この結果から,並走した動脈と静脈とのあいだの熱の交換が体温の制御において重要であることが示された.
はじめに
生体の全身にはりめぐらされる血管系は,その形態および機能的な特徴から動脈,静脈,毛細血管に分類される.それぞれを構成する血管内皮細胞も特異的な表現型を示すことが報告されており,分子レベルにおける分化の制御機構も明らかにされつつある.恒温動物において動脈と静脈および神経が並走していることは古くから知られており,16世紀に出版された解剖学の古典である “De humani corporis fabrica” においてもすでに記載が認められる.しかしながら,動脈と静脈の並走性がどのような分子機構により制御され,どのような生理的な意義をもつのかについては不明なままであった.
近年の遺伝子改変動物を用いた解析により,動脈の形成において神経が重要な役割をはたすことが明らかにされつつある.血管の発生の過程においては,まず一様な網目状の毛細血管が形成され,そこに神経が現われると近傍の毛細血管が動脈へと分化することにより,神経と動脈との並走性が構築される.この毛細血管の動脈化においては,神経から産生されるVEGFおよびCXCL12が重要なはたらきを担うことが報告されている1,2).一方で,静脈の形成は動脈が出現したのちひきつづいて進行する.これまでに,動脈に特異的なタンパク質として膜結合型のリガンドであるEphrinB2が,静脈にはその受容体であるEphB4が発現しており,両者のあいだに反発作用を生みだしていることが明らかにされている.実際に,マウスにおいてEphrinB2あるいはEphB4を欠損させると,動脈と静脈とが近接し融合してしまうため胎生致死になることが報告されている3,4).このように,動脈と静脈とのあいだの反発作用は重要であるが,動脈と静脈とが隣接して並走するという適切な位置関係を保つためには,それにくわえて誘引作用も必要であると考えられる.しかしながら,動脈と静脈のあいだの相互作用にはたらくタンパク質はこれまでほとんど同定されていない.今回,筆者らは,動脈と静脈との相互作用において誘引作用に機能するタンパク質としてApelin-APJ系を同定し,動脈と静脈の美しい並走のパターンがいかにして構築されるかを分子レベルおよび細胞レベルにおいて明らかにした.
1.動脈と静脈の並走したパターンの形成にはApelin-APJ系が必要である
血管のパターンの形成において動脈と静脈とのあいだの誘引作用にはたらくタンパク質として,生理活性オリゴペプチドであるApelin,および,その受容体であるAPJに着目した.これまでに,Apelin-APJ系は血圧の制御,体液の制御,脂質の代謝など,多様な生理機能に関与することが報告されている5).また,新生された血管において高度に発現することが明らかにされており,血管の形成において重要な役割をはたすことが示唆されていた6).筆者らも,血管におけるApelin-APJ系の役割について検討し,血管の成熟化や安定化に作用していることを報告してきた7,8).その解析の過程において,ApelinおよびAPJの発現が時間的および空間的に興味深い特徴をもつことが見い出された.マウスの胎仔の皮膚において免疫染色を行ったところ,Apelinの発現は胎生13.5日目の動脈化した直後の血管において特異的に認められ,それに対し,APJは胎生14.5日目以降の静脈化した直後の血管において高い発現が確認された.そこで,動脈と静脈とのあいだの相互作用におけるApelin-APJ系の役割を解明するため,ApelinノックアウトマウスおよびAPJノックアウトマウスの血管の構造を解析した.これらのノックアウトマウスは通常の条件においてはめだった異常を示すことなく成体にまで成長したが,血管を観察したところ,本来は並走すべき動脈と静脈の走行が乱れ,静脈が動脈から離れて形成されていた.一方で,神経と動脈の並走性には異常は認められなかった.これらの結果から,Apelin-APJ系が静脈の位置を決めるうえで重要な役割をはたすことが示された.
2.静脈が動脈の側へと移動することにより動脈と静脈の並走性が構築される
Apelin-APJ系がいかにして動脈と静脈の並走パターンを制御しているのかを検討するためには,静脈の血管がどのような過程をへて形成されるのか明らかにする必要がある.マウスの皮膚における血管の形成の過程を経時的に詳細に検討したところ,胎生14日目~胎生14.5日目に出現した直後の静脈は動脈から離れていることが明らかにされた.そののち,静脈は徐々に動脈の近傍へと位置を変えていき,胎生15.5日目以降には動脈と静脈とが並走したパターンが完成していた.一方で,Apelinノックアウトマウスにおいては静脈が動脈から離れたまま血管の発生が進行し,結果として,乱れた走行を示す静脈が形成された.この結果から,静脈が構造を保持したまま移動するという新規の血管の形成機構の存在が示唆された.また,“血管移動”と名づけたこの現象において,静脈の血管内皮細胞におけるAPJの活性化が鍵となることが示された.
3.静脈をとりかこむ細胞外基質の分解により血管移動は可能になる
APJの活性化はどのような分子機構により静脈の血管移動を誘導しているのだろうか? このことを解明するため,血管内皮細胞に対する直接的な作用,および,血管の周囲の環境に対する影響の2つの方向から検討した.まず,静脈血管内皮細胞への作用として運動能への影響について解析した.マウスの胎仔から回収した血管内皮細胞を用いて遊走活性について検討したところ,Apelinが静脈の血管内皮細胞を特異的に遊走させることが明らかにされた.つづいて,血管の周囲の環境への間接的な影響として,血管をとりかこむ主要な細胞外基質であるIV型コラーゲンに着目した.胎生14.5日目のマウスの皮膚において免疫染色を行ったところ,ほぼすべての血管はIV型コラーゲンによりおおわれており,血管が組織に固定されているようすが認められた.一方で,静脈の血管を注意深く観察したところ,血管移動の過程にあると思われる静脈のみにおいてIV型コラーゲンの分解が確認された.以上のように,Apelin-APJ系は血管内皮細胞に対し直接的に運動能を亢進させ,さらに,血管の周囲の細胞外基質の分解を促進するという間接的な作用により静脈の血管移動を誘導していることが明らかにされた.
4.静脈の血管内皮細胞から分泌されるSfrp1は好中球様の細胞からのマトリックスメタロプロテアーゼの産生を誘導する
静脈の周囲のIV型コラーゲンの分解には分解酵素であるマトリックスメタロプロテアーゼの関与が予想された.そこで,マウスの胎仔の皮膚から回収した細胞をApelinにより刺激しゼラチンザイモグラフィーにより解析したところ,マトリックスメタロプロテアーゼ9の産生の誘導が確認された.Apelinの受容体であるAPJの発現は静脈の血管内皮細胞に特異的であるが,静脈の血管内皮細胞においてマトリックスメタロプロテアーゼ9の発現はほとんど認められなかったため,その産生はほかの細胞を介した間接的なものであることが示唆された.マトリックスメタロプロテアーゼ9を産生する細胞を探索するため,胎生14.5日目のマウスの皮膚において免疫染色を行ったところ,動脈と静脈とのあいだに集積した好中球様の細胞においてマトリックスメタロプロテアーゼ9の特異的な発現が確認された.これらの結果から,Apelin-APJ系により活性化された静脈の血管内皮細胞が好中球様の細胞にはたらきかけ,マトリックスメタロプロテアーゼ9の産生を誘導していることが示された.そこで,静脈の血管内皮細胞と好中球様の細胞とをつなぐタンパク質を探索するため,APJノックアウトマウスの血管内皮細胞においてマイクロアレイ解析を行った.その結果,Wntシグナル経路のアンタゴニストとして報告されている分泌タンパク質Sfrp1が同定された9).以上をまとめると,Apelin-APJ系は静脈の血管内皮細胞におけるSfrp1の産生を誘導し,このSfrp1が近傍の好中球様の細胞からのマトリックスメタロプロテアーゼ9の分泌を促進させ,静脈の周囲のIV型コラーゲンは分解され血管移動が可能になることが明らかにされた(図1).実際に,阻害剤によるマトリックスメタロプロテアーゼの抑制,抗体を用いた好中球の枯渇,さらには,Sfrp1ノックアウトマウスにおいては,動脈と静脈の並走性に異常が認められた.
5.並走する動脈と静脈とのあいだの熱の交換は外気温の変化に対する体温の維持に必須である
古くから,隣接して並走する動脈と静脈のあいだには対向流熱交換が起こっており,体温の維持にはたらいていると考えられてきた10).しかしながら,これまで生体においてこの現象を実証した例はなく,動脈と静脈との並走性がもたらす生理的な意義は明確にはされていなかった.さきに述べたように,ApelinノックアウトマウスおよびAPJノックアウトマウスは動脈と静脈が並走していないが,通常の条件においてはめだった異常は認められなかった.対向流熱交換は外部の気温と体温とのあいだに大きな差が生じた際に重要であるとされている.たとえば,外部の気温が低下した場合には,心臓から送り出される温かい動脈血が末梢へむかう際にあらかじめ静脈血へ熱を移動させておくことにより,末梢における熱の損失を減少させる役割をはたす(図2).そこで,ApelinノックアウトマウスあるいはAPJノックアウトマウスを低温の環境にさらして体温の変化を観察したところ,野生型マウスと比べ顕著な体温の低下が認められた.また反対に,これらのノックアウトマウスを高温の環境にさらした場合にはいちじるしい体温の上昇が認められ,早期に熱中症様の症状を示した.この結果は,恒温生物において認められる動脈と静脈との並走性の生理的な意義を実証したはじめての報告となった.
おわりに
静脈と動脈のあいだには反発作用が存在することが知られていたが,今回,ApelinがAPJに作用することにより誘引作用が生じることが明らかにされた.このように相反する力が巧妙なバランスを生みだすことにより動脈と静脈の並走したパターンが形成されることが示された.近年,iPS細胞などの多能性細胞から樹立された組織を用いた再生医療の実現が社会的に望まれているが,そのためには,移植した再生組織へ酸素や栄養分を届けるための血管の再生も重要な問題になる.この研究の成果は,体温の制御という血管の構造のもつ新たな機能を明確にし,血管の再生において動脈と静脈の整然としたパターンを形成させることの重要性を提示した.さらには,機能的な血管のパターンの形成においてApelin-APJ系が重要な役割を担うことを明らかにし,血管の高次のネットワーク形成の分子基盤を提供するものと期待される.
文 献
- Mukouyama, Y. S., Shin, D., Britsch, S. et al.: Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell, 109, 693-705 (2002)[PubMed]
- Li, W., Kohara, H., Uchida, Y. et al.: Peripheral nerve-derived CXCL12 and VEGF-A regulate the patterning of arterial vessel branching in developing limb skin. Dev. Cell, 24, 359-371 (2013)[PubMed]
- Adams, R. H., Wilkinson, G. A., Weiss, C. et al.: Roles of ephrinB ligands and EphB receptors in cardiovascular development: demarcation of arterial/venous domains, vascular morphogenesis, and sprouting angiogenesis. Genes Dev., 13, 295-306 (1999)[PubMed]
- Gerety, S. S., Wang, H. U., Chen, Z. F. et al.: Symmetrical mutant phenotypes of the receptor EphB4 and its specific transmembrane ligand ephrin-B2 in cardiovascular development. Mol. Cell, 4, 403-414 (1999)[PubMed]
- O'Carroll, A. M., Lolait, S. J., Harris, L. E. et al.: The apelin receptor APJ: journey from an orphan to a multifaceted regulator of homeostasis. J. Endocrinol., 219, R13-R35 (2013)[PubMed]
- Kasai, A., Shintani, N., Oda, M. et al.: Apelin is a novel angiogenic factor in retinal endothelial cells. Biochem. Biophys. Res. Commun., 325, 395-400 (2004)[PubMed]
- Kidoya, H., Ueno, M., Yamada, Y. et al.: Spatial and temporal role of the apelin/APJ system in the caliber size regulation of blood vessels during angiogenesis. EMBO J., 27, 522-534 (2008)[PubMed]
- Kidoya, H., Naito, H. & Takakura, N.: Apelin induces enlarged and nonleaky blood vessels for functional recovery from ischemia. Blood, 115, 3166-3174 (2010)[PubMed]
- Bovolenta, P., Esteve, P., Ruiz, J. M. et al.: Beyond Wnt inhibition: new functions of secreted Frizzled-related proteins in development and disease. J. Cell Sci., 121, 737-746 (2008)[PubMed]
- Bazett, H. C., Love, L., Newton, L. et al.: Temperature changes in blood flowing in arteries and veins in man. J. Appl. Physiol., 1, 3-19 (1948)[PubMed]
著者プロフィール
略歴:2008年 大阪大学大学院医学系研究科にて博士号取得,2009年より大阪大学微生物病研究所 助教.
研究テーマ:血管の発生の機構の解明をつうじた,新規の血管の制御法の開発.
抱負:血管の“美しさ”を理解することにより,病的な乱れた血管に対する制御法をみつけ,新しい概念をもつ治療法を開発したい.
高倉 伸幸(Nobuyuki Takakura)
大阪大学微生物病研究所 教授.
研究室URL:http://st.biken.osaka-u.ac.jp/
© 2015 木戸屋浩康・高倉伸幸 Licensed under CC 表示 2.1 日本