小胞体タンパク質ERp44による酸化還元状態に依存した血圧の制御
久恒智博・御子柴克彦
(理化学研究所脳科学総合研究センター 発生神経生物研究チーム)
email:久恒智博,御子柴克彦
DOI: 10.7875/first.author.2015.066
ERp44 exerts redox-dependent control of blood pressure at the ER.
Chihiro Hisatsune, Etsuko Ebisui, Masaya Usui, Naoko Ogawa, Akio Suzuki, Nobuko Mataga, Hiromi Takahashi-Iwanaga, Katsuhiko Mikoshiba
Molecular Cell, 58, 1015-1027 (2015)
小胞体タンパク質であるERp44はさまざまなタンパク質のオリゴマー形成や分泌を制御し,分泌タンパク質の品質管理にかかわっている.しかしながら,ERp44がマウスの個体レベルにおいてどのようなはたらきをするのかについてはほとんど明らかにされていない.筆者らは,ERp44ノックアウトマウスを作製し,このノックアウトマウスが低血圧を示すことを明らかにした.また,野生型のマウスにおいては,アンジオテンシンIIを分解する酵素ERAP1はERp44とジスルフィド結合を形成し小胞体にとどまっていたが,ERp44ノックアウトマウスではERAP1は小胞体にとどまることができず細胞外に多量に分泌され,その結果,血液においてアンジオテンシンIIが分解され低血圧がひき起こされた.また,症状のひとつとして血圧の急速な低下を示す敗血症モデルにおいては,ERp44とERAP1の結合が増加し血圧の低下が抑制された.以上のことから,小胞体に存在するERp44が酸化還元状態に依存してERAP1の細胞内あるいは細胞外における局在を制御し,その結果,血圧を制御することが示唆された.
小胞体には多くの分子シャペロンやタンパク質修飾酵素が存在し,分泌タンパク質や膜タンパク質の正常な立体構造あるいはオリゴマーの形成を制御している.ERp44はチオレドキシン様ドメインをもつ分子シャペロンのひとつであり1),これまで,免疫グロブリンやアデイポネクチンにおけるオリゴマーの形成や2,3),酸化還元酵素であるEro1やPrdx4の小胞体への局在の制御4,5) について報告されてきた.しかしながら,ERp44のマウスの個体レベルにおける生理的な機能に関してはほとんど明らかにされていない.筆者らは,ERp44ノックアウトマウスを作製し,ERp44がマウスの個体レベルにおいてどのようなはたらきを担うのかについて解析した.
最初に,C57BL/6系統のマウスからERp44ノックアウトマウスを作製した.このノックアウトマウスは12%の割合で生まれたが,野生型のマウスに比べ全体的に身体が小さく,生後24時間以内にそのほとんどすべてが死亡した.しかし,4匹は成体まで生育したので,異なる遺伝的な背景をもつERp44ノックアウトマウスの作製を試みたところ,FVB/NJ系統を掛け合わせたERp44ノックアウトマウスはほとんどが成体まで生育した.また,どちらの系統のERp44ノックアウトマウスにおいても,生後における腎臓の尿細管の肥大や尿が少ないなどの表現型が観察された.
これらのERp44ノックアウトマウスの表現型はアンジオテンシノーゲンノックアウトマウスに似ていたため,血圧を測定したところ野生型のマウスに比べ血圧が大きく低下していた.また,血液におけるアンジオテンシンの濃度を測定したところ,アンジオテンシンIIの濃度が低下していた.
ERp44ノックアウトマウスの血液においてアンジオテンシンIIの濃度が低下している理由を明らかにするため,アンジオテンシンIIの合成経路に異常があるかどうか調べた.その結果,アンジオテンシンIIの原料となるアンジオテンシノーゲン,また,レニンやアンジオテンシン変換酵素の発現量には野生型マウスとの違いはなかった.そこで,血液におけるアンジオテンシンIIの安定性が低下しているとの仮説をたてた.野生型マウスあるいはERp44ノックアウトマウスの血清に合成アンジオテンシンIIを添加し,37℃にて一定の時間にわたりインキュベートしたのち,HPLCにより残存するアンジオテンシンIIを定量した.その結果,野生型マウスに比べERp44ノックアウトマウスの血清はアンジオテンシンIIをより速く分解することが明らかにされた.また,血液検査の結果,ERp44ノックアウトマウスの血液においてロイシンアミノペプチダーゼの活性が上昇していることが判明した.
これまでの研究により,ERp44はさまざまなタンパク質と結合し,そのオリゴマーの形成や分泌を制御することが報告されている.そこで,ロイシンアミノペプチダーゼ活性をもちアンジオテンシンIIを分解する酵素が小胞体においてERp44と結合し,ERp44の欠損によりその酵素が血液に過剰に分泌されたとの仮説をたてた.質量分析法を用いて肝臓の抽出液においてERp44と結合するタンパク質を解析した結果,ロイシンアミノペプチダーゼ活性をもちアンジオテンシンIIを分解するERAP1 6) がERp44と結合することが明らかにされた.ERp44とERAP1との結合はジチオスレイトールの処理により減少したため,酸化還元状態に依存して結合していることが示唆された.ERAP1は小胞体残留シグナル配列をもたず当初は分泌タンパク質として報告されたが,のちに,内在性のERAP1は小胞体に存在すること7),また,培養細胞に強制発現させると培地に分泌されることから6),ERAP1には小胞体にとどまるなんらかの機構があると考えられていた.さらに,ERAP1にはそのホモログである胎盤性ロイシンアミノペプチダーゼにはないアミノ酸配列が存在し,その配列がERAP1の細胞における局在と深いかかわりのあることが示唆されていた8).このアミノ酸配列を解析したところ,Cys487をSerに変異させるとERp44との結合が大きく減少することが明らかにされた.一方,Cys29をSerに変異させたERp44はERAP1との結合が大きく減少した.これらの変異は小胞体にとどまるERAP1の量を減少させ,その一方,培地に分泌されるERAP1の量を増加させた.これらの結果から,ERp44のCys29とERAP1のCys487とがジスルフィド結合を介して酸化還元状態に依存的に結合し,ERAP1を小胞体にとどめていることが示唆された.
ERp44ノックアウトマウスから胎仔線維芽細胞を作製し,培養上清のロイシンアミノペプチダーゼ活性を測定したところ,ERp44を欠損した細胞において野生型の細胞に比べ有意に活性の上昇が認められ,この活性の上昇は抗ERAP1抗体の処理によりなくなった.細胞内に存在するERAP1の量をウェスタンブロット法により測定したところ,ERp44を欠損した胎仔線維芽細胞では大きく減少していた.さらに,35SによりERAP1を標識しその動態を調べた結果,野生型の胎仔線維芽細胞においてERAP1は細胞内にとどまったのに対し,ERp44を欠損した胎仔線維芽細胞においては1時間以内に細胞外に分泌された.
ERp44ノックアウトマウスの血液におけるアンジオテンシンIIの安定性の低下はERAP1によるものなのかどうか検証した.野生型マウスおよびERp44ノックアウトマウスの血清のERAP1をウェスタンブロット法により測定した結果,ERp44ノックアウトマウスにおいては検出されたが野生型マウスにおいては検出されなかった.また,抗ERAP1抗体によりERAP1を除去した血清においては,野生型マウスとERp44ノックアウトマウスとのあいだでアンジオテンシンIIの分解速度に差はなくなった.以上の結果から,ERp44ノックアウトマウスの低血圧は血液に分泌された過剰のERAP1によりアンジオテンシンIIが分解されその濃度が低下することによりひき起されるものと結論した.
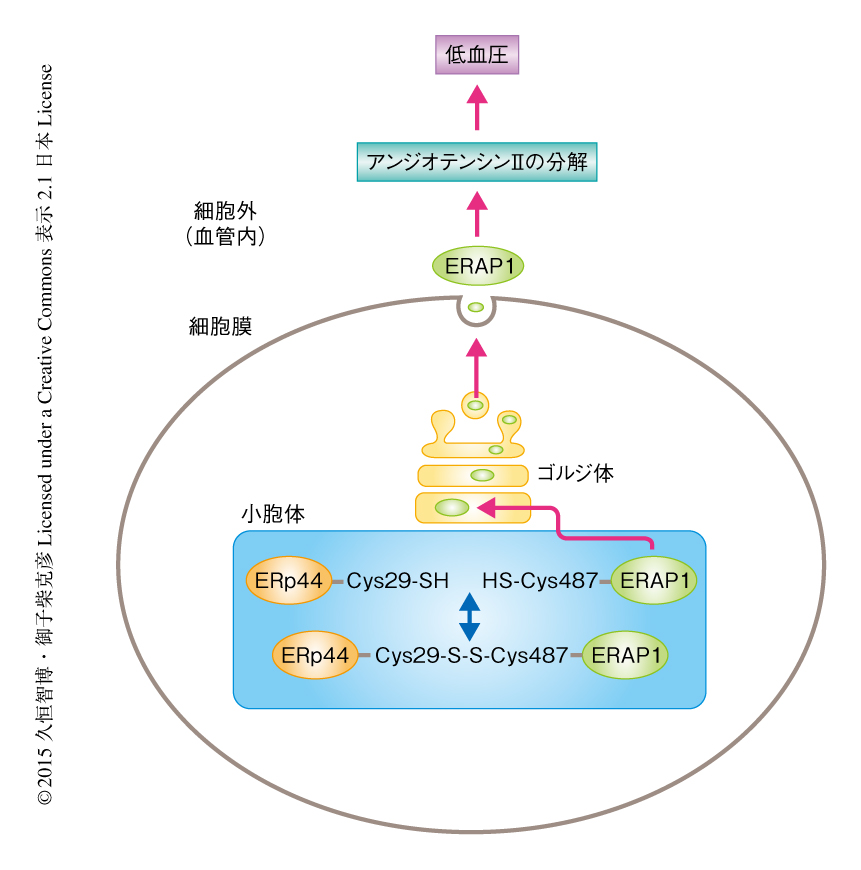
敗血症は細菌が血液に侵入して起こる全身性の感染症であり,その症状のひとつに血圧の急速な低下がある.また,敗血症の際には細胞が小胞体ストレスを起こし,BIPやPDIなどの分子シャペロンの発現が誘導されることが知られている.そこで,マウスにインターフェロンγおよびリポ多糖を投与することにより敗血症をひき起こし,ERp44とERAP1の結合がどのように変化するか解析した.その結果,敗血症の発症の際にはERp44およびERAP1の発現が上昇すること,また,ERp44とERAP1との結合が増加することが明らかにされた.また,ERp44ヘテロノックアウトマウスにおいては敗血症の際に小胞体にとどまることのできるERAP1の量が減少し,その結果,ERAP1が血液に多く分泌されることにより野生型のマウスより血圧の低下の程度が大きくなった.この結果から,敗血症の際にERp44とERAP1との結合が増加し血圧の低下を抑制していることが示唆された.以上の結果から,小胞体に存在するERp44がその酸化還元状態に応じてERAP1の細胞内および細胞外における局在を制御し,その結果,血液に分泌されたERAP1がアンジオテンシンIIを分解し血圧を制御するというモデルを提唱した(図1).
今回の研究から,小胞体の酸化還元状態がERp44とERAP1との結合に影響すること,また,その結果,血液におけるERAP1の量が変化してアンジオテンシンIIの濃度が変化し,血圧に影響をあたえることが考えられた.小胞体の酸化還元状態は,活性酸素種,小胞体におけるCa2+濃度の低下など,さまざまなストレスに影響されることが示されている.これらの要因と血圧の変化との関係をERp44とERAP1との相互作用に着目して解明できる可能性がある.それゆえ,どのような過程をへてERp44とERAP1とのあいだにジスルフィド結合が形成されるのか,その詳細な機構を解析する必要があると考えられる.また,ERp44の結合タンパク質として新たに同定されたERAP1はMHCクラスI分子の提示に関係することが知られており9),最近,そのヒトにおける遺伝子多型は高血圧だけでなく10),強直性脊椎炎や乾癬11,12) といった疾患と関係のあることが報告された.これらの疾患が小胞体の酸化還元状態や細胞の内外のERAP1の量とかかわりがあるのか興味深い.
略歴:1999年 東京大学大学院医学系研究科 修了,同年 理化学研究所脳科学総合研究センター 基礎科学特別研究員,2006年 東京大学医科学研究所 助手を経て,2007年より理化学研究所脳科学総合研究センター 研究員.
研究テーマ:小胞体関連タンパク質とその生理機能.
御子柴 克彦(Katsuhiko Mikoshiba)
理化学研究所脳科学総合研究センター チームリーダー.
研究室URL:http://mikoshiba-lab.brain.riken.jp/indexj.html
© 2015 久恒智博・御子柴克彦 Licensed under CC 表示 2.1 日本
(理化学研究所脳科学総合研究センター 発生神経生物研究チーム)
email:久恒智博,御子柴克彦
DOI: 10.7875/first.author.2015.066
ERp44 exerts redox-dependent control of blood pressure at the ER.
Chihiro Hisatsune, Etsuko Ebisui, Masaya Usui, Naoko Ogawa, Akio Suzuki, Nobuko Mataga, Hiromi Takahashi-Iwanaga, Katsuhiko Mikoshiba
Molecular Cell, 58, 1015-1027 (2015)
要 約
小胞体タンパク質であるERp44はさまざまなタンパク質のオリゴマー形成や分泌を制御し,分泌タンパク質の品質管理にかかわっている.しかしながら,ERp44がマウスの個体レベルにおいてどのようなはたらきをするのかについてはほとんど明らかにされていない.筆者らは,ERp44ノックアウトマウスを作製し,このノックアウトマウスが低血圧を示すことを明らかにした.また,野生型のマウスにおいては,アンジオテンシンIIを分解する酵素ERAP1はERp44とジスルフィド結合を形成し小胞体にとどまっていたが,ERp44ノックアウトマウスではERAP1は小胞体にとどまることができず細胞外に多量に分泌され,その結果,血液においてアンジオテンシンIIが分解され低血圧がひき起こされた.また,症状のひとつとして血圧の急速な低下を示す敗血症モデルにおいては,ERp44とERAP1の結合が増加し血圧の低下が抑制された.以上のことから,小胞体に存在するERp44が酸化還元状態に依存してERAP1の細胞内あるいは細胞外における局在を制御し,その結果,血圧を制御することが示唆された.
はじめに
小胞体には多くの分子シャペロンやタンパク質修飾酵素が存在し,分泌タンパク質や膜タンパク質の正常な立体構造あるいはオリゴマーの形成を制御している.ERp44はチオレドキシン様ドメインをもつ分子シャペロンのひとつであり1),これまで,免疫グロブリンやアデイポネクチンにおけるオリゴマーの形成や2,3),酸化還元酵素であるEro1やPrdx4の小胞体への局在の制御4,5) について報告されてきた.しかしながら,ERp44のマウスの個体レベルにおける生理的な機能に関してはほとんど明らかにされていない.筆者らは,ERp44ノックアウトマウスを作製し,ERp44がマウスの個体レベルにおいてどのようなはたらきを担うのかについて解析した.
1.ERp44ノックアウトマウスは低血圧を示す
最初に,C57BL/6系統のマウスからERp44ノックアウトマウスを作製した.このノックアウトマウスは12%の割合で生まれたが,野生型のマウスに比べ全体的に身体が小さく,生後24時間以内にそのほとんどすべてが死亡した.しかし,4匹は成体まで生育したので,異なる遺伝的な背景をもつERp44ノックアウトマウスの作製を試みたところ,FVB/NJ系統を掛け合わせたERp44ノックアウトマウスはほとんどが成体まで生育した.また,どちらの系統のERp44ノックアウトマウスにおいても,生後における腎臓の尿細管の肥大や尿が少ないなどの表現型が観察された.
これらのERp44ノックアウトマウスの表現型はアンジオテンシノーゲンノックアウトマウスに似ていたため,血圧を測定したところ野生型のマウスに比べ血圧が大きく低下していた.また,血液におけるアンジオテンシンの濃度を測定したところ,アンジオテンシンIIの濃度が低下していた.
2.ERp44ノックアウトマウスの血液においてはアンジオテンシンIIの分解速度が速い
ERp44ノックアウトマウスの血液においてアンジオテンシンIIの濃度が低下している理由を明らかにするため,アンジオテンシンIIの合成経路に異常があるかどうか調べた.その結果,アンジオテンシンIIの原料となるアンジオテンシノーゲン,また,レニンやアンジオテンシン変換酵素の発現量には野生型マウスとの違いはなかった.そこで,血液におけるアンジオテンシンIIの安定性が低下しているとの仮説をたてた.野生型マウスあるいはERp44ノックアウトマウスの血清に合成アンジオテンシンIIを添加し,37℃にて一定の時間にわたりインキュベートしたのち,HPLCにより残存するアンジオテンシンIIを定量した.その結果,野生型マウスに比べERp44ノックアウトマウスの血清はアンジオテンシンIIをより速く分解することが明らかにされた.また,血液検査の結果,ERp44ノックアウトマウスの血液においてロイシンアミノペプチダーゼの活性が上昇していることが判明した.
3.ERAP1はジスルフィド結合を介しERp44と結合することにより小胞体にとどまる
これまでの研究により,ERp44はさまざまなタンパク質と結合し,そのオリゴマーの形成や分泌を制御することが報告されている.そこで,ロイシンアミノペプチダーゼ活性をもちアンジオテンシンIIを分解する酵素が小胞体においてERp44と結合し,ERp44の欠損によりその酵素が血液に過剰に分泌されたとの仮説をたてた.質量分析法を用いて肝臓の抽出液においてERp44と結合するタンパク質を解析した結果,ロイシンアミノペプチダーゼ活性をもちアンジオテンシンIIを分解するERAP1 6) がERp44と結合することが明らかにされた.ERp44とERAP1との結合はジチオスレイトールの処理により減少したため,酸化還元状態に依存して結合していることが示唆された.ERAP1は小胞体残留シグナル配列をもたず当初は分泌タンパク質として報告されたが,のちに,内在性のERAP1は小胞体に存在すること7),また,培養細胞に強制発現させると培地に分泌されることから6),ERAP1には小胞体にとどまるなんらかの機構があると考えられていた.さらに,ERAP1にはそのホモログである胎盤性ロイシンアミノペプチダーゼにはないアミノ酸配列が存在し,その配列がERAP1の細胞における局在と深いかかわりのあることが示唆されていた8).このアミノ酸配列を解析したところ,Cys487をSerに変異させるとERp44との結合が大きく減少することが明らかにされた.一方,Cys29をSerに変異させたERp44はERAP1との結合が大きく減少した.これらの変異は小胞体にとどまるERAP1の量を減少させ,その一方,培地に分泌されるERAP1の量を増加させた.これらの結果から,ERp44のCys29とERAP1のCys487とがジスルフィド結合を介して酸化還元状態に依存的に結合し,ERAP1を小胞体にとどめていることが示唆された.
ERp44ノックアウトマウスから胎仔線維芽細胞を作製し,培養上清のロイシンアミノペプチダーゼ活性を測定したところ,ERp44を欠損した細胞において野生型の細胞に比べ有意に活性の上昇が認められ,この活性の上昇は抗ERAP1抗体の処理によりなくなった.細胞内に存在するERAP1の量をウェスタンブロット法により測定したところ,ERp44を欠損した胎仔線維芽細胞では大きく減少していた.さらに,35SによりERAP1を標識しその動態を調べた結果,野生型の胎仔線維芽細胞においてERAP1は細胞内にとどまったのに対し,ERp44を欠損した胎仔線維芽細胞においては1時間以内に細胞外に分泌された.
ERp44ノックアウトマウスの血液におけるアンジオテンシンIIの安定性の低下はERAP1によるものなのかどうか検証した.野生型マウスおよびERp44ノックアウトマウスの血清のERAP1をウェスタンブロット法により測定した結果,ERp44ノックアウトマウスにおいては検出されたが野生型マウスにおいては検出されなかった.また,抗ERAP1抗体によりERAP1を除去した血清においては,野生型マウスとERp44ノックアウトマウスとのあいだでアンジオテンシンIIの分解速度に差はなくなった.以上の結果から,ERp44ノックアウトマウスの低血圧は血液に分泌された過剰のERAP1によりアンジオテンシンIIが分解されその濃度が低下することによりひき起されるものと結論した.
4.敗血症におけるERp44とERAP1との結合の生理的な意義
敗血症は細菌が血液に侵入して起こる全身性の感染症であり,その症状のひとつに血圧の急速な低下がある.また,敗血症の際には細胞が小胞体ストレスを起こし,BIPやPDIなどの分子シャペロンの発現が誘導されることが知られている.そこで,マウスにインターフェロンγおよびリポ多糖を投与することにより敗血症をひき起こし,ERp44とERAP1の結合がどのように変化するか解析した.その結果,敗血症の発症の際にはERp44およびERAP1の発現が上昇すること,また,ERp44とERAP1との結合が増加することが明らかにされた.また,ERp44ヘテロノックアウトマウスにおいては敗血症の際に小胞体にとどまることのできるERAP1の量が減少し,その結果,ERAP1が血液に多く分泌されることにより野生型のマウスより血圧の低下の程度が大きくなった.この結果から,敗血症の際にERp44とERAP1との結合が増加し血圧の低下を抑制していることが示唆された.以上の結果から,小胞体に存在するERp44がその酸化還元状態に応じてERAP1の細胞内および細胞外における局在を制御し,その結果,血液に分泌されたERAP1がアンジオテンシンIIを分解し血圧を制御するというモデルを提唱した(図1).
おわりに
今回の研究から,小胞体の酸化還元状態がERp44とERAP1との結合に影響すること,また,その結果,血液におけるERAP1の量が変化してアンジオテンシンIIの濃度が変化し,血圧に影響をあたえることが考えられた.小胞体の酸化還元状態は,活性酸素種,小胞体におけるCa2+濃度の低下など,さまざまなストレスに影響されることが示されている.これらの要因と血圧の変化との関係をERp44とERAP1との相互作用に着目して解明できる可能性がある.それゆえ,どのような過程をへてERp44とERAP1とのあいだにジスルフィド結合が形成されるのか,その詳細な機構を解析する必要があると考えられる.また,ERp44の結合タンパク質として新たに同定されたERAP1はMHCクラスI分子の提示に関係することが知られており9),最近,そのヒトにおける遺伝子多型は高血圧だけでなく10),強直性脊椎炎や乾癬11,12) といった疾患と関係のあることが報告された.これらの疾患が小胞体の酸化還元状態や細胞の内外のERAP1の量とかかわりがあるのか興味深い.
文 献
- Anelli, T., Alessio, M., Mezghrani, A. et al.: ERp44, a novel endoplasmic reticulum folding assistant of the thioredoxin family. EMBO J., 21, 835-844 (2002)[PubMed]
- Cortini, M. & Sitia, R.: From antibodies to adiponectin: role of ERp44 in sizing and timing protein secretion. Diabetes Obes. Metab., 12, 39-47 (2010)[PubMed]
- Wang, Z. V., Schraw, T. D., Kim, J. Y. et al.: Secretion of the adipocyte-specific secretory protein adiponectin critically depends on thiol-mediated protein retention. Mol. Cell. Biol., 27, 3716-3731 (2007)[PubMed]
- Anelli, T., Alessio, M., Bachi, A. et al.: Thiol-mediated protein retention in the endoplasmic reticulum: the role of ERp44. EMBO J., 22, 5015-5022 (2003)[PubMed]
- Kakihana, T., Araki, K., Vavassori, S. et al.: Dynamic regulation of Ero1α and Prx4 localization in the secretory pathway. J. Biol. Chem., 288, 29586-29594 (2013)[PubMed]
- Hattori, A., Kitatani, K., Matsumoto, H. et al.: Characterization of recombinant human adipocyte-derived leucine aminopeptidase expressed in Chinese hamster ovary cells. J. Biochem., 128, 755-762 (2000)[PubMed]
- Saric, T., Chang, S. C., Hattori, A. et al.: An IFN-γ-induced aminopeptidase in the ER, ERAP1, trims precursors to MHC class I-presented peptides. Nat. Immunol., 3, 1169-1176 (2002)[PubMed]
- Hattori, A., Goto, Y. & Tsujimoto, M.: Exon 10 coding sequence is important for endoplasmic reticulum retention of endoplasmic reticulum aminopeptidase 1. Biol. Pharm. Bull., 35, 601-605 (2012)[PubMed]
- Serwold, T., Gonzalez, F., Kim, J. et al.: ERAAP customizes peptides for MHC class I molecules in the endoplasmic reticulum. Nature, 419, 480-483 (2002)[PubMed]
- Goto, Y., Hattori, A., Ishii, Y. et al.: Reduced activity of the hypertension-associated Lys528Arg mutant of human adipocyte-derived leucine aminopeptidase (A-LAP)/ER-aminopeptidase-1. FEBS Lett., 580, 1833-1838 (2006)[PubMed]
- Keidel, S., Chen, L., Pointon, J. et al.: ERAP1 and ankylosing spondylitis. Curr. Opin. Immunol., 25, 97-102 (2013)[PubMed]
- Sun, L. D., Cheng, H., Wang, Z. X. et al.: Association analyses identify six new psoriasis susceptibility loci in the Chinese population. Nat. Genet., 42, 1005-1009 (2010)[PubMed]
著者プロフィール
略歴:1999年 東京大学大学院医学系研究科 修了,同年 理化学研究所脳科学総合研究センター 基礎科学特別研究員,2006年 東京大学医科学研究所 助手を経て,2007年より理化学研究所脳科学総合研究センター 研究員.
研究テーマ:小胞体関連タンパク質とその生理機能.
御子柴 克彦(Katsuhiko Mikoshiba)
理化学研究所脳科学総合研究センター チームリーダー.
研究室URL:http://mikoshiba-lab.brain.riken.jp/indexj.html
© 2015 久恒智博・御子柴克彦 Licensed under CC 表示 2.1 日本