ATACアセチルトランスフェラーゼ複合体はMAPキナーゼと協調することでJNKの標的遺伝子を制御する
菅沼 環
(米国Stowers Institute for Medical Research,Workman Lab)
email:菅沼 環
DOI: 10.7875/first.author.2010.029
The ATAC acetyltransferase complex coordinates MAP kinases to regulate JNK target genes.
Tamaki Suganuma, Arcady Mushegian, Selene K. Swanson, Susan M. Abmayr, Laurence Florens, Michael P. Washburn, Jerry L. Workman
Cell, 142, 726-736 (2010)
細胞外刺激への対応においてc-Junなど転写因子はシグナル伝達の標的となっている.筆者らは,JNK(Jun N-terminal kinase,Jun N末端キナーゼ)の標的遺伝子であるJra遺伝子あるいはchickadee遺伝子において,ATACアセチルトランスフェラーゼ複合体がc-Junの共役転写調節因子としての機能を担うことを見い出した.ATACアセチルトランスフェラーゼ複合体は,これら標的遺伝子への転写因子Jraの結合,Jra遺伝子のエンハンサー領域およびプロモーター領域におけるヒストンH4の16番目のリジン残基のアセチル化,さらに,転写において必須であった.浸透圧ストレス刺激下において,ATACアセチルトランスフェラーゼ複合体はc-Junと共局在し,上流のMAPキナーゼであるMSN,MKK4,JNKをリクルートしJNKのさらなる活性化を抑制した.これらMAPキナーゼの再局在とATACアセチルトランスフェラーゼ複合体によるJNKの活性抑制は,ATACアセチルトランスフェラーゼ複合体の構成タンパク質のひとつCG10238に依存していた.このように,ATACアセチルトランスフェラーゼ複合体は共役転写活性化因子として,また一方で,上流シグナルを抑制することによって,MAPキナーゼシグナル伝達系を統合していた.
ショウジョウバエのATACアセチルトランスフェラーゼ複合体は,Gcn5/KAT2とAtac2/KAT14という異なる基質特異性を示すヒストンアチルトランスフェラーゼを含む13種類のタンパク質から構成されている1).さらに,その構成タンパク質Gcn5,Ada3,CG30390(酵母ではSgf29)は共役転写活性化因子SAGAとも共通することから,ATACアセチルトランスフェラーゼ複合体も共役転写因子として機能することが予想されていた.ショウジョウバエのATACアセチルトランスフェラーゼ複合体はモリブデン補因子Mocoの合成に関与するMoaEドメインと,MAPキナーゼの上流キナーゼを阻害するMBIPドメインとをもつCG10238を構成タンパク質として含んでいる2,3).ヒトではMBIPが独立したタンパク質としてCG10238に対応して存在する4).
ショウジョウバエS2細胞から得たATACアセチルトランスフェラーゼ複合体の質量分析計による解析により,いずれもMAPキナーゼシグナル伝達系に関連するタンパク質である,c-JunのホモログJra,SteキナーゼMisshapen(MSN)に由来するペプチドが検出された.また,ほかのSteキナーゼであるMKK4,MEK3/MKK3,JNK経路に遺伝的に相互作用するChickadeeに由来するペプチドがATACアセチルトランスフェラーゼ複合体の構成タンパク質であるCG10238の精製より検出された5).
MAPキナーゼシグナル伝達系は浸透圧ストレスにより活性化され,リン酸化によりJNKを活性化する6).ATACアセチルトランスフェラーゼ複合体の構成タンパク質であるCG10238がMAPキナーゼシグナル伝達系において上流キナーゼを阻害する機能を担っているのかどうかを,CuSO4により誘導されるCG10238安定発現S2細胞における浸透圧ストレスへの反応性により調べた.浸透圧ストレス無刺激下では,CuSO4の有無にかかわらず野生型S2細胞およびCG10238安定発現S2細胞の両者においてJNKの活性は認められなかった.浸透圧ストレス刺激により,野生型S2細胞でのJNKの活性化は認められたが,CuSO4誘導によるCG10238の発現によってJNKの活性化は抑制された.
ショウジョウバエATACアセチルトランスフェラーゼ複合体の構成タンパク質であるCG10238は,ヒトではそれぞれ別のタンパク質として存在するMoaEドメインとMBIPドメインとから構成されている.CG10238の発現によるJNKの活性抑制が,CG10238単独の機能によるものなのか,ATACアセチルトランスフェラーゼ複合体の機能の一部なのかを知るため,まず,MBIPドメインのみを発現するCG10238変異体,あるいは,MoaEドメインのみを発現するCG10238変異体に相互作用するタンパク質を精製し質量分析計により解析するとともに,ATACアセチルトランスフェラーゼ複合体の構成タンパク質に対する抗体を用いたウェスタンブロットにより解析した.その結果,CHRAC14を除くすべてのATACアセチルトランスフェラーゼ複合体の構成タンパク質はMBIPドメインのみを発現する変異体から得たサンプルより検出されたが,MoaEドメインのみを発現する変異体から得たサンプルからは3種の構成タンパク質のみが検出され,MBIPドメインがCG10238のATACアセチルトランスフェラーゼ複合体への結合に必須であることが示された.
アミノ酸の配列解析において,MoaEドメインは真正細菌から多細胞生物にまで認められるが,MBIPドメインは真正細菌や原核生物ではみつからなかった.ほとんどの昆虫は,CG10238のようにMoaEドメインとMBIPドメインとが融合したかたちのタンパク質をもつ.相同性検索における多細胞生物のMBIPドメインN末端とMoaEドメインとの高い類似性より,ヒトMBIPタンパク質は進化においてMoaEドメインに由来するものと予想した.そこで,CG10238においてMoaEドメインとMBIPドメインのどちらがJNKの活性抑制を担うのかを,CG10238変異体の安定発現S2細胞を用いて調べた.その結果,予想とは異なり,CG10238によるJNKの活性抑制はMoaEドメインによって担われていることが示された.
JNKの活性抑制が,MoaEドメイン単独の機能によるものなのか,ATACアセチルトランスフェラーゼ複合体による機能の一部なのかを知るため,ATACアセチルトランスフェラーゼ複合体ノックダウンS2細胞におけるJNKの活性化を指標にウェスタンブロッティングにより調べた.対照の細胞においては浸透圧ストレス無刺激下でのJNKの活性化は認められなかったが,Atac2ノックダウンS2細胞では浸透圧ストレス無刺激下でJNKの活性化がみられ,浸透圧ストレス刺激によるJNKの活性化は対照の細胞と比較してさらに亢進していた.これらの結果は,ATACアセチルトランスフェラーゼ複合体の構成タンパク質であるNC2βのノックダウン細胞あるいはCG10238のノックダウン細胞でも認められ,293T細胞でのヒトATACアセチルトランスフェラーゼ複合体のノックダウンでも浸透圧ストレス刺激下でのJNKの活性化の亢進が観察された.以上より,ATACアセチルトランスフェラーゼ複合体がJNKの活性化を抑制することが明らかとなった.
質量分析によりJraに由来するペプチドが検出されたことから,ATACアセチルトランスフェラーゼ複合体がJraの共役転写因子として機能することが予想された.事実,S2細胞においてJraはATACアセチルトランスフェラーゼ複合体に結合し,さらに,MSNとATACアセチルトランスフェラーゼ複合体とは相互作用した.c-Jun遺伝子は自己産物c-Junにより転写活性化される.ATACアセチルトランスフェラーゼ複合体構成タンパク質のノックダウンS2細胞,JraノックダウンS2細胞,あるいは,MSNノックダウンS2細胞におけるJra転写産物を定量リアルタイムPCR法によって計測した.Atac2ノックダウン細胞あるいはCG10238ノックダウン細胞では,Jraノックダウン細胞と同様に,Jra遺伝子の転写レベルが顕著に低下し,Jra遺伝子に依存性の遺伝子であるchickadee遺伝子の転写も低下していた.JNKシグナル伝達系の活性化はc-Junの発現を上昇させるので,Jra遺伝子およびchickadee遺伝子の転写レベルを浸透圧ストレス刺激下で計測した.Atac2ノックダウン細胞でのJra遺伝子およびchickadee遺伝子の転写レベルの低下は認められず,むしろ,CG10238ノックダウン細胞においては転写レベルの上昇が認められた.したがって,ATACアセチルトランスフェラーゼ複合体は浸透圧ストレス無刺激下ではJNK標的遺伝子の転写を促進し,浸透圧ストレス刺激下ではこの転写を優位に抑制することが示された.さらに,JNK標的遺伝子の発現への促進的な機能はおもにAtac2によって担われ,一方,抑制的な機能はおもにCG10238に依存することがわかった.
つぎに,ATACアセチルトランスフェラーゼ複合体ノックダウン細胞,あるいは,MSNノックダウン細胞において,JNK標的遺伝子におけるATACアセチルトランスフェラーゼ複合体とMAPキナーゼの局在を,クロマチン免疫沈降(chromatin immunoprecipitation:ChIP)アッセイにより調べた.c-Jun遺伝子プロモーターはAP-1様配列とNF-jun結合配列を含み,c-Junは外的刺激に非依存的にc-Jun遺伝子と結合する7,8).実際,JraはJra遺伝子コーディング領域の中央のNF-jun結合配列を含む領域に顕著に局在した.つぎに,ATACアセチルトランスフェラーゼ複合体の局在を,JNK標的遺伝子のエンハンサー領域,AP-1結合領域,5’末端側コーディング領域,コーディング領域中央のNF-jun結合配列を含む領域,コーディング領域下流の領域において調べた.浸透圧ストレス無刺激下でAtac2はエンハンサー領域およびプロモーター領域に局在し,これらの領域のヒストンH4の16番目のリジン残基のアセチル化に必須であった1).浸透圧ストレス刺激下ではプロモーター領域へのAtac2の局在とヒストンH4の16番目のリジン残基のアセチル化は無刺激下と同様であったが,エンハンサー領域でのATACアセチルトランスフェラーゼ複合体の局在とヒストンH4の16番目のリジン残基のアセチル化レベルが低下し,代わって,Jra結合領域で局在が増加していた.Jraの局在は浸透圧ストレス無刺激下ではAtac2,CG10238,および,MSNに顕著に依存していたが,ストレス刺激下ではCG10238への優位な依存性を示した.
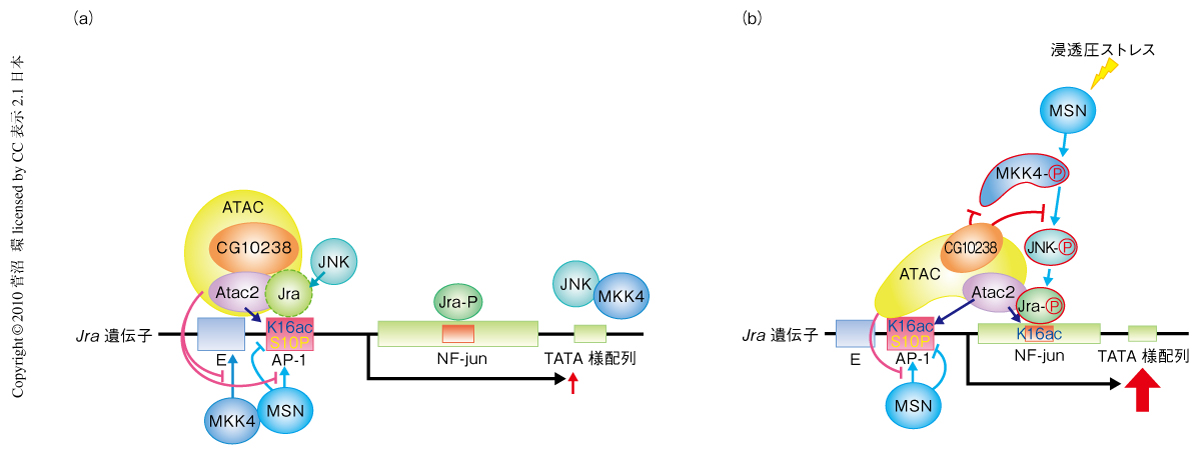
さらに,ChIPアッセイの結果はATACアセチルトランスフェラーゼ複合体と活性型JNK,活性型MKK4,MSNなど上流MAPキナーゼとの相互関係を明らかにした.プロモーター領域におけるヒストンH4の16番目のリジン残基のアセチル化は,浸透圧ストレス無刺激下ではMSNに非依存性であるが,浸透圧ストレス刺激下ではMSNに抑制され,コーディング領域での最大のアセチル化をもたらした.浸透圧ストレス無刺激下でのエンハンサー領域,プロモーター領域,コーディング領域下流への活性型JNKの局在にはAtac2を要し,MSNには抑制され,一方,浸透圧ストレス刺激下でのコーディング領域への結合にはATACアセチルトランスフェラーゼ複合体とMSNとの両者を要した.活性型MKK4のエンハンサー領域への結合は浸透圧ストレス無刺激下でAtac2およびMSNにより抑制されていたが,浸透圧ストレス刺激下ではとくにCG10238とMSNとを必要とした.MSNのプロモーター領域への結合は浸透圧ストレス無刺激下でATACアセチルトランスフェラーゼ複合体により抑制されたが,浸透圧ストレス刺激下においてはATACアセチルトランスフェラーゼ複合体の存在にかかわらずコーディング領域に結合した.このように,上流MAPキナーゼは浸透圧ストレス刺激により,Atac2と同様,顕著にJra結合領域を含むコーディング領域に集結した.FOSL1遺伝子におけるヒストンH3の10番目のセリン残基のリン酸化は,MOFによるエンハンサー領域のヒストンH4の16番目のリジン残基のアセチル化のきっかけとなる9).しかし,浸透圧ストレス無刺激下でのATACアセチルトランスフェラーゼ複合体によるJra遺伝子エンハンサー領域でのヒストンH4の16番目のリジン残基のアセチル化は,MOFによるアセチル化とは異なり,ヒストンH3の10番目のセリン残基のリン酸化とは独立していた(図1).
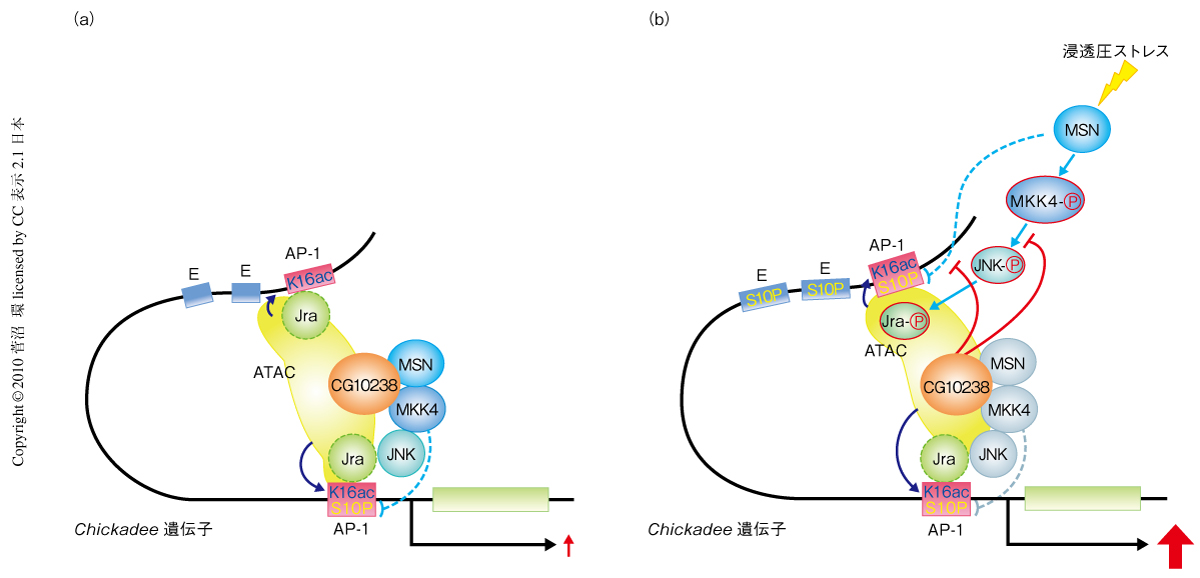
Jra遺伝子において,ATACアセチルトランスフェラーゼ複合体とMAPキナーゼが浸透圧ストレスにより顕著に再局在したのは,Jraに依存するのかコーディング領域に結合するためなのかを知るため,明らかなNF-jun結合配列をもたずコーディング領域から6.4 kb上流(エンハンサー領域付近)と2 kb上流にいくつかのAP-1様配列をもつchickadee遺伝子をChIPアッセイにより解析した.Jraは浸透圧ストレス無刺激下では両方のAP-1様配列にCG10238依存的あるいはMSN依存的に局在した.これらの領域には,ヒストンH4の16番目のリジン残基アセチル化をともなってATACアセチルトランスフェラーゼ複合体がJra非依存的に局在していた.しかし,浸透圧ストレス刺激によりATACアセチルトランスフェラーゼ複合体はヒストンH4の16番目のリジン残基のアセチル化をともなって最上流のAP-1様配列にJra依存的に再局在し,浸透圧ストレス無刺激下ではおのおの関連性を逸して局在した.活性型JNK,活性型MKK4およびMSNも,浸透圧ストレス刺激によりJra依存的に最上流のAP-1様配列に集結した.さらに,MAPキナーゼの再局在はAtac2によりわずかに抑制され,一方,CG10238には顕著に依存した.ヒストンH3の10番目のセリン残基のリン酸化はJra遺伝子でみられたように浸透圧ストレス無刺激下でAtac2およびMSNにより抑制され,ストレス刺激下ではMSNにより特異的に抑制された(図2).
筆者らは,ATACアセチルトランスフェラーゼ複合体は共役転写活性化因子として機能するとともに,JNKシグナル伝達系を抑制し負のフィードバックを供することを示した.細胞外刺激に対し細胞が適切に対応するように,ATACアセチルトランスフェラーゼ複合体はマスターレギュレーターとして機能するのだろう.
略歴:2001年 東京医科歯科大学大学院医歯学総合研究科博士課程 修了,同年 東京医科歯科大学難治疾患研究所 特別研究員,2002年 米国Pennsylvania州立大学Postdoctoral fellowを経て,2003年より米国Stowers Institute for Medical ResearchにてResearch Associate.
研究テーマ:ATACアセチルトランスフェラーゼ複合体の機能解析.
© 2010 菅沼 環 Licensed under CC 表示 2.1 日本
(米国Stowers Institute for Medical Research,Workman Lab)
email:菅沼 環
DOI: 10.7875/first.author.2010.029
The ATAC acetyltransferase complex coordinates MAP kinases to regulate JNK target genes.
Tamaki Suganuma, Arcady Mushegian, Selene K. Swanson, Susan M. Abmayr, Laurence Florens, Michael P. Washburn, Jerry L. Workman
Cell, 142, 726-736 (2010)
要 約
細胞外刺激への対応においてc-Junなど転写因子はシグナル伝達の標的となっている.筆者らは,JNK(Jun N-terminal kinase,Jun N末端キナーゼ)の標的遺伝子であるJra遺伝子あるいはchickadee遺伝子において,ATACアセチルトランスフェラーゼ複合体がc-Junの共役転写調節因子としての機能を担うことを見い出した.ATACアセチルトランスフェラーゼ複合体は,これら標的遺伝子への転写因子Jraの結合,Jra遺伝子のエンハンサー領域およびプロモーター領域におけるヒストンH4の16番目のリジン残基のアセチル化,さらに,転写において必須であった.浸透圧ストレス刺激下において,ATACアセチルトランスフェラーゼ複合体はc-Junと共局在し,上流のMAPキナーゼであるMSN,MKK4,JNKをリクルートしJNKのさらなる活性化を抑制した.これらMAPキナーゼの再局在とATACアセチルトランスフェラーゼ複合体によるJNKの活性抑制は,ATACアセチルトランスフェラーゼ複合体の構成タンパク質のひとつCG10238に依存していた.このように,ATACアセチルトランスフェラーゼ複合体は共役転写活性化因子として,また一方で,上流シグナルを抑制することによって,MAPキナーゼシグナル伝達系を統合していた.
はじめに
ショウジョウバエのATACアセチルトランスフェラーゼ複合体は,Gcn5/KAT2とAtac2/KAT14という異なる基質特異性を示すヒストンアチルトランスフェラーゼを含む13種類のタンパク質から構成されている1).さらに,その構成タンパク質Gcn5,Ada3,CG30390(酵母ではSgf29)は共役転写活性化因子SAGAとも共通することから,ATACアセチルトランスフェラーゼ複合体も共役転写因子として機能することが予想されていた.ショウジョウバエのATACアセチルトランスフェラーゼ複合体はモリブデン補因子Mocoの合成に関与するMoaEドメインと,MAPキナーゼの上流キナーゼを阻害するMBIPドメインとをもつCG10238を構成タンパク質として含んでいる2,3).ヒトではMBIPが独立したタンパク質としてCG10238に対応して存在する4).
1.ATACアセチルトランスフェラーゼ複合体はMAPキナーゼシグナル伝達系の関連タンパク質と相互作用する
ショウジョウバエS2細胞から得たATACアセチルトランスフェラーゼ複合体の質量分析計による解析により,いずれもMAPキナーゼシグナル伝達系に関連するタンパク質である,c-JunのホモログJra,SteキナーゼMisshapen(MSN)に由来するペプチドが検出された.また,ほかのSteキナーゼであるMKK4,MEK3/MKK3,JNK経路に遺伝的に相互作用するChickadeeに由来するペプチドがATACアセチルトランスフェラーゼ複合体の構成タンパク質であるCG10238の精製より検出された5).
2.CG10238は浸透圧ストレスによるJNKの活性化を抑制する
MAPキナーゼシグナル伝達系は浸透圧ストレスにより活性化され,リン酸化によりJNKを活性化する6).ATACアセチルトランスフェラーゼ複合体の構成タンパク質であるCG10238がMAPキナーゼシグナル伝達系において上流キナーゼを阻害する機能を担っているのかどうかを,CuSO4により誘導されるCG10238安定発現S2細胞における浸透圧ストレスへの反応性により調べた.浸透圧ストレス無刺激下では,CuSO4の有無にかかわらず野生型S2細胞およびCG10238安定発現S2細胞の両者においてJNKの活性は認められなかった.浸透圧ストレス刺激により,野生型S2細胞でのJNKの活性化は認められたが,CuSO4誘導によるCG10238の発現によってJNKの活性化は抑制された.
3.CG10238のATACアセチルトランスフェラーゼ複合体への結合にはMBIPドメインが必要である
ショウジョウバエATACアセチルトランスフェラーゼ複合体の構成タンパク質であるCG10238は,ヒトではそれぞれ別のタンパク質として存在するMoaEドメインとMBIPドメインとから構成されている.CG10238の発現によるJNKの活性抑制が,CG10238単独の機能によるものなのか,ATACアセチルトランスフェラーゼ複合体の機能の一部なのかを知るため,まず,MBIPドメインのみを発現するCG10238変異体,あるいは,MoaEドメインのみを発現するCG10238変異体に相互作用するタンパク質を精製し質量分析計により解析するとともに,ATACアセチルトランスフェラーゼ複合体の構成タンパク質に対する抗体を用いたウェスタンブロットにより解析した.その結果,CHRAC14を除くすべてのATACアセチルトランスフェラーゼ複合体の構成タンパク質はMBIPドメインのみを発現する変異体から得たサンプルより検出されたが,MoaEドメインのみを発現する変異体から得たサンプルからは3種の構成タンパク質のみが検出され,MBIPドメインがCG10238のATACアセチルトランスフェラーゼ複合体への結合に必須であることが示された.
4.CG10238のMoaEドメインはJNK活性化の抑制を担う
アミノ酸の配列解析において,MoaEドメインは真正細菌から多細胞生物にまで認められるが,MBIPドメインは真正細菌や原核生物ではみつからなかった.ほとんどの昆虫は,CG10238のようにMoaEドメインとMBIPドメインとが融合したかたちのタンパク質をもつ.相同性検索における多細胞生物のMBIPドメインN末端とMoaEドメインとの高い類似性より,ヒトMBIPタンパク質は進化においてMoaEドメインに由来するものと予想した.そこで,CG10238においてMoaEドメインとMBIPドメインのどちらがJNKの活性抑制を担うのかを,CG10238変異体の安定発現S2細胞を用いて調べた.その結果,予想とは異なり,CG10238によるJNKの活性抑制はMoaEドメインによって担われていることが示された.
5.ATACアセチルトランスフェラーゼ複合体はJNKの活性化を抑制する
JNKの活性抑制が,MoaEドメイン単独の機能によるものなのか,ATACアセチルトランスフェラーゼ複合体による機能の一部なのかを知るため,ATACアセチルトランスフェラーゼ複合体ノックダウンS2細胞におけるJNKの活性化を指標にウェスタンブロッティングにより調べた.対照の細胞においては浸透圧ストレス無刺激下でのJNKの活性化は認められなかったが,Atac2ノックダウンS2細胞では浸透圧ストレス無刺激下でJNKの活性化がみられ,浸透圧ストレス刺激によるJNKの活性化は対照の細胞と比較してさらに亢進していた.これらの結果は,ATACアセチルトランスフェラーゼ複合体の構成タンパク質であるNC2βのノックダウン細胞あるいはCG10238のノックダウン細胞でも認められ,293T細胞でのヒトATACアセチルトランスフェラーゼ複合体のノックダウンでも浸透圧ストレス刺激下でのJNKの活性化の亢進が観察された.以上より,ATACアセチルトランスフェラーゼ複合体がJNKの活性化を抑制することが明らかとなった.
6.ATACアセチルトランスフェラーゼ複合体はJNK標的遺伝子の共役転写因子として機能する
質量分析によりJraに由来するペプチドが検出されたことから,ATACアセチルトランスフェラーゼ複合体がJraの共役転写因子として機能することが予想された.事実,S2細胞においてJraはATACアセチルトランスフェラーゼ複合体に結合し,さらに,MSNとATACアセチルトランスフェラーゼ複合体とは相互作用した.c-Jun遺伝子は自己産物c-Junにより転写活性化される.ATACアセチルトランスフェラーゼ複合体構成タンパク質のノックダウンS2細胞,JraノックダウンS2細胞,あるいは,MSNノックダウンS2細胞におけるJra転写産物を定量リアルタイムPCR法によって計測した.Atac2ノックダウン細胞あるいはCG10238ノックダウン細胞では,Jraノックダウン細胞と同様に,Jra遺伝子の転写レベルが顕著に低下し,Jra遺伝子に依存性の遺伝子であるchickadee遺伝子の転写も低下していた.JNKシグナル伝達系の活性化はc-Junの発現を上昇させるので,Jra遺伝子およびchickadee遺伝子の転写レベルを浸透圧ストレス刺激下で計測した.Atac2ノックダウン細胞でのJra遺伝子およびchickadee遺伝子の転写レベルの低下は認められず,むしろ,CG10238ノックダウン細胞においては転写レベルの上昇が認められた.したがって,ATACアセチルトランスフェラーゼ複合体は浸透圧ストレス無刺激下ではJNK標的遺伝子の転写を促進し,浸透圧ストレス刺激下ではこの転写を優位に抑制することが示された.さらに,JNK標的遺伝子の発現への促進的な機能はおもにAtac2によって担われ,一方,抑制的な機能はおもにCG10238に依存することがわかった.
7.ATACアセチルトランスフェラーゼ複合体はJraの共役転写因子として機能しJra遺伝子において上流のMAPキナーゼと協調する
つぎに,ATACアセチルトランスフェラーゼ複合体ノックダウン細胞,あるいは,MSNノックダウン細胞において,JNK標的遺伝子におけるATACアセチルトランスフェラーゼ複合体とMAPキナーゼの局在を,クロマチン免疫沈降(chromatin immunoprecipitation:ChIP)アッセイにより調べた.c-Jun遺伝子プロモーターはAP-1様配列とNF-jun結合配列を含み,c-Junは外的刺激に非依存的にc-Jun遺伝子と結合する7,8).実際,JraはJra遺伝子コーディング領域の中央のNF-jun結合配列を含む領域に顕著に局在した.つぎに,ATACアセチルトランスフェラーゼ複合体の局在を,JNK標的遺伝子のエンハンサー領域,AP-1結合領域,5’末端側コーディング領域,コーディング領域中央のNF-jun結合配列を含む領域,コーディング領域下流の領域において調べた.浸透圧ストレス無刺激下でAtac2はエンハンサー領域およびプロモーター領域に局在し,これらの領域のヒストンH4の16番目のリジン残基のアセチル化に必須であった1).浸透圧ストレス刺激下ではプロモーター領域へのAtac2の局在とヒストンH4の16番目のリジン残基のアセチル化は無刺激下と同様であったが,エンハンサー領域でのATACアセチルトランスフェラーゼ複合体の局在とヒストンH4の16番目のリジン残基のアセチル化レベルが低下し,代わって,Jra結合領域で局在が増加していた.Jraの局在は浸透圧ストレス無刺激下ではAtac2,CG10238,および,MSNに顕著に依存していたが,ストレス刺激下ではCG10238への優位な依存性を示した.
さらに,ChIPアッセイの結果はATACアセチルトランスフェラーゼ複合体と活性型JNK,活性型MKK4,MSNなど上流MAPキナーゼとの相互関係を明らかにした.プロモーター領域におけるヒストンH4の16番目のリジン残基のアセチル化は,浸透圧ストレス無刺激下ではMSNに非依存性であるが,浸透圧ストレス刺激下ではMSNに抑制され,コーディング領域での最大のアセチル化をもたらした.浸透圧ストレス無刺激下でのエンハンサー領域,プロモーター領域,コーディング領域下流への活性型JNKの局在にはAtac2を要し,MSNには抑制され,一方,浸透圧ストレス刺激下でのコーディング領域への結合にはATACアセチルトランスフェラーゼ複合体とMSNとの両者を要した.活性型MKK4のエンハンサー領域への結合は浸透圧ストレス無刺激下でAtac2およびMSNにより抑制されていたが,浸透圧ストレス刺激下ではとくにCG10238とMSNとを必要とした.MSNのプロモーター領域への結合は浸透圧ストレス無刺激下でATACアセチルトランスフェラーゼ複合体により抑制されたが,浸透圧ストレス刺激下においてはATACアセチルトランスフェラーゼ複合体の存在にかかわらずコーディング領域に結合した.このように,上流MAPキナーゼは浸透圧ストレス刺激により,Atac2と同様,顕著にJra結合領域を含むコーディング領域に集結した.FOSL1遺伝子におけるヒストンH3の10番目のセリン残基のリン酸化は,MOFによるエンハンサー領域のヒストンH4の16番目のリジン残基のアセチル化のきっかけとなる9).しかし,浸透圧ストレス無刺激下でのATACアセチルトランスフェラーゼ複合体によるJra遺伝子エンハンサー領域でのヒストンH4の16番目のリジン残基のアセチル化は,MOFによるアセチル化とは異なり,ヒストンH3の10番目のセリン残基のリン酸化とは独立していた(図1).
8.ATACアセチルトランスフェラーゼ複合体はchickadee遺伝子においてヌクレオソームをアセチル化する
Jra遺伝子において,ATACアセチルトランスフェラーゼ複合体とMAPキナーゼが浸透圧ストレスにより顕著に再局在したのは,Jraに依存するのかコーディング領域に結合するためなのかを知るため,明らかなNF-jun結合配列をもたずコーディング領域から6.4 kb上流(エンハンサー領域付近)と2 kb上流にいくつかのAP-1様配列をもつchickadee遺伝子をChIPアッセイにより解析した.Jraは浸透圧ストレス無刺激下では両方のAP-1様配列にCG10238依存的あるいはMSN依存的に局在した.これらの領域には,ヒストンH4の16番目のリジン残基アセチル化をともなってATACアセチルトランスフェラーゼ複合体がJra非依存的に局在していた.しかし,浸透圧ストレス刺激によりATACアセチルトランスフェラーゼ複合体はヒストンH4の16番目のリジン残基のアセチル化をともなって最上流のAP-1様配列にJra依存的に再局在し,浸透圧ストレス無刺激下ではおのおの関連性を逸して局在した.活性型JNK,活性型MKK4およびMSNも,浸透圧ストレス刺激によりJra依存的に最上流のAP-1様配列に集結した.さらに,MAPキナーゼの再局在はAtac2によりわずかに抑制され,一方,CG10238には顕著に依存した.ヒストンH3の10番目のセリン残基のリン酸化はJra遺伝子でみられたように浸透圧ストレス無刺激下でAtac2およびMSNにより抑制され,ストレス刺激下ではMSNにより特異的に抑制された(図2).
おわりに
筆者らは,ATACアセチルトランスフェラーゼ複合体は共役転写活性化因子として機能するとともに,JNKシグナル伝達系を抑制し負のフィードバックを供することを示した.細胞外刺激に対し細胞が適切に対応するように,ATACアセチルトランスフェラーゼ複合体はマスターレギュレーターとして機能するのだろう.
文 献
- Suganuma, T., Gutierrez, J. L., Li, B. et al.: ATAC is a double histone acetyltransferase complex that stimulates nucleosome sliding. Nat. Struct. Mol. Biol., 15, 364-372 (2008)[PubMed]
- Fukuyama, K., Yoshida, M., Yamashita, A. et al.: MAPK upstream kinase (MUK)-binding inhibitory protein, a negative regulator of MUK/dual leucine zipper-bearing kinase/leucine zipper protein kinase. J. Biol. Chem., 275, 21247-21254 (2000)[PubMed]
- Schwarz, G. & Mendel, R. R.: Molybdenum cofactor biosynthesis and molybdenum enzymes. Annu. Rev. Plant Biol., 57, 623-647 (2006)[PubMed]
- Wang, Y. L., Faiola, F., Xu, M. et al.: Human ATAC is a GCN5/PCAF-containing acetylase complex with a novel NC2-like histone fold module that interacts with the TATA-binding protein. J. Biol. Chem., 283, 33808-33815 (2008)[PubMed]
- Jasper, H., Benes, V., Schwager, C. et al.: The genomic response of the Drosophila embryo to JNK signaling. Dev. Cell, 1, 579-586 (2001)[PubMed]
- de Nadal, E., Alepuz, P. M. & Posas, F.: Dealing with osmostress through MAP kinase activation. EMBO Rep., 3, 735-740 (2002)[PubMed]
- Rozek, D. & Pfeifer, G. P.: In vivo protein-DNA interactions at the c-jun promoter: preformed complexes mediate the UV response. Mol. Cell. Biol., 13, 5490-5499 (1993)[PubMed]
- Angel, P. & Karin, M.: The role of Jun, Fos and the AP-1 complex in cell-proliferation and transformation. Biochim. Biophys. Acta, 1072, 129-157 (1991)[PubMed]
- Zippo, A., Serafini, R., Rocchigiani, M. et al.: Histone crosstalk between H3S10ph and H4K16ac generates a histone code that mediates transcription elongation. Cell, 138, 1122-1136 (2009)[PubMed]
著者プロフィール
略歴:2001年 東京医科歯科大学大学院医歯学総合研究科博士課程 修了,同年 東京医科歯科大学難治疾患研究所 特別研究員,2002年 米国Pennsylvania州立大学Postdoctoral fellowを経て,2003年より米国Stowers Institute for Medical ResearchにてResearch Associate.
研究テーマ:ATACアセチルトランスフェラーゼ複合体の機能解析.
© 2010 菅沼 環 Licensed under CC 表示 2.1 日本